不同NaCl浓度微咸水灌溉对棉花幼苗生理特性的影响①
董元杰,陈为峰,王文超,王慧桥,诸葛玉平
(山东农业大学资源与环境学院,山东泰安 271018)
土壤盐渍化是由自然或人类活动引起的一种主要的环境风险,全球大约有8.31亿hm2的土壤受到盐渍化的威胁。我国盐渍土总面积约3 600万hm2,占全国可利用土地面积的4.88%[1]。因而,开发利用盐碱地具有重要意义,可以缓解我国当前严重的人地矛盾。
进入21世纪以来,中国水资源供需矛盾越来越突出。在我国的华北、西北以及沿海地带,微咸水资源丰富,利用率低,研究微咸水资源的安全利用,可促进盐碱地的开发利用,有效缓解淡水资源短缺的危机[2]。在利用微咸水代替淡水灌溉方面,前人进行了很多有益的探索。研究表明,咸水畦灌和沟畦轮灌均造成土壤积盐,连续利用3 g/L 的微咸水灌溉,会造成土壤表层盐分的累积,并会使作物受到盐分胁迫,微咸水灌溉条件下,碱土的水分和盐分运移与入渗水矿化度均呈正相关关系[3-7]。不同盐分浓度微咸水处理对番茄生长指标叶绿素含量和产量没有明显的影响,利用微咸水灌溉能够增加土壤湿度,促进作物生长,但同时也能增加土壤中的盐分含量。如灌溉措施不当,可能会造成土壤的次生盐渍化,给作物造成盐分胁迫[8-9]。因而,选择适当的微咸水浓度,避免咸水盐分对植物产生盐胁迫是合理利用微咸水灌溉的关键。
棉花属于耐盐性较强的一类作物,是盐碱地农业生产的先锋作物,但棉花苗期耐盐性差,仍然要受到不同程度的盐害。随着粮食安全问题倍受重视和粮棉争地矛盾日益显现,滨海盐土区棉花的地位也越来越重要[10-11]。而中国东部滨海盐土区广泛分布的浅层微咸水为耐盐性较强的棉花适时播种以及抑制土壤返盐提供了条件。为此,前人针对微咸水在棉花灌溉上的利用和棉花耐盐机理进行了较多的探讨。王艳娜等[10]、阮明艳等[11]及吕宁等[12]发现滴灌微咸水对棉花干物质积累量影响不大,但棉花生育进程出现滞后[10-12]。Liu等[13]的研究表明,NaCl胁迫下,棉花幼苗生长受到了不同程度的抑制,叶绿素遭到破坏,抗氧化酶活性提高,H2O2、丙二醛(MDA)等逆境物质的积累量增加。上述研究多集中于西北盐碱土区和实验室的相关研究,目前对东部滨海盐土区棉花微咸水灌溉的相关研究报道较少。
本研究针对山东省滨海盐土区淡水资源缺乏造成的棉花出苗难,成苗率低,棉苗生长受抑制,产量品质低的生产困境,在滨海盐土区实地采集土壤样品,进行盆栽试验,用不同咸度微咸水浇灌,探讨了不同咸度微咸水对棉花发芽率及幼苗生理特性的影响,以探讨滨海盐土区棉花幼苗适宜的微咸水灌溉浓度,明确滨海盐土区棉花幼苗微咸水灌溉的可行性,为滨海盐碱土区浅层咸水资源与盐碱地资源的开发利用和滨海盐土区的棉花生产提供依据。
1 材料与方法
1.1 试验设计
盆栽试验在山东农业大学资源与环境学院植物营养系日光温室进行。供试土壤采自黄河三角洲山东省滨州市无棣县的渤海粮仓试验示范基地的滨海盐土。土壤基本性状为:全盐含量3.1 g/kg,全氮1.31 g/kg,有效磷12.17 mg/kg,速效钾533.45 mg/kg,pH 7.84,有机质14.64 g/kg;土壤颗粒组成:<0.001 mm 2 g/kg,0.001~0.005 mm 10 g/kg,0.005~0.01 mm 30 g/kg,0.01~0.05 mm 580 g/kg,0.25~1 mm 5.6 g/kg,0.05~0.25 mm 372.4 g/kg;容重 1.25 g/cm3,比重2.53,孔隙度 50.72%。
供试土壤取样点山东省滨州市无棣县气候特点为典型的大陆性半干旱半湿润季风气候,光照充足,四季分明,雨热同期,年平均日照时数为2 736.1 h,全年平均气温 12.5 ℃,多年平均无霜期 205 d,降水年际变化大,年内分配不均匀,雨量主要集中在夏季,年蒸发量是年降水量的 2.3 倍。
试验用塑料盆,每盆装过 5 mm 筛的风干土2.5 kg。供试棉花品种为“山农丰抗棉6号”。盆栽试验于2016年4月10日播种,每盆播种10粒,最后留苗5株。出苗后用蒸馏水培养至棉苗顶土出苗子叶未展开,然后再用微咸水进行处理。微咸水浇灌试验设4个处理包括:CK:蒸馏水;T1:2 g/L NaCl溶液;T2:3 g/L NaCl溶液;T3:4 g/L NaCl溶液,每个处理重复4次。
试验前测定土壤的田间持水量(作为灌水量的依据),出苗后每隔2 d 灌水1次,通过称量盆和土的重量确定试验处理的灌水量,当土壤含水量降到最大持水量的50%~60% 时,统一补水至田间持水量的90%~100%,保持每盆用水量一致。整个试验期间共处理7次,处理过程中定期交换位置以保证每盆所受环境影响一致。
1.2 测定项目与方法
发芽率:在直径10 cm培养皿中加一张滤纸,再加入15 ml相应浓度NaCl溶液,每处理播种10粒,置于温度为25 ℃±1 ℃恒温培养箱中培养, 每天更换NaCl溶液(发芽率试验用微咸水同盆栽试验)。第 7天统计发芽率[14]。
形态指标:鲜重和干重采用天平称重法。微咸水处理20 d后,收获植株并将地上部和地下部分开,蒸馏水冲洗干净,称鲜重;然后在110 ℃下杀青,70 ℃烘干至恒重,测干重。株高和根长采用常规直尺测量法[14]。
生理生化指标:叶绿素含量采用乙醇提取-紫外分光光度法测定;超氧化物歧化酶(SOD)活性用氮蓝四唑(NBT)法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外吸收法测定。丙二醛(MDA)含量测定采用硫代巴比妥酸法测定,可溶性蛋白含量采用考马斯亮蓝法测定[13]。游离脯氨酸(Pro)含量采用酸性水合茚三酮法测定。超氧阴离子(O2·-)产生速率采用羟胺氧化反应法测定;H2O2含量参照Patterson等[14]的方法测定。
1.3 数据处理
采用Excel 2003软件处理数据和绘图,采用DPS 7.05软件进行数据统计分析,采用最小显著极差法(LSD)进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 不同 NaCl浓度微咸水对棉花种子发芽率的影响
由图1可见,与CK相比,T1和T2处理降低了棉花种子的发芽率,但差异未达显著水平(P>0.05),说明用NaCl浓度为2 g/L 和3 g/L 的微咸水浇灌不会严重抑制棉花种子的发芽。T3处理与 CK相比,种子发芽率显著降低26.09%(P<0.05),说明NaCl浓度为4 g/L 的微咸水严重抑制了棉花种子的发芽。
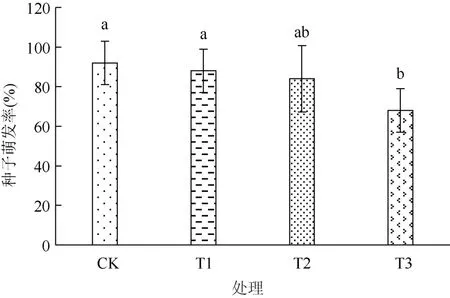
图1 不同NaCl浓度微咸水对棉花发芽率的影响Fig. 1 Effects of brackish water under different NaCl concentrations on cotton germination
2.2 不同NaCl浓度微咸水对棉花幼苗生长的影响
由表1可知,与CK相比,不同NaCl浓度的微咸水对棉花幼苗的鲜重、株高、根长和干重都有一定的抑制作用。但是,T1处理各指标的降低幅度均未达显著水平(P>0.05),T1与T2处理各指标的差异也未达到显著水平(P>0.05)。与 CK相比,T2处理鲜重、株高、根长和干重分别降低了19.55%、8.70%、37.96% 和29.41%;与T1处理相比,T2处理鲜重、株高、根长和干重分别降低了 25.77%、2.63%、37.96% 和29.41%。与CK相比,T3处理鲜重、株高、根长和干重分别显著降低了34.08%、27.27%、38.26% 和35.29%。说明在NaCl浓度为2 g/L 的微咸水没有显著抑制棉花幼苗的生长,但当NaCl浓度达到3 g/L 和4 g/L 时抑制了棉花幼苗的生长,特别是当NaCl浓度达4 g/L 时严重抑制了棉花幼苗的生长。这可能是由于盐胁迫条件下,植物碳同化物减少,渗透调节能耗和维持生长能耗增加,生长受到抑制所造成的。

表1 不同NaCl浓度微咸水对棉花幼苗生长的影响Table 1 Effects of brackish water under different NaCl concentrations on growths of cotton seedlings
2.3 不同 NaCl浓度微咸水对棉花幼苗叶绿素含量的影响
光合色素尤其是叶绿素在植物的光合作用中对光能的吸收、传递和转化起着极为重要的作用[13]。由表2可知,不同NaCl浓度的微咸水均降低了总叶绿素、叶绿素a、叶绿素b和类胡萝卜素的含量。与CK相比,T2和T3处理显著降低了总叶绿素、叶绿素 a、叶绿素 b和类胡萝卜素的含量(P<0.05),说明NaCl浓度为3 g/L 和4 g/L 的微咸水严重抑制了叶绿素的合成。

表2 不同NaCl浓度微咸水对棉花幼苗叶片叶绿素含量的影响Table 2 Effects of brackish water under different NaCl concentrations on chlorophyll contents of cotton seedling leaves
2.4 不同 NaCl浓度微咸水对棉花幼苗抗氧化酶活性的影响
由图2可见,与CK相比,T1处理棉花幼苗叶片中SOD和POD的活性降低1.40% 和13.97%,CAT活性增加5.78% 。T2处理叶片中SOD和POD活性较 CK分别降低 3.82% 和 19.48%,CAT活性提高11.16%;T3处理较CK处理SOD和POD活性分别降低 13.78%、39.90%,CAT活性提高 15.04%。与 CK相比,T1处理对SOD和CAT活性的影响不显著,但显著降低了POD的活性,T2和T3处理显著降低了SOD和POD活性,提高了CAT的活性。这表明NaCl浓度为2 g/L 的微咸水灌溉导致的轻度盐胁迫没有显著降低抗氧化酶的活性,并且刺激棉花提高抗逆性从而提高其耐盐能力,以维持其正常生长。但是,当NaCl浓度大于 3 g/L 时,显著降低了棉花幼苗抗氧化酶SOD和POD的活性,抑制了棉花幼苗的正常生长。
2.5 不同 NaCl浓度微咸水对棉花幼苗可溶性蛋白和游离脯氨酸(Pro)的影响
由图3可见,T1处理的棉花幼苗叶片可溶性蛋白含量较 CK显著提高了10.76%,说明植物为缓解盐胁迫,使植物体内积累大量的可溶性蛋白。T2和T3处理叶片中可溶性蛋白的含量较 CK分别显著提高 19.15%、45.76%。表明盐胁迫可提高棉花幼苗植株内可溶性蛋白含量,且随盐胁迫程度的加重植株内可溶性蛋白含量呈现出增加的趋势,这可能是棉花应对盐胁迫的一种适应性反应。

图2 不同NaCl浓度微咸水对棉花幼苗SOD、POD和CAT活性的影响Fig. 2 Effects of brackish water under different NaCl concentrations on activities of SOD, POD and CAT in Cotton Seedlings
植物在正常条件下,游离脯氨酸含量很低,但遇到逆境时,游离脯氨酸便会大量积累[15]。由图3可见,与CK相比,T1处理植株的Pro含量没有显著增加,但是T2与T3处理分别显著提高了190% 和467.52%。这表明NaCl浓度为2 g/L 时,植物没有表现出很强的盐胁迫反应,而当微咸水的浓度大于2 g/L 时,则表现出较强的盐胁迫反应。这也表明NaCl浓度为2 g/L 的微咸水灌溉不会对棉花幼苗的生长起到严重的胁迫作用。
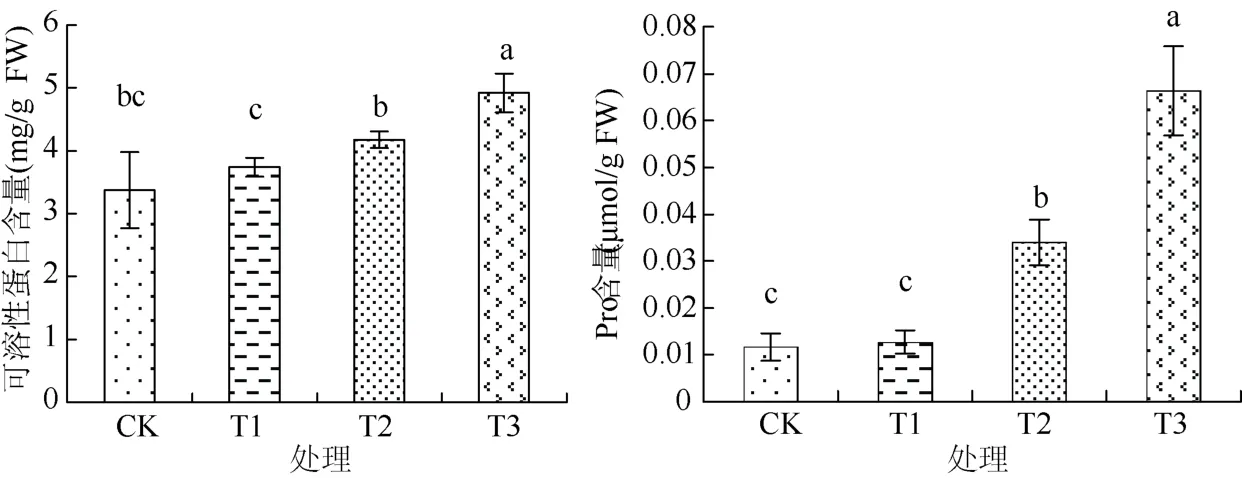
图3 不同NaCl浓度微咸水对棉花幼苗可溶性蛋白和脯氨酸含量的影响Fig. 3 Effects of brackish water under different NaCl concentrations on contents of soluble protein and proline in cotton seedlings
2.6 不同 NaCl浓度微咸水对棉花幼苗 H2O2含量、O2·- 产生速率和MDA含量的影响
由图 4可见,在正常条件下,棉花幼苗叶片中H2O2产生速率较低,与CK相比,T1、T2和T3处理的植株叶片中H2O2含量均显著提高,且随盐浓度的提高植株体内盐含量逐步增加。CK处理棉花幼苗O2·-产生速率在较低水平。与 CK 相比,T1、T2 与T3处理 O2·-产生速率分别增加 20.26%、8.09% 和6.78%,但 T1和T2处理的棉花幼苗O2·-产生速率差异不显著。MDA是植物逆境胁迫下产生的一种膜脂过氧化产物,其含量高低反映了植物受伤害的程度。本研究结果显示(图4),浇灌蒸馏水的CK处理棉花幼苗叶片中MDA含量较低,与CK相比,T1、T2和 T3处理的叶片中 MDA含量分别显著提高11.15%、20.46% 和108.78%,但T1和T2处理差异不显著。以上结果表明,浇灌不同浓度微咸水显著提高了棉花幼苗叶片中 H2O2含量、O2·-产生速率 和MDA的含量,且随灌溉微咸水盐分浓度的增加其含量相应呈现出上升趋势。
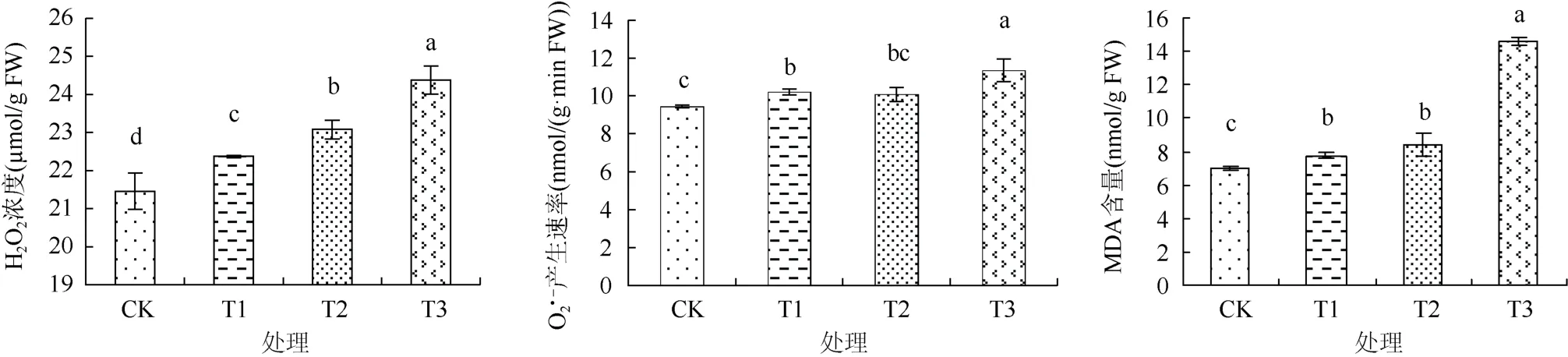
图4 不同NaCl浓度微咸水对棉花幼苗叶片中H2O2含量、O2·-产生速率和MDA含量的影响Fig. 4 Effects of brackish water under different NaCl concentrations on H2O2 concentrations, O2·- production rates and MDA contents of cotton seedlings leaves
3 讨论
盐胁迫会显著降低棉花种子的发芽率[13]。但本试验条件下T1和T2微咸水处理降低了棉花种子的发芽率但是没有达到显著水平,表明NaCl浓度为2 g/L 和 3 g/L 的微咸水浇灌不会严重抑制棉花种子的发芽。这可能是盐胁迫抑制棉花种子发芽存在一定的浓度极限的原因,本试验条件下,当盐浓度超过3 g/L 时,棉花种子发芽受到显著抑制。
微咸水灌溉条件下,棉花幼苗生长受到了显著的抑制作用,这与Liu等[13]的研究结果一致。盐胁迫也显著降低了植株叶片叶绿素的合成。有研究表明,叶绿素酶是叶绿素降解代谢中起关键作用的酶,NaCl 能增强叶绿素酶活性,加速叶绿素分解[14]。盐胁迫下,植物细胞叶绿体和线粒体电子传递中泄漏的电子增加,活性氧大量产生。渗透胁迫下叶绿素的降解主要由活性氧的氧化损伤引起,而质膜电解质外渗的增加与脂质过氧化速率呈显著正相关[15]。本研究证实在盐害的影响下,棉花的叶绿素含量明显降低,但是浇灌NaCl浓度小于3 g/L的微咸水并没有显著抑制叶绿素的合成,这也可能是NaCl浓度2 g/L 的微咸水没有显著抑制棉花幼苗生长的主要原因(表1)。
在微咸水灌溉条件下,棉花幼苗遭受一定程度的盐胁迫下,植物机能受到伤害,SOD的活性有一定的降低,POD的活性有明显的降低,CAT的活性有一定的增加[13,16]。本试验条件下微咸水灌溉对棉花幼苗SOD、POD、CAT活性的影响与上述结果一致,这可能是盐胁迫下棉花自生的抗盐反应所造成的。
植物在逆境条件下,由于体内活性氧代谢加强导致H2O2发生累积,H2O2能造成细胞膜损害,加快细胞衰老和解体[13,17]。植物能通过分子氧单电子还原过程,一些酶催化过程和低分子化合物的自动氧化,不断地产生活性氧[13]。在正常情况下,植物体内活性氧的产生与消除处于平衡状态,不会造成细胞伤害,但是在逆境条件下,平衡会遭到破坏,引起过多活性氧的产生,过量的活性氧会引起细胞膜脂过氧化,造成细胞膜系统损伤或导致细胞死亡[14-15]。为消除活性氧的伤害,植物体内存在酶促和非酶促两类防御活性氧损伤的保护系统,它们协同作用,防御活性氧等集团对细胞膜系统的过氧化损伤,减轻盐胁迫对植物细胞的伤害[16-17]。SOD 把 O2·-歧化为 H2O2,而 POD是清除H2O2的酶,所以SOD、POD和CAT是膜保护系统的重要酶类,能清除自由基,保护膜系统的完整性,以减轻盐胁迫对植物的伤害[18]。在生物体内, MDA的过多积累会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性。O2·-性质活泼,具有很强的氧化性和还原性,过量生成可损伤组织,在体内主要通过SOD清除。本试验研究表明浇灌NaCl浓度2g/L 的微咸水,抗氧化酶系统被激活(图2),逆境物质的含量没有大幅度提高。在本试验条件下,用NaCl浓度低于3 g/L 的微咸水浇灌棉花幼苗,提高了抗氧化酶的活性,增强了植物盐胁迫的耐受能力,但是没有抑制棉花幼苗的生长(表1,图 2,图 4)。
4 结论
1) NaCl浓度为4 g/L 的微咸水严重抑制了棉籽发芽,而NaCl浓度为2~3 g/L 的微咸水没有显著降低棉籽的发芽率。
2) NaCl浓度为3 g/L 和4 g/L 微咸水灌溉显著抑制了棉花幼苗的生长,降低了棉花幼苗的生长指标与叶绿素含量;提高了抗氧化酶的活性、可溶性蛋白含量和游离脯氨酸含量;增加了O2·-产生速率、H2O2含量以及MDA积累量,并以NaCl浓度为4 g/L 的微咸水对棉花生长的抑制作用最为显著,而NaCl浓度为2 g/L 的微咸水激活了棉花幼苗的耐盐性,但对棉花幼苗的生长抑制作用不显著。
3) 在黄河三角洲滨海盐土上,棉花播种期和幼苗期可以用NaCl浓度为2 g/L 的微咸水代替淡水灌溉。
[1] 王佳丽, 黄贤金, 钟太洋, 等. 盐碱地可持续利用研究综述[J]. 地理学报, 2011, 66(5): 673-684
[2] 张余良, 陆文龙, 张伟, 等. 长期微咸水灌溉对耕地土壤理化性状的影响[J]. 农业环境科学学报, 2006, 25(4):969-973
[3] 史晓楠, 王全九, 巨龙. 微咸水入渗条件下Philip模型与Green-Ampt模型参数的对比分析[J]. 土壤学报, 2007,44(2): 360-363
[4] 吴忠东, 王全九. 不同微咸水组合灌溉对土壤水盐分布和冬小麦产量影响的田间试验研究[J]. 农业工程学报,2007, 23(11): 71-76
[5] 虎胆·吐马尔白, 吴争光, 等. 棉花膜下滴灌土壤水盐运移规律数值模拟[J]. 土壤,2012, 44 (4): 665-670
[6] 王全九, 张继红, 谭帅. 微咸水入渗下施加PAM土壤水盐运移特性研究[J]. 土壤学报, 2016,53(4):1056-1064
[7] 万书勤, 康跃虎, 王 丹,等. 华北半湿润地区微咸水滴灌对番茄生长和产量的影响[J]. 农业工程学报, 2008,24(8): 30-35
[8] 赵秀芳, 杨劲松, 张清,等. 石膏-微咸水复合灌溉量对土壤水盐分布特征的影响. 土壤, 2010, 42(6):978-982
[9] 曹彩云, 郑春莲, 孙景生, 等. 长期咸水灌溉对土壤理化性质和土壤酶活性的影响[J]. 水土保持学报, 2014,28(3):172-176
[10] 王艳娜, 侯振安, 龚江, 等. 咸水滴灌对棉花生长和离子吸收的影响[J]. 棉花学报, 2007, 19(6): 472-476
[11] 阮明艳, 张富仓, 侯振安. 咸水膜下滴灌对棉花生长和产量的影响[J]. 节水灌溉, 2007(5): 14-16
[12] 吕宁, 侯振安, 龚江. 不同滴灌方式下咸水灌溉对棉花根系分布的影响[J]. 灌溉排水学报, 2007, 26(5): 58-62
[13] Liu S, Dong Y J, Xu L L, et al. Effects of foliar applications of nitric oxide and salicylic acid on salt-induced changes in photosynthesis and antioxidative metabolism of cotton seedlings[J]. Plant Growth Regulation, 2013, 73(1): 67-78
[14] 陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2002: 119-127
[15] 周万海, 师尚礼, 寇江涛. 外源水杨酸对苜蓿幼苗盐胁迫的缓解效应[J]. 草业学报, 2012, 21(3): 171-176
[16] Chen S F, Zhu Y L. Effects of NaCl stress on activities of protective enzymes, contents of osmotic adjustment substances and photosynthetic characteristics in grafted tomato seedings[J]. Acta Hort. Sin., 2005, 32(4):609-613
[17] Tian X Y, He M R, Wang Z L, et al. Application of nitric oxide and calcium nitrate enhances tolerance of wheat seedlings to salt stress[J]. Plant Growth Regulation, 2015, 77: 343-356

