微创旋切术和开放局部切除术治疗乳腺良性叶状肿瘤的疗效比较
梁丽春, 莫春生, 李娟娟, 孔之华, 洪强
乳腺叶状肿瘤(phyllodes tumors of breast,PTB)是一种罕见的乳腺肿瘤类型,发生率在所有乳腺肿瘤类型中小于1%[1]。手术切除治疗预后良好。传统的治疗术式有广泛肿块切除术和局部肿块切除术,广泛切除甚至可能造成患侧上肢肌力及前屈、后伸、内旋等活动的影响[2]。近年来,女性乳腺肿瘤发病率逐年增加,对术后并发症及乳房外形美观等方面的要求越来越高。乳腺外科的微创化可明显改善传统开放手术的不足[3]。超声引导下真空辅助微创旋切系统具有微创、美观、操作简单、安全可靠等优点[4-5]。本研究通过回顾性分析超声引导乳腺微创旋切术治疗良性PTB的效果,评价其安全性及优势。
1 资料与方法
1.1 研究对象入组标准
①术前超声检查显示肿瘤直径≤3 cm,形态为卵圆形,无分叶状,无钙化,内部回声均匀,肿物内部无血流信号;②35岁以上患者术前钼靶检查提示BI-RADS 2或3类(级);③行乳腺肿物麦默通微创旋切术或乳腺肿物切除术治疗;④术后病理确诊为良性叶状肿瘤;⑤排除行乳腺肿物扩大切除术者。
1.2 一般资料
2009年5月至2017年1月我院共收治符合入组标准的患者72例,根据术式不同分为微创组(接受麦默通微创乳腺肿瘤旋切术)与局切组(接受开放性乳腺肿瘤切除术)。微创组34例,年龄14~53岁,肿块直径1.1~3.0 cm,病程1周~60个月;局切组38例,年龄15~62岁,肿块直径1.0~3.0 cm,病程1周~56个月。两组术后随访时间均为7~60个月,两组患者年龄、肿瘤直径、平均病程、随访时间(表1)比较,差异无统计学意义(P>0.05) ,具有一定可比性。

表1 微创组与局切组患者一般资料比较
1.3 治疗方法
1.3.1 微创组 采用超声引导乳腺肿瘤微创旋切术治疗,选用Mammotome乳腺全自动旋切系统(美国强生公司)。术前超声探查,明确肿块位置、大小并标记,制定操作路径等手术计划。常规消毒铺巾后进行局部浸润麻醉,于乳房外侧方向距离肿块2~3 cm处做一3~5 mm切口,在超声引导下沿麻醉路径置入Mammotome旋切刀于肿块底部,打开刀槽并将肿块尽可能全部置于刀槽内,然后启动旋切系统,对肿块进行逐条旋切,要求将穿刺刀体、凹槽及病灶的最大切面同时显示。切割全程须在超声监测下完成,通过负压吸引将肿块逐步取出后清除积血,再次超声检测确认已完全切除肿瘤,闭合穿刺口并用弹力绷带加压包扎。术后持续加压包扎48 h。
1.3.2 局切组 采用传统开放性肿块切除术。常规消毒铺巾,局部麻醉后切开皮肤,分离皮瓣,显露乳腺肿物,完整切除肿块,包括肿块周围0.5~1.0 cm正常乳腺组织,止血、冲洗,采用可吸收线缝合皮下组织及切口,常规包扎。
1.4 观察项目
记录两组手术时间、术中出血量、切口愈合时间以及瘢痕长度,是否出现术后血肿、瘀斑、迟发性出血、伤口愈合不良并发症的情况。术后每半年复查彩超随访肿瘤复发情况,以复发肿物穿刺或再次手术后的病理确诊叶状肿瘤为依据。术后6个月随访评价患者总体满意度,采用问卷调查形式,分值为0~100分(包括治疗满意度0~70分,外观满意度0~30分),分数越高则满意度越高。
1.5 统计学方法

2 结果
2.1 微创组和局切组手术资料比较
微创组在手术时间、术中出血量、术后愈合时间以及瘢痕长度上均优于局切组,差异有统计学意义(P<0.05),详见表2。

表2 微创组和局切组患者手术资料的比较
2.2 微创组和局切组术后并发症发生率及复发率比较
两组术后血肿、迟发性出血和伤口愈合不良并发症的比较(表3),差异无统计学意义(P>0.05)。其中微创组无1例患者出现迟发性出血和伤口愈合不良,但微创组较局切组更易出现术后瘀斑,两组比较差异有统计学意义(P<0.05)。
微创组有4例复发,复发率为11.8%,局切组有5例复发,复发率为13.2%,差异无统计学意义(P>0.05)。见表3。
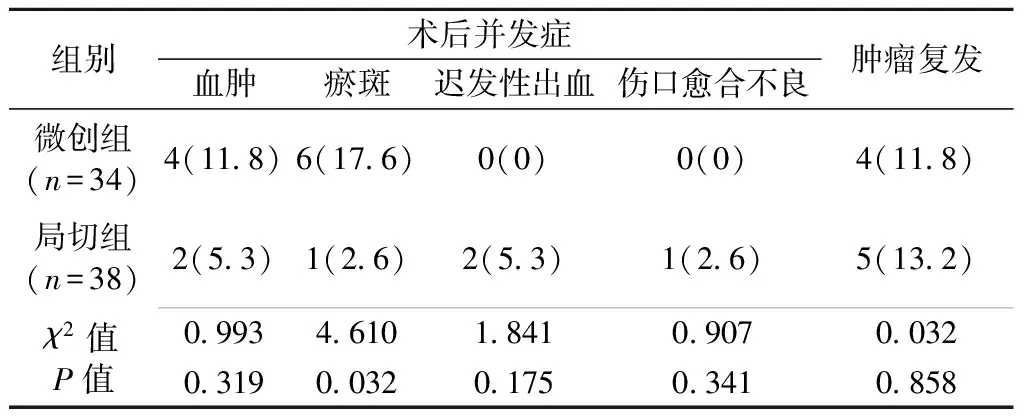
表3 微创组和局切组患者术后并发症发生率及肿瘤复发率的比较(例,%)
2.3 微创组和局切组满意度调查评分比较
微创组的治疗满意度、乳房外观满意度和总体满意度评分均高于局切组,差异有统计学意义(P<0.05)。见表4。

表4 微创组和局切组患者满意度问卷调查评分比较
3 讨论
根据组织学特点,PTB分为良性、交界性和恶性3类[6],其中大部分为良性PTB。PTB影像学表现极欠特异性,且与纤维腺瘤存在极大的相似之处[7]。纤维腺瘤病程较长,多缓慢增大或无变化,快速增大者较少见,平均直径较叶状肿瘤小[8]。若发现乳房肿块呈叶状分布、边界极为明显、直径超过5 cm且无钙化情况时,尤其是病灶有短期迅速增长史时可初步诊断为乳腺叶状肿瘤[9]。但若肿块呈卵圆形,短期增长不明显,直径<5 cm,临床上容易误诊为纤维腺瘤。从肿块特征上判断,良性PTB当属中医的“乳核”范畴。《外科大成》指出,乳中结核“如梅如李,虽患日浅,亦乳岩之渐也”,已认识到乳核中包括增长迅速的叶状肿瘤类型及少数年深日久可能会恶变为乳岩者。
临床上对<3 cm的乳核多采用局部切除或微创切除方式治疗。中医古籍中早在《内经》的《刺齐论》、《刺要论》中就有了微创的治疗理念,曰:“刺骨者无伤筋,刺筋者无伤肉,刺筋者无伤骨。刺有浅深,各至其理,无过其道,过之则内伤,不及则生外壅,壅则邪从之”。其微创的概念在于以最小的侵袭或损伤达到外科疗效。《灵枢·九针十二原》及《灵枢·官针》中衍生出的针刀、铍针的微创方法至今仍广泛被应用。微创技术的形成不仅有技术进步的因素,同时也得益于外科医师治疗理念的进步。
超声引导下真空辅助微创旋切系统于2006年开始在中国应用于临床,具有微创、美观、操作简单、安全可靠等优点,在微创化趋势的当下,真空辅助旋切系统成为良性较小肿物的首选方式[10]。研究证明,超声引导下真空辅助微创旋切系统治疗乳腺良性肿瘤,在伤口长度、出血量、手术时间、术后康复时间、术后瘢痕大小、伤口感染率及乳房美观度方面均优于常规开放手术,是治疗乳腺良性肿瘤理想的手术方式[11-13]。本研究结果表明,微创组在手术时间、术中出血量、术后愈合时间、瘢痕长度、患者满意度均优于局切组,且无1例患者出现迟发性出血和伤口愈合不良,虽容易产生局部瘀斑,但瘀斑极易消散,对患者满意度并无影响;血肿形成与加压包扎不完善和包扎时间过短有关,可通过延长加压包扎时间和预防性应用止血药物等方法避免。
有研究表明良性叶状肿瘤的术后复发率为10%~17%[14]。Kim等[15]通过对比超声引导下真空辅助微创旋切手术组20例及传统局部扩大切除术126例乳腺良性叶状肿瘤患者的随访(平均32.3个月)发现3例复发患者均为传统手术组。本研究显示微创组肿瘤复发率为11.8%,局切组复发率为13.2%,两组肿瘤复发率差异无统计学意义。
几点体会:①大样本研究并没有发现手术切缘状况能预测乳腺肿瘤局部复发情况,特别是对乳腺良性叶状肿瘤[16],因此,对于术前检查评估为良性肿瘤可能性大且直径≤3 cm的乳腺肿物,若患者有美观要求,我们首选微创旋切术式。②虽然麦默通微创手术刚开始被用于肿瘤的活检,但近年来被广泛应用于较小良性肿瘤的切除,但彻底切除是手术成功的关键[17-20]。我们除了在超声立体监控下进行旋转、扇形切除外,还对切除的每一条组织都观察其形态及硬度,不但在超声下确认无残留,还必需经肉眼确认切除到正常腺体或脂肪组织,方认可在该方向上已切除干净[21],一般切缘距肿瘤>1 cm适宜。③对于良性叶状肿瘤术后同侧乳房再发的肿物,不排除纤维腺瘤可能,亦不排除良性PTB升级为交界性、恶性PTB可能,可行粗针穿刺活检[22-23],然后决定手术方式,若病理确诊为PTB复发需行广泛切除术。
[1] Bendifallah S, Canlorbe G. Common benign breast tumors including fibroadenoma, phyllodes tumors, and papillary lesions: Guidelines[J]. J Gynecol Obstet Biol Reprod (Paris),2015,44(10):1017-1029.
[2] 杨连祥, 王立军, 刘洪峰, 等. 广泛肿块切除术与乳腺局部肿块切除术治疗乳腺分叶状肿瘤的临床效果比较[J].中华普外科手术学杂志(电子版),2015,(3):221-224.
[3] 骆成玉. 乳腺肿瘤微创功能治疗的若干问题[J].中国微创外科杂志,2011,11(12):1057-1060.
[4] Plantade R, Hammou JC, Gerard F, et al.Ultrasound-guided vacuum-assisted biopsy: review of 382 cases[J]. J Radiol, 2005,86(9 Pt 1):1003-1015.
[5] 张永成,向海卿,杨焰,等.两种乳腺微创旋切系统的临床应用比较[J].中国肿瘤外科杂志,2010,2(2):90-92.
[7] 程文, 张久维, 荆慧, 等. 乳腺叶状肿瘤的影像分析[J].中国医学影像技术,2009,25(8):1381-1383.
[8] 谢菲, 王殊. 乳腺叶状肿瘤的诊断及手术治疗[J].中国实用外科杂志,2016,36(7):741-743.
[9] 薛学医, 薛来平, 高岚. 超声检查与X线检查在诊断乳腺叶状肿瘤方面的临床价值分析[J].当代医药论丛,2015,13(2):35-36.
[10] Pan S, Liu W, Jin K, et al. Ultrasound-guided vacuum-assisted breast biopsy using Mammotome biopsy system for detection of breast cancer: results from two high volume hospitals[J]. Int J Clin Exp Med, 2014,7(1):239-246.
[11] Ding B, Chen D, Li X, et al. Meta analysis of efficacy and safety between Mammotome vacuum-assisted breast biopsy and open excision for benign breast tumor[J]. Gland Surg, 2013,2(2):69-79.
[12] 黄晓庆, 何文山, 李治. 超声引导下乳腺微创旋切手术治疗乳腺肿块的效果[J].中华肿瘤防治杂志,2016,23(S1):66-67.
[13] 黄宇康,彭伟强,何咏梅,等.超声引导下麦默通微创旋切活检术在不可触及乳腺病灶诊治中的应用[J].中国肿瘤外科杂志,2011,3 (1):54-55.
[14] Tan PH, Schnitt SJ, van de Vijver MJ, et al. Papillary and neuroendocrine breast lesions: the WHO stance[J]. Histopathology, 2015, 66(6):761-770.
[15] Kim GR, Kim EK, Yoon JH, et al. Recurrence Rates of Benign Phyllodes Tumors After Surgical Excision and Ultrasonography-Guided Vacuum-Assisted Excision[J]. Ultrasound Q, 2016,32(2):151-156.
[16] Zhou ZR, Wang CC, Yang ZZ, et al. Phyllodes tumors of the breast: diagnosis, treatment and prognostic factors related to recurrence[J]. J Thorac Dis, 2016,8(11):3361-3368.
[17] Silverstein MJ. Radical Mastectomy to Radical Conservation (Extreme Oncoplasty): A Revolutionary Change[J]. J Am Coll Surg, 2016, 222(1): 1-9.
[18] Chen Z, Xu Y, Shu J, et al. Breast-conserving surgery versus modified radical mastectomy in treatment of early stage breast cancer: A retrospective study of 107 cases[J]. J Cancer Res Ther, 2015, 11(Suppl 1): C29-C31.
[19] Muradas RR, Velho MT, Riesgo Idos S, et al. Clinical and mammographic profile of patients with breast cancer surgically treated[J]. Rev Assoc Med Bras (1992), 2015, 61(3): 220-226.
[20] Wu FP, Wang J, Wang H,et al. Chest wall recurrence location and the lower-bound target of preventive radiotherapy after transverse incision in modified radical mastectomy[J].Genet Mol Res, 2015,14(1):1068-1075.
[21] 王建东, 李席如, 张艳君, 等. 超声引导下乳腺肿物Mammotome切除活检1 200例报告[J].中国实用外科杂志,2011,31(1):94-95.
[22] 魏莉, 孟宪杰. 超声引导下粗针活检术在乳腺叶状肿瘤诊断中的应用[J].中国医学影像学杂志,2015,23(12):909-912.
[23] Wu FP, Wang J, Wang H, et al. Chest wall recurrence location and the lower-bound target of preventive radiotherapy after transverse incision in modified radical mastectomy[J]. Genet Mol Res, 2015, 14(1): 1068-1075.

