复方苦参注射液联合化疗治疗晚期非小细胞肺癌的多指标疗效观察
任占良, 任小朋, 张泳, 韩英杰, 张卫锋
肺癌是常见的恶性肿瘤之一,吸烟、空气污染(雾霾、汽车尾气、煤烟排放等)、饮食结构改变等,是导致肺癌发生的元凶。随着老龄化时代的到来,肺癌发病率及死亡率逐年增加,居恶性肿瘤之首。非小细胞肺癌(non-small cell lung cancer,NSCLC)发病率占肺癌的80%,部分早期NSCLC患者合并基础疾病如,心脑血管疾病、肺功能较差而不能耐受手术治疗,而2/3以上NSCLC患者在确诊时已不能手术根治性切除,属于晚期肺癌[1-2],以化疗为主的综合治疗成为主要的治疗方法。对于晚期NSCLC治疗,NCCN指南推荐的一线化疗方案是以铂类为基础的两药联合方法,化疗综合治疗成为晚期NSCLC主要方法之一。但化疗毒副反应,使部分患者放弃治疗。有效控制或减轻不良反应,一直是临床医师追求的化疗目标。我们对NSCLC患者化疗的同时加用复方苦参注射液,发现近期疗效好,镇痛效果可靠,现将结果报道如下。
1 资料与方法
1.1 临床资料
2016年2月至2017年4月,陕西中医药大学附属医院胸心外科收治的52例老年患者,病理确诊为NSCLC,患者均签署知情同意书。随机数字化分为治疗组26例,男17例,女9例;年龄61~83岁,平均74岁;合并双肺多发结节9例,胸腔积液9例,脊柱转移1例,肾上腺转移2例,脑转移1例,肋骨转移1例,颈部多发转移结节、胸壁结节3例;KPS评分(61.34±5.01)分。对照组26例,男19例,女7例;年龄62~85岁,平均72岁;合并双肺多发结节6例,胸腔积液10例,脊柱转移2例,肾上腺转移2例,脑转移1例,肋骨转移2例,颈部多发转移结节、胸壁结节转移、纵隔多发转移3例;KPS评分(62.58±4.79)分。
1.2 治疗方法
两组在化疗前做血常规、肝肾功能、血糖、心电图、腹部常规B超、胸部CT、颅脑MRI、骨扫描等检查,排除化疗禁忌证。两组均给予DP方案化疗:多西他赛(江苏奥赛康药业股份有限公司,规格 0.5 ml:20 mg)75 mg/m2加入生理氯化钠溶液250 ml中静脉滴注,顺铂[齐鲁制药(海南)有限公司,规格20 mg]75 mg/m2加入生理氯化钠溶液250 ml中静脉滴注,21 d为1个周期,每周期第1天用药。治疗组在化疗同时联合复方苦参注射液(山西振东制药股份有限公司 规格5 ml)20 ml加入生理氯化钠溶液250 ml中静脉滴注,每天1次,第 1~14 天为1个疗程,21 d为1个周期。化疗结束后3 d复查血常规、肝肾功能,记录消化道反应(恶心、呕吐、腹痛、腹泻等)并采取对症处理。治疗组和对照组均化疗3个周期后判定疗效、生存质量、镇痛效果、化疗毒副反应。
1.3 观察指标
1.3.1 近期临床疗效评定 疗效指标采用在治疗3个周期中CT测量病灶大小,采用实体瘤近期疗效评价标准[3]:完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD);临床有效率(CR+PR)计算。
1.3.2 生存质量 以Karnofsky评分标准为指标,治疗前后行KPS评分,治疗后较治疗前KPS评分提高 ≥ 10分为改善,增加及减少 < 10分为稳定,减少≥10分为降低[4];生存质量好转率以改善率计算。
1.3.3 化疗毒副反应 治主要表现:白细胞和血小板减少,消化道反应(恶心、呕吐、腹痛、腹泻)等;按WHO抗肿瘤药急性及亚急性毒性反应的表现与分度标准为0~Ⅳ度[5]。
1.3.4 癌性疼痛 评估采取视觉模拟评分法(visual analogue scale, VAS),使用VAS游动标尺,两端分别为0分和10分,代表无痛和难以忍受的剧烈疼痛,标尺背面有一条由绿色向红色渐变加重的彩色直线,能反映患者当时疼痛的程度。检测评分时由患者根据自己的疼痛程度在直线上指出相应位置,背面对应数值即为疼痛评分值。治疗后:完全无痛为CR,疼痛明显减轻为PR,疼痛减轻,但仍感明显疼痛为SD,疼痛无减轻为NR;缓解率以CR+PR+SD率计算。
1.4 统计学方法
采用 SPSS 16.0统计软件进行统计学处理,计数资料采用率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 近期临床疗效
2 组治疗后的近期临床疗效比较,治疗组有效率高于对照组,差异有统计学意义(P<0.05),详见表1 。
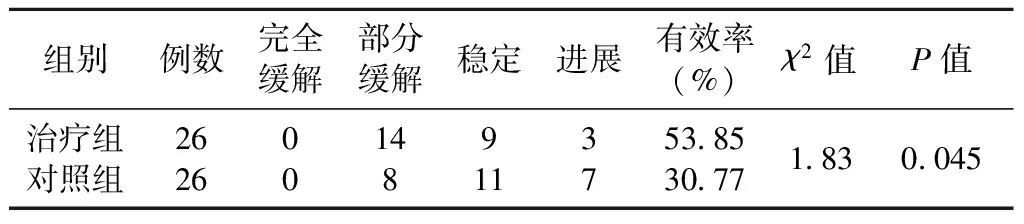
表1 治疗组和对照组化疗后近期疗效比较
2.2 生存质量
两组治疗后生存质量情况比较,治疗组生存质量改善优于对照组,差异有统计学意义(P<0.05),详见表2。
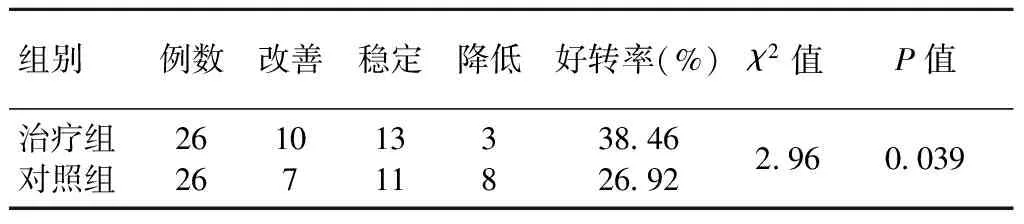
表2 治疗组和对照组化疗后生存质量比较
2.3 化疗毒副反应
两组治疗后,白细胞和血小板减少情况,消化道反应(恶心、呕吐、腹痛、腹泻)比较,见表 3。治疗组化疗后Ⅲ~Ⅳ度不良反应总发生率低于对照组,差异有统计学意义(χ2=5.65,P=0.042)。
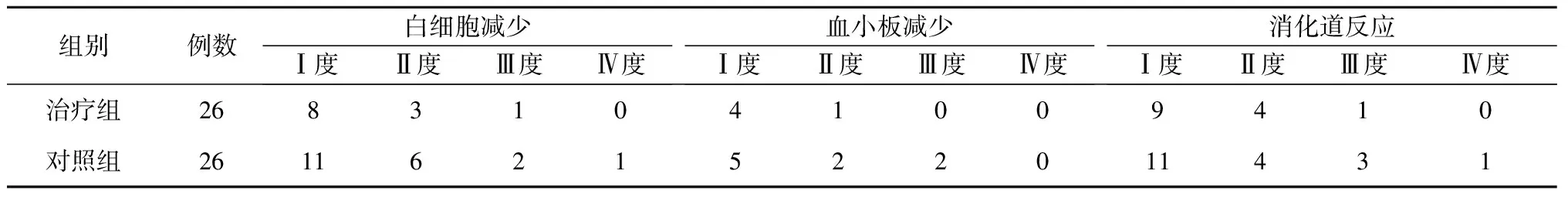
表3 治疗组和对照组化疗后毒副反应比较
2.4 镇痛效果
治疗后两组镇痛效果比较,治疗组镇痛效果缓解率优于对照组,差异有统计学意义(P<0.05),详见表4。

表4 治疗组和对照组疗后镇痛效果缓解率
3 讨 论
恶性肿瘤患者脏器功能减退、体质虚弱、免疫功能低下。化疗在杀伤或杀灭肿瘤细胞的同时对机体正常细胞的功能、活动、代谢有一定的损害作用,可导致一系列毒副反应及并发症,有些患者因不能耐受化疗毒副反应被迫放弃治疗。NSCLC主要是T细胞免疫,复方苦参注射液能激活机体免疫系统,使T细胞活性及数量增加[6],起到抗肿瘤作用。与化疗药物协同,有效地控制肿瘤细胞生长,抑制肿瘤体积生长,改善及提高了机体免疫功能,使肿瘤生长与人体抗肿瘤能力形成动态平衡,获得长期带瘤生存的效果[7]。本研究结果显示,联合复方苦参注射液的治疗组近期临床疗效及生存质量改善情况均优于对照组 (均P<0.05)。
晚期肺癌发展到一定程度,可出现恶性胸腔积液、远处转移等并发症,可造成不同程度的胸闷气短、咳嗽咳痰、呼吸困难、难以忍受的疼痛等症状,可危及生命。刘玲等[8]将复方苦参注射液联合顺铂治疗恶性胸腔积液,可降低化疗的毒副作用,改善患者的生存质量。骨转移是肺癌转移常见的部位,主要为溶骨性破坏,表现为病理性骨折、活动受限以及局部疼痛等,影响患者生存质量[9]。现代药理研究显示:复方苦参注射液具有活血化瘀、改善微循环瘀滞及血液高粘滞状态,抑制肿瘤细胞黏附和侵袭,进而抑制肿瘤细胞转移。杨蜜等[10]对复方苦参注射液在国内应用研究进行Meta分析,结果显示:顺铂联合复方苦参注射液能改善恶性胸腔积液患者的一般状况,降低化疗毒副反应,与化疗药物有协同作用。占明等[11]研究发现,肺癌骨转移联合复方苦参注射液具有明显镇痛作用。李世良、黄献球、郭一萌等[12-14]报道复方苦参注射液具有抗癌、抗炎、镇痛、升白细胞等多种作用[16]。本研究结果显示:联合应用复方苦参注射液治疗组的化疗毒副反应,白细胞减少低于对照组,镇痛效果优于对照组(均P<0.05)。
综上所述,复方苦参注射液联合DP方案治疗晚期NSCLC的近期疗效好,镇痛效果明显,改善生存质量,化疗毒副反应少,有效率高,且患者可耐受,适合临床应用。
[1] Socinski MA, Scappaticci FA, Samant M, et al. Safety and efficacy of combining sunitinib with bevacizumab+paclitaxel/carboplatin in non-small cell lung cancer[J]. J Thorac Oncol, 2010,5(3):354-360.
[2] Wang L, Correa CR, Zhao L, et al. The effect of radiation dose and chemotherapy on overall survival in 237 patients with Stage III non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 73(5): 1383-1390.
[3] 周际昌.实用肿瘤内科学[M].北京:人民卫生出版社,2003.
[4] 郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社, 2002.
[5] 石远凯, 孙燕.临床肿瘤内科手册.第6版[M].北京:人民卫生出版社, 2015.
[6] 亓宪银, 刘民杰.复方苦参注射液对肺癌术后化疗患者免疫功能的影响[J].现代肿瘤医学,2014,22(1):84-86.
[7] 张桂枝, 贺园丽.复方苦参注射液联合复方斑蝥胶囊治疗晚期肝癌临床观察[J].山西中医,2011,27(8):30-31.
[8] 刘玲, 钟世寿, 李国苗.复方苦参注射液联合顺铂治疗恶性胸腔积液疗效及不良反应观察[J].现代肿瘤医学,2017,25(2):230-232,233.
[9] 成松梅, 陈齐鸣.滋肾活血通络法联合唑来膦酸治疗骨转移癌疼痛22例临床研究[J].江苏中医药,2013,45(9):36-37.
[10] 杨蜜, 任杰, 文世民, 等.复方苦参注射液联合顺铂治疗恶性胸腔积液的 Meta 分析[J].现代肿瘤医学,2016,24(21):3393-3398.
[11] 占明, 高宝安, 王锡恩.复方苦参注射液联合伊班膦酸钠治疗非小细胞肺癌骨转移癌疼痛的临床观察[J].世界中医药,2015,(2):206-208.
[12] 李世良, 孙成晖, 孙钦文, 等.复方苦参注射液联合化疗治疗非小细胞肺癌临床研究[J].辽宁中医杂志,2017,44(3):556-557.
[13] 黄献球.复方苦参注射液治疗肝癌并血性胸水65例临床观察[J].华夏医学,2013,26(4):692-693.
[14] 郭一萌, 杨静, 严虹霞, 等.复方苦参注射液辅助治疗肺癌的系统评价[J].中国医院用药评价与分析,2017,17(3):379-384.
[15] Mori K, Kamiyama Y, Kondo T, et al. Phase II study of the combination of vinorelbine and cisplatin in advanced non-small-cell lung cancer[J]. Cancer Chemother Pharmacol, 2004, 53(2): 129-132.

