CXCL12/CXCR4/MMP-2信号通路对三阴型乳腺癌生物学行为的影响
焦 娟,宋艳艳,刘 霞,刘 倩,冯志寅,苏丽萍,何鼎盛,张 巍
乳腺癌是女性最常见恶性肿瘤,其病死率为14%。2006年Bryan等[1]首次提出三阴型乳腺癌的概念,将ER、PR及HER-2均为阴性的乳腺癌定义为三阴型乳腺癌。该亚型乳腺癌对化疗有较高敏感性,但是肿瘤侵袭能力强、进展快,缺乏内分泌治疗和靶向治疗,治疗效果与其他亚型相比疗效较差。目前,乳腺癌治疗失败的主要原因是淋巴道转移和血行转移,因此深入分析三阴型乳腺癌浸润和转移的机制,并从中寻找有效的标志物和治疗靶点,对改善三阴型乳腺癌患者的治疗效果和预后有重要意义。
近年趋化因子在多种肿瘤中的研究均涉及肿瘤的浸润和转移。CXCL12又称基质细胞衍生因子SDF-1,是趋化因子家族中的一员,CXCL12主要与其相应的受体CXCR4结合诱导肿瘤的转移进程。MMP-2是促进肿瘤细胞浸润转移的重要因子,多项研究证实MMP-2在乳腺癌中存在基因拷贝数的增加。有文献报道[2]在前列腺癌中CXCL12/CXCR4可能通过活化MMP-2的表达促进肿瘤的浸润,但有关 CXCL12/CXCR4和MMP-2在三阴型乳腺癌浸润转移中的作用报道较少。本文以人乳腺癌MDA-MB-231细胞株为分析对象,分别转染CXCR4-siRNA和pcDNA3.1-CXCR4,干扰 CXCR4的表达,并检测转染后肿瘤细胞的增殖和迁移能力,探讨CXCL12/CXCR4及MMP-2对 MDA-MB-231 细胞株增殖、迁移等生物学行为的影响。
1 材料与方法
1.1细胞系及主要试剂细胞系及主要试剂包括人三阴型乳腺癌MDA-MB-231细胞株细胞(由新疆医科大学临床医学研究院细胞库提供),Trizol (Invitrogen公司,美国),DMEM细胞培养液,0.25%胰酶,胎牛血清(Gibco公司,美国),青霉素-链霉素双抗(Hyclone公司,美国),OptiMEM(Invitrogen公司,美国),凋亡试剂盒(BD公司,美国),Lipofectamine 3000转染试剂盒、Negative RNAi(Life technologies公司,美国),β-actin(Abcam公司,美国),SYBR Select Master Mix(ABI),pcDNA3.1(上海欧易公司,中国)。
1.2细胞培养将冻存于液氮中的MDA-MB-231细胞迅速取出,置于37 ℃水浴锅使其融化。融化后取出冻存管,用乙醇消毒后开启,用移液器将细胞转移到15 mL离心管中,加入含10%胎牛血清的DMEM培养基,轻轻颠倒混匀数次。以1 000 r/min离心5 min,弃上清。加入1 mL含10%新生胎牛血清的DMEM培养基重悬细胞。细胞计数后,将细胞液接种于干净的培养瓶中,补足培养基,于37 ℃ 5%CO2条件下培养。当细胞密度>70%时,用胰酶按照常规方法进行传代。取对数成长期的细胞进行实验。
1.3细胞转染转染前1天,将处于对数期生长的MDA-MB-231细胞用胰蛋白酶进行消化,计数后稀释成所需的密度,接种到相应的板孔中(保证在转染前细胞密度约70%),于37 ℃ 5%CO2条件下培养过夜,阴性对照用Oligofectamine转染试剂按照Lipofectamine 3000说明书进行转染。实验分为3组:实验组(转染CXCR4-siRNA和pcDNA3.1-CXCR4)、阴性对照组(转染阴性对照品)和空白对照组(未做转染处理)。
1.4Westernblot实验取细胞≥1×106个,加入500 μL RIPA裂解液,充分混匀。冰上放置30 min, 4 ℃,12 000 r/min离心15 min,收集上清,BCA蛋白定量试剂盒测定蛋白浓度。蛋白经凝胶进行电泳分离后,稳压冰浴电转至PVDF膜上,5%脱脂牛奶封闭2 h,一抗孵育4 ℃过夜,二抗孵育后,AP法显色,化学发光仪检测、拍照,与内参β-actin比较,计算目的蛋白的表达丰度。
1.5RT-PCR实验分别取2 μg总RNA,使用反转录引物进行逆转录反应,以获得的cDNA为模板,进行qRT-PCR反应,每孔设3个复孔。引物序列如下:CXCR4上游引物:5′-GGCCCTAGCTTTCTTCCACT-3′,下游引物:5′-GAGAGGATCTTGAGGCTGGA-3′;CXCL12上游引物:5′-GGCTCCCTGTAACCTCTTCAG-3′,下游引物:5′-CAGACTCAATCCCAACACACA-3′;MMP-2上游引物:5′-GATACCCCTTTGACGGTAAGGA-3′,下游引物:5′-CCTTCTCCCAAGGTCCATAGC-3′;β-actin上游引物:5′-ATGATGATATCGCCGCGCTC-3′,下游引物:5′-TCGATGGGGTACTTCAGGG-3′。利用SYBR Green染料检测细胞目的基因的表达,并将β-actin作为内参。总反应体积为20 μL,反应条件:50 ℃ 2 min,95 ℃ 2 min 预变性后,95 ℃ 15 s、60 ℃ 60 s合计进行40个循环扩增。采用相对定量公式:2-△△Ct,计算细胞目的基因的相对表达量。
1.6划痕实验铺板细胞培养12 h,使用不含胎牛血清的培养基培养4 h进行细胞转染,并在37 ℃、5%CO2的培养箱中继续培养6 h,进行细胞划痕实验并用DMEM完全培养基换液。分别在划痕培养0、24、48、72 h进行拍照,计算划痕之间细胞愈合的距离。
1.7MTT实验检测转染前一天用胰酶消化收集细胞,接种于96孔板,转染步骤同前,每孔加入MTT溶液(5 mg/mL)20 μL,37 ℃、5%CO2的培养箱中继续培养4 h后弃去上清液,每孔加入150 μL DMSO,避光震荡8~10 min,选择490 nm波长,在酶标仪上测定待测样孔光吸收值,记录结果并绘制生长曲线。

2 结果
2.1Westernblot法检测分别转染CXCR4-siRNA和pcDNA3.1-CXCR4后CXCR4、CXCL12及MMP-2蛋白的变化体外通过脂质体介导的瞬时转染CXCR4-siRNA和pcDNA3.1-CXCR4,在转染72 h后收集细胞,经Western blot实验检测,CXCR4蛋白条带在4.3×104处显色,CXCL12蛋白在1.1×104处显色,MMP-2蛋白条带在7.2×104处显色,内参β-actin蛋白条带在4.2×104处显色(图1)。分析各条带的灰度值,以β-actin蛋白为内参,对CXCR4、CXCL12及MMP-2蛋白的相对表达量进行统计分析,结果显示转染CXCR4-siRNA,CXCR4蛋白的表达量显著低于空白对照组和阴性对照组(P<0.01),CXCL12蛋白表达量显著高于空白对照组和阴性对照组(P<0.01),MMP-2蛋白的表达量显著低于空白对照组和阴性对照组(P<0.01);转染pcDNA3.1-CXCR4后CXCR4蛋白的表达量显著高于空白对照组和阴性对照组(P<0.01),CXCL12蛋白的表达量显著低于空白对照组和阴性对照组(P<0.01),MMP-2蛋白表达量显著高于空白对照组和阴性对照组(P<0.01)。
2.2RT-PCR检测分别转染CXCR4-siRNA和pcDNA3.1-CXCR4后CXCR4、CXCL12及MMP-2mRNA的变化体外通过脂质体介导瞬时转染CXCR4-siRNA和pcDNA3.1-CXCR4,在转染72 h后收集细胞,提取各组细胞中的总RNA。经RT-PCR检测,并通过2-△△Ct计算目的基因CXCR4、CXCL12及MMP-2 mRNA的相对表达量。结果显示:转染CXCR4-siRNA后CXCR4的mRNA表达量显著低于空白对照组和阴性对照组(P<0.01),CXCL12的mRNA表达量显著高于空白对照组和阴性对照组(P<0.01),MMP-2的mRNA表达量显著低于空白对照组和阴性对照组(P<0.01);转染pcDNA3.1-CXCR4后CXCR4的mRNA表达量显著高于空白对照组和阴性对照组(P<0.01),CXCL12的mRNA表达量显著低于空白对照组和阴性对照组(P<0.01),MMP-2的mRNA表达量显著高于空白对照组和阴性对照组(P<0.01,图2~4)。

图1 Western blot检测CXCR4-siRNA(A)和 pcDNA3.1-CXCR4(B)转染MDA-MB-231细胞后CXCR4、CXCL12及MMP-2蛋白的表达
2.3划痕实验检测分别转染CXCR4-siRNA和pcDNA3.1-CXCR4后MDA-MB-231细胞迁移能力的变化沿6孔板的直径均匀用力划痕后,转染CXCR4-siRNA和pcDNA3.1-CXCR4,检测干扰CXCR4基因的表达对MDA-MB-231细胞迁移能力的影响。从倒置显微镜中细胞划痕的图像可见,在转染CXCR4-siRNA 72 h后与空白对照组和阴性对照组相比,实验组细胞间距宽于对照组,愈合距离比大于对照组,且差异有统计学意义(P<0.01),提示转染CXCR4-siRNA后细胞的迁移能力下降,划痕愈合迟缓,下调CXCR4基因的表达可抑制肿瘤细胞的迁移;在转染pcDNA3.1-CXCR4 72 h后与空白对照组和阴性对照组相比,实验组细胞间距窄于对照组,愈合距离比小于对照组,且差异有统计学意义(P<0.01,图5),提示转染pcDNA3.1-CXCR4后细胞的迁移能力增强,划痕愈合加快,上调CXCR4基因的表达可促进肿瘤细胞的迁移。

图2 RT-PCR检测各组MDA-MB-231细胞中CXCR4 mRNA水平表达
A.转染CXCR4-siRNA组;B.转染pcDNA3.1-CXCR4组;**P<0.01

图3 RT-PCR检测各组MDA-MB-231细胞中CXCL12 mRNA水平表达
A.转染CXCR4-siRNA组;B.转染pcDNA3.1-CXCR4组;**P<0.01
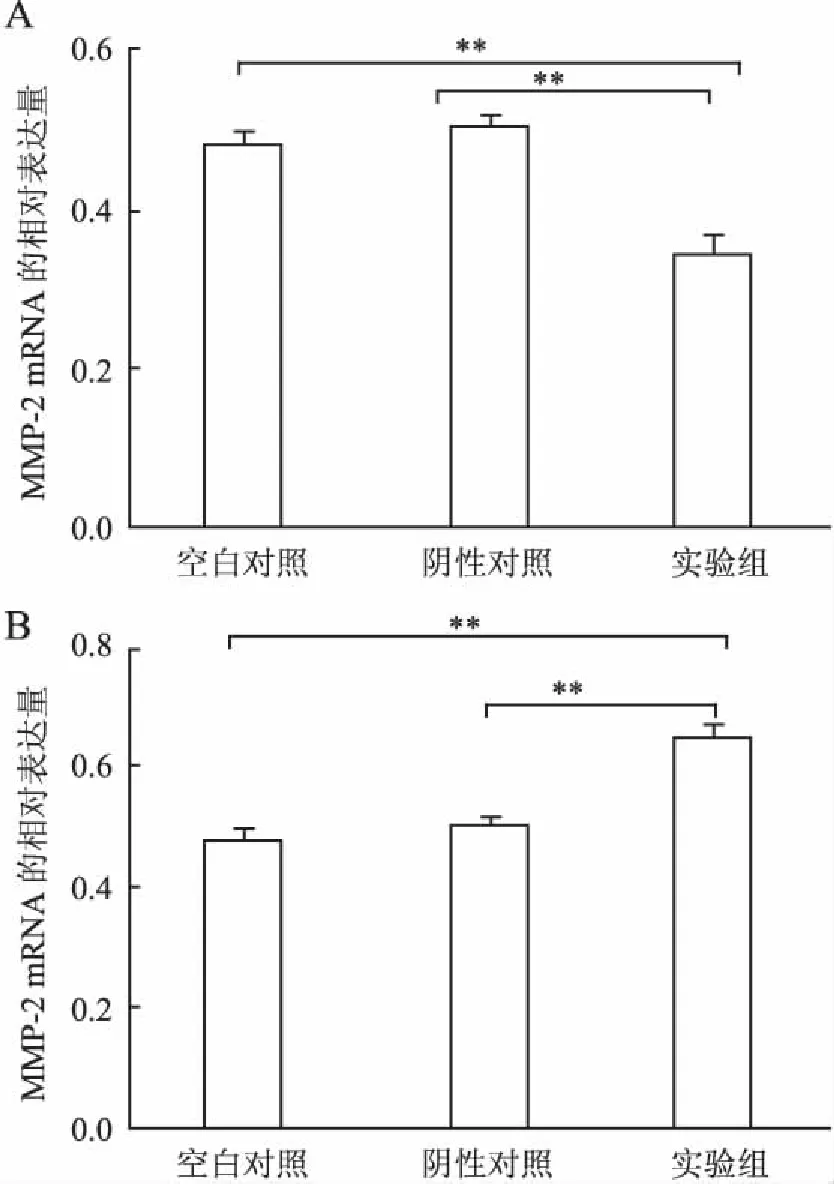
图4 RT-PCR检测各组MDA-MB-231细胞中MMP-2 mRNA水平表
A.转染CXCR4-siRNA组;B.转染pcDNA3.1-CXCR4组;**P<0.01
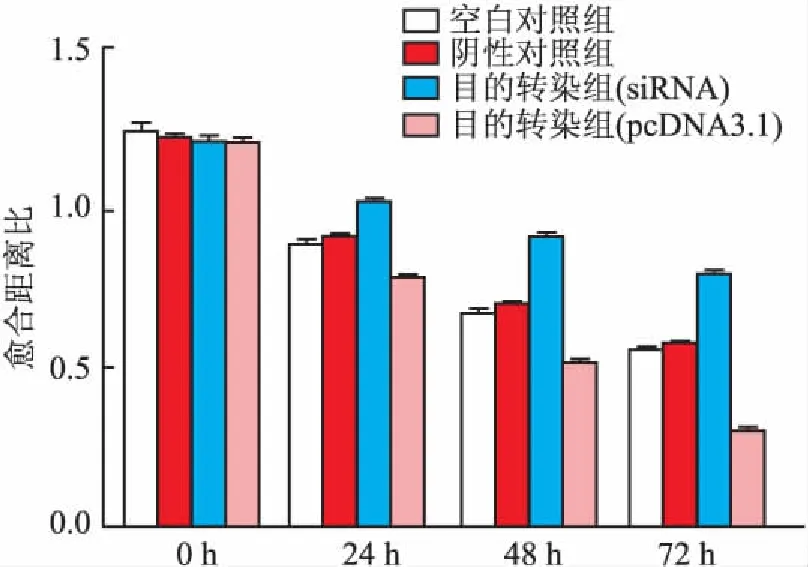
图5 细胞划痕实验检测CXCR4-siRNA和pcDNA3.1-CXCR4转染MDA-MB-231后细胞迁移能力变化
2.4MTT实验检测分别转染CXCR4-siRNA和pcDNA3.1-CXCR4后MDA-MB-231细胞增殖能力的变化应用MTT法检测各组细胞的增殖能力,结果显示:CXCR4-siRNA 转染MDA-MB-231细胞48、72、96 h后,实验组细胞增殖能力较阴性对照组和空白对照组降低,其中以72 h降低最为显著,差异有统计学意义(P<0.05);阴性对照组和空白对照组相比,差异无统计学意义(P>0.05),提示下调CXCR4的表达能够显著抑制MDA-MB-231细胞的增殖能力。pcDNA3.1-CXCR4转染MDA-MB-231细胞48 、72、96 h后,实验组细胞增殖能力与阴性对照组和空白对照组相比显著增加,其中以72 h降低最为显著,差异有统计学意义(P<0.05);阴性对照组与空白对照组相比,差异无统计学意义(P>0.05,图6)。提示下调CXCR4的表达能够显著促进MDA-MB-231细胞的增殖能力。
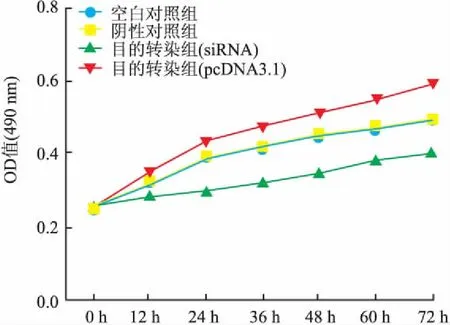
图6 MTT实验检测转染CXCR4-siRNA和pcDNA3.1-CXCR4后细胞增殖能力的变化
3 讨论
乳腺癌是女性最常见的恶性肿瘤,WHO(2014)乳腺肿瘤分类的统计数据显示乳腺癌占女性肿瘤的16%,每年约50万以上的患者死亡。其中三阴型乳腺癌占浸润性乳腺癌的15%~20%,具有侵袭性强、病理分级高和广泛的淋巴结转移,且在年轻患者中更为常见[3]。与其他亚型的乳腺癌相比,三阴型乳腺癌患者在治疗2~3年后发生远处转移和早期复发的可能性较高,患者的生存率更低。因此,立足分子水平深入分析三阴型乳腺癌的浸润和转移机制有重要的临床意义。
CXCL12是趋化因子CXC亚家族成员,并在肺、肝、骨髓和淋巴结等组织中广泛表达。研究发现CXCL12与其受体CXCR4结合在造血过程中发挥重要作用,即调控骨髓造血干细胞的归巢和驱使淋巴细胞转运至炎症部位[4]。CXCR4是存在于细胞表面的7次跨膜G蛋白偶联受体,在正常状态下CXCR4多表达于白细胞、内皮和上皮细胞的表面。在肿瘤中CXCR4参与多种实体肿瘤的发生与转移,如乳腺癌[5]、肾透明细胞癌[6]、结直肠肿瘤[7]、卵巢透明细胞癌[8]和子宫颈鳞癌[9]等,并与肿瘤的不良预后相关。有研究报道在局灶晚期乳腺癌中CXCR4过表达组肿瘤复发的相对危险度和肿瘤死亡的相关危险度均显著高于CXCR4低表达组[10]。Holm等[11]在103例乳腺癌样本中证实存在CXCR4过表达,并与肿瘤大小、淋巴结转移、ER/PR及HER-2的表达差异无统计学意义,但CXCR4高表达且HER-2阴性的乳腺癌侵袭性更强且更易复发,CXCR4可作为评估HER-2阴性乳腺癌的侵袭性生物学行为指标。Wu等[5]研究结果显示CXCR4在乳腺癌中的表达显著高于癌旁正常组织,而CXCL12在两者之间的表达差异无统计学意义,CXCL12在原发性乳腺癌和淋巴结转移的乳腺癌中表达存在差异。有研究报道[12]在151例三阴型乳腺癌中有近75%的病例存在CXCR4高表达,CXCR4高表达组患者肿瘤复发和发生癌症相关死亡原因的概率是CXCR4低表达组的6倍。
本实验选用人三阴型乳腺癌细胞株MDA-MB-231作为分析对象,通过体外瞬时转染技术分别转染CXCR4-siRNA和pcDNA3.1-CXCR4,干扰CXCR4的表达,并通过Western blot和RT-PCR检测转染效果,结果显示CXCR4在蛋白水平和mRNA水平的表达均发生相应改变,证实转染有效。继而从细胞增殖、迁移运动能力以及MMP-2表达变化等方面探讨CXCL12/CXCR4信号通路与MMP-2的关系,以期为三阴型乳腺癌浸润转移的阻断治疗提供理论基础。
CXCR4除诱导白细胞的迁移,还是B淋巴细胞生成和骨髓生成所必需的诱导因子,CXCR4通过与CXCL12相互作用,诱导造血干细胞细胞骨架的重排,增加细胞之间的黏附,诱导它们迁移至特定的器官,并促进肿瘤细胞增殖,直接或以旁分泌的方式促进血管生成,最终形成转移性肿瘤[13]。间质的成纤维细胞构成乳腺癌细胞微环境的主要部分,研究报道肿瘤相关成纤维细胞(并非正常的乳腺成纤维细胞)中CXCL12呈高表达[14],CXCL12的表达通过直接增强肿瘤细胞生长和通过招募肿瘤血管生成所需的内皮祖细胞,促进乳腺癌的浸润和转移。
本组在MTT实验和细胞划痕实验中发现,下调CXCR4表达,乳腺癌MDA-MB-231细胞的增殖和迁移能力受到明显抑制;而上调CXCR4表达,乳腺癌MDA-MB-231细胞的增殖和迁移能力明显增强,表明肿瘤中CXCR4表达的增加会刺激肿瘤细胞的增殖和侵袭性,并可能与间质肿瘤相关成纤维细胞中的CXCL12共同作用,改变肿瘤的微环境,进而促进肿瘤的浸润转移。
细胞外基质的降解在肿瘤的浸润和侵袭过程中起重要作用,其中细胞外基质的降解主要依靠蛋白水解酶,MMP是蛋白水解酶中较为重要的一类,MMP-2是最主要的降解细胞外基质的水解酶。本实验结果显示MDA-MB-231细胞转染CXCR4-siRNA后MMP-2的表达降低,而转染pcDNA3.1-CXCR4后MMP-2表达上调,提示三阴型乳腺癌MDA-MB-231细胞中CXCR4诱导MMP-2的活化,进而促进肿瘤的浸润转移。这与CXCR4/MMP-2在前列腺癌[2]、肺癌和甲状腺癌[15-16]浸润转移中的研究结果一致,但具体机制仍有待进一步分析。
综上所述,在三阴型乳腺癌中存在CXCL12/CXCR4/MMP-2信号通路的激活,下调CXCR4可以抑制乳腺癌细胞的增殖和迁移,还需深入探讨三阴型乳腺癌浸润转移的分子机制。
[1] Bryan B B, Schnitt S J, Collins L C,etal. Ductal carcinoma in situ with basal-like phenotype: a possible precursor to invasive basal-like breast cancer[J]. Mod Pathol, 2006,19(5):617-621.
[2] Ying X, Jing L, Ma S,etal. GSK3β mediates pancreatic cancer cell invasion in vitro via the CXCR4/MMP-2 pathway[J]. Cancer Cell Int, 2015,15:70.
[3] Foulkes W D, Smith I E, Reis-Filho J S. Triple-negative breast cancer[J]. N Engl J Med, 2010,363:1938-1948.
[4] Sharma M, Afrin F, Tripathi R P,etal. Transgene expression study of CXCR4 active mutants. Potential prospects in up-modulation of homing and engraftment effciency of hematopoietic stem/progenitor cells[J]. Cell Adhes Migr, 2014,8:384-388.
[5] Wu W, Qian L, Chen X,etal. Prognostic significance of CXCL12, CXCR4, and CXCR7 in patients with breast cancer[J]. Int J Clin Exp Pathol, 2015,8(10):13217-13224.
[6] Li G, Badin G, Zhao A,etal. Prognostic value of CXCR4 expression in patients with clear cell renal cell carcinoma[J]. Histol Histopathol, 2013,28(9):1217-1222.
[7] Huang W S, Hsieh M C, Huang C Y. The association of CXC receptor 4 mediated signaling pathway with oxaliplatin-resistant human colorectal cancer cells[J]. PLoS One, 2016,26,11(9) :e0159927.
[8] Sekiya R, Kajiyama H, Sakai K,etal. Expression of CXCR4 indicates poor prognosis in patients with clear cell carcinoma of the ovary[J]. Hum Pathol, 2012,43(6):904-910.
[9] 王文普,孙 红. 子宫颈鳞状细胞癌中p16和CXCR4的表达及意义[J]. 临床与实验病理学杂志, 2013,29(8):914-918.
[10] Hiller D J, Meschonat C, Kim R,etal. Chemokine receptor CXCR4 level in primary tumors independently predicts outcome for patients with locally advanced breast cancer[J]. Surgery, 2011,150(3):459-465.
[11] Holm N T, Byrnes K, Li B D,etal. Elevated levels of chemokine receptor CXCR4 in HER-2 negative breast cancer specimens predict recurrence[J]. J Surg Res, 2007,141(1):53-59.
[12] Chu Q D, Panu L, Holm N T,etal. High chemokine receptor CXCR4 level in triple negative breast cancer specimens predicts poor clinical outcome[J]. J Surg Res, 2010,159(2):689-695.
[13] Teicher B A. Antiangiogenic agents and targets: a perspective[J]. Biochem Pharmacol, 2011,81(1):6-12.
[14] Orimo A, Gupta P B, Sgroi D C,etal. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion[J]. Cell, 2005,121:335-348.
[15] Ghosh M C, Makena P S, Gorantla V,etal. CXCR4 regulates migration of lung alveolar epithelial cells through activation of Rac1 and matrix metalloproteinase-2[J]. Am J Physiol Lung Cell Mol Physiol, 2012,302(9):L846-L856.
[16] Zhu X, Bai Q, Lu Y,etal. Expression and function of CXCL12/CXCR4/CXCR7 in thyroid cancer[J]. Int J Oncol, 2016,48(6):2321-2329.

