植物生长调节剂对刨花润楠种子发芽的影响
张冬生,邓春亮,黄锦荣,范剑明,谢金兰
(1.梅州市林业科学研究所,广东 梅州 514011; 2.嘉应学院,广东 梅州 514015)
刨花润楠为亚热带不可多得的园林绿化树种,目前华南地区常用绿化树种中还未见有刨花润楠。刨花润楠春梢呈鲜红色,观赏价值高;花量大,是重要的蜜源植物之一;整株树体利用率高,可做香粉、粘合剂,提取精油、单宁等;且其根深常绿,适应性强的生长特性适合园林绿化[1]。因此研究刨花润楠种子培育具有重要的现实意义。
关于刨花润楠的观赏性评价,本文作者已作讨论[1]。目前,国内外在刨花润楠幼苗生长栽培方面已有不少报道[2-6],对刨花润楠种子培育的报道较少。胡希华[7]、张冬生等[8]讨论了刨花润楠种子随采随种的育苗技术,陶遂刚[9]讨论了刨花润楠种子的容器育苗技术,但他们研究的种子均未进行外源植物生长调节剂处理;陈怡佳等[10]采用组培育苗的方式研究表明GA33种质量浓度处理(500、1000、1500 mg·L-1)对刨花润楠种子萌芽率分别为65%、78%、70%。然而采用不同的培养技术,所得结果会有很大的差异。种子的发芽过程与植物生长调节剂的种类、含量及浓度配比等有着密切的关系。目前,国内外还未有关于不同植物生长调节剂处理对刨花润楠种子培育影响的报道,此研究可为种苗繁育提供技术参考。
本文作者已运用TOPSIS及模糊综合评价法对梅州市平远县、梅县区、丰顺县2012—2015年调查初选出的25株野生刨花润楠进行了评价,评价结果得出,编号为2014-18,2015-19,2012-01属于一级品,其中2014-18综合得分最高,观赏价值最高[1]。为探究刨花润楠种子发芽及生长的适应条件,对前期工作评选出的一级品优良单株2014-18的种子进行采摘、培育。对采回的种子分别用4种植物生长调节剂,每种植物生长调节剂6种浓度处理,进行双因子试验,研究不同植物生长调节剂、浓度对刨花润楠种子发芽及生长的影响。
1 材料与方法
1.1 试验地概况
试验于2015年5月26日—6月27日在梅州市林业科学研究所的苗圃场进行。苗圃场位于115°18′—116°56′E、23°23′—24°56′N,年均气温20.6~21.4 ℃;年均日照时间1714.6~2010.5 h,年日照百分率为41%~47%,年均降水量1483~1798 mm。
1.2 试验材料
1.2.1 供试材料 在刨花润楠种子成熟季节,于2015年5月25日采摘观赏价值最高的2014-18号树的种子,并挑选出蓝黑色成熟饱满的种子,在常温下用清水洗去种皮,然后用0.1%高锰酸钾溶液进行灭菌处理2 min,再用清水冲洗10~15 min,呈现原有种子色泽为宜。
1.2.2 植物生长调节剂 选用赤霉素(GA3)、双吉尔(生根粉)(GGR)、吲哚丁酸(IBA)、萘乙酸(NAA)。其中,GGR购于北京艾比蒂生物科技有限公司,其余3种植物生长调节剂均购于广州市林国化肥有限公司。另外,准备口径为6 cm、高8 cm的经紫外线消毒好的玻璃容器,备用。
1.3 试验设计与方法
采用双因子试验设计,植物生长调节剂为A因素,浓度为B因素。4种植物生长调节剂:GA3、GGR、IBA、NAA分别记为:A1、A2、A3、A4,每一种植物生长调节剂均设6个水平:10、50、100、200、300、500 mg·L-1,分别记为:B1、B2、B3、B4、B5、B6,共24种处理。以清水处理为对照(CK)。
按试验设计将配制好的植物生长调节剂溶液倒入口径为6 cm、高8 cm的经紫外线消毒好的玻璃容器中,然后将准备好的无菌种子投入其中浸泡24 h,每瓶30粒种子,3次重复。浸泡条件:室内、室温、日光均匀。
将浸泡处理后的种子用清水冲洗3~5 min,然后将清洗后的种子播种在装有黄心土的营养袋中,覆土0.5 cm遮盖,营养袋置于露天苗床,整齐分组摆放,苗床拱盖农用尼龙薄膜,上方架设75%的遮阳网遮荫,防止阳光直射,整个苗床播种条件一致。
播种后第19天~第31天,进行跟踪测量,观察种子随时间变化的发芽规律,并对这13 d的发芽情况进行双因素重复测量的方差分析;然后于发芽结束时,即种子发芽的第31天对发芽数及苗高进行统一测量,观测种子发芽生长分布情况。对不同处理下的发芽率及苗高进行双因素方差分析,并用发芽势、发芽率、发芽指数、平均发芽天数对种子的发芽情况进行衡量。
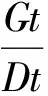
1.4 数据分析
数据采用Excel及SPSS软件进行统计分析。
2 结果与分析
2.1 不同植物生长调节剂及浓度对刨花润楠种子发芽势的影响
种子的发芽有快有慢,种子的发芽势是衡量种子发芽能力、种子活力的一项重要指标。从图1整体上看,随着时间的增加,不同植物生长调节剂及浓度处理的种子发芽势快速增长,至第24、25天时,一些处理发芽暂停;随后,发芽又快速增长;至第27、28天时,发芽又出现暂停;随后又继续增加,到第29天时,绝大多数处理种子的发芽率已达到70%以上;到第30、31天时,发芽率已基本稳定。绝大多数处理在这13 d的发芽情况与对照组存在明显差异,说明绝大多数处理的种子活力比对照组强。

图1 不同植物生长调节剂及浓度处理下刨花润楠种子的发芽势
2.2 不同植物生长调节剂及浓度对刨花润楠种子发芽率及苗高的影响
为确保结果的准确性,先对第19~31天,共13 d的种子发芽率重复测量数据,进行球形性检验[11],检验结果见表1,球形度显著性概率P值为0.000小于0.05,说明发芽率不满足球形对称假设。因此用Geisser系数0.270对自由度进行调整,调整后的方差分析结果(表2)表明,植物生长调节剂、浓度及植物生长调节剂与浓度的交互作用的显著性概率值P值均小于0.05,说明不同植物生长调节剂、浓度及植物生长调节剂与浓度的交互作用对种子发芽率的影响存在显著差异。与图1不同植物生长调节剂浓度处理的发芽势呈现的差异性相符。
再由种子发芽至第31天时的发芽率及幼苗苗高的方差分析(表3、表4)可知,植物生长调节剂、浓度及植物生长调节剂与浓度交互作用的显著性概率P值均小于0.05,说明不同植物生长调节剂、浓度及植物生长调节剂与浓度的交互作用对种子的发芽率及幼苗苗高影响显著,即不同植物生长调节剂、浓度处理的种子的生长与对照差异显著。

表1 发芽率球形度检验
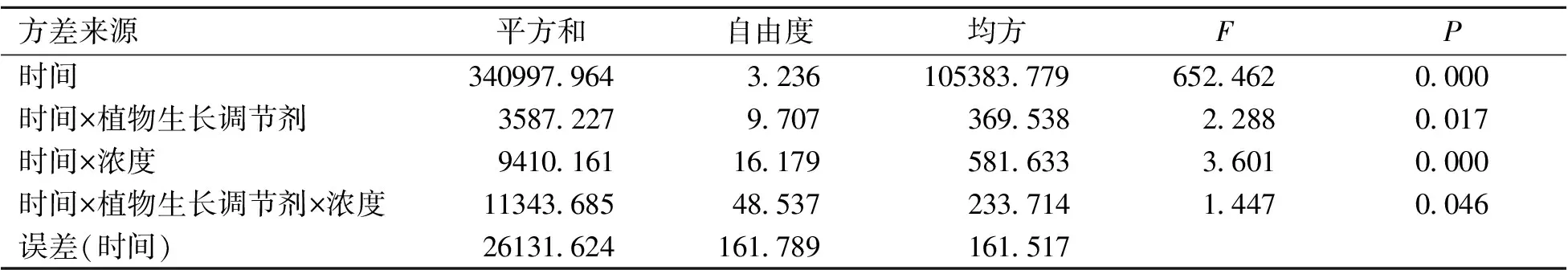
表2 Geisser系数修正自由度后的重复测量方差分析
2.3 不同植物生长调节剂对刨花润楠种子发芽及生长的影响
根据种子发芽第31天的相关指标进一步分析,找出种子发芽生长的最佳植物生长调节剂和浓度。由表5可知,GA3、GGR、IBA处理的发芽率、发芽指数、平均苗高三者间相差不大,但均明显高于对照;平均发芽天数也较接近,均小于对照。其中GA3处理的发芽指数最高,平均发芽天数最短,幼苗的平均苗高最高,达4.51 cm;GGR处理的发芽率最高,但发芽指数比GA3处理低,即种子的活力比GA3处理的种子差些,平均发芽天数也比GA3处理长些,其幼苗平均苗高4.09 cm仅次于GA3处理;再次是IBA处理;而NAA处理效果最差,其发芽指数及发芽率只是略高于对照组,平均发芽天数也比对照组长。从整体上看,GA3处理的种子活力最强,平均发芽时间最短,成苗的幼苗平均苗高最高。

表3 发芽第31天刨花润楠种子发芽率方差分析

表4 发芽第31天刨花润楠种子幼苗苗高方差分析

表5 外源植物生长调节剂对刨花润楠种子发芽及幼苗的影响
2.4 不同浓度的植物生长调节剂对刨花润楠种子发芽及生长的影响
不同植物生长调节剂在不同浓度下对种子发芽的影响也存在不同的差异。
2.4.1 赤霉素GA3不同浓度对种子发芽及幼苗的影响 由表6可知,种子在GA3不同浓度处理下,各项指标均与对照组差异显著,其中B2处理下发芽率、发芽指数最高。种子在不同浓度下的平均发芽天数及幼苗的平均苗高差异不明显,发芽天数平均相差不到0.5 d,平均苗高相差不超过0.5 cm。从总体上看,种子在GA350 mg·L-1处理下发芽效果最佳。
2.4.2 GGR不同浓度对种子发芽及幼苗的影响 由表7可知,种子在GGR不同浓度处理下的平均发芽天数差异不明显,平均苗高相差也不大。其中B3100 mg·L-1处理下发芽率、发芽指数最高,发芽效果最佳。

表6 GA3不同浓度对刨花润楠种子发芽及幼苗的影响

表7 GGR不同浓度对刨花润楠种子发芽及幼苗的影响
2.4.3 IBA不同浓度对种子发芽及幼苗生长的影响 由表8可知,种子在IBA不同浓度处理下,B5处理的发芽率最高(90%),发芽指数次高(9.12);在B3处理下发芽指数最高(9.13),发芽率次高(87%)。B5与B3处理间的平均发芽天数、幼苗平均苗高差异不明显。相对来讲,种子在IBA 300 mg·L-1处理下发芽效果较佳。

表8 IBA不同浓度对刨花润楠种子发芽及幼苗的影响

表9 NAA不同浓度对刨花润楠种子发芽及幼苗的影响
2.4.4 NAA不同浓度对种子发芽及幼苗生长的影响 由表9可知,种子在NAA不同浓度处理下,B3处理的发芽率最高(90%),发芽指数次高(8.09);在B1处理下发芽率次高(85.56%),发芽指数最高(8.53)。B3与B1处理的平均发芽天数、幼苗平均苗高同样非常接近。从发芽的整齐性来看,种子在NAA 100 mg·L-1处理下的发芽效果较佳。
3 结论与讨论
本研究结果表明,4种植物生长调节剂都有其最佳发芽浓度。从表10可知,GA350 m·L-1处理的种子发芽指数最高、发芽天数最短、幼苗平均苗高最高,属于快长型;且其发芽率也达到88.89%。与陈怡佳[10]采用组培方式,用GA31000 mg·L-1处理的种子发芽率78%相比,要高出10.89%。说明本文方法较陈怡佳的方法更优。而NAA 100 mg·L-1处理的种子发芽率最高,即发芽最整齐,但发芽指数最低,平均发芽天数最长,幼苗平均苗高最矮,是属于慢长型的。GGR 100 mg·L-1、IBA 300 mg·L-1处理的种子各项指标居中,与GA3、NAA相比,种子发芽生长不快不慢。

表10 各植物生长调节剂最佳浓度发芽及苗高情况
因此,在种苗繁育的生产过程中,如果希望幼苗强壮,则选择GA350 mg·L-1浸种;如果希望种子发芽更整齐,发芽率更高,则选择NAA 100 mg·L-1浸种;而GGR 100 mg·L-1或IBA 300 mg·L-1浸种则根据具体情况进行选用。
然而本研究没有找到一致最优的处理,即使用某一植物生长调节剂、某一浓度浸种,刨花润楠种子发芽率最高、最整齐,发芽指数最高,发芽的平均时间最短,且长出的幼苗苗高最高。另外,本文只研究了种子发芽期间的发芽生长情况,随着时间的增长,经过0.5 a或1 a,苗木生长的各项指标可能会发生变化,也有待进一步跟踪研究。但本研究选出的4种较优的处理,可为刨花润楠种子的发芽培育提供参考。且种子采用植物生长调节剂浸泡处理后直接点播的培育方法成本低,效率高,运用简便,因此具有一定的现实意义。
[1]张冬生,邓春亮.TOPSIS及模糊综合评价法在植物观赏特性评价中的应用[J].福建林业科技,2017,44(2):117-122,156.
[2]刘全勇,卢锟,李泽,等.水分胁迫对刨花润楠幼苗生长及光合特性的影响[J].中南林业科技大学学报,2016,36(9):29-35,43.
[3]胡厚臻,侯文娟,潘启龙,等.配方施肥对刨花润楠幼苗生长和光合生理的影响 [J].西北林学院学报,2015,30(6):39-45.
[4]蓝肖,梁瑞龙,周全连.刨花润楠栽培技术初探 [J].广西林业科学,2008,37(4):203-205.
[5]郭雄飞,陈红跃.间作对刨花润楠幼苗生长及土壤特性的影响[J].现代农业科技,2016(15):143.
[6]董国华.坡向与造林密度对刨花润楠幼林生长的影响[J].福建林业科技,2010,37(4):70-72.
[7]胡希华.刨花润楠的优良特性及育苗栽培技术[J].湖南林业科技,2006,33(1):65-66.
[8]张冬生,张锡洲,谢金兰,等.刨花润楠播种育苗技术探讨[J].园艺与种苗,2016(2):13-14,17.
[9]陶遂刚.刨花润楠容器育苗与栽培技术探讨 [J].绿色科技,2015(8):60-61.
[10]陈怡佳,鲁好君,赵帅,等.刨花润楠组织培养技术的初步研究[J].植物生理学报,2016,52(10):1519-1526.
[11]张文彤,董伟.统计分析高级教程[M].2版.北京:高等教育出版社,2013:53-60.

