胶原蛋白/壳聚糖共混材料的制备及性能研究
杨艳玲
(潍坊科技学院,山东 寿光 262700)
科技进展
胶原蛋白/壳聚糖共混材料的制备及性能研究
杨艳玲
(潍坊科技学院,山东 寿光 262700)
将壳聚糖醋酸溶液与胶原蛋白溶液按一定比例共混制备出一系列胶原蛋白/壳聚糖共混材料,对共混材料进行结构表征,并研究了胶原蛋白/壳聚糖共混溶液的粘度,以及胶原蛋白/壳聚糖共混材料的吸水性能、和断面微观形貌。实验结果表明,胶原蛋白和壳聚糖之间有较强的相互作用,随着壳聚糖含量的增加,共混材料的粘度逐渐减小,吸水率逐渐增加,共混膜的玻璃化转变温度比胶原蛋白和壳聚糖的玻璃化转变温度都低,断面脆性较大。
壳聚糖 胶原蛋白 物理共混
壳聚糖是自然界中唯一的碱性天然多糖高分子材料,其化学性质较为活泼[1]。由于其良好的可生物再生性、生物降解性、生物相容性、生物功能性以及无毒性,目前已经被广泛应用于生物医药、食品及日化等领域,但是壳聚糖不具备生物活性,而且其可加工性较差。胶原蛋白具有多肽分子结构,含有大量亲水基团,具有抗氧化活性、抑制血压上升等作用。但胶原蛋白存在机械强度较低、亲水性强等性能缺陷。将胶原和壳聚糖进行复合,可以在性能上互相补充,赋予单一材料所不具有的许多特性,并在一定程度上有效改善二者的缺陷。目前以胶原和壳聚糖为原料的研究是医用材料和生物材料领域的热点。
叶易春,但卫华等[2]研究发现,胶原与壳聚糖分子间的作用力使得其复合材料具有作为优良生物材料的潜力。周玉惠等[3]将胶原蛋白与两种去乙酰度(95%,85%)的壳聚糖分别配成不同质量比的乙酸共混溶液,在28℃下测定了共混液的粘度,利用毛细管粘度法能简单准确地表征胶原蛋白与壳聚糖的相容性。付强等[4]用壳聚糖以不同比例与胶原共混以改善胶原膜性能。当壳聚糖在共混膜中所占比例较少时,膜的热稳定性得到改善。Ye[5]等的研究证实,壳聚糖大分子链是纤维刚性结构,含有大量的氨基和羟基,使之具有很强的吸附作用,容易与含两性基团的胶原蛋白分子产生分子间的静电吸引作用,形成聚电解质配合物网络。
将胶原蛋白与壳聚糖共混改性,既保持了天然材料的特有性能,又避免引入化学物质,之后采用不同手段进行后期干燥处理,使二者性能得到最佳复合,制备出性能优良的共混材料。
1实验部分
1.1 实验试剂和仪器

胶原蛋白(M=600~2000)生物试剂山东青州隆贝生物科技有限公司壳聚糖生物试剂国药集团化学试剂有限公司氢氧化钠分析纯国药集团化学试剂有限公司乙酸分析纯莱阳市康德化工有限公司IRPrestige-21型傅里叶变换红外光谱仪日本岛津公司TAQ-10型差示扫描量热仪美国TA仪器101-2A型电热鼓风干燥箱天津市泰斯特仪器有限公司Quanta200型环境扫描电镜(ESEM)荷兰FEI公司DV-E粘度计美国Brookfield公司
1.2 胶原蛋白/壳聚糖共混材料的制备
配制质量分数为1.5%的壳聚糖(含1%乙酸溶液)溶液和质量分数为1.5%的胶原蛋白溶液。将胶原蛋白与壳聚糖溶液按一定比例混合搅拌均匀,超声脱气20 min。将胶原蛋白/壳聚糖共混溶液置于聚四氟乙烯模具中,于25 ℃下干燥成膜。所有胶原蛋白/壳聚糖共混膜的编号及配比如表1所示。
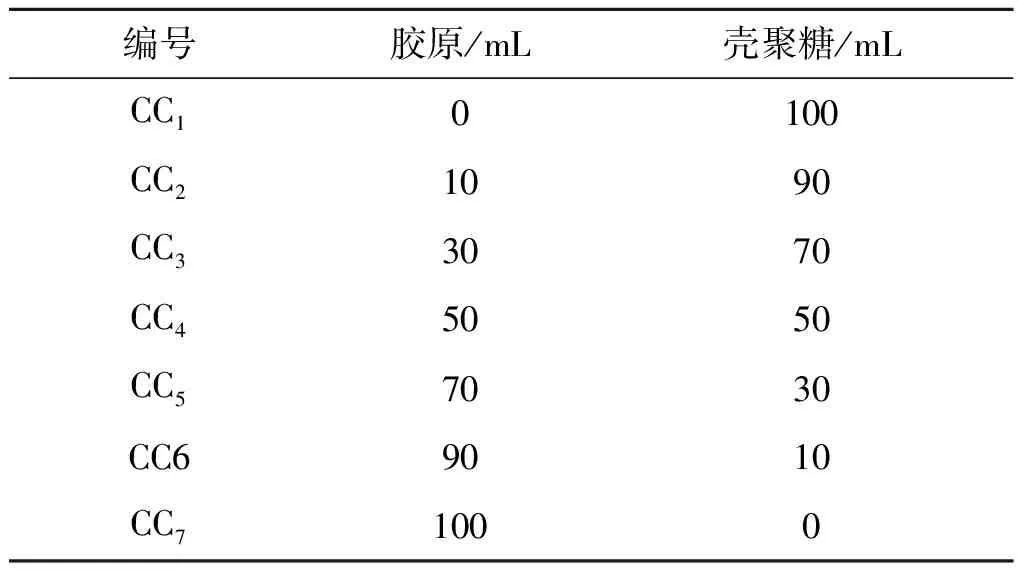
表1 胶原蛋白/壳聚糖共混膜的编号及配比表Table 1 The number and proportion of collagen/chitosan blending membrane
1.3 表征与测试
粘度测定:采用美国Brookfield公司生产的的DV-E粘度计来测定胶原蛋白/壳聚糖共混溶液的粘度,选用2、3号转子,转速都设定为100 rpm,在室温下测定共混溶液的粘度。
将裁好的样品膜准确称重后放入烧杯中,加入到2%的氢氧化钠溶液中,浸泡2h后取出。用滤纸迅速吸干表面水份,准确称量膜的质量,计算吸水率。
采用傅里叶变换红外光谱仪对样品膜进行红外光谱分析,KBr压片制样。
使用TAQ-10差示扫描量热仪测定样品膜的DSC曲线,其升温速率控制为10 ℃/min。
将样品膜采用液氮冷却处理后掰断,断面真空喷金后,用环境扫描电镜观察断面微观形貌。
2结果与讨论
2.1 红外光谱分析
为了表征胶原蛋白和壳聚糖共混后结构变化,分别测定了共混膜CC1、CC3和CC7的红外光谱,如图1所示。
从图1可知,胶原蛋白的特征吸收峰分别为:酰胺Ⅰ带(1 651.1cm-1)、酰胺Ⅱ带(1 541.1 cm-1)和酰胺Ⅲ带(1 242.2 cm-1)。壳聚糖在1 595.1cm-1处N-H弯曲振动吸收峰强度较大,无明显的酰胺Ⅱ带(1 550 cm-1) ,1 660.7cm-1处为酰胺Ⅰ带的特征吸收峰,1 323.2 cm-1处为酰胺Ⅲ带的特征吸收峰。

图1 胶原蛋白/壳聚糖共混材料的红外光谱 (CC1为壳聚糖、CC3为共混材料、CC7为胶原蛋白)Fig 1 IR spectra of collagen / chitosan blending material (CC1 is chitosan, CC3 is the blend material, CC7 is collagen)
胶原蛋白/壳聚糖共混膜CC3的红外光谱中,胶原蛋白的酰胺Ⅰ带没有改变,壳聚糖伯氨基的N-H弯曲振动吸收峰由于氢键作用减弱移至1 558.4 cm-1处。由于氢键作用C-N伸缩振动加强,使胶原蛋白的酰胺Ⅱ带和Ⅲ带吸收峰移至1 546.9 cm-1和1 253.7 cm-1处。同时在1 381.0 cm-1、898.8 cm-1等处吸收峰有所减弱或消失,这些都表明共混后胶原蛋白与壳聚糖之间有较强的相互作用。其他比例的胶原蛋白/壳聚糖共混膜的红外光谱图与CC3的红外光谱图基本一致,就不再列出。

图2 胶原蛋白/壳聚糖共混溶液的粘度与壳聚糖含量的关系图Fig 2 Relation schema between the viscosity and the content of chitosan in collagen/chitosan blending solution
2.2 粘度分析
实验中所合成的所有胶原蛋白/壳聚糖共混溶液都具有良好的储存稳定性,在室温条件下,静置6个月没有沉淀析出。胶原蛋白/壳聚糖共混溶液的粘度与壳聚糖含量的关系如图2所示。
由图2可知,随着壳聚糖含量的逐渐增多,胶原蛋白/壳聚糖共混溶液的粘度逐渐增加。这主要是由于随着壳聚糖含量的逐渐增加,胶原蛋白含量逐渐减小,壳聚糖溶液本身的高粘度特征越来越明显,所以共混溶液的粘度不断增加。
2.3 亲水性能分析
将干燥的样品膜称重(m1)加入到2%的氢氧化钠溶液中浸泡2 h后,吸干表面水分记为m2,将样品膜干燥至恒重记为m3,按下式(1)、(1),计算样品膜的失重率和吸水率。

(1)

(2)
测定胶原蛋白/壳聚糖共混膜在碱性溶液中的失重率和吸水率,如下表所示。

表2 胶原蛋白/壳聚糖共混膜的失重率和吸水率Table 2 Weightlessness rate and water absorption of collagen/chitosan blending membrane
由表2可知,共混膜的失重率随着壳聚糖含量的减小而逐渐增加,共混膜的吸水率随壳聚糖含量的减小而逐渐增大。这种现象是由于壳聚糖在碱性溶液中稳定存在,而胶原蛋白不论在酸性或碱性溶液中都极易吸水溶解的原因。
2.4 热性能分析
为了研究共混后热性能的改变,测定了样品壳聚糖(CC1)、胶原蛋白/壳聚糖共混膜(CC3)和胶原蛋白(CC7)的DSC曲线如图3所示。
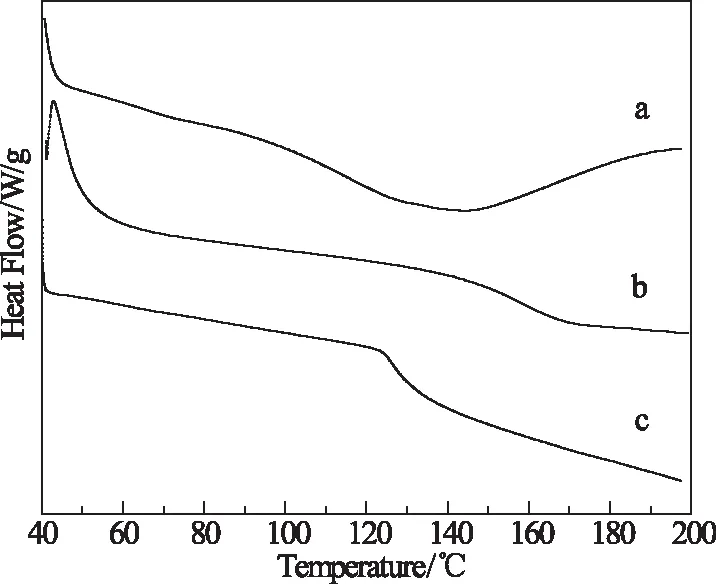
图3 CC1(a)、CC7(b)和CC3(c)的DSC曲线Fig 3 DSC curves of CC1 (a), CC7 (b) and CC3 (c)
由图3可知,壳聚糖CC1的玻璃化转变温度为140.8 ℃,与相关报道一致,胶原蛋白CC7的玻璃化转变温度为168.5 ℃,共混膜CC3的玻璃化转变温度为126.5℃。共混膜的玻璃化转变温度比胶原蛋白和壳聚糖都低,且只有一个玻璃化转变温度,说明胶原蛋白/壳聚糖共混膜具有较好的相容性和较低的玻璃化转变温度。
2.5 ESEM分析
用环境扫描电镜对壳聚糖膜(CC1)和胶原蛋白/壳聚糖共混膜(CC3)的断面微观形貌进行观察,如图4所示。

图4 壳聚糖膜和胶原蛋白/ 壳聚糖共混膜的断面ESEM图片 (CC1 a 800倍、b 1 600倍) (CC3 c 800倍、d 1 600倍)Fig 4 The ESEM pictures of tchitosan membrane and collagen / chitosan blending membrane section (CC1 a 800 times, b 1 600 times) (CC3 C 800 times, D1 600 times)
从图a、b中可以看出,壳聚糖膜的断面比较光滑,但断面有断纹。从图c、d中可以看出,胶原蛋白/壳聚糖共混膜的断面整齐光滑。可见胶原蛋白/壳聚糖共混膜的脆性大于壳聚糖膜。这是由于壳聚糖具有较好的成膜性,但胶原蛋白分子量很小,不具有成膜性,与壳聚糖共混后成膜能力有所增加,但脆性仍然很大。直接观察共混溶液成膜后形态发现,随着壳聚糖含量的减少,共混膜的脆性逐渐增加,与上述分析结果一致。
3结 论
(1)红外光谱分析表明:采用物理共混法制备的胶原蛋白/壳聚糖共混材料中胶原蛋白和壳聚糖之间有较强的相互作用。
(2)随着壳聚糖含量的逐渐减小,胶原蛋白/壳聚糖共混溶液的粘度逐渐减小,而胶原蛋白/壳聚糖共混膜的失重率和吸水率都逐渐增加。
(3)利用差示扫描量热仪研究胶原蛋白/壳聚糖共混膜的DSC曲线变化。结果表明:共混膜的玻璃化转变温度为126.5 ℃比胶原蛋白和壳聚糖的玻璃化转变温度都低。
(4)利用环境扫描电镜表征共混膜的微观形貌。结果表明胶原蛋白/壳聚糖共混膜断面比壳聚糖的断面更加整齐光滑,脆性更大。
[1] 董英,徐自明,徐斌.壳聚糖制备技术的研究进展[J].食品研究与开发,2005,26(5):23~26.
[2] 叶易春,卫华,曾睿,等.胶原与壳聚糖分子间的作用力[J].高分子材料科学与工程. 2007,23(5).
[3] 周玉惠,孙艳斌,刘海,等.胶原蛋白与壳聚糖相容性研究[J].胶体与聚合物.2008,26(1).
[4] 付强,李国英.壳聚糖-胶原共混改善胶原膜性能的研究[J].中国皮革.2007,36(5).
[5] Ye Y C, Dan W H,Zeng R,et al. Miscibility studies on the blends of collagen/chitosan by dilute solution viscometry[J].European Polymer Journal, [6] Dong Y, Ruan Y, Wang H, et al. Studies on glass transition temperature of chitosan with four techniques[J]. Journal of Applied Polymer Science, 2004,93(4):1 553~1 558.
PreparationandPropertiesStudyofCollagenChitosanBlendMaterials
Yang Yanling
(Weifang University of Science and Technology, Shandong Shouguang 262700)
The acetic acid solution of chitosan and collagen solution were mixed in some ratio to prepare a series of collagen/chitosan blending. The structures of blending materials were characterized. The viscosity of collagen/chitosan blend solution, and collagen/chitosan blend materials, water absorption, thermal properties and cross-section morphology were determined. The experimental results showed that there was a strong interaction between collagen and chitosan, with the increase of the content of chitosan ,blending materials viscosity decreased gradually, water absorption rate increased gradually. The glass transition temperature of blending membrane was lower than the glass transition temperature of collagen and chitosan, the brittleness of section was larger.
chitosan collagen physical blending
10.16597/j.cnki.issn.1002-154x.2017.05.001
2017-03-28
杨艳玲(1981~),女,硕士,讲师,主要研究方向:复合材料

