AtGHR1介导拟南芥对LPS先天免疫反应的分子机制研究
铁 英,杨成林,常 诚,王耀辉,孙鸿举
(1.内蒙古和盛生态科技研究院有限责任公司,内蒙古 呼和浩特 010010;2.呼和浩特启秀中学,内蒙古 呼和浩特 010000;3.内蒙古大学 生命科学学院,内蒙古 呼和浩特 010021)
植物依赖细胞质膜模式识别受体(Pattern-recognition receptors,PRRs)来识别微生物表面的特异组分,即病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)[1]。这是植物先天免疫的核心机制。植物的模式识别受体和微生物表面的病原相关分子模式相互识别以后,会诱导植物细胞内信号分子的瞬时升高,主要有细胞质Ca和一氧化氮(NO),进一步诱导下游基因表达。
脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的保守成分,具有3个保守的结构:脂A、核心寡糖和O-侧链[2]。LPS是细菌黏附在植物表面的必需组分[3-5]。植物细胞对于LPS具有多层的先天免疫反应,包括活性氧(ROS)、一氧化氮(NO)和细胞内钙离子浓度([Ca2+]cyt)的瞬时升高[6-9],以及下游胼胝质在细胞壁的沉积和防御基因表达[10]。哺乳动物细胞对LPS的识别依赖于细胞质膜中的TLR4(Toll-Like Receptor4 )复合体[11],该复合体由LPS结合蛋白(LPS-Binding Protein ,LBP)、糖基化磷脂酰肌醇锚定蛋白(CD14)、髓样细胞分化蛋白2(Myeloid Differentiation Protein2,MD2)和TLR4蛋白组成。LBP首先与LPS结合,形成LPS-LBP复合体,然后与CD14互作,形成LPS-LBP-CD14复合体[12-14]。形成的三元复合体将LPS转移到MD2,MD2是TLR4重要的辅助因子。最终激活TLR4并依次打开下游的信号转导通路。TLR4具有3个结构域,细胞的亮氨酸富集结构域、跨膜域和细胞质内的激酶结构域。大多数植物的防御反应被100 ng/mL的LPS激活,而在动物中是在pg到ng之间[15-16],植物脂多糖受体对LPS的亲和性与动物相比存在差异。通过氨基酸比对,我们发现拟南芥的AtGHR1蛋白序列同动物细胞的TLR4类似。本研究主要探索了AtGHR1介导的拟南芥对LPS的先天免疫反应。
1 材料和方法
1.1 试验材料
本试验所用的拟南芥野生型材料 (Columbia ecotype,Col-0)、大肠杆菌菌株DH5α、根癌农杆菌菌株GV3101由内蒙古大学祁智教授实验室保存;拟南芥缺失型突变体atghr1-1来源于中国农业大学巩志忠老师;atghr1-2(salk_031493)购自拟南芥生物资源中心(Arabidopsis Biological Resource Center);Primer Star HS DNA Polymerase购自TaKaRa;EasyTaq PCR Supermix DNA聚合酶和T4DNA连接酶购自全式金公司;引物由南京金斯瑞生物科技有限公司合成;Pseudomonassyringaepv.tomatoDC3000购自拟南芥生物资源中心(Arabidopsis Biological Resource Center);表达载体pORE-R1、pORE-R3购自拟南芥生物资源中心(Arabidopsis Biological Resource Center);其他化学试剂购自Sigma公司。
1.2 试验方法
1.2.1AtGHR1编码蛋白的亚细胞定位 以拟南芥野生型Col-0 cDNA为模板,扩增AtGHR1基因的2 934 bp编码序列,所用引物为5′-AAAGCGGCCGCTGGGGCAACTTCCATCACAG-3′和5′-CCCATCGAT TGCTGCTGCAATAGAAGAAAGATCTTCG-3′。以拟南芥野生型Col-0 基因组DNA为模板,扩增AtGHR1的1 477 bp启动子序列,所用引物为5′-TTTCCGCGG CTAGTCAACGTAGTCAGCATGTGG-3′和5′-CCGAAC GTTTGCAGATAGAAAAAACATGGAG-3′。将上述扩增产物克隆连入pEASY-T1(全式金)载体上,然后分别转入E.coliDH5α中测序,测序正确后将AtGHR1启动子和AtGHR1基因克隆入双元载体pORE R3并转化到农杆菌中。将带有AtGHR1基因的农杆菌与带有膜标记蛋白 AtPIP2A∷mCherry 的农杆菌共同注入生长32 d的烟草(Nicotianabenthamiana)叶片中,用激光共聚焦显微镜(Zeiss LSM 510 )记录荧光位置。
1.2.2 拟南芥中AtGHR1 启动子的活性检测 将AtGHR1启动子扩增产物克隆到pEASY-T1(全式金)载体上,然后转入E.coliDH5α中。将测序正确的AtGHR1启动子克隆入双元载体pORE R1报告基因β-葡萄糖苷酸酶基因(GUS)的上游并转化到农杆菌中。利用农杆菌侵染拟南芥野生型Col-0花序,通过抗生素筛选T1阳性苗并进行繁种,继续筛选寻找纯合体阳性苗。将纯合体阳性苗进行GUS酶活染色,检测AtGHR1 启动子的活性。
1.2.3 病原菌感病试验 将拟南芥野生型和突变体atghr1播种在含有1%蔗糖,0.4% Phytagel的1/2 MS基本培养基上,水平生长21 d。在无菌条件下,用无菌水和浓度为5×105cfu/mL的Pst DC3000(guard cell hydrogen peroxide-resistant1)悬液淹没幼苗3 min,然后倒掉悬液,并用灭菌的滤纸吸干剩余的悬液。用透气医用胶布封好培养皿,放到光照培养箱观察表型。叶片内细菌的扩繁密度测定依照Chinchilla等[16]的研究方法。
1.2.4 活性氧的测量 将野生型Col-0与突变体atghr1-1、atghr1-2播种在含1%蔗糖的1/2 MS基本培养基上,水平生长,21 d后分别取1片叶片浸没于100 μL灭菌水中于24 ℃暗室过夜。在弱光条件下用100 μL发光液(0.2 mmol/L鲁米诺和20 μg/mL辣根过氧化物酶的水溶液)置换100 μL无菌水,并静置30 min以上[17]。将样品置于化学荧光测试仪(Luminometer,Turner Biosystem,20/20)测10个计数为背景值(1个计数/10 s),吸取100 μL 200 μg/mL LPS处理液快速加入样品中并测量,LPS终浓度为100 μg/mL。
1.2.5 细胞质钙离子的测量 利用花粉杂交产生细胞质中稳定表达水母发光蛋白的植株Col-0∷aequorin和atglr1-2∷aequorin,将2种植株单个叶片放入1.5 mL离心管中,加入100 μL测钙缓冲液(1 mmol/L KCl,1 mmol/L CaCl2,5 mmol/L MES,pH值5.7),保证植物叶片完全浸入溶液中。在黑暗条件下加入腔肠荧光素(500 μmol/L母液),测试浓度为5 mmol/L(100 μL测钙溶液中加入1 μL腔肠荧光素),黑暗处理4 h以上[17]。放入化学荧光测试仪(Luminometer,Turner Biosystem,20/20),每秒一个点进行检测。首先测100个点的背景值,暂停,加入100 μL 200 μg/mL LPS处理液,LPS终浓度达到100 μg/mL,记录结果。
1.2.6 植物保卫细胞内NO的检测 用镊子撕取野生型Col-0与突变体atghr1-1、atghr1-2的下表皮,用含 5 μmol/L DAF-FM DA (4-氨基,5-甲基氨基,2′,7′-二氯荧光素二乙酸酯)的对照缓冲液(1.0 mmol/L CaCl2,2.5 mmol/L MgCl2,pH值7.6)处理30 min。分别用无菌水或 100 μg/mL LPS处理,产生绿色荧光的保卫细胞用尼康 Eclipse Ti 荧光倒置显微镜观察。为定量DAF-FM DA 荧光,使用 Adobe Photoshop 7.0.1 (Adobe Systems,San Jose,CA,USA) 测量保卫细胞照片的灰度值。
1.2.7 转录组分析 将Col-0 和atghr1-2播种于0.4% 凝胶的1/2MS 培养基上生长21 d后,用无菌水或 100 μg/mL LPS淹没拟南芥Col-0 或atghr1-2 的幼苗,36 h 后提取叶子的 RNA。送北京博奥晶典生物技术有限公司做芯片试验,重复3次试验。转录组结果分析后分别从上调基因和下调基因中各选5个基因进行定量PCR验证。用于检测基因芯片结果上调基因和下调基因定量PCR引物序列见表1。

表1 定量 PCR引物序列Tab.1 Primers used for real time PCR
2 结果与分析
2.1 AtGHR1启动子的活性检测
为了研究AtGHR1基因表达的组织特异性,笔者构建了AtGHR1启动子和编码β-葡萄糖苷酸酶报告基因(GUS)的融合DNA片段ProAtGHR1∷GUS,通过农杆菌介导的花序侵染法,整合到拟南芥基因组中,得到含有ProAtGHR1∷GUS的转基因植物,在GUS底物X-Glu存在的条件下,进一步通过组织化学染色发现AtGHR1启动子活性主要集中在根尖和叶脉,在叶子保卫细胞中有相对较弱的活性(图1)。
2.2 AtGHR1的亚细胞定位
为了确定AtGHR1基因编码蛋白在细胞内的位置,构建了AtGHR1启动子驱动的AtGHR1和绿色荧光蛋白(GFP)编码序列的融合DNA片段ProAtGHR1∷AtGHR1-GFP。进一步在烟草叶片内瞬时表达ProAtGHR1∷AtGHR1-GFP和编码细胞质膜标记蛋白基因35S∷AtPIP2A-mCherry。在不同激发光照射的条件下,发现ProAtGHR1∷AtGHR1-GFP的绿色荧光和35S∷AtPIP2A-mCherry红色荧光完全重合,表明AtGHR1蛋白位于细胞质膜(图2)。
2.3 AtGHR1参与脂多糖诱导防御反应
为了研究AtGHR1基因是否参与植物对含有LPS病原菌的防御反应,用含有和不含有Pst DC3000病原菌的水溶液短暂淹没生长在培养基上的拟南芥野生型Col-0和2个缺失AtGHR1基因的突变体,atghr1-1以及atghr1-2。不含有Pst DC3000病原菌的水溶液的短暂淹没,对植物生长没有明显作用(图3)。但是,含有Pst DC3000病原菌的水溶液的短暂淹没引起植物叶子黄化死亡。相对而言,atghr1突变体叶子黄化死亡程度更重。为了量化植物对病原菌Pst DC3000的感病程度(图3),对叶子内病原菌密度进行了统计,叶片注菌1 d以后,无论野生型还是突变体叶子内菌密度含量都显著高于0 d,但是野生型和突变体之间没有显著区别(图3-B)。叶片注菌2 d以后,野生型还是突变体叶子内菌密度含量相对0,1 d继续显著升高,同时突变体叶子内菌密度显著高于野生型(图3),说明atghr1更感病,证明GHR1基因是植物防御Pst DC3000病原菌必需基因。

A.幼苗;B.叶片;C.叶脉;D.保卫细胞;E.根。A.Young seedling;B.Leaf;C.Vein;D.Guard cell;E.Root.

A.绿色通道;B.红色通道;C.明场;D.绿色通道和红色通道的合并。 A.Green channel;B.Red channel;C.Light field;D.Co-localization of green and red channel.
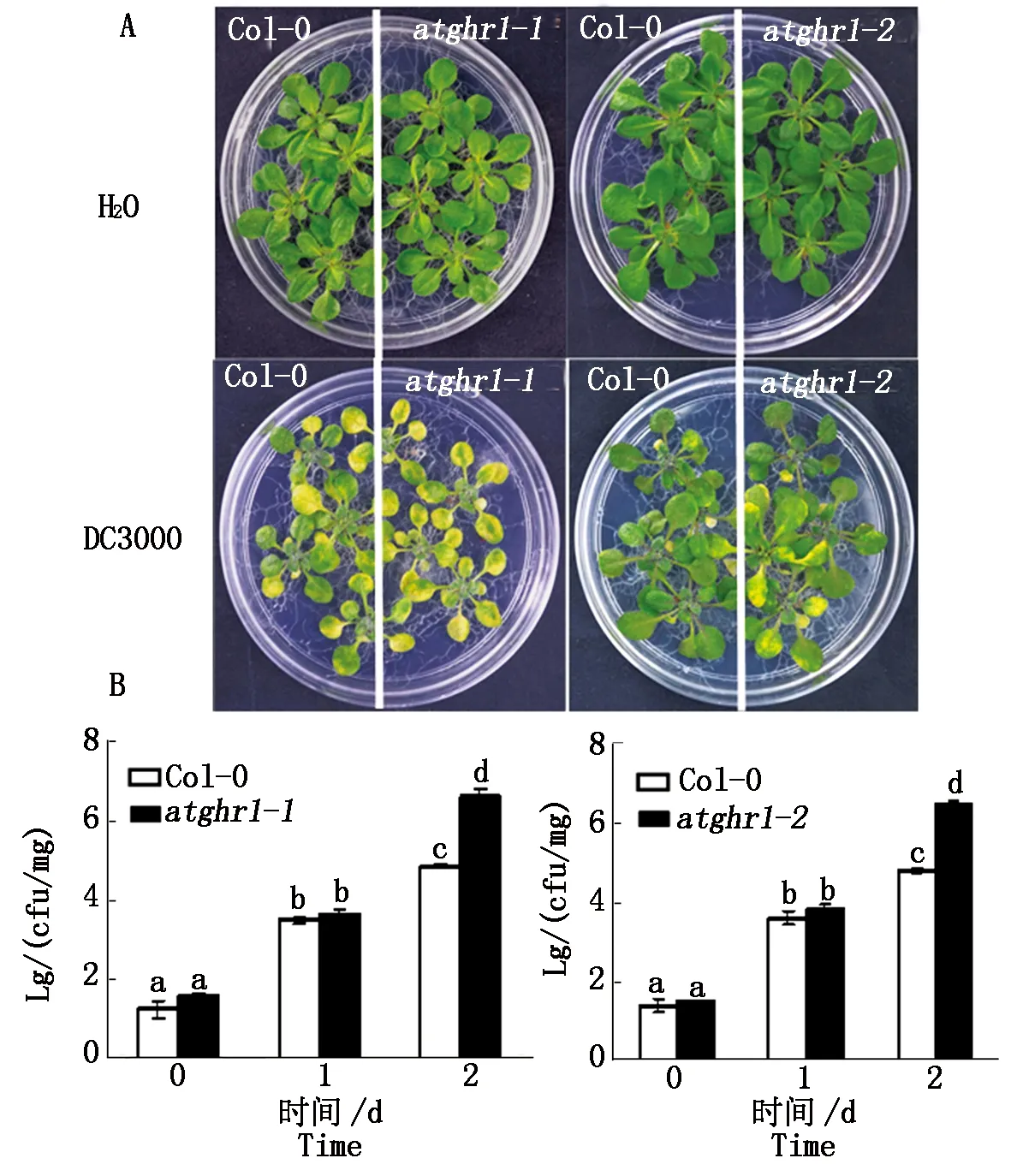
A.分别用H2O或含有Pst DC3000病原菌水溶液淹没植物3 min,倒掉溶液2 d以后的表型;B.对经过病原菌侵染植物叶片中病原菌的密度进行统计分析结果,数据标记不同字母表示t-检验,P<0.01。图4-6同。
A.The seedlings were floated with either H2O or H2O containing Pst DC3000 for 3 minutes,after the solution was discard,the seedling phenotype was displayed two-day later;B.Statistical analysis of the pathogen density,data with different letter indicatesP<0.01 witht-test.The same as Fig.4-6.
图3拟南芥野生型Col-0和atghr1突变体对PstDC3000病原菌的反应
Fig.3ArabidopsiswildtypeCol-0andatghr1mutantresponsetoPstDC3000
2.4 AtGHR1不参与LPS诱导H2O2和细胞质中Ca2+浓度升高
已有研究表明,H2O2和细胞质Ca参与了植物对LPS的感应过程。为了探索AtGHR1基因是否介导LPS对植物细胞H2O2和细胞质Ca的调节作用,首先将野生型Col-0 与突变体atghr1-1、atghr1-2播种在含1%蔗糖的1/2MS基本培养基上,21 d后分别取1片叶片,利用化学发光法对H2O2含量进行测量。图4结果表明,LPS处理诱导的H2O2含量,在野生型Col-0 与突变体atghr1-1、atghr1-2叶片之间没有显著区别,说明AtGHR1不参与LPS诱导H2O2的产生。
为了检测细胞质内Ca2+浓度,将编码水母发光蛋白aequorin的基因导入拟南芥野生型和atglr1-2突变体中,形成Col-0∷aequorin和atglr1-2∷aequorin转基因植物。水母发光蛋白在底物腔肠荧光素存在的情况下,和Ca2+结合以后发出470 nm的荧光,荧光强度和Ca2+浓度呈正相关,从而可以通过检测水母发光蛋白的荧光强度间接检测细胞质的Ca2+浓度。图5检测结果表明,LPS处理导致植株Col-0∷aequorin和atglr1-2∷aequorin细胞质中Ca2+浓度显著升高,但是在Col-0∷aequorin和atglr1-2∷aequorin之间没有显著区别,说明AtGHR1不参与LPS诱导细胞质Ca2+升高的过程。
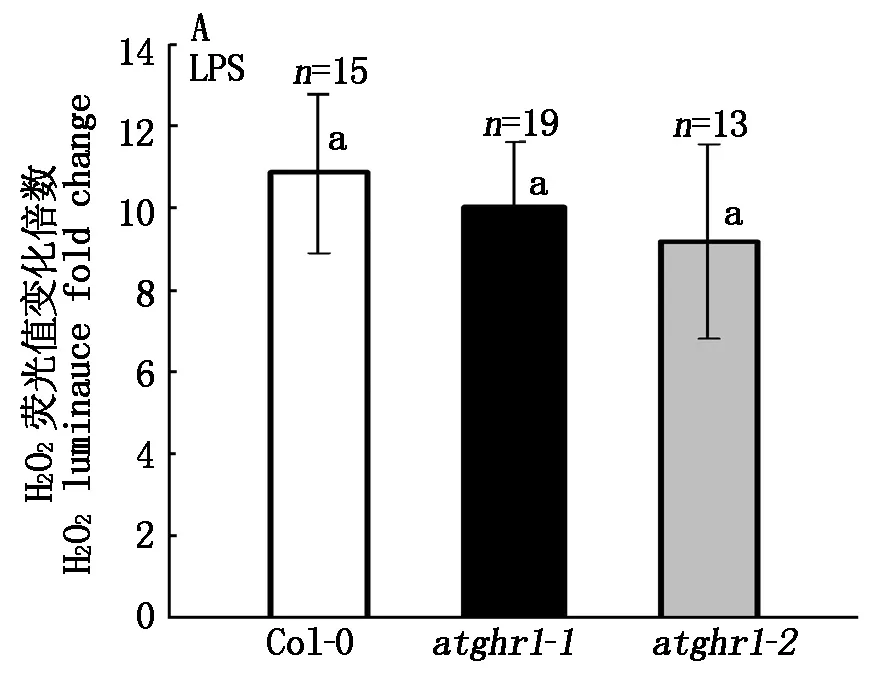
图4 LPS诱导野生型Col-0 与突变体ghr1叶片产生的H2O2Fig.4 LPS induced H2O2 production in leaf of Arabidopsis Col-0 and mutant ghr1
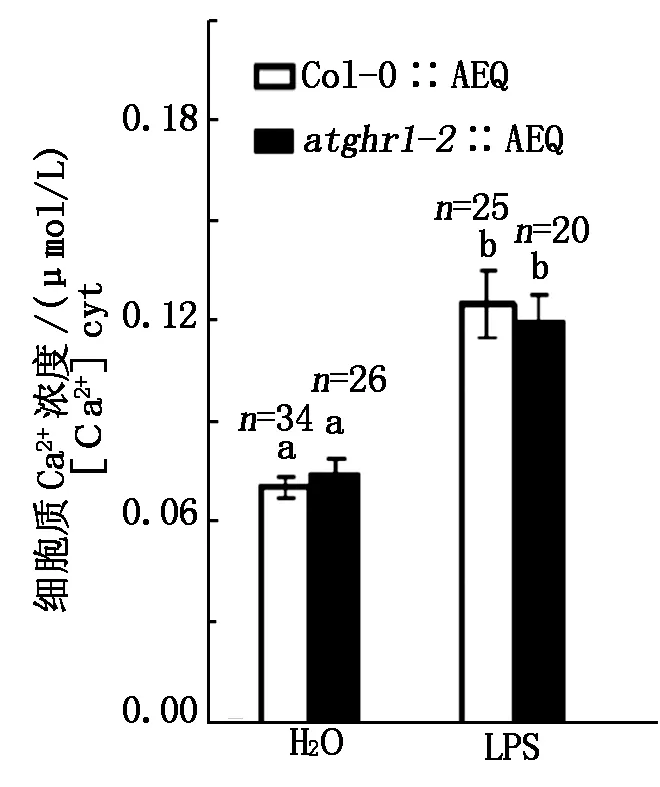
图5 LPS处理 Col-0∷aequorin(Col-0∷AEQ)和atglr1-2∷aequorin(atghr1-2∷AEQ)叶子的钙信号值Fig.5 The LPS induced[Ca2+]cyt rise in Col-0∷aequorin(Col-0∷AEQ) and atghr1-2∷aequorin (atghr1-2∷AEQ)
2.5 AtGHR1参与LPS诱导NO的产生
已有研究表明,LPS可以诱导拟南芥保卫细胞内NO的产生。利用NO特异的荧光探针DAF-FM 对拟南芥野生型和atghr1突变体保卫细胞内的NO进行检测。相对于H2O处理,在LPS处理条件下,拟南芥野生型Col-0保卫细胞内产生大量绿色荧光。进一步研究发现,在LPS处理条件下,变体atghr1-1和atghr1-2保卫细胞内产生的NO显著低于野生型拟南芥Col-0,说明AtGHR1参与LPS诱导保卫细胞内NO的产生(图6)。

A.LPS处理以后,拟南芥野生型Col-0和突变体atghr1-2保卫细胞内NO荧光图;B.NO荧光强度的相对定量。A.The NO fluorescent image in the guard cells of Arabidopsis Col-0 and mutant atghr1-2;B.Relative quantitation of the NO fluorescent density.

图7 LPS处理野生型Col-0与突变体atghr1-2芯片转率组分析上调与下调基因数目结果Fig.7 LPS-induced transcriptional response in Col-0 and atglr1-2 of up-regulated gene and down-regulated genenumbers
2.6 AtGHR1参与LPS诱导的拟南芥基因转录应答
用H2O 和 100 μg/mL LPS处理生长在培养皿中的拟南芥Col-0 和 突变体atghr1-2幼苗,36 h 后提取叶子的 RNA,送公司做基于芯片的转录组分析试验。图7结果表明,用LPS处理Col-0导致547个基因上调,701个基因下调。其中由AtGHR1介导的上调基因145个,下调基因211个。从上调基因和下调基因中各选5个基因进行定量PCR验证,发现定量PCR结果与芯片结果在变化趋势上相符(图8)。

图8 LPS调节拟南芥野生型和突变体atghr1-2基因表达的定量PCR分析
3 结论与讨论
在动物细胞中,位于细胞质膜的TLR4蛋白可以识别细菌性病原菌上的LPS,而位于细胞质膜的TLR5蛋白可以识别细菌性病原菌上的鞭毛蛋白[18]。在拟南芥中,识别细菌编码蛋白的受体是FLS2,其氨基酸序列同动物细胞的TLR5相似[19]。本研究利用动物细胞识别LPS的TLR4蛋白的氨基酸序列,搜索拟南芥基因组,鉴定到AtGHR1和TLR4的序列最相似。进一步通过基因缺失突变体和细胞生物学技术证明,拟南芥AtGHR1参与植物对细菌性病原菌的感应。
以前的研究发现,AtGHR1在ABA诱导气孔关闭信号转导途径中位于H2O2的下游[20]。与此一致,本研究发现,AtGHR1不参与LPS对植物H2O2和细胞质Ca2+的调节作用。但是,缺失AtGHR1基因的突变体部分丧失LPS对NO的诱导作用,这一方面说明,LPS调节NO合成存在不依赖AtGHR1的途径,另一方面说明,细菌LPS对植物细胞H2O2、Ca2+和NO信号分子的调节机理是完全不同的。以前的研究发现,在拟南芥保卫细胞内AtGHR1参与H2O2激发SLAC1阳离子通道和细胞外Ca2+跨膜内流[20]。在本研究中,笔者以拟南芥整个叶子为材料发现AtGHR1不参与LPS对细胞质Ca2+的调节,这个区别可能是因为研究的具体细胞和具体的处理不同而导致。
AtGHR1基因的缺失并没有完全阻断LPS对保卫细胞内NO浓度和叶子基因表达的调节作用,这说明LPS在植物叶子中的细胞信号转导途径不完全依赖AtGHR1。在动物细胞内,LPS信号转导途径依赖TLR4受体复合体,包括CD14和MD2蛋白[15]。笔者利用动物细胞CD14蛋白氨基酸序列搜索拟南芥基因组,发现CD14同拟南芥At4g22130高度同源,这个基因编码蛋白为Strubbelig-receptor family 8,但是这个基因的功能还没有任何报道,可能会和AtGHR1形成复合体参与对LPS的感应过程。同时,笔者在拟南芥基因组中没有找到同动物MD2蛋白氨基酸序列相似的同源物。这些初步的分析表明,植物细胞中有可能存在LPS受体复合体,但是这个受体复合体的组成和动物细胞中的TLR4、CD14、MD2复合体是不同的。
[1] Ausubel F M. Are innate immune signaling pathways in plants and animals conserved nat[J].Immunology,2005,6(10): 973-979.
[2] Raetz C R,Whitfield C.Lipopolysaccharide endotoxins[J].Annual Review of Biochemistry,2002,71:635-700.
[3] Deng W L,Lin Y C,Lin R H,et al.Effects of galU mutation onPseudomonassyringae-plant interactions[J].Molecular Plant-microbe Interactions :MPMI,2010,23(9):1184-1196.
[4] Erbs G,Newman M A.The role of lipopolysaccharide and peptidoglycan,two glycosylated bacterial microbe-associated molecular patterns (MAMPs),in plant innate immunity[J].Molecular Plant Pathology,2012,13(1):95-104.
[5] Newman M A,Dow J M,Molinaro A,et al.Priming,induction and modulation of plant defence responses by bacterial lipopolysaccharides[J].Journal of Endotoxin Research,2007,13(2):69-84.
[6] Braun S G,Meyer A,Holst O,et al.Characterization of the×anthomonascampestrispv.campestrislipopolysaccharide substructures essential for elicitation of an oxidative burst in tobacco cells[J].Molecular Plant-microbe Interactions :MPMI,2005,18(7):674-681.
[7] Desaki Y,Miya A,Venkatesh B,et al.Bacterial lipopolysaccharides induce defense responses associated with programmed cell death in rice cells[J].Plant & Cell Physiology,2006,47(11):1530-1540.
[8] Sun A,Nie S,Xing D.Nitric oxide-mediated maintenance of redox homeostasis contributes to NPR1-dependent plant innate immunity triggered by lipopolysaccharides[J].Plant Physiology,2012,160(2):1081-1096.
[9] Zeidler D,Zähringer U,Gerber I,et al.Innate immunity inArabidopsisthaliana:lipopolysaccharides activate nitric oxide synthase (NOS) and induce defense genes[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15811-15816.
[10] Yeats T H,Rose J K.The formation and function of plant cuticles [J].Plant Physiol,2013,163(1):5-20.
[11] Song D H,Lee J O.Sensing of microbial patterns by Toll-like receptors[J].Immunol Rev,2012,250(1):216-229.
[12] Lemaitre B,Nicolas E,Michaut L,et al.The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response inDrosophilaadults[J].Cell,1996,86(6):973-983.
[13] Medzhitov R,Preston-Hurlburt P,Janeway C A.A human homologue of theDrosophilaToll protein signals activation of adaptive immunity[J].Nature,1997,388(6640):394-397.
[14] Newman M A,Daniels M J,Dow J M.Lipopolysaccharide fromXanthomonascampestrisinduces defense-related gene expression inBrassicacampestris[J].Molecular Plant-microbe Interactions,1995,8(5):778-780.
[15] Wright S D,Ramos R A,Tobias P S,et al.CD14,a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein[J].Science,1990,249(4975):1431-1433.
[16] Chinchilla D,Zipfel C,Robatzek S,et al.A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence[J].Nature,2007,448(7152):497-500.
[17] Li F, Wang J, Ma C, et al.Glutamate receptor like channel 3.3 is involved in mediating glutathione-triggered Cytosolic Ca2+transients, transcriptional changes and innate immunity responses inArabidopsis[J].Plant Physiology, 2013,162(3):1497-1509.
[18] Ranf S,Gisch N,Schaffer M,et.al.A Lectin S-domain receptor kinase mediates lipopolysaccharide sensing inArabidopsisthaliana[J].Nat Immunol,2015,16(4):426-433.
[19] Robatzek S,Wirthmueller L.Mapping FLS2 function to structure:LRRs,kinase and its working bits[J].Protoplasma,2014,251(3):727-727.
[20] Hua D,Wang C,He J,et al.A plasma membrane receptor kinase,GHR1,mediates abscisic acid- and hydrogen peroxide-regulated stomatal movement inArabidopsis[J].The Plant Cell,2012,24(6):2546-2561.

