高血脂病人中他汀类药物治疗引发2型糖尿病危险性评估
左岩霞
(山东中医药大学第二附属医院,山东 济南 250001)
1 资料与方法
1.1 研究对象及分组
以山东省中医药大学第二附属医院男性查体患者,高脂血症(下列任一指标高于正常:空腹血浆总胆固醇(>5.17 mmol/l)、甘油三酯(>2.3 mmol/l)以及低密度脂蛋白胆固醇(>3.4 mmol/l))且无高血糖(空腹血糖(FPG)<6.11 mmol/l并且餐后2小时血糖(2hPG)<7.77 mmol/l)作为研究对象,患者年龄不低于40岁,不高于60岁,无他汀类药物服用史,随机分组。治疗组(301例)均服用辛伐他汀片(20 mg,每天一次),对照组(271例)服用其他降脂药物如立平脂等非他汀药物治疗。双组病人均无需服用人类免疫缺陷病毒(HIV)和丙型肝炎病毒(HCV)蛋白酶抑制剂的病史。患者进入试验的登记日期为2011年2月1日~2015年1月31日。首次登记需检查身高,体重,血压,血脂,空腹血糖及糖化血红蛋白(HPLC离子交换色谱法)作为对照值,同时个人问卷调查其生活习惯,如吸烟饮酒等。此后每2周复查血压,血脂,血糖一次;肝肾功能需每8周复查一次;随访期限为48周。研究结束时复查糖化血红蛋白;对发现有明显肝肾功能异常者,退出试验。对于怀疑新发糖尿病患者以任意血糖≥11.1 mmol/l或空腹血糖≥7.0 mmol/l确诊,并及时饮食控制治疗。所有实验室检查以清晨空腹静脉血为基础。血压测量及问卷调查由同一指定试验人员完成。
1.2 统计学方法
病人血糖水平为本研究的第一研究变量,是计量变量,随访结果以t检验作两组间均数比较。如有新发糖尿病患者病例数,则为计数变量,两组间在实验结束时做x2检验,估计相对危险度的95%可信区间(Miettinen法)。为精确计算他汀类治疗组的致糖尿病危险性,每个观察对象对本实验贡献的时间按周计算。随访每人每周(人周)为一单位,直至糖尿病诊断成立停止计入。其他副作用不做统计分析。对于随访缺失值按LOCF(Last Observation carried forword)方法处理。所有统计分析均由SAS程序完成(SAS 9.3, the SAS Institute,Cary,NC,USA.)。
2 试验结果
本实验是一随机分组的临床对照研究。自2011年2月1日到2015年1月31日间共筛选并登记572名符合试验条件患者(治疗组301人,对照组271人),每人随访时间为48周。最后一名试验参与者的随访截止日期是2016年2月1日。有3人因死亡原因失访(治疗组1人,对照组2人),其血糖值按LOCF处理。在所有患者中,其中新发糖尿病患者31例(治疗组20例,对照组11例),无患者因重大的药物毒副作用退出试验。
进入研究时,治疗组与对照组在平均年龄,血压, 身高体重指数(BMI),血脂,血糖以及糖化血红蛋白未见统计学意义上的差异,见表1。研究对象均为高血脂患者,血糖水平及糖化血红蛋白未见异常。患者的家族史及吸烟饮酒等习惯,未观察到两组有明显区别,见表2。
他汀类药物药物组的患者血糖水平试验初始值为(5.37±0.33)mmol/l,经过48周的他汀类药物治疗,血糖最后检测值为(6.03±0.94)mmol/l。其中21例病人被诊断为糖尿病,并行饮食控制治疗。两组间患者经48周治疗后血糖及糖化血红蛋白水平的比较,见表3,未见明显统计学意义差异。在研究过程中的患者血糖均值在正常范围内波动。见图1。本实验中在他汀类药物治疗组共有20(6.64%)例诊断为新糖尿病患者,而在对照组有11(4.06%)例新糖尿病患者。他汀组的人年发病率为6.84/百人年,而对照组为4.10/百人年。相对危险度(RR)为1.67(95% 可信区间1.06,6.49),x2检验显示P=0.015,他汀组新发糖尿病患者危险性相比对照组有明显差异。见表4。
表1 实验人群身体健康初始情况(±s)
治疗组 对照组 P总数 301 271年龄(year) 47±3.3 50±5.2 >0.05体重(kg) 84.2±4.6 81.7±4.3 >0.05身高(m) 1.72±0.12 1.71±0.14 >0.05 BMI 28.4±2.8 27.6±2.4 >0.05总胆固醇(mmol/l) 7.92±1.54 8.26±2.01 >0.05血甘油三酯 4.31±1.67 4.55±1.74 >0.05低密度脂蛋白 4.1±1.21 4.1±1.10 >0.05血压(mmHg) >0.05收缩压 144±7 152±8 >0.05舒张压 84±4 81±4 >0.05血糖(mmol/l) 5.37±0.33 5.46±0.29 >0.05糖化血红蛋白(%) 4.30±0.22 4.5±0.19 >0.05
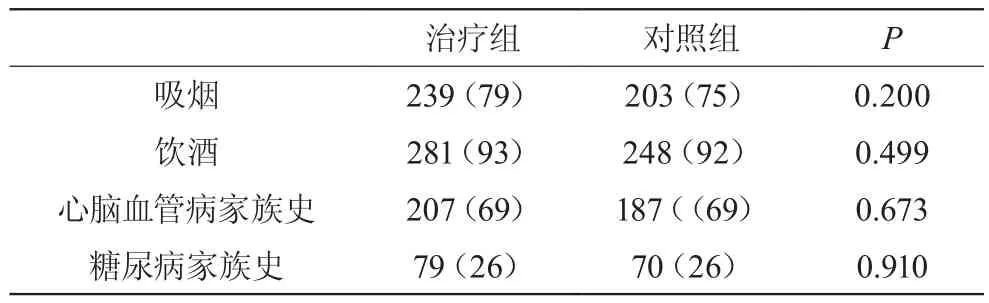
表2 实验人群生活习惯情况 [n(%)]
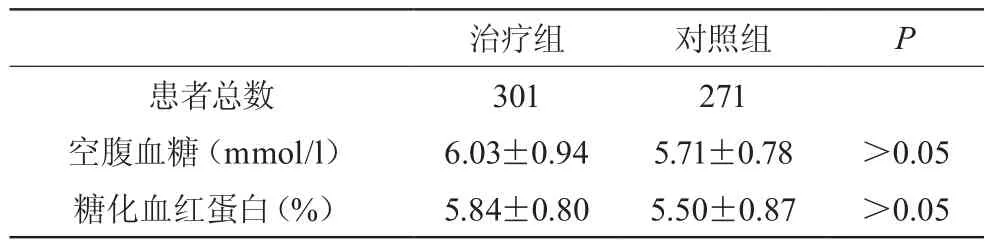
表3 48周后患者血糖及糖化血红蛋白的组间比较
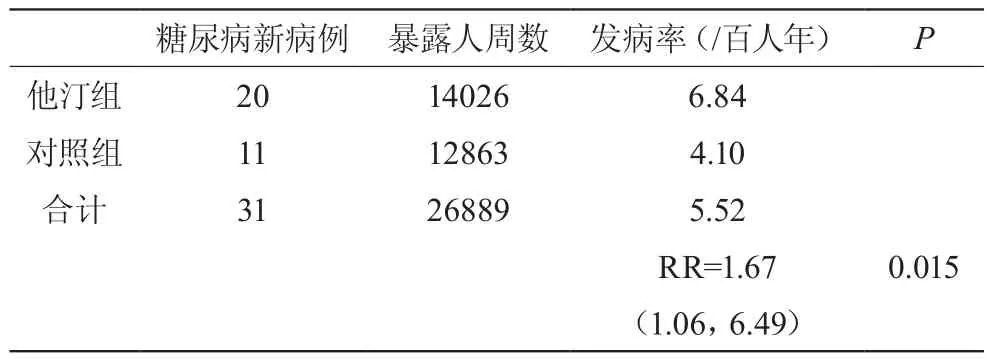
表4 试验两组间新发糖尿病病例比较

图1 治疗组和对照组实验人群48周血糖平均水平曲线
3 讨 论
作为中国大陆地区第一个对他汀类降脂药物的升血糖作用观察的临床试验,患者的血糖浓度被持续观察48周[1-5]。在本实验中,在开始服用他汀类降脂药物16~18周后患者血糖平均水平开始上升,且比对照组升高幅度大,但是整体血糖水平和对照组没有统计学意义的差异[6-10]。作为一个随机对照的临床试验,各种对健康的影响因素,如年龄,吸烟,饮酒等均未观察到有明显的组间差异。一个重要的影响血糖水平的因素是糖尿病新发病例诊断后的血糖控制,尽管新发糖尿病病例他汀组只有20例(6.64%)和对照组11例(4.06%),也有可能使得新发病例较多的一组实际血糖水平低于期望值。同理,糖化血红蛋白的实际测量值也会低于期望值,其降低程度和该组新发糖尿病病例数有关。在本实验中,治疗组服用辛伐他汀片20 mg每天1次,为保守剂量,其血糖的升高与对照组比较无明显差异[10-11]。
高脂血症是糖尿病的高度相关危险因素,在应用他汀类降脂药患者(40~60岁)群中,糖尿病发病率为6.84/百人年,近似于其他研究报道的人群的发病率,高于美国亚裔人群在2007年的发病率,其相对危险比是1.67(95%CI:1.06,6.49),具有明显统计学意义(P=0.015),既服用他汀类降脂药物患糖尿病的危险性比未服用该药的高脂血症患者高67%。此结果和大多数研究的结果类似。
本次试验的研究对象年龄在糖尿病高发段(40~60之间),同时伴高脂血症和高血压,是糖尿病的高发易发人群,因此本实验内的糖尿病发病率高过其他研究是正常的。其他危险因素校正过后,他汀组的发病率仍比对照组高67%,因此在临床应用中,这种致糖尿病风险性是需要临床医生衡量的[13-15]。但在实际临床应用中,临床医生需要考虑的不仅仅是风险,还要考虑其用药的受益,按照欧洲糖尿病治疗指南,他汀类药物降低心血管病危险的作用收益是远大于其致糖尿病引起的风险的[16]。在临床控制高胆固醇的治疗中,临床医生必须警惕患者的血糖水平变化及糖尿病发病的危险性。
[1]Ellen RLB,McPherson R.Long-Term Efficacy and Safety of Fenofibrate and a Statin in the Treatment of Combined Hyperlipidemia.The American Journal of Cardiology.1998,81,Issue 4,Supplement 1:60B-65B.
[2]Athyros VG,Papageorgiou AA,et al.Safety and Ef fi cacy of Long-Term Statin-Fibrate Combinations in Patients With Refractory Familial Combined Hyperlipidemia. The American journal of Cardiology,1997,80,Issue 5:608-613.
[3]Guyton JR,Capuzzi DM.Treatment of hyperlipidemia with combined niacin–statin regimens.The American journal of cardiology.1998,82,Issue 12,Supplement 1:82U-84U.
[4]Rao AD and Milbrandt EB.To JUPITER and beyond: Statins, in fl ammation,and primary prevention.Critical Care,2010,14:310.
[5]SattarN.Preiss D.Et al.Statins and risk of incident diabetes:a collaborative meta-analysis of randomised statin trials.The lancet.2010,375,No.9716:735–742.
[6]Rajpathak SN,Kumbhani DJet al.Statin Therapy and Risk of Developing Type 2 Diabetes:A Meta-Analysis.Diabetes Care.2009,32,No 10.doi:10.2337/dc09-0738.
[7]Carter AA,Gomes T,et al.Risk of incident diabetes among patients treated with statins:population based study.BMJ 2013,346:f2610.
[8]Sasaki J,Iwashita M, et al.(2006) Statins:Bene fi cial or adverse for glucose metabolism.J.Atheroscler Thromb.2006,13:123-129.
[9]Tanaka A,Yamada N,et al.A double-blind trial on the effects of atorvastatin on glycemic control in Japanese diabetic patrients with hypercholesterolemia. ClinChimActa 2001;312:41-47.
[10]Endo K,Miyashita Y,et al.Atorvastatin and Pravastatin elevated Pre-heparin lipoprotein lipase mass of type 2 diabetes with hypercholesterolemia.J AtherosclerThromb,2004.11:341-347.
[11]Kameda W,Igarashi M,et al.Effect of atorvastatin vs.bezafibrat on atheroogenicoutcomes in type 2 diabetes patients with hyperlipidemia.Therapeutic Res,2003.24.851-860.
[12]Sato N and Miyachi Y:Evaluation of clinical efficacy and safty of atorvastatin,a new HMG-CoA reducatas inhibitor,in hyperlipidemix patients with diabetes mellitus (in Japanese,with
title translated by the authors).Prog Med,2001;21:1741-1749.
[13]Diabetes Prevention Program Research Group.10-year follow-up of diabetes incidence and weight loss in the Diabetes Prevention Program Outcomes Study.The lancet 2009,Volume 374,Issue 9702:1677-1686.
[14]GeissLS,Pan L,et al.Changes in incidence of diabetes in U.S.adults,1997-2003.Am J Prev Med.2006:30(5):371-7.
[15]Wang KL,Liu CJ,Chao TF et al Statins,risk of diabetes,and implications on outcomes in the general population.J AmColl Cardiol 2012. 60:1231-1238.
[16]Zaharan NL,Williams D,Bennett K Statins and risk of treated incident diabetes in a primary care population.Br J Clin Pharmacol2013.75:1118–1124.

