全二维气相色谱-质谱法检测天然奶油和人造奶油中的脂肪酸
周瑞泽, 周 雅, 毛 婷, 姜 洁
(北京市食品安全监控和风险评估中心, 北京 100094)
广义上来说,奶油包括天然奶油和人造奶油。天然奶油是以乳为原料加工而成的乳制品,根据含脂量的不同可分为稀奶油和黄油[1],同时含有蛋白质、维生素、矿物质等多种营养成分[2,3]。人造奶油指食用油脂加水和其他辅料乳化后,经速冷捏和或不经速冷捏和而制成的可塑性或流动性的产品,其中的脂肪含量不低于80%[4],包含植脂奶油和人造黄油(又称麦淇淋)。人造奶油有来源稳定、原料成本低廉、用途与天然奶油相近的特点[5]。近年来,随着我国经济增长和人们生活水平的提高,国内对奶油的消费量大幅增加。研究表明,人造奶油的制作中经过氢化处理,会产生反式脂肪酸,从而对人体健康造成一定的危害[6,7]。由于不同种类的奶油以及同一种类但来源不同的奶油中所含脂肪酸种类、含量有一定差异[8,9],因此建立奶油中脂肪酸组成和含量的分析方法,获取不同种类奶油的特征脂肪酸标识物,对于确保奶油的质量安全、减少奶油的掺假伪劣等都有重要意义。
目前有关奶油中脂肪酸组成检测中常见的仪器分析方法有气相色谱法[10]、气相色谱- 质谱法[11]、核磁共振法[12]、拉曼光谱法[13]、红外光谱法[14]和分子荧光光谱法[15]等。这些方法常见于高含量脂肪酸成分的分析,但是由于奶油中脂肪成分复杂,且有许多脂肪酸的含量较低,使用上述方法较难对奶油中的所有脂肪酸做进一步的鉴别区分。近年来发展的全二维气相色谱- 质谱(GC×GC- MS)技术具有峰容量大、灵敏度高、分离度好等特点,已被广泛运用到复杂基质成分分析等领域[16-19]。但采用GC×GC- MS进行奶油中脂肪酸成分分析的研究未见报道。本研究建立了天然奶油和人造奶油中脂肪酸成分的GC×GC- MS定性定量分析方法,一些奶油中的微量脂肪酸成分也得到了识别。
1 实验部分
1.1 仪器、试剂与材料
QP2010Ultra GC×GC- MS仪(日本岛津公司) 配ZX1冷喷调制器(美国Zoex公司); 7890A气相色谱仪配氢火焰离子检测器(FID)、DB- 5毛细管气相色谱柱(30 m×0.25 mm×0.25 μm)购自美国Agilent公司; BPX- 50毛细管气相色谱柱(2.5 m×0.1 mm×0.1 μm,美国SGE公司)。一维数据采集由GC- MS solution 4.2软件完成,二维数据采集由GC Image R 2.5软件完成。
37种混合脂肪酸甲酯标准品(纯度≥99.0% )购自美国NU- CHEK公司;甲苯、正己烷和甲醇(均为色谱级)购自美国Thermo Fisher公司;乙酰氯(色谱级)购自德国CNW公司。其他试剂均为国产分析纯。
稀奶油、植脂奶油、黄油和麦淇淋均为市售商品。
1.2 实验步骤
1.2.1样品制备
奶油中脂肪酸的衍生参考国标方法[20]进行,简述如下:准确称取奶油试样0.2 g于15 mL干燥螺口玻璃管中,加入5.0 mL甲苯和6 mL乙酰氯- 甲醇(1∶9,v/v)溶液,充氮气后振荡混合,于(80±1) ℃水浴中放置2 h,期间每隔20 min取出振摇1次,水浴后取出冷却至室温。将反应后的样液转移至50 mL离心管中,分别用3 mL碳酸钠溶液清洗玻璃管3次,合并碳酸钠溶液于50 mL离心管中,混匀,以5 000 r/min的速度离心5 min,取上清液作为试液待测。
1.2.2标准溶液的配制
称取适量混合脂肪酸甲酯标准品,用正己烷稀释定容,储存于-10 ℃以下冰箱。
1.3 仪器条件
1.3.1GC
色谱柱:HP- 88毛细管气相色谱柱(100 m×0.25 mm×0.2 μm,美国Agilent公司);进样口温度:250 ℃;进样量:1μL;分流比:30∶1。升温程序:130 ℃保持1 min,以6.5 ℃/min的速率升温至170 ℃,然后以2.75 ℃/min的速率升温至205 ℃,保持15 min,再以2.75 ℃/min的速率升温至215 ℃,保持5 min,最终以4 ℃/min的速率升温至230 ℃,保持6 min。FID温度:270 ℃;氢气流量:30 mL/min;空气流量:300 mL/min。
1.3.2GC×GC- MS
气相色谱参数:一维色谱柱为DB- 5毛细管气相色谱柱(30 m×0.25 mm×0.25 μm);二维色谱柱为BPX- 50毛细管气相色谱柱(2.5 m×0.1 mm×0.1 μm)。进样口温度:250 ℃;进样量:1 μL;分流比:100∶1;恒线速度模式:80.8 cm/s。升温程序:50 ℃保持2 min,以20 ℃/min的速率升温至180 ℃,然后以2.5 ℃/min的速率升温至250 ℃,再以3 ℃/min的速率升温至300 ℃,保持5 min。
质谱参数:扫描范围为m/z40~385;电子轰击(EI)源为70 eV;离子源温度为200 ℃;传输线温度为300 ℃;冷气流量为6 L/min;热气温度为350 ℃;调制周期为5 s;热喷时间为400 ms;溶剂延迟时间为6 min。其他质谱参数见表1。

表 1 37种化合物的保留时间、基峰离子及特征离子
Retention I: retention time of the 1st dimensional chromatography; Retention II: retention time of the 2nd dimensional chromatography.
2 结果与讨论
2.1 GC×GC- MS条件优化
2.1.1载气控制模式的选择
色谱分离系统的第一维选用DB- 5型弱极性色谱柱,柱长为30 m,膜厚为0.25 μm;第二维选用BPX- 50型中等极性色谱柱,柱长为2.5 m,膜厚为0.1 μm,柱长与膜厚均比第一维色谱柱小很多,该柱系统可有效分离奶油中的脂肪酸。在此基础上,比较了不同载气控制模式(恒压模式和恒线速度模式)的分离效果(见图1)。结果表明,在15~28 min,恒线速度模式下C10~C15的脂肪酸甲酯分布更均匀;而在34~54 min, C18和C20类脂肪酸甲酯在恒线速度模式下分离效果更好。因此选择恒线速度模式。
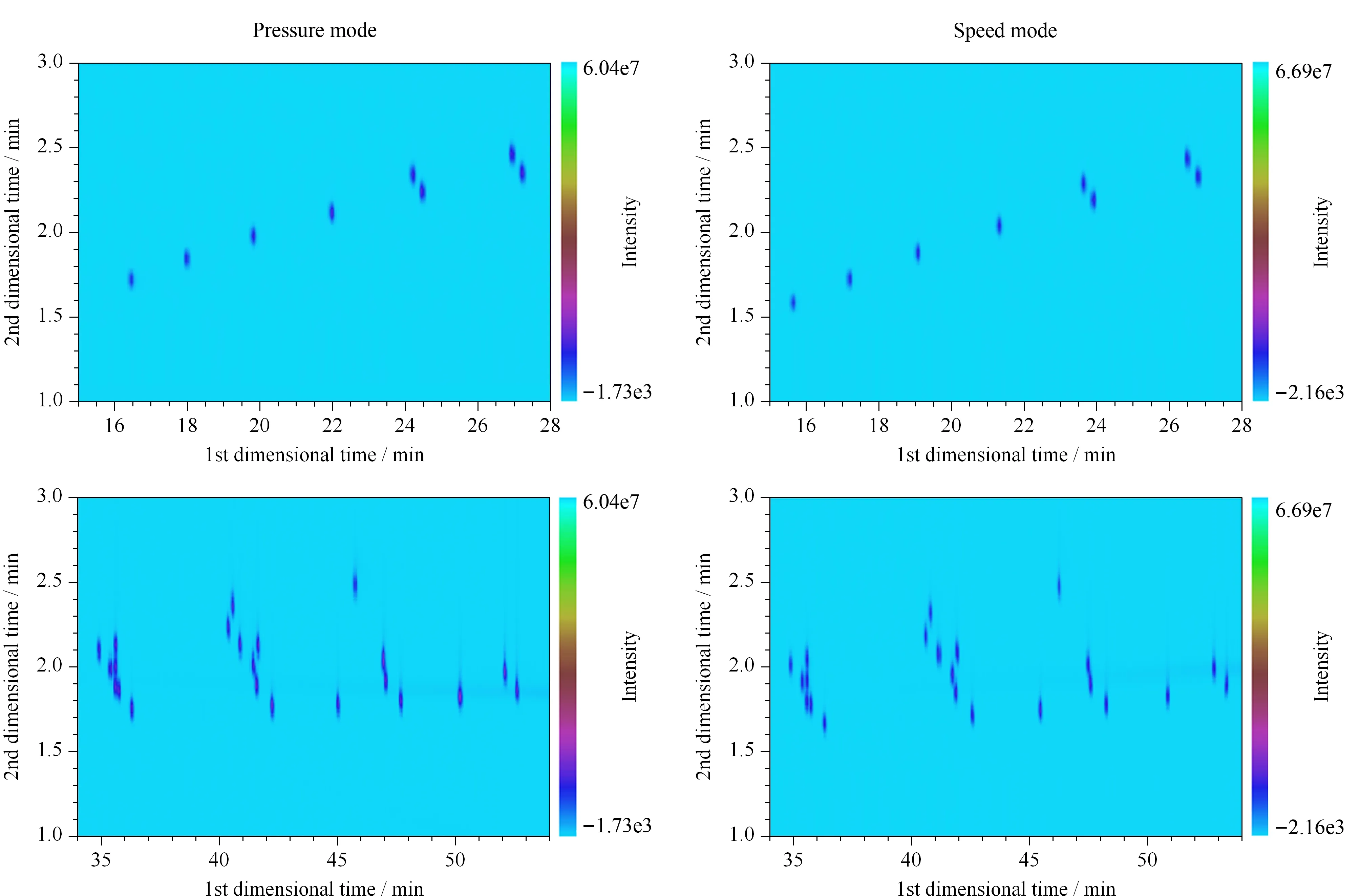
图 1 不同载气控制模式下37种化合物的色谱图Fig. 1 Chromatograms of the 37 compounds in different carrier gas control modes
2.1.2升温程序的优化
选择合适的柱温是实现各种脂肪酸良好分离的关键。为保证目标物从一维柱流出后能被有效切割3次以上,程序升温的速率不能太大,一般为0.5~5 ℃/min[21]。由于奶油中的脂肪酸组成多大于8个碳原子,大部分均在180 ℃以后出峰,因此本试验选择以较大的升温速率10 ℃/min升至180 ℃,再以较小的速率2 ℃/min升温,色谱条件如下:60 ℃始温保持2 min,以10 ℃/min的速率升温至180 ℃,保持2 min后再以2 ℃/min的速率升温至300 ℃,保持10 min。结果显示,虽然脂肪酸组分分离完全,但整个程序持续86 min,耗时太长(见图2a)。由于37种脂肪酸的相对分子质量、熔点和沸点分布范围较广,很难用简单的升温程序得到最佳分离效果。在确保分离度的前提下,通过仔细调节色谱柱升温程序,发现多阶升温程序对脂肪酸有很好的分离效果。最终确定的升温程序为:50 ℃始温保持2 min,以20 ℃/min的速率升温至180 ℃,然后以2.5 ℃/min的速率升温至250 ℃,再以3 ℃/min的速率升温至300 ℃,保持5 min。整个检测过程仅需58 min,且奶油中的脂肪酸组成检测完全,分离效果好,分布也更均匀(见图2b)。
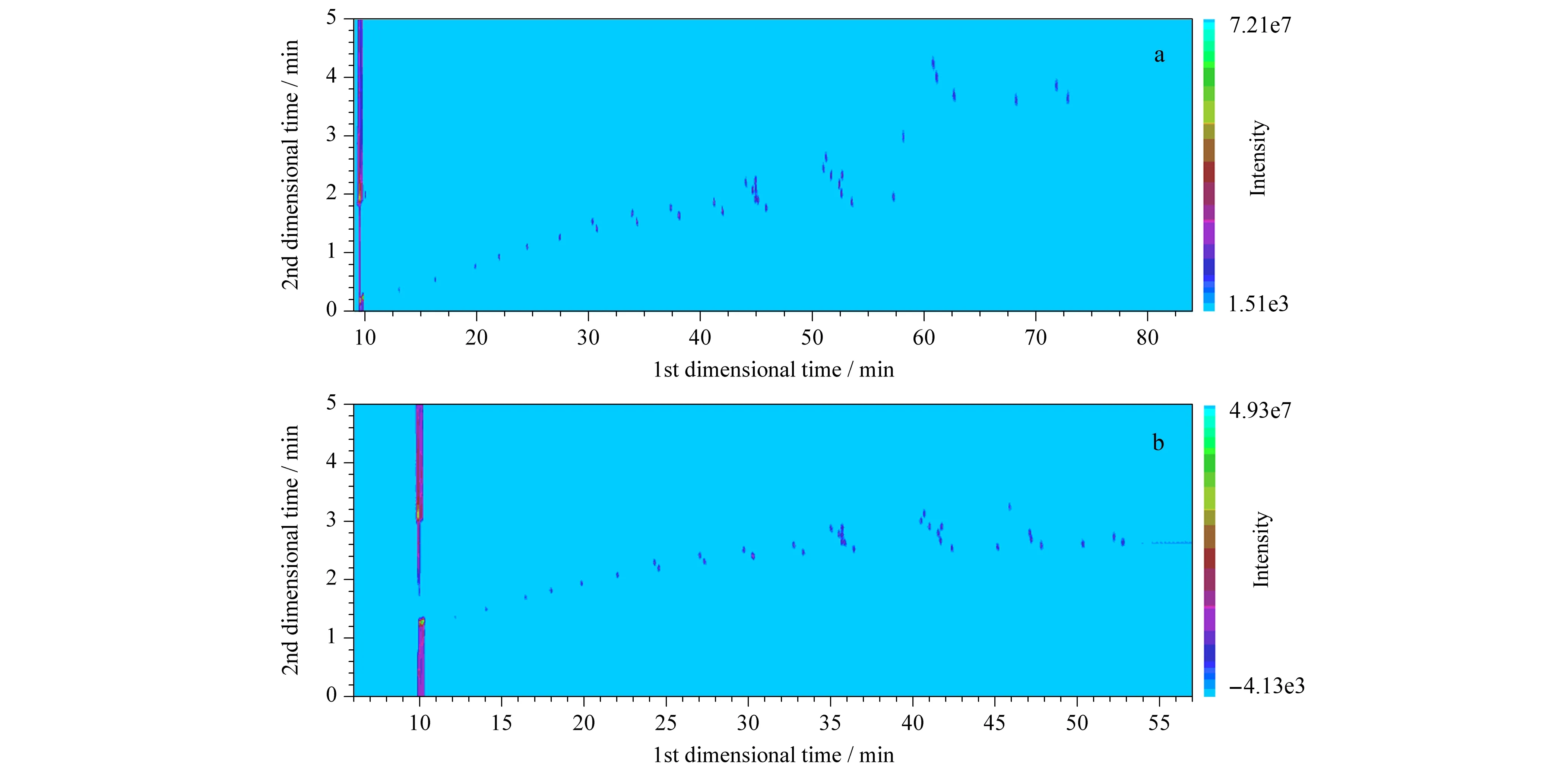
图 2 不同升温程序下37种化合物的色谱图Fig. 2 Chromatograms of the 37 compounds with different temperature programs a. chromatography of 86 min: 60 ℃, held for 2 min; increased to 180 ℃ at 10 ℃/min, held for 2 min; increased to 300 ℃ at 2 ℃/min, held for 10 min; b. chromatography of 58 min: 50 ℃, held for 2 min; increased to 180 ℃ at 20 ℃/min, increased to 250 ℃ at 2.5 ℃/min; increased to 300 ℃ at 3 ℃/min, held for 5 min.
2.1.3调制解调器参数的优化
调制解调器是二维色谱的核心部件,包含冷喷气和热喷气。在二维色谱运行过程中,冷喷气持续释放,热喷气脉冲式喷射,前后两次热喷之间的时间间隔称为调制周期[22],每次热喷气释放的时间称为热喷时间[23]。
本试验考察了不同调制周期(3、4、5和6 s)对分离度的影响。如图3所示,调制周期对目标物在二维色谱上的分离情况和信号强度有重要的影响,尤其是对同分异构体化合物如亚油酸甲酯、反式亚油酸甲酯、γ- 亚麻酸甲酯、油酸甲酯和反式油酸甲酯。调制周期为3 s时,γ- 亚麻酸甲酯和油酸甲酯被分割在多个调制周期,导致信号强度降低;调制周期为6 s时,5种化合物因保留时间超过调制周期导致共流出;调制周期为4和5 s时,5种化合物二维谱图轮廓清晰,分离效果好。另外,通过比较发现调制周期为5 s时的三维轮廓图峰形较4 s时更好,目标物基本不拖尾(见图4)。
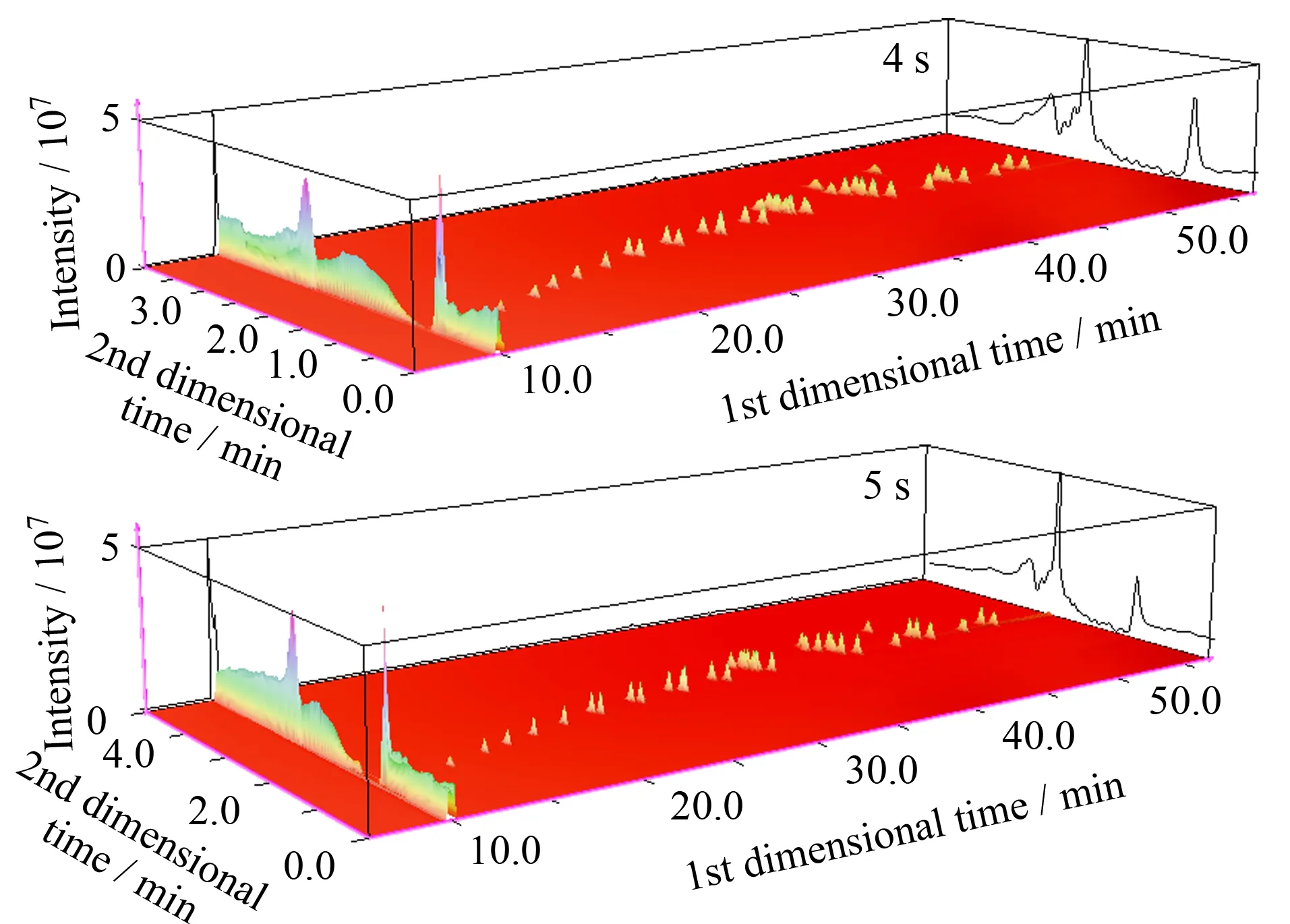
图 4 不同调制周期的三维轮廓图Fig. 4 Three dimensional profiles at different modulation periods
冷喷气流量的大小与目标物沸点有关,对于C4~C40的化合物来说,其所需冷气量随碳数增加逐渐降低,一般为15.5~1.5 L/min[24]。通过观察本研究中的目标物在不同冷气流量条件下的一维色谱峰是否被切开,确定冷气流量为6 L/min。
考察发现热喷时间(350、400和450 ms)的加大并不能明显改善分离效果,信号强度虽有所增大,但仍在同一数量级,因此选择400 ms的热喷时间。
2.1.4扫描范围的确定
由于二维色谱峰峰形较窄,为提高分析灵敏度及定性定量的准确度,需要选择尽量窄的质谱扫描范围。由于丁酸、己酸、辛酸和癸酸等低碳数脂肪酸属于奶油中的重要风味化合物,且质荷比41和43的碎片离子为脂肪酸甲酯的常见碎片离子,为保证谱图的完整性,起始扫描质荷比设为40。而本研究考察的37种脂肪酸化合物中相对分子质量最大的为C24∶0,其甲酯化合物分子离子峰的质荷比为382,因此选择385作为扫描的最大质荷比。各化合物的保留时间及特征离子见表1。
2.2 灵敏度的考察
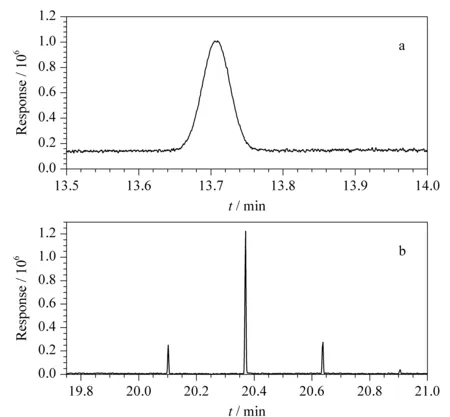
图 5 月桂酸甲酯在(a)GC- FID和(b)GC×GC- MS上的灵敏度Fig. 5 Sensitivities of C12∶0 by (a) GC- FID and (b) GC×GC- MS
本研究比较了优化条件下脂肪酸甲酯在二维色谱GC×GC- MS和传统一维色谱GC- FID上灵敏度的差异(见图5)。其中图5a为月桂酸甲酯在一维色谱上的响应情况,图5b为月桂酸甲酯在二维色谱上的响应情况。月桂酸甲酯在二维色谱上被调制成3个碎片峰,其信号响应强度比一维色谱提高了10倍以上,信噪比比一维色谱提高了90倍以上,该结果与文献[22]报道吻合。
2.3 定性和定量分析方法
本研究中37种脂肪酸化合物的定性分析主要通过将混合标准品的全扫描二维谱图中各峰点质谱图导入NIST谱库检索而实现;对于谱图相近、无法识别的同分异构体则通过单一标准品进样的方式进行判定。结果表明,所有化合物都得到了较好的分离,未发现在二维色谱上出现重组的现象;各化合物的色谱保留时间规律与质谱特征也与吴惠勤等[25]的描述一致。由于本研究旨在确定不同奶油中脂肪酸组成的差异,考虑到脂肪酸同系物的响应值相近,可用面积归一化定量法测定各脂肪酸的相对含量来表示其含量。
2.4 实际样品分析
选取包括稀奶油、植脂奶油、黄油和麦淇淋的4种奶油样品进行检测,结果见表2。由表2可知,天然奶油与人造奶油所含脂肪酸组成差异显著。稀奶油、黄油及植脂奶油均以饱和脂肪酸为主,含量分别为51.72% ~98.96% ;其中植脂奶油的总饱和脂肪酸含量最高,为98.63% ~98.96% 。而麦淇淋则以不饱和脂肪酸为主,总含量为59.55% ~69.61% ;其中单不饱和脂肪酸总含量低于多不饱和脂肪酸总含量。

表 2 不同样品中脂肪酸的含量
ND: not detected.
天然奶油以牛乳脂为主要原料,其脂肪酸组成与牛乳相似,含有丁酸、己酸、辛酸、癸酸等特征碳链脂肪酸[26],也包括本文检出的肉豆蔻油酸、十五碳一烯酸、十七碳一烯酸等微量脂肪酸,这类风味物质可用于区别人造奶油。即便同为天然奶油,稀奶油和黄油因其原料乳受牧草生长、饲料来源、奶牛年龄和泌乳期的影响[27],脂肪酸组成也不尽相同。植脂奶油多以氢化棕榈仁油为原料,其脂肪酸以饱和脂肪酸为主,常见的不饱和脂肪酸如十八碳烯酸、二十碳烯酸和二十二碳烯酸基本未检出,而高含量的肉豆蔻酸和硬脂酸可作为特征组成的依据;说明植脂奶油在制备过程中,增加了饱和脂肪酸的含量,该结果与加工工艺吻合[9]。麦淇淋则是以植物油为主要原料的人造奶油,其脂肪酸组成与植物油类似,一般为10~22碳脂肪酸[28],且不饱和脂肪酸含量较高。与其他奶油相比,麦淇淋中的亚油酸和花生酸的相对含量较高,十四碳以下脂肪酸的含量最少,该结果与文献描述相近[29]。
3 结论
本文建立了GC×GC- MS分析奶油中脂肪酸组成的方法,实现了食品复杂基质中脂肪酸的有效分离和准确认定。相较于传统的GC- FID法,本方法定性更准确,有助于根据脂肪酸种类及含量的不同进一步区分天然奶油和人造奶油。将本方法应用到市售奶油样品的检测中,其中常规脂肪酸的检测结果与传统方法一致,而且检出成分更丰富,为今后奶油品质评价、掺假鉴别等食品安全保障工作提供了有力的技术支撑。
[1] GB 19646- 2010
[2] Schripsema J. J Agric Food Chem, 2008, 56(8): 2547
[3] Cui H J, Lin Y, Wang D. Journal of Medicine and Pharmacy of Chinese Minorities, 2009, 2(2): 52
崔鸿江, 林燕, 王栋. 中国民族医药杂志, 2009, 2(2): 52
[4] NY 479- 2002
[5] Ma H, Yang H L, Yang S, et al. Food Research and Development, 2017, 38(13): 205
马慧, 杨宏黎, 杨舒, 等. 食品研究与开发, 2017, 38(13): 205
[6] Wang H, Wang J, Song F, et al. Chinese Journal of Tropical Agriculture, 2014, 34(11): 99
王挥, 汪金, 宋菲, 等. 热带农业科学, 2014, 34(11): 99
[7] Lin Q, Li G B, Ge P, et al. Chinese Journal of Chromatography, 2016, 34(5): 520
林麒, 李国波, 葛品, 等. 色谱, 2016, 34(5): 520
[8] Liu Z D, Huang H L, Shen J, et al. Academic Periodical of Farm Products Processing, 2012(10): 93
刘志东, 黄洪亮, 沈建, 等. 农产品加工, 2012(10): 93
[9] Wang H, Wang J, Chen W J, et al. Chinese Journal of Tropical Agriculture, 2015, 35(10): 94
王挥, 汪金, 陈卫军, 等. 热带农业科学, 2015, 35(10): 94
[10] Masson L, Alfaro T, Camilo C, et. al. Grasas Y Aceites, 2015, 66(1): 17
[11] Chen L L. Food Research and Development, 2010, 31(1): 106
陈林林. 食品研究与开发, 2010, 31(1): 106
[12] Li W, Jia J Y, Jiang J, et al. Science and Technology of Food Industry, 2016, 37(23): 319
李玮, 贾静怡, 姜洁, 等. 食品工业科技, 2016, 37(23): 319
[13] Wang X, Dai C J. Spectroscopy and Spectral Analysis, 2015(4): 929
王翔, 戴长健. 光谱学与光谱分析, 2015(4): 929
[14] Wu X H, Cheng Y X, Yang Y, et al. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2013(9): 1025
吴晓红, 程欲晓, 杨勇, 等. 理化检验- 化学分册, 2013(9): 1025
[15] Zhao S J, Chen B, Lu D L. Spectrometric Instruments and Analysis, 2011(10): 172
赵守敬, 陈斌, 陆道礼. 光谱仪器与分析, 2011(10): 172
[16] Purcao G, Tranchida P Q, Dugo P, et al. J Sep Sci, 2010, 33(15): 2334
[17] Shi Q N, Liu Z F, Zhu J, et al. Environmental Chemistry, 2017, 36(1): 204
时秋娜, 刘占芳, 朱军, 等. 环境化学, 2017, 36(1): 204
[18] Xu H, Li S J, He J, et al. Food Research and Development, 2013(6): 114
许泓, 李淑静, 何佳, 等. 食品研究与开发, 2013(6): 114
[19] Xia D, Gao L R, Zheng M H. Chinese Journal of Chromatography, 2017, 35(1): 91
夏丹, 高丽荣, 郑明辉. 色谱, 2017, 35(1): 91
[20] GB 5009.268- 2016
[21] Li Y Q, Zhang Y, Qian S, et al. Chinese Journal of Analysis Laboratory, 2013(2): 109
李燕群, 张渝, 钱蜀, 等. 分析试验室, 2013(2): 109
[22] Zheng Y M, Feng F, Guo W, et al. Chinese Journal of Chromatography, 2012, 30(11): 1166
郑月明, 冯峰, 国伟, 等. 色谱, 2012, 30(11): 1166
[23] Xu G W. Modern Practical Gas Chromatography. Beijing: Chemical Industry Press, 2004: 246
许国旺. 现代实用气相色谱法. 北京: 化学工业出版社, 2004: 246
[24] Gaines R B, Frysinger G S. J Sep Sci, 2004, 27(5/6): 380
[25] Wu H Q, Huang X L, Lin X S, et al. Chinese Journal of Analytical Chemistry, 2007, 35(7): 998
吴惠勤, 黄晓兰, 林晓珊, 等. 分析化学, 2007, 35(7): 998
[26] Ma Y L, Cao Y P, Yang Z N, et al. Food Science, 2013, 34(20): 103
马艳丽, 曹雁平, 杨贞耐, 等. 食品科学, 2013, 34(20): 103
[27] Sun J F, Wang J. Food and Nutrition in China, 2011, 17(11): 33
孙剑锋, 王颉. 中国食物与营养, 2011, 17(11): 33
[28] Huang Y H. [MS Dissertation]. Zhengzhou: Henan University of Technology, 2010
黄月华. [硕士学位论文]. 郑州: 河南工业大学, 2010
[29] Li W, Jia J Y, Li L, et al. Food Science, 2017, 38(12): 278
李玮, 贾婧怡, 李龙, 等. 食品科学, 2017, 38(12): 278

