术中B超在神经外科手术中的应用研究
彭逸龙 伍益* 李智斌 董家军 陈少霭 古机泳 冯子泽 钟鸣谷 黄戈 李小辉 何锦浪
(江门市中心医院神经外科,广东 江门 529000)
能否准确地定位、在手术中尽量减少副损伤,在神经外科手术是非常重要的。随着术中CT、MRI及神经导航技术的应用,大大提高了神经外科手术的精准性及安全性,但这些设备价格昂贵、操作复杂,无法在国内广泛应用,并且存在放射性、术中漂移等情况,而术中超声技术自20世纪50年代问世并应用于神经外科以来,随着设备的改进、图像质量的提高,使其越来越广泛地应用于神经外科手术中。术中B超具有实时定位、操作方便、经济实用、无创等优点,我科自2015年6月至2016年12月使用术中B超监测颅内手术60例,总结了一些经验,现报告如下。
一、对象与方法
1.一般资料:选取我科2015年6月至2016年12月需进行手术治疗的患者60例(术前经CT/MRI诊断),年龄20~75岁。男28例,女32例。其中脑肿瘤35例,直径1.5~6.0 cm,全部位于大脑半球;脑外伤13例,全部位于大脑半球,其中1例术中后颅窝迟发性出血;12例自发性脑出血中,11例在幕上,1例为小脑出血。
2.临床表现:脑肿瘤的患者主要表现为不同程度的颅内高压症状及相关的功能障碍,其中头痛33例,伴有恶心、呕吐15例,癫痫11例,一侧肢体活动乏力12例,视物模糊3例。脑出血及脑外伤的患者均有一定程度的意识障碍,GCS>8分5例,6~8分17例,3~5分3例。术前单侧瞳孔散大3例,双侧瞳孔散大2例。
3.影像学检查:低级别胶质瘤超声影像表现为边界较清晰和规则,回声较均匀弥漫,以较高回声或回声增强为主,可不伴有瘤周水肿(图1)。而高级别胶质瘤则表现为边界不清楚的、内部回声不均匀性的、杂乱的高回声病变,且伴有瘤周水肿,发生中心性坏死者为无回声的液化灶。血供丰富的肿瘤周边可探及彩色的血流信号。囊性胶质瘤可在囊壁上发现肿瘤结节,周围多见低回声水肿。脑膜瘤呈一均匀高或稍高、等、低混杂回声结节,边界清楚,有时伴有钙化灶,表现为伴声影的强化灶。海绵状血管瘤呈高回声结节,境界尚清,内回声不均匀。急性脑内血肿回声比脑组织的回声要强,血肿边缘模糊,呈不规则状,均匀或混杂区域以强光点为主,与周围正常脑组织界限明显;血肿如仍在发展则表现为弱回声,与强回声的颅骨及脑皮质界面清楚,同时可以显示强回声的中线结构和弱回声的脑室。亚急性及慢性血肿表现为暗区,边界清晰(图2、3)。
4.B超在神经外科手术中的应用:在B超监测下进行开颅手术60例,病灶均显示。35例肿瘤患者根据术前CT、MRI等影像学资料,做好术前计划,设计手术皮瓣,进行开颅肿瘤切除手术。脑外伤及脑出血患者根据患者术前的意识状态、术前中线移位的情况进行硬膜下/外血肿清除或脑挫伤脑组织清除+血肿清除手术,严重的患者需进行去大骨瓣减压手术。术中采用日本ALOKA ProSound ɑ7型彩超机,探头为1.0 cm×5.0 cm直型探头,发射频率5 MHz。用低温等离子消毒接头。打开骨瓣后、打开硬膜之前,用探头在脑表面检查定位,其间助手持续滴注无菌生理盐水以改善成像质量,并随时进行图像分析,利用实时图像可以设计硬膜切口。打开硬膜后,在脑表面再次用探头检查对比是否有移位。然后进行冠状面、矢状面及水平面多层面的扫查,探测病灶所在部位与周围脑组织的关系,并结合术前的影像学照片,根据实际情况选择避开功能区的最佳入路,并计算出病灶距离皮质的距离及病灶大小(图1)。脑外伤患者中,可以了解术前血肿、挫伤及中线移位等情况,主要是排除术中有无继发挫伤、出血以及原因不明急性脑膨出,使术者可以快速判断是否进行第二次手术[1],从而为抢救患者生命争取了时间;而在自发性脑出血患者中,主要是了解血肿清除情况,有无血肿残留或者出现新发血肿[2]。当手术结束后,将残腔内充盈生理盐水,再次扫描了解手术效果。因我科使用的专科探头较大,当骨窗不够大,出现探头不能完全在硬膜表面覆盖时,可将乳胶手套注水制成水囊,将探头贴附在水囊上进行操作,此法可使图像质量明显改善[3]。
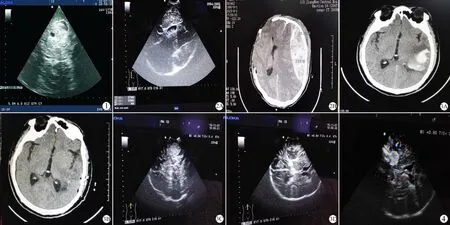
图1 胶质瘤患者的术中B超影像
绿色小圆点为测量皮质至肿瘤的距离,左下角1.9 cm为测量结果;扇形图像中白色高回声为肿瘤,边界不清,内见黑色低回声,考虑有囊变坏死
图2 脑外伤患者术前及术后B超图像
A:脑外伤患者出现迟发性血肿的术中B超影像:梭形不均匀回声为术区对侧新发硬膜外血肿,经测量长为8.9 cm,宽为3.7 cm,脑室明显受压变形;B:复查CT的影像:术后出现对侧瞳孔散大,急查头颅CT,再次开颅前在第一次手术去骨瓣区域头皮上直接用B超探查,与CT在部位、大小及脑内结构上基本相仿
图3 脑出血患者术前及术后影像学所见
A, C: 左颞叶脑出血患者术前CT及B超影像,超声影像可见团块状稍高回声;B, D:术后对比: 血肿清除后超声见术区低回声,中线及脑室结构清晰可见
图4 左侧颞部脑膜瘤患者,术中超声多普勒显示的肿瘤周围的血流成像,肿瘤为白色高回声影像,边界清楚
二、结果
所有胶质瘤患者于72 h内复查头部增强MRI,其余肿瘤患者术后第二天复查头颅CT,术后3月复查头颅MR增强,对比术前MR增强,了解肿瘤切除情况;所有脑外伤及脑出血的患者术后第二天复查头颅CT,了解血肿清除、中线移位等颅内情况。在B超监测下进行手术60例,病灶均显示。35例肿瘤患者中,术中B超均能准确定位肿瘤,并对肿瘤的切除范围有指导意义。其中18例脑膜瘤、11例胶质瘤及2例海绵状血管瘤均全切除,4例胶质瘤因种种原因行次全切除。13例急性颅脑损伤手术中,发现同侧迟发性颅内出血2例,发现对侧远隔部位出血1例,均及时再次手术,术后恢复良好;12例高血压脑出血手术中,术后用多田公式计算血肿清除90%以上10例;2例术中出血,其中1例出现恶性脑膨胀,术后死亡。所有患者术后未发生与B超应用有明显相关的神经功能障碍,无颅内感染,手术疗效满意。
三、讨论
在神经外科手术中,手术入路的设计、手术中的定位至关重要。神经外科医师主要是根据术前的CT或MRI等影像学资料来定位病灶及制订手术入路。但是开颅后只能凭借肉眼以及临床经验来确定病灶,而且当放出脑脊液后,脑组织还可能存在漂移等情况,并不能及时、准确地了解颅内情况。当然,目前在国内有些单位拥有术中MRI、术中CT、神经导航等设备可以弥补这一点,但是这些设备价格昂贵、操作复杂,难以在国内普及。而超声技术是在CT、MRI诞生之前就已经广泛应用于临床,但因其不易透过颅骨,所以阻滞了其在神经外科的使用。当去除了颅骨后,在硬膜表面操作就可以显示颅内的结构和病灶的形态,从而使术中实时定位及监测成为了可能。结合本人在术中使用B超监测的一些经验,概括总结并归纳如下:
1.在进行实时监测的过程中,要严格遵守无菌原则(我科使用的探头用低温等离子消毒,无需使用无菌薄膜)。操作的时候要小心轻柔,对操作区域进行连续、多层面的扫描,以确定病灶与周围正常脑组织的关系[4]。必要时还可以进行多普勒血流成像检查,以初步估计肿瘤的血供情况。
2.在实际操作中可以根据病变的位置深浅使用深度旋钮来调节视野深度,使用增益旋钮调整图像的灵敏度。根据实时监测的图像,如病变在非功能区,选择距离皮质最近的位置切开皮质暴露病灶;如在神经功能区,则选择远离神经功能区的皮质切口,在脑实质内潜行到达病灶,尽可能地减少神经功能的损伤[5-6]。
3.在如肿瘤的切除中,术中可实时进行监测,以了解病灶切除的程度。对于边界不清的病灶(如高级别胶质瘤),肿瘤生长速度较快,肿瘤与周围水肿脑组织无明显过渡[7-9],我们在手术中加入了超声多普勒血管检查,通过观察肿瘤组织新生血管的多少来鉴别肿瘤和瘤周水肿,具有很好的实用性,使得其敏感度提高。对于可疑的回声,应在不影响功能的前提下,积极进行切缘的多点活检。在安全的前提下尽量多地切除回声信号区,以减少术后肿瘤残留。
4.对于超声发现但显微镜下肉眼难辨的肿瘤,我们采用持瘤钳等金属钝头显微器械为导引,在超声下反复验证可疑回声区并加以切除,必要时此操作可以反复进行,能够大大减少肿瘤的残留。
5.在脑出血及脑外伤的手术监测过程中,需注意应清除血凝块、脑棉和明胶海绵等,尤其用双氧水冲洗术区后需用生理盐水或林格氏液反复冲洗,防止空气进入液体中而造成伪影,影响结果的观察。术后可将探头置于术区周围正常的脑组织表面进行扫查,可比直接经过正常的脑组织进行深部探查获得更优质的图像。
超声监测在神经外科手术中应用简单,术中定位不受脑组织漂移影响,而且可以实时进行,反复监测,操作简单,价格低廉并且准确性较高[10]。对于脑肿瘤患者,可以提高肿瘤全切除率;对于急诊脑外伤、脑出血患者,可以快速诊断出手术中发生急性脑膨出的原因,并为及时清除血肿提供指导,从而有效地避免或减少创伤性探查,为术者提供了准确的位置,缩短了手术时间,提高了手术效果,避免遗漏颅内血肿。
但是,术中B超也有其局限性,B超图像的分辨率较CT和MRI低,对发现脑实质内较小的病灶和部位较深的病灶较困难(如病灶与探头的距离超过5~6 cm,病灶直径<5 mm,超声对病变定位的准确性会下降),且对实质性肿瘤的定性也较困难。此外,B超需打开骨瓣进行操作,骨窗的位置、大小将决定扫描的范围及显示病变完整与否,且显示的是非标准化的扇形断层图像,操作者必须熟练掌握颅脑矢状位,冠状位和轴位的断层解剖,才能增强对颅脑术中B超的认识。
1廖驭国, 黄传平. 重型颅脑损伤术中B超对迟发性颅内血肿的诊治 [J]. 中国临床神经外科杂志, 2010, 15(10): 597-599.
2吴明伟, 廉承凯. 术中B超在自发性脑内血肿手术中的应用 [J]. 中华神经外科疾病研究杂志, 2009, 8(2): 176-177.
3唐运涛, 刘伦波, 陈宏刚, 等. B型超声波在颅脑损伤中及术后的应用研究 [J]. 中华神经医学杂志, 2003, 2(5): 374-375.
4STROWITZKI M, MORINGLANE J R, STEUDEL W. Ultrasound-based navigation during intracranial burr hole procedures: experience in s series of 100 cases [J]. Surg Neurol, 2000, 54(2): 134-144.
5董家军, 彭逸龙, 钟明谷, 等. 术中实时超声在脑胶质瘤切除中的应用 [J]. 广东医学, 2015, 36(2): 244-246.
6王飞, 张保中, 邓剑玲, 等. 术中超声在运动皮层深部小病变手术中的应用 [J].中华神经外科疾病研究杂志, 2014, 13(4): 367-369.
7WANG J, LIU X, BA Y M, et al. Effect of sonographically guided cerebral glioma surgery on survival time [J]. J Ultrasound Med, 2012, 31(5): 757-762.
8RYGH O M, SELBEEK T, TORP S H. Comparison of navigated 3D uhrasound findings with histopathology in subsequent phases of glioblastoma resection [J]. Acta Neurochir (Wien), 2008, 150(10): 1033-1042.
9RYGH O M, NAGELHUS HERNES T A, LINDSETH F, et al. Intraoperative navigated 3-dimensional ultrasound angiography in tumor surgery [J]. Surg Neurol, 2006, 66(5): 581-592.
10何文. 颅脑术中超声应用现状及进展 [J]. 中华医学超声杂志, 2006, 3(4): 200-203.

