不同土壤灭菌方法对土壤微生物活性的影响
郑嘉慧,陈鸿洋,李金全,聂 明,方长明
(复旦大学 生命科学学院 生物多样性科学研究所,上海 200438)
不同土壤灭菌方法对土壤微生物活性的影响
郑嘉慧,陈鸿洋,李金全,聂 明,方长明
(复旦大学 生命科学学院 生物多样性科学研究所,上海 200438)
灭菌处理是土壤生态学、微生物学及其相关学科的一种重要研究手段,灭菌效果的好坏直接关系到后续研究的进行及其结果的准确性.常用土壤灭菌方法的灭菌效果及其评估仍然存在很大的不确定性.本文选取目前常用的3种灭菌方法,即高温高压蒸汽法、氯仿熏蒸法及辐射灭菌法,对不同背景的土壤样品进行灭菌.通过改变灭菌次数及灭菌间隔时间,观察灭菌后土壤微生物呼吸速率的变化.结果表明: (1) 常规氯仿熏蒸灭菌后土壤微生物呼吸速率并不完全随着微生物量的减小而降低,说明单纯从土壤微生物量的角度不能准确界定灭菌效果以及解析微生物在土壤生态过程中的作用;(2) 高温高压蒸汽比常规氯仿熏蒸和辐射灭菌方法有更好的土壤微生物灭活效果.实际应用中采用高温高压蒸汽灭菌时,建议采用灭菌2次、时间间隔为3d的灭菌处理;在相关研究中,对使用该方法灭菌效果的分析研究最佳时间不宜超过2d.
土壤灭菌; 土壤微生物活性; 土壤微生物量; 灭菌次数; 灭菌间隔天数
在土壤生态学、微生物学及其他相关研究中,为确定土壤微生物的生物量或微生物活性及其调控机制,常需要对土壤进行灭菌处理[1-4].常规土壤灭菌方法包括物理方法如高温高压蒸汽灭菌、辐射灭菌、微波灭菌及化学方法如氯仿(三氯甲烷)熏蒸灭菌等[5],其中氯仿熏蒸灭菌的相关技术不仅是目前测定土壤微生物生物量的通用方法,也是解析微生物呼吸对土壤总呼吸贡献的基础[6].
常规土壤灭菌方法各有利弊,高温高压蒸汽灭菌操作简单成本低,但是对土壤理化性质的扰动很大,虽然适当添加化学辅助剂会提高灭菌效率,但是辅助剂的残留也会带来一定的后续影响[7-8].辐射灭菌既能达到一定的灭菌效果同时对土壤理化性质影响较小,但易使土壤有机物质溶解出现不平衡的迹象[9].氯仿熏蒸法操作简便成本低,但是试剂本身的残留会对后续土壤实验带来负作用,此外灭菌操作过程中挥发出的氯仿蒸汽会对环境带来一定的污染[10].由于土壤理化性状的高异质性及土壤微生物的多样性,不同灭菌方法的效果存有较大的不确定性,灭菌处理后土壤仍会表现出高低不等的微生物活性.另外,在土壤灭菌过程中,处于休眠态的土壤微生物需要一定的时间转化为活性状态后才能在灭菌处理中被除去[11-12],常规一次性灭菌可能不足以对微生物有效灭活.因此,对于同一种灭菌方法,重复灭菌的次数及改变灭菌时间的间隔也会影响到土壤灭菌的效果.曾有研究发现,灭菌2次以上时土壤微生物的灭活效果会更显著[13-15].为了达到较好的土壤微生物灭活效果,需要在常规灭菌方法基础上对灭菌次数及灭菌时间间隔进行优化.
一些土壤研究认为,测量灭菌前后的土壤微生物量的变化,计算被灭活的土壤微生物占整个土壤微生物群落的比例,也可以反映出土壤灭菌效果及整个微生物群落的状态[16].这种观点的基础是灭菌后土壤微生物量的变化与微生物活性的变化存在相关性,如Griffiths[17]通过氯仿熏蒸对土壤进行灭菌以降低其中的微生物量,发现在灭菌后微生物量显著降低的土壤中,有机质分解速率及土壤恢复能力均较低,进而推测灭菌后土壤微生物的活性也随之降低.实际应用中经常会有不同的情形发生.Tuominen等[18]采用高温高压蒸汽、辐射、甲醛和氯化汞4种方法对土壤进行灭菌处理后,发现土壤微生物量确实会显著降低,但是Ramsay等[19-20]在后续研究中却发现其中辐射及氯仿熏蒸处理后,灭菌土壤的微生物活性却显著地高于未灭菌土壤.说明灭菌处理后微生物量的减少并不完全代表微生物活性程度的降低,土壤微生物活性在一定程度上才是反应土壤中整个微生物群落存活状态的关键[21],单纯从土壤微生物量变化的角度不能准确界定微生物的灭活效果.虽然土壤微生物量及微生物活性均可以作为观测整个土壤微生物群落的重要指标,但是采用不同方法灭菌过程中土壤微生物量及微生物活性之间关系的变化仍不是很明确,给土壤生态学的相关研究带来不确定性.
在以往研究和生产应用中,经过常规灭菌处理的土壤,通常被认为微生物活性已得到最大程度的降低[22].氯仿熏蒸法作为测定土壤微生物量的常规技术,其基本假设就是绝大多数土壤微生物已经被氯仿蒸汽杀死[23].但在实际应用灭菌处理后,土壤微生物是否已基本灭活并未能系统完善的评价.土壤中的大多数生物化学过程都是由微生物介导,如有机质矿化、硝化/反硝化[24]以及有机物转化[25]等.土壤微生物呼吸(通常称为土壤异养呼吸,以与土壤中的植物根系呼吸相区别)速率是度量由微生物介导的土壤过程的一个有效指标,通过测定土壤微生物吸收的氧气或释放的二氧化碳总量,可以表征土壤微生物的总体表观活性[26].系统地测量灭菌处理前后土壤的呼吸强度,可较好地反映出微生物的灭活效果[22].目前通过测定灭菌前后土壤呼吸的变化来定量评价土壤微生物灭活效果的研究较为少见,尤其是对氯仿熏蒸灭菌后土壤微生物量及微生物活性变化之间的关系尚未有系统研究.本文选取3种常见的土壤灭菌方法,即高温高压蒸汽灭菌法、氯仿熏蒸法及辐射灭菌法,对4种不同发育背景的土壤样品进行灭菌处理,改变灭菌次数及灭菌时间间隔,测定灭菌后土壤呼吸的变化,比较各灭菌方法在不同处理情景下对土壤微生物的灭活效果及灭活持续性的差异,以寻求最佳的土壤灭菌条件组合.同时选取一种土样(沈阳森林)进行氯仿熏蒸灭菌,测量灭菌前后土壤微生物量及土壤呼吸的变化,探究该灭菌方法不同灭菌次数及灭菌时间间隔处理后的土壤微生物量及微生物活性之间的变化关系.
1 材料与方法
1.1 土壤样品的采集与预处理
本研究选取4种不同土壤,样品采集于2015年9月至2016年4月间,采样地背景和土壤基本理化性质如表1所示.土样采集时,随机在每个取样地设置3个采样点,采样点之间的距离不小于10m.先除去地表石子、植被等杂物,然后用土壤取样器(直径8cm)在每个采样点处采取0~20cm的表层土,并将3个样点的土壤均匀混合.采取的土样在最短时间内运回实验室,挑拣出碎石子与植物根系等杂物后,置于25℃恒温箱中储存以供后续使用.
新鲜土样的含水量用烘干法测定.将部分鲜土样经过自然风干,研磨后过不锈钢筛(孔径2mm,10目)备用.取经上述处理后的土样用数字酸度计(PHS-3E,上海佑科仪器有限公司)于2h内测定土壤pH值,样品水土比例为2.5∶1.取鲜土样研磨后过不锈钢筛(孔径0.15mm,100目),使用碳氮分析仪(Flash EA 1112 Series NC Analyzer, Thermo Fisher Scientific, USA)测定土壤总碳、总氮含量,同时使用总有机碳分析仪(Multi N/C 3100 with solid module HT1300, Analytic Jena AG, Germany)测定土壤有机碳的含量.

表1 各样地土壤背景值及相关理化性质Tab.1 The background information and physio-chemical properties of soil samples
1.2 土壤预培养及灭菌处理
样品分为空白对照和灭菌处理组.空白对照组不进行任何灭菌处理,每种土样有4个重复.灭菌处理组采用3种灭菌方法,即高温高压蒸汽、氯仿熏蒸和射线灭菌.每种方法均重复灭菌3次,但有3种不同的时间间隔,即两次灭菌之间的间隔分别为1d、3d、5d.灭菌处理样品总计: 4种土壤×3种灭菌方法×3种时间间隔×4个重复.
预培养: 每个样品称取相当于20g干土的鲜土壤置于150mL玻璃培养瓶中,并将土样含水量调至土壤饱和含水量的60%,放入25℃的恒温箱中培养7d,并定时调水以保证含水量稳定.
高温高压灭菌: 预培养结束后,将土样瓶口包扎好通气封口膜,置于高温高压灭菌锅内,于121℃高温高压条件下灭菌1.5h.每次灭菌后需用无菌水调节含水量至土壤饱和含水量的60%.
氯仿熏蒸灭菌: 将待灭菌的土样放入真空罐中氯仿熏蒸24h,然后取出装氯仿的烧杯.密闭真空罐后抽气5min,重复8次,以除去中土壤中残留的氯仿[27-28].灭菌后的土样用无菌水调节含水量至土壤饱和含水量的60%.
辐射灭菌: 将待灭菌的土样平铺于自封袋中,接受钴-60(60Co)放射源(上海市核铭辐射科技有限公司)的照射,每次照射剂量为30kGy,每次灭菌后在无菌台上将土样转移回150mL培养瓶中,并用无菌水调节含水量至土壤饱和含水量的60%.
1.3 灭菌后土样培养、土壤微生物量及土壤呼吸的测定
土壤培养: 将空白对照和灭菌处理组的土壤样瓶用橡皮塞密封后放入恒温水浴槽中(DC-0530,上海比朗仪器),新鲜空气经带滤菌装置的分配系统均匀地流通至每一个样瓶中,空气流速约为700mL/min,所有样品均于25℃下恒温培养[29-30].
土壤微生物生物量碳(Microbial Biomass Carbon, MBC)含量的测定: 采用氯仿熏蒸浸提法[31],土样经过熏蒸浸提离心后,将上清液过滤置于试管内,稀释10倍后用TOC仪测定土样溶液中的碳含量,并根据各土样对应的土壤含水量计算土壤微生物生物量碳含量.
土壤微生物量碳的计算公式:
wMBC=ΔEC/kC,
(1)
其中wMBC为土壤微生物量碳含量(mg·kg-1),ΔEC为熏蒸与未熏蒸土壤有机碳含量的差值,kC为转换系数,取值0.38.
土壤呼吸测定: 待培养温度稳定后,开始测定土壤呼吸.关闭通气阀门,立即用注射器在每个待测样瓶中抽取5mL样气.密闭培养瓶一定时间后再次抽取各样瓶中的气体5mL,针对不同的土样和处理情境,通过预实验来确定各自的密闭时间.取样结束后打开通气阀门恢复系统通气状态,直至下一次取样.抽取的气体样品用气相色谱仪(Agilent Technologies, Inc)测定其中的CO2浓度.根据密闭前后所抽取的样气中的CO2浓度差值计算土壤的呼吸速率.
土壤样品呼吸速率的计算公式为:
(2)
其中:Rs为土壤呼吸速率(μmol·g-1·h-1);22.4为标准状态下(273.2K,1013kPa)气体的摩尔体积(L/mol);P为取气样时培养瓶内的气压(kPa);P0和T0分别为标准状态下空气的绝对气压(kPa)和绝对温度(K);T为取气样时培养瓶内的绝对温度(K);ΔC为CO2浓度(mg/m3)在密闭时间内的增加值: Δt为密闭时间(h);V为培养瓶内的空气体积(L);M为培养土样的干重(g).
土壤样品呼吸变化率计算公式为:
Rc=R1/R0,
(3)
其中:Rc表示灭菌后土样呼吸的变化率;R1为灭菌处理后的土壤呼吸速率(μmol·g-1·h-1);R0为空白对照组的土壤呼吸速率(μmol·g-1·h-1).
1.4 数据分析
本研究采用单因素方差分析氯仿熏蒸灭菌后土壤微生物量与微生物活性变化之间的关系、不同灭菌方式处理下土壤呼吸变化率及高温高压3次灭菌后土壤呼吸速率.所有数据统计分析均使用SPSS 13.0完成,所有数据作图均采用Sigmaplot 12.0完成.
2 结 果
2.1 氯仿熏蒸灭菌后土壤微生物量碳及土壤微生物活性的变化
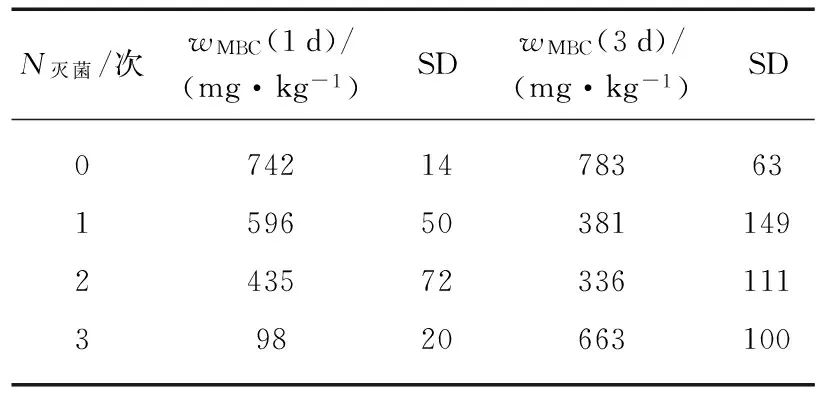
表2 土壤经氯仿熏蒸灭菌后的土壤MBC含量Tab.2 Soil wMBC values after sterilization treatments by Chloroform fumigation method
对沈阳森林土样进行氯仿熏蒸灭菌,改变灭菌次数及灭菌间隔天数,各种处理的wMBC值见表2.当灭菌间隔为1d时,随着灭菌次数的增加灭菌后wMBC值逐渐依次减小,且在第3次灭菌后wMBC值达到了3次灭菌后的最小值98.
当灭菌间隔为3d时,前2次灭菌后wMBC显著减小且2者间无显著性差异(P>0.05),平均约为359,第3次灭菌后土壤wMBC值略有增加,但仍小于对照组.
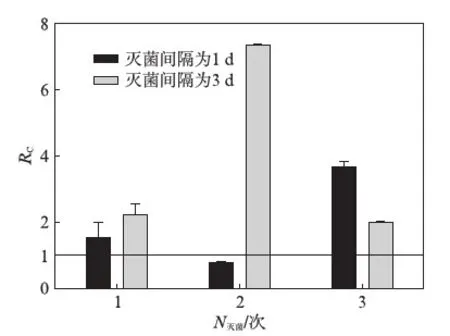
图1 氯仿熏蒸灭菌处理下土壤呼吸变化率Fig.1 Changes of soil respiration rate after Chloroform fumigation sterilization
图1为沈阳森林土样经氯仿熏蒸灭菌后微生物的呼吸变化率.当灭菌间隔为1d时,仅有第2次灭菌后土壤呼吸低于对照组,呼吸变化率介于0~1.0之间,与对照组的比值约为0.73.而第1次及第3次灭菌后土壤呼吸均高于对照组,平均约为对照组的2.57倍.当灭菌间隔为3d时,3次灭菌后土壤呼吸均高于对照组,平均约为对照组的3.85倍.其中第3次灭菌后土壤呼吸增加程度最小,第2次灭菌后土壤呼吸增加程度最大.结果显示,氯仿熏蒸灭菌并未有效降低土壤微生物活性,反而在短时间内使微生物的活性显著增强.
2.2 不同灭菌处理后土壤呼吸的变化
在灭菌间隔为1d的处理下,高温高压灭菌处理后的土壤呼吸速率最低,与对照组比值平均约为0.12.氯仿熏蒸灭菌后,除沈阳森林土样在第2次灭菌后的土壤呼吸低于对照外(图2-A),其余所有土样每次灭菌后的土壤呼吸均高于对照,约为对照组的14.99倍.辐射灭菌处理下,除沈阳森林、抚顺农田土样在第2次、第3次灭菌后(图2-A、2-B)的土壤呼吸变化率介于0~1.0之间外,其余所有土样每次灭菌结束后的土壤呼吸变化率均大于1.0,平均约为对照组的6.56倍.
图3是在灭菌间隔为3d的处理下,采用不同灭菌方法灭菌后土壤呼吸的变化.高温高压灭菌后的所有土壤样品的呼吸均显著降低,且低于各自的未灭菌对照组,与对照组的比值平均为约0.12.氯仿熏蒸后所有土壤的呼吸均显著高于对照,平均约为未灭菌对照组土壤的4.5倍.辐射灭菌处理下,除抚顺农田土样(图3-B)在第2次、第3次灭菌后的土壤呼吸低于对照组外,其他处理的土壤呼吸变化率均显著高于对照组,平均约为对照组的5.11倍.
在灭菌间隔为5d的处理下(图4,),高温高压灭菌处理后各土壤样品的呼吸均显著降低,与对照组平均呼吸的比值约为0.21.氯仿熏蒸和辐射处理后的土壤呼吸均显著高于对照组,呼吸速率分别为对照组平均值的4.8倍和3.8倍.
图2~图4的结果表明,当利用氯仿熏蒸灭菌和辐射灭菌时,以土壤呼吸表征的微生物活性并没有降低,反而在短期内显著增加.高温高压蒸汽方法的灭活效果最好,土壤呼吸速率平均降低为对照组的18%.灭活的效果与土壤特性有关,但与灭菌处理没有明显的相关.碱性土壤对CO2有吸收作用,经高温高压蒸汽灭菌后残留的微生物呼吸强度低,使得灭菌后土壤呼吸的测量值很小甚至为负值.土壤的微生物呼吸不可能为负值,所有的测量负值均未呈现在图2-D、图3-D、图4-D中.而崇明森林土样的微生物呼吸本底值较高,经过高温高压灭菌后测得的残留物呼吸均为正值(图2-C、图3-C、图4-C).
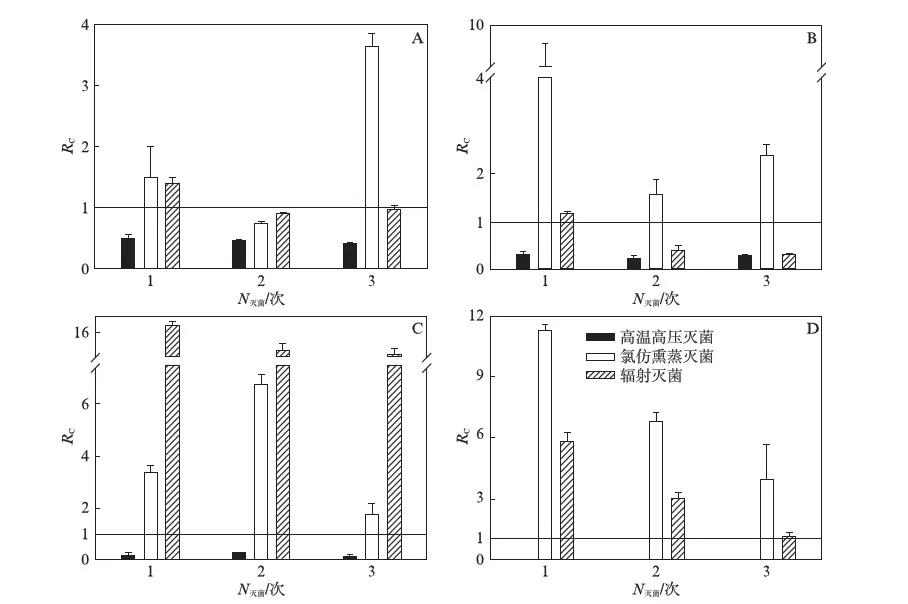
图2 不同灭菌方式下间隔为1d时土壤呼吸变化率Fig.2 Rc of sterilized soil over control by different techniques with one day interval of sterilizationA为沈阳森林土样;B为抚顺农田土样;C为崇明森林土样;D为崇明农田土样.
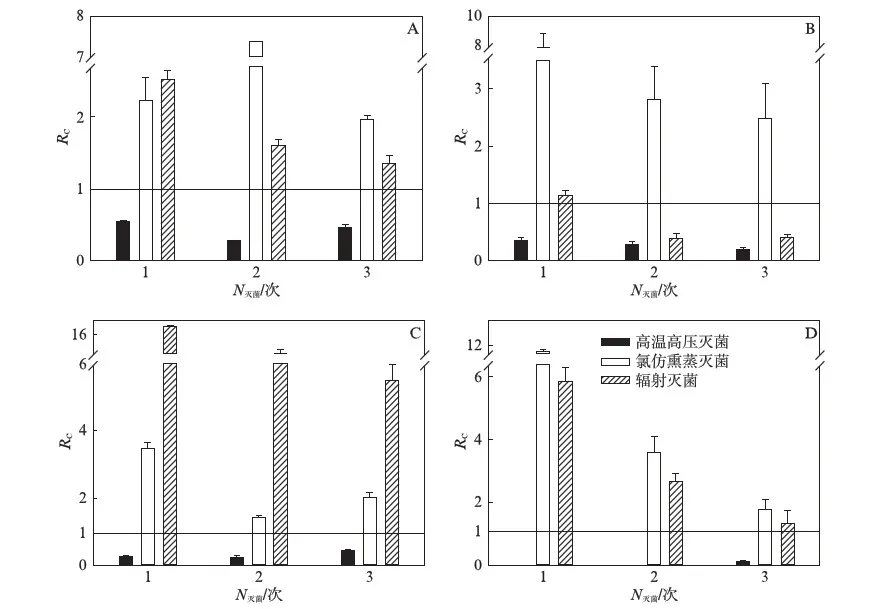
图3 不同灭菌方式下间隔为3d时土壤呼吸变化率Fig.3 Rc of sterilized soil over control by different techniques with three days interval of sterilizationA为沈阳森林土样;B为抚顺农田土样;C为崇明森林土样;D为崇明农田土样.
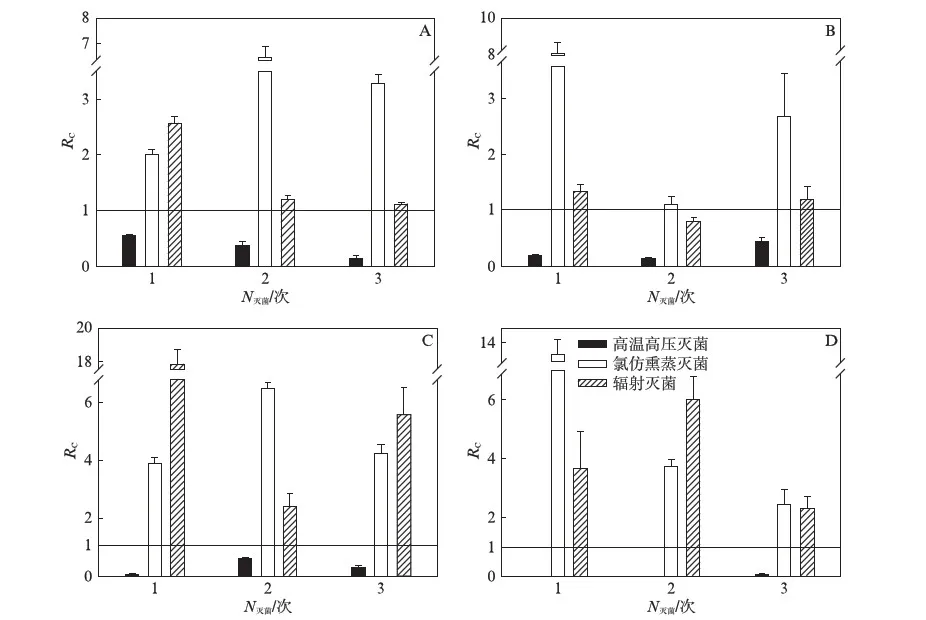
图4 不同灭菌方式下间隔为5d时土壤呼吸变化率Fig.4 Rc of sterilized soil over control by different techniques with five days interval of sterilizationA为沈阳森林土样;B为抚顺农田土样;C为崇明森林土样;D为崇明农田土样.
2.3 高温高压蒸汽灭菌对土壤微生物的灭活效果
表3是不同土壤用高温高压灭菌处理时采用不同的灭菌次数与间隔下土壤呼吸的变化.在3次灭菌过程中,当灭菌间隔为1d时,森林土样第3次灭菌后、农田土样第2次灭菌后的土壤呼吸变化率达到了最小值.当灭菌间隔为3d时,沈阳森林、崇明森林及抚顺农田土第2次灭菌后、崇明农田土样第3次灭菌后的土壤呼吸变化率达到了最小值.当灭菌间隔为5d时,沈阳森林土样第3次、抚顺农田土样第2次灭菌后的土壤呼吸变化率达到最小值,而崇明两种土样第1次灭菌后的土壤呼吸变化率就已达到最小值.灭菌间隔和灭菌次数对微生物灭活效果没有显示系统性的显著影响.
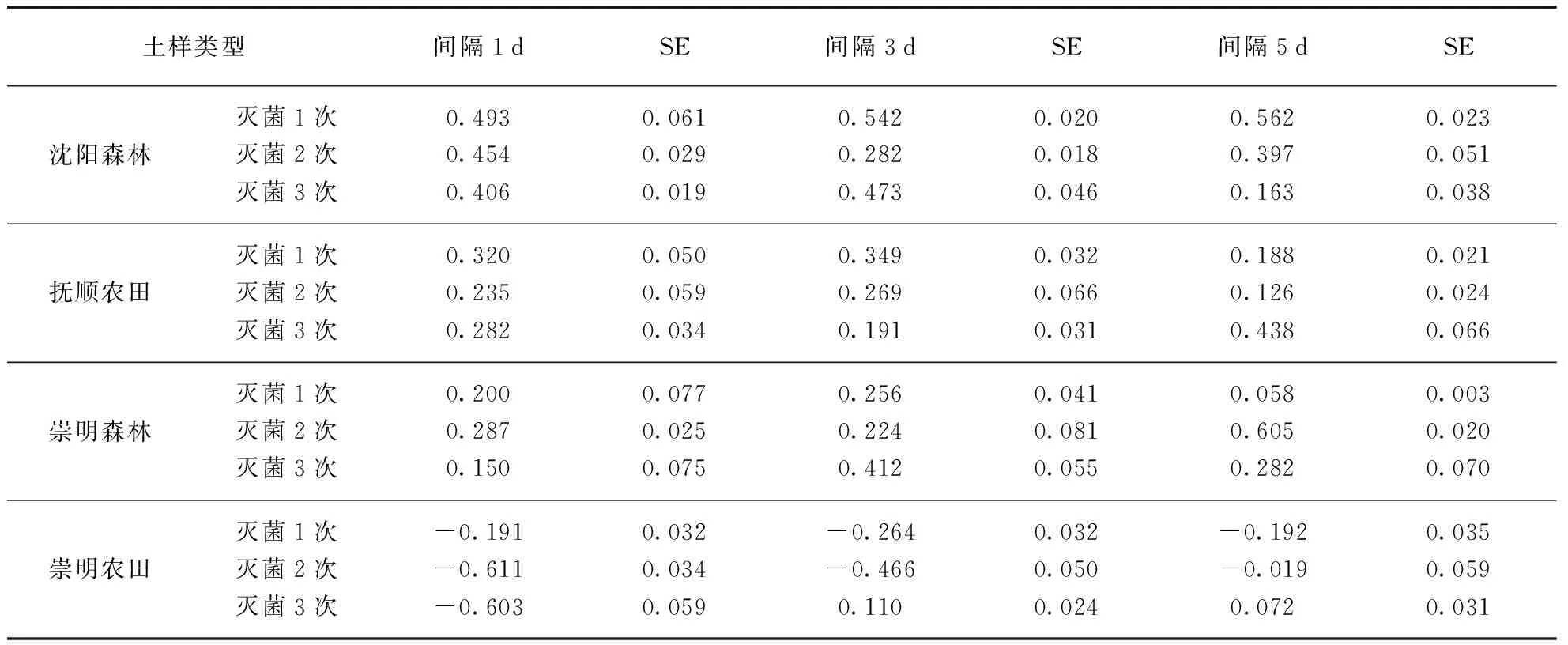
表3 高温高压灭菌方法中不同间隔、次数处理下的土壤呼吸变化率Tab.3 Rc of High temperature and high pressure sterilization method in different intervals, numbers of treatment
图5为高温高压灭菌3次处理后,土样呼吸在5d内的变化.沈阳森林土样在灭菌间隔为1d、3d处理下,灭菌后的5d内土壤呼吸值持续低于未灭菌的土壤;在灭菌间隔为5d处理下,灭菌后的土壤呼吸值则在第3d时就出现大幅度的增加且高于未灭菌土壤.抚顺农田土样在灭菌间隔为1d处理下,灭菌后的5d内土壤呼吸值持续低于未灭菌土壤.而在灭菌间隔为3d、5d的处理下,灭菌后的土壤呼吸值均在第4d出现大幅度增加.对于崇明两种类型土样,无论何种灭菌间隔处理,灭菌后的土壤呼吸值均在第3d时出现大幅度增加且高于未灭菌的土壤.
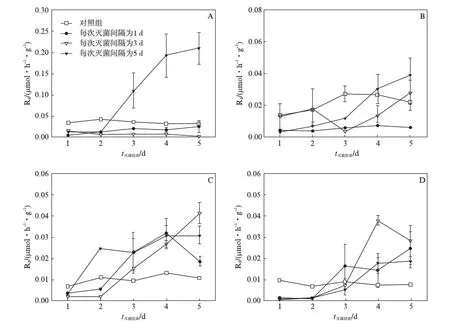
图5 高温高压3次灭菌结束后土壤的变化Fig.5 The variations of soil respiration after 3 times of steam sterilizationA为沈阳森林土样;B为抚顺农田土样;C为崇明森林土样;D为崇明农田土样.
3 讨 论
3.1 氯仿熏蒸灭菌后土壤微生物量与微生物活性的变化关系
土壤微生物量碳是土壤微生物生物量的重要组成成分,是目前通用的微生物定量指标.本研究结果表明,当灭菌间隔为1d时,氯仿熏蒸灭菌后土壤wMBC随着灭菌次数的增加而逐渐减少,但是仍有相当数量的微生物量存在,表明目前研究中常用的一次熏蒸灭菌法可能显著低估了土壤微生物的生物量.虽然这种低估可能通过kC的取值得到部分抵消,但是在不同土壤和不同的情境下,测定结果的不确定性增大,且难以估算.灭菌处理后,土壤微生物活性随着灭菌次数的增加呈现先降低后上升的趋势.当灭菌间隔为3d时,灭菌土壤微生物量随着灭菌次数的变化呈现先降低后增加的趋势,且均持续低于对照组,但土壤微生物活性的变化却呈现先增加后降低的趋势.说明氯仿熏蒸灭菌处理下,土壤微生物量的降低并不代表土壤微生物活性的降低,单纯从土壤微生物量的角度观测分析灭菌效果是不具有说服力的.
3.2 不同灭菌方法对土壤微生物的灭活效果
本研究结果表示,改变灭菌次数及灭菌间隔天数,土壤在各灭菌方法处理下所达到的微生物灭活效果存在一定的差异.相比于其他的两种灭菌方法,高温高压灭菌能使灭菌后的土壤呼吸处于较低水平,具有较好的土壤微生物灭活效果.但是,目前常用的几种土壤灭菌方法,都难以使土壤微生物的活性降低到可忽略的程度.如果采用灭菌与未灭菌对照的途径确定微生物活性与贡献,会使结果产生偏差.
3.3 高温高压灭菌的灭菌间隔与灭菌次数对土壤微生物灭活效果的影响
本研究中,在灭菌间隔为1d的处理下,森林土样与农田土样分别在3次、2次高温高压蒸汽灭菌后才达到较好的灭活效果.Wolf等[6]及Carter等[21]曾用高温高压灭菌法对3种土壤进行连续灭菌,实验中设置了不同的灭菌次数,并对每次灭菌结束后土样中真菌和细菌数量的进行测定,发现需要2次甚至3次灭菌处理才能使待灭菌土壤中的真菌和细菌有效地被除去,这与本实验中的结果相一致.这是由于在高温高压灭菌的过程中,样品在容器中很难达到完全分布均匀的状态,所以当灭菌时间间隔较短时,需要进行多次灭菌才能较好的将土壤中绝大多数的微生物消除.
在灭菌间隔为3d的处理下,多数土样在灭菌2次后就能达到较好的灭菌效果.表明虽然多次灭菌可以在一定程度上达到较好的灭菌效果,但是土壤中的大部分的微生物可能处于芽孢或休眠的状态,此时微生物对高温高压处理有很强的抗性,短时间内即使连续多次灭菌也不能完全将这些微生物杀死[32].若2次灭菌之间存在一定的时间间隔时,土壤中这些休眠的微生物会在此时间内转为活性状态,在接下来的灭菌处理中才会被除去.不同来源的土壤所需最适灭菌间隔天数可能会有所不同,沈阳森林土样及所有崇明土样在灭菌间隔为3d的处理下,2次灭菌后能达到较好的灭菌效果,抚顺农田土样则需要在灭菌间隔为5d的处理下,2次灭菌后能达到较好的灭菌效果.
当灭菌间隔为5d时,崇明土样第1次灭菌后的土壤呼吸速率最低,而后续灭菌处理的效果反而不如第1次灭菌的效果好.Tuominen[9]通过平板计数法检测到高温高压灭菌结束后土壤微生物数量确实有所减少,但被杀死的土壤微生物会使土壤中的DOC(可溶性有机碳)含量显著增加[33].此外高温高压灭菌方法对土壤的性状有所改变,同时会使土壤中可利用的微量营养元素增加[6],这些因素可能会增加土壤底物的可利用性[34].实际上,所有方法的灭菌处理都会引起土壤底物有效性的增加,只是高温高压蒸汽法表现相对明显.Wang[35]指出在特定的条件下,土壤呼吸受土壤底物可利用性的控制会比受土壤微生物数量的影响更加显著.如果2次灭菌处理间隔过长,会导致微生物得到较大程度地恢复,第1次灭菌后未杀死的处于休眠态的土壤微生物不仅能在灭菌间隔期间恢复活性,且灭菌后土壤底物可利用性增加还会促使这部分微生物及其余残留微生物快速增长,使土壤中微生物数量大幅上升,导致后续灭菌效果没有第1次灭菌后的效果显著.在这种情形下,2次灭菌的间隔为5d可能过长,易使土壤中残留微生物得以较大程度的恢复.
3.4 高温高压灭菌后微生物灭活效果的持久性
一般而言,灭菌处理对土壤微生物的灭活效果只能持续有限的一段时间,其后土壤微生物的活性和种群便会逐渐恢复.灭活效果持续时间的长短与很多因素有关,土壤中未被杀灭微生物/休眠态孢子体数量、营养底物的有效性以及土壤性状(如pH、有机质含量及DOC含量等)都可能影响到灭活效果的持续时间.原则上,有机质含量高的土壤,高温高压灭菌后活性有机质增加对微生物的影响可能相对较小,而有机质本底较低的土壤,灭菌处理引起的活性有机质增加对微生物的恢复可能会有较显著的作用.本研究发现,经过3次高温高压灭菌后,沈阳森林、抚顺农田两种土样在灭菌后的5d中能维持相对较低的呼吸水平(灭菌间隔为5d的沈阳森林土样的有效灭活效果只能维持2d).崇明两种土样在采用不同灭菌间隔的3次灭菌后,土壤呼吸值在第3d时均出现大幅增加且高于未灭菌土壤,灭菌效果维持的时间较短.有研究指出,土壤若酸碱性不同,土壤中微生物群落结构组成会有一定的差异.以K策略为主的微生物如土壤真菌、放线菌等多存在于酸性土壤中[36],当高温高压蒸汽灭菌处理时,这些酸性土壤中的真菌、放线菌较易被除去,从而使灭菌后在一定时间内能维持较低的呼吸水平.以R对策生长为主的细菌在碱性土壤中比例较高且生长效果更好,它们对于高温高压的抗性更加强烈.灭菌处理使土壤中营养底物的有效性在短时间内显著增加,R对策微生物会利用这些营养底物,在短时间内大量繁殖,微生物的整体活性很快会恢复并超过原初状态[37-39].我们的研究表明,崇明两种呈碱性的土样在灭菌后的微生物活性虽然显著降低(图5-C,D),但维持时间很短.虽然高温高压蒸汽灭菌相比较其他常用灭菌方法更有效,但无论对实验中何种土壤,都只能在一个非常有限的时间内维持低的土壤微生物活性.我们建议,在相关研究中,对灭菌土壤的所有测试分析应在灭菌处理后2d内完成,否则可能会对研究结果带来较大偏差.
4 结 论
1) 经常规灭菌处理后土壤微生物量的减少并不代表土壤微生物活性程度的降低,通过观测灭菌后土壤微生物量及其变化来判断土壤灭菌效果不够准确.
2) 基于灭菌处理后土壤微生物活性的变化,高温高压蒸汽灭菌比常规氯仿熏蒸和辐射灭菌方法有更好的效果.氯仿熏蒸和60Co射线照射虽然有可能杀灭大多数土壤微生物活体,但处理后的土壤微生物整体表观活性并未有效降低.
3) 采用高温高压蒸汽灭菌,灭菌次数与灭菌间隔对土壤微生物的灭活效果有显著影响.在实际应用中,建议采用2次灭菌处理,2次处理的时间间隔为3d.
4) 碱性土壤的微生物有效灭活效果的持续时间在2d左右,酸性土壤可能稍长.在相关研究中,对土壤灭菌效果的分析研究以不超过2d为佳.
[1] 汪崇正,黄水招,李建军,等.漂白粉土壤灭菌预防茄果蔬菜土传病害的效果 [J].浙江农业科学,2008,02(23): 224-225.
[2] HUANG L, SONG L, XIA X,etal. Plant-soil feedbacks and soil sickness: From mechanisms to application in agriculture [J].JournalofChemicalEcology, 2013,39(2): 232-242.
[3] 侯永侠,周宝利,吴晓玲,等.土壤灭菌对辣椒抗连作障碍效果 [J].生态学杂志,2006,3(3): 340-342.
[4] KLEINSCHMIDT G D, GERDEMANN J W. Stunting of citrus seedlings in germinated nursery solid related to absence of end mycorrhizae [J].Phytopathology, 1972,62(12): 1447-1453.
[5] WOLF D C, DAO T H, SCOTT H D,etal. Influence of sterilization methods on selected soil microbiological, physical, and chemical-properties [J]. JournalofEnvironmentalQuality, 1989,18(1): 39-44.
[6] OCAMPO J A, HAYMAN D S. Effects of pesticides on mycorrhiza in field-grown barley, maize and potatoes [J].TransBritMycolSoc, 1980,74(4): 413-416.
[7] MCNAMARA N P, BLACK H, BERESFORD N A,etal. Effects of acute gamma irradiation on chemical, physical and biological properties of soils [J].AppliedSoilEcology, 2003,24(2): 117-132.
[8] LOTRARIO J B, STUART B J, LAM T,etal. Effects of sterilization methods on the physical characteristics of soil-implications for sorption isotherm analyses [J].BullEnvironContamToxicol, 1995,54(5): 668-675.
[9] STAUNTON S, BARTHES M, LECLERC E,etal. Effect of sterilization and experimental conditions on the isotopic exchange of nickel in two contrasting soils [J].EuropeanJournalofSoilScience, 2002,53(4): 655-661.
[10] KATAN J, GREENBERGER A, ALON H,etal. Solar heating by polyethylene mulching for control of diseases caused by soil-borne pathogens [J].Phytopathology, 1976,66(5): 683-688.
[11] POWLSON D S, JENKINSON D S. A comparison of the organic matter, biomass, adenosine triphosphate and mineralizable nitrogen contents of ploughed and direct-drilled [J].JournalofAgriculturalScience, 1981,97(5): 713-721.
[12] ZIMMERMANN M, MEIR P, BIRD M I,etal. Climate dependence of heterotrophic soil respiration from a soil-trans-location experiment along a 3000 m tropical forest attitudinal gradient [J].EuropeanJournalofSoilScience, 2009,60(6): 895-906.
[13] WOLF D C, DAO T H, SCOTT H D,etal. Influence of sterilization on methods on selected soil microbiological, physical, and chemical-properties [J].JournalofEnvironmentalQuality, 1989,18(1): 39-44.
[14] CARTER D O, YELLOWLEES D, TIBBETT M. Autoclaving kills soil microbes yet soil enzymes remain active [J].Pedobiologia, 2007,51(4): 295-299.
[15] NOWAK A, WRONKOWSKA H. The efficiency of soil sterilization [J].ZentralblattFurMicrobiologie, 1987,142(7): 521-525.
[16] 孙波,赵其国,张桃林,等.土壤质量与持续环境──Ⅲ.土壤质量评价的生物学指标 [J].土壤,1997(5): 225-234.
[17] GRIFFITHS B S, RITZ K, BARDGETT R D,etal. Ecosystem response of pasture soil communities to fumigation-induced microbial diversity reductions: An examination of the biodiversity-ecosystem function relationship [J].OIKOS, 2000,90(2): 279-294.
[18] TUOMINEN L, KAIRESALO T, HARTIKAINEN H. Comparison of methods for inhibiting bacterial-activity in sediment [J].AppliedandEnvironmentalMicrobiology, 1994,60(9): 3454-3457.
[19] SPARLING G P, WHALE K N, RAMSAY A J. Quantifying the contribution from the soil microbial biomass to the extractable p-levels of fresh and air-dried soils [J].AustJSoilRes, 1985,23(4): 613-621.
[20] KEMITT S J, LANYON C V, WAITE I S,etal. Mineralization of native soil organic matter is not regulated by the size, activity or composition of the soil microbial biomass-a new perspective [J].SoilBiolBiochem, 2008,40(1): 61-73.
[21] HOITINK H, BOEHM M J. Biocontrol within the context of soil microbial communities: A substrate-dependent phenomenon [J].AnnualReviewofPhytopathology, 1999,37(5): 427-446.
[22] INSAM H. Are the soil microbial biomass and basal respiration governed by the climatic regime [J].SoilBiolBiochem, 1990,22(4): 525-532.
[23] POWLSON D S, JENKINSON D S. The effects of biocidal treatments on metabolism in soil-Ⅰ fumigation with chloroform [J].SoilBiolBiochem, 1976,8(7): 167-177.
[24] ALLISON S D, MARTINY J B. Resistance, resilience and redundancy in microbial communities [J].ProcNatAcadSciUSA, 2008,105(11): 512-519.
[25] PATERSON E, CAMPBELL C, 杨元根. Biology方法在区分城市土壤与农村土壤微生物特性上的应用 [J].土壤学报,2002,39(4): 582-589.
[26] ANDERSON J M. The effects of climate change on decomposition processes in grassland and coniferous forests [J].EcologicalApplications, 1991,93(8): 326-347
[27] JENKINSON D S. Studies on decomposition of plant material in .2. Partial sterilization of soil and soil [J].JournalofSoilScience, 1966,17(2): 280.
[28] LANDI L, BADALUCCO L, NANNIPIERI P. Changes in inorganic-N and CO2evolution in soil induced by l-methadone-sulfoximine [J].SoilBiolBiochem, 1995,27(10): 1345-1351.
[29] CHEN X, TANG J, JIANG L,etal. Evaluating the impacts of incubation procedures on estimated Q10values of soil respiration [J].SoilBiolBiochem, 2010,42(12): 2282-2288.
[30] FANG C, MONCRIEF J B. The dependence of soil CO2efflux on temperature [J].SoilBiolBiochem, 2001,33(2): 155-165.
[31] BANK T L, KUKKADUPA R K, MADDEN A S,etal. Effects of gamma-sterilization on the physic-chemical properties of natural sediments [J].ChemicalGeology, 2008,251(1-4): 1-7.
[32] BROOKES P C, LANDMAN A, PRUDEN G,etal. Chloroform fumigation and the release of soil-nitrogen-a rapid direct extraction method to measure microbial biomass nitrogen in soil [J].SoilBiolBiochem, 1985,17(6): 837-842.
[33] BLAGODATSKAYA E K. Active microorganisms in soil: Critical review of estimation criteria and approaches [J].SoilBiolBiochem, 2013,67(7): 192-211.
[34] RASMUSSEN J, KUZYKOV Y. Carbon isotopes as proof for plant uptake of organic nitrogen: Relevance of inorganic carbon uptake [J].SoilBiolBiochem, 2009,41(7): 1586-1587.
[35] BERNS A E, PHILIPP H, NARRES H D,etal. Effect of gamma-sterilization and autoclaving on soil organic matter structure as studied by solid state NMR, UV and fluorescence spectroscopy [J].EuropeanJournalofSoilScience, 2008,59(3): 540-550.
[36] WANG W J, DALAL R C, MOODY P W,etal. Relationships of soil respiration to microbial biomass, substrate availability and clay content [J].SoilBiolBiochem, 2003,35(12): 273-284.
[37] 唐琨,朱伟文,周文新,等.土壤pH对植物生长发育影响的研究进展 [J].作物研究,2013,27(2): 207-212.
[38] 李忠,孙波,林心雄.我国东部土壤有机碳的密度及转化的控制因素 [J].地理科学,2001,21(4): 301-307.
[39] 朱海平,姚槐应,张勇勇,等.不同培肥管理措施对土壤微生物生态特征的影响 [J].土壤通报,2003,34(2): 140-142.
TheEffectsofDifferentSoilSterilizationTreatmentsonSoilMicrobialActivity
ZHENGJiahui,CHENHongyang,LIJinquan,NIEMing,FANGChangming
(InstituteofBiodiversityScience,SchoolofLifeSciences,FudanUniversity,Shanghai200438,China)
Soil sterilization is important in researches of soil ecology, microbiology and other relevant areas. The efficiency of soil sterilization affects greatly the reliability of subsequent research. However, there are still large uncertainties in how to assess soil sterilization efficiency of different techniques. In this study, we used three common methods of soil sterilization at present, i.e. high-temperature and high-pressure steaming, chloroform fumigation and radiation, to sterilize soils taken from forests and croplands. Variations of soil respiration before and after sterilization with different sterilization times and intervals were monitored. Our result indicated that (1) after sterilization by chloroform fumigation, soil microbial respiration did not decrease with the reduced soil microbial biomass, suggesting that changes of soil microbial biomass alone could not appropriately reflect sterilization efficiency, neither microbial contribution to soil ecological processes; (2) High-temperature and high-pressure steaming could achieve a better inactivation of soil microbes than chloroform fumigation and radiation techniques. For achieving a best result of soil sterilization with high-temperature and high-pressure steaming technique, we recommended to sterilize soil 2 times with high-temperature and high-pressure steam with a time interval of 3 days, and to complete follow-on studies within 2 days after soil sterilization.
soil sterilization; soil microbial activity; soil microbial biomass; times of sterilization; time interval of sterilization
0427-7104(2017)06-0681-11
2017-03-21
国家自然科学基金(31670491);上海浦江学者计划(16PJ1400900)
郑嘉慧(1991—),女,硕士研究生;方长明,男,教授,通信联系人,E-mail: cmfang@fudan.edu.cn.
Q148
A

