Wnt信号通路对骨髓间充质干细胞CXCR4表达的调控作用
孙吉平 马莹 张文静 吕佳 尹爱萍
·实验研究·
Wnt信号通路对骨髓间充质干细胞CXCR4表达的调控作用
孙吉平 马莹 张文静 吕佳 尹爱萍
目的研究经典Wnt信号通路对骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)CXCR4表达的影响,探索Wnt通路调节干细胞迁移的可能机制。方法培养雄性SD大鼠BMSCs,对所培养的细胞进行鉴定;通过反转录-聚合酶链反应(reverse transcription polymerase chain reaction, RT-PCR)探讨活化/阻断Wnt信号通路对BMSCs表达CXCR4的影响。结果①BMSCs的体外培养及鉴定:细胞呈梭形,漩涡状排列,放射状生长。细胞表面标志CD29(+)、CD90(+)、CD45(-),能定向诱导细胞表达神经细胞标记物,体外能分化为脂肪细胞,符合BMSCs表面标记物表达及多向分化潜能特征。②应用200 ng/ml的Wnt3a作用24 h即可以充分激活经典Wnt信号通路,应用100 ng/ml的DKK-1作用24 h可以充分阻断经典Wnt信号通路。③阻断经典Wnt信号通路可以促进体外培养的BMSCs的CXCR4的表达;激活经典Wnt信号通路可以抑制体外培养的BMSCs的CXCR4的表达。结论干预Wnt信号通路可以调控BMSCs CXCR4表达,经典Wnt信号通路有望通过CXCR4/SDF-1通路调控BMSCs向组织的迁移。
骨髓间充质干细胞;经典Wnt信号通路;β-catenin;CXCR4
干细胞工程的兴起为多种疾病的治疗带来了希望。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)易于获取,具有高分化潜能,可以实现自体移植,具有低免疫原性,不会诱发移植后排斥反应,不涉及伦理问题,作为组织工程的种子细胞,具有相当明朗的应用前景[1]。BMSCs可以通过静脉/动脉/器官移植等方式移植入体内;然而,无论静脉、动脉或者多次器官内移植,均面临BMSCs移植后靶向迁移数量少这一缺点[2-3]。因此,提高BMSCs靶向迁移能力对于提高BMSCs在疾病治疗中的应用至关重要。经典Wnt信号通路即Wnt/GSK-3/β-catenin信号通路,是胚胎发育、组织形成过程中决定细胞命运的关键性信号通路。已经证实,经典Wnt信号通路参与调控BMSCs细胞外基质的迁移过程[4],然而其确切的机制与效应尚存在争议。BMSCs表面表达多种黏附分子及整合素,其中许多分子都被认为与细胞迁移有关。CXC趋化因子受体4(CXC chemokine Receptor 4,CXCR4)选择性地与基质细胞衍生因子1(stromal cell derived factor 1, SDF-1)结合,已经被证明在肿瘤发生、增生、代谢、血管生成中、细胞迁移中发挥重要作用[5]。通过上调干细胞表面CXCR4表达促进干细胞的靶向归巢作用,从而促进干细胞发挥治疗作用,改善干细胞移植后的治疗效果,是近些年医学研究的热点之一。本研究旨在探索经典Wnt信号通路状态与BMSCs表面CXCR4表达量的关系,探索经典Wnt通路调节BMSCs迁移的可能机制。
材料与方法
一、实验动物
选择成年近交封闭群SD大鼠(清洁级,3~4周龄、80~100 g),由西安交通大学医学院动物中心提供使用。
二、试剂
DMEM(一种含各种氨基酸和葡萄糖的培养基,Dulbecco’s MEM)、Trypsin胎牛血清、青霉素、链霉素均购自GIBCO公司;DAPT[(3,5-二氟苯乙酰基)-L-丙氨酰基-L-2-苯基甘氨酸叔丁酯]、DAPI(4,6-二脒基-2-苯基吲哚)、尼克酰胺、琼脂糖均购自Sigma公司;EGF(表皮生长因子)、bFGF(碱性成纤维细胞生长因子)、激活素a均购自peprotech公司;小鼠抗大鼠胰岛血糖素抗体、兔大鼠抗ngn3抗体购自Santa Crμz公司;小鼠抗大鼠胰岛素抗体购自CST公司;GAPDH抗体购自Proteintech;Trizol购自Invitrogen 公司;β-巯基乙醇购自Amresco公司;逆转录试剂盒、PCR试剂盒购自大连宝生物公司;IGF-1购自武汉禾元生物科技有限公司。荧光标记二抗购自北京中杉金桥公司。
三、大鼠BMSCs分离、培养和扩增
SD大鼠经水合氯醛腹腔注射麻醉后,75%酒精浸泡5~10 min,无菌条件下逐层剪开皮肤、肌肉,取其双侧股骨、胫骨,超净台内用5 ml注射器抽取含10% FBS(胎牛血清)培养基冲出骨髓,1 000 r/min离心5 min,弃上清,加入含10% FBS的L-DMEM培养液,充分吹打成单细胞悬液,按1×106密度接种于2个25 cm2培养瓶中于37 ℃、5% CO2孵箱中培养,3 d后首次半量换液,后每3 d换液。待细胞长至80%~90%融合时传代。每瓶细胞加1 ml的0.25%胰蛋白酶+0.02%EDTA(乙二胺四乙酸),置孵箱消化2~3 min,各加入2 ml含10%FBS培养基终止消化,吹打成单细胞悬液,转移入离心管中,1 000 r/min离心5 min,弃上清,用含10%FBS的L-DMEM培养基重悬浮沉淀,按1∶2比例传代。
四、BMSCs鉴定
(1)流式细胞仪检测细胞CD45、CD90、CD29等表面抗原表达:对数生长期细胞常规消化、离心后,PBS洗涤3次后,PBS重悬细胞,计数,调整浓度为1×107/ml,混匀后各取100 μl细胞悬液至4个1.5 ml EP管中,分别加入0.5 μl FITC(anti-rat CD45)抗体、2 μl anti-rat CD29抗体、1 μl PE anti-rat CD90抗体,同时设立同型阴性对照,避光冰上孵育30 min;PBS调至 500 μl;轻柔振荡,重悬细胞,流式细胞仪检测。
(2)体外诱导分化为神经细胞:参考Sanchez-Ramos等的方法进行。BMSCs去除培养基,D-Hank’s液清洗3次,换为Neurobasel培养基(添加5%马血清,1%标准胎牛血清,2%ITS,0.5 μM维甲酸,10 ng/ml BDNF)培养6 d,间接免疫荧光染色检测神经细胞相关标记物NSE、GFAP、NF-200等的表达。
(3)诱导BM-MSC成脂肪分化:P3的细胞制成单细胞悬液后,成脂诱导培养基(10%FBS的DMEM/F12培养基,含有4 mmol/L L-谷氨酰胺、10 μg/ml胰岛素、0.25 μmol/L地塞米松、0.5 mmol/L IBXM、50 μmol/L吲哚美辛及1ml/L青霉素和链霉素混悬液等)重悬并计数,以5×104/ml孔细胞密度接种6孔板,十字形晃动6孔板,使细胞分散均匀,置于37℃、5% CO2培养箱培养;每3 d全量换液,持续15 d诱导培养,PBS洗涤后-20℃冻存20 min;4%多聚甲醛固定后PBS洗涤,加油红O稀释液1.5 ml,室温静置30 min;PBS洗涤后苏木素复染5 min,倒置显微镜观察。
五、干预BMSCs经典Wnt信号通路
选用同一批处于对数增长期第3代细胞,待细胞长至60%~70%融合时即可分组进行干预。将细胞随机分为Wnt3a组(W组)、DKK-1组(D组)、对照组(C组)。弃去细胞培养瓶中的培养基。用PBS液洗2~3遍后,在W组、D组细胞中按目标浓度加入相应体积的Wnt3a、DKK-1(表1),最终使得培养基中分别含有200 ng/ml的Wnt3a,100 ng/ml的DKK-1,对BMSCs的经典Wnt信号通路进行干预。24 h后终止干预。随后Real Time PCR及Western-blotting研究Wnt信号通路下游mRNA和蛋白的表达。

表1 各干预组培养液配制方法
注:每个25 cm2培养瓶中加入培养基的总体积为3 000 μl
六、Real Time PCR法检测Wnt信号通路下游β-catenin mRNA转录水平
将消化脱落的贴壁BMSCs离心收集,取100 μl细胞悬液放入1.5 ml EP管中;加入标有RA2的液体500 μl,充分混匀,颠倒5~10次,静置1 min;将裂解后的混悬液全部吸入已经插在外套管里的内套管中,15 000 rpm离心1 min;取出各个内套管,先吸去外套管中液体,再将其放入内套管中,加入500 μl洗液,15 000 rpm离心1 min;将内套管取出,移入备好的1.5 ml的EP管中,在内套管的膜的正中部位加入洗液28 μl;室温静置1 min后,15 000 rpm离心1 min,获得总RNA;采用SYBR Green分析法反转录合成cDNA。应用Thermal Cycler Dice Real Time System II扩增仪进行Real Time PCR反应,采用两步法PCR扩增标准程序(图1),所有操作均在冰上进行。
注:Stage1:预变性,95℃,30s;Repeat:1;Stage2:PCR反应,95℃,5s;60℃,30s;Repeat:40图1 两步法PCR扩增标准程序
七、激活/阻断经典Wnt信号通路对于CXCR4/SDF-1的影响
通过RT-PCR法检测CXCR4 mRNA转录水平。提取RNA、反转录为cDNA、实时荧光定量PCR方法与步骤同前,加入CXCR4的上下游引物。
以上RT-PCR反应所使用的引物序列见表2。以β-actin为内参照基因,分析各组细胞目的基因的相对表达量。

表2 RT-PCR反应引物序列
八、统计学分析
采用SPSS 20.0软件分析,计量数据用均数±标准差表示,组间比较采用单因素分析,包括方差分析、t检验,两两比较采用LSD法。P<0.05为差异有统计学意义。
结 果
一、BMSC培养及鉴定
流式细胞仪检测显示:第4代BMSCs表达干细胞表面特异性标志物CD29、CD90,而不表达CD45(造血细胞标记),说明其同源性,符合BMSCs免疫表型特征(图2)。为证明其多向分化潜能,本文研究了BMSCs体外向神经细胞、脂肪细胞的分化潜能。BMSCs诱导后能表达神经细胞标记物Nestin蛋白、NSE及神经胶质细胞标记物GFAP,证实BMSCs体外可向神经细胞分化。此外,BMSCs经成脂诱导2周后进行油红O染色,可见细胞内出现圆形的红色颗粒,大小不等,证明胞浆中的颗粒确实为脂肪滴。(图3~4)
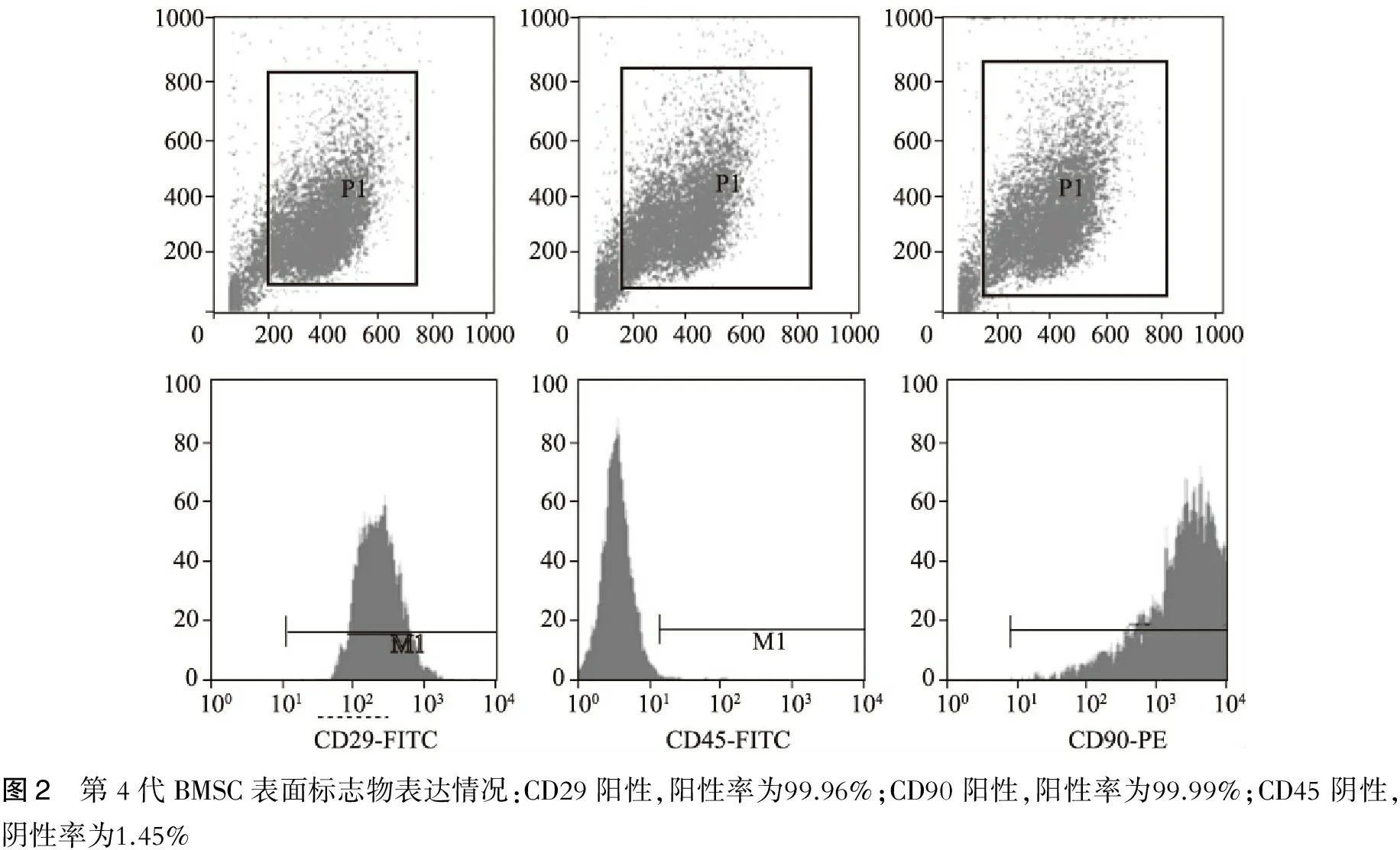
图2 第4代BMSC表面标志物表达情况:CD29阳性,阳性率为99.96%;CD90阳性,阳性率为99.99%;CD45阴性,阴性率为1.45%
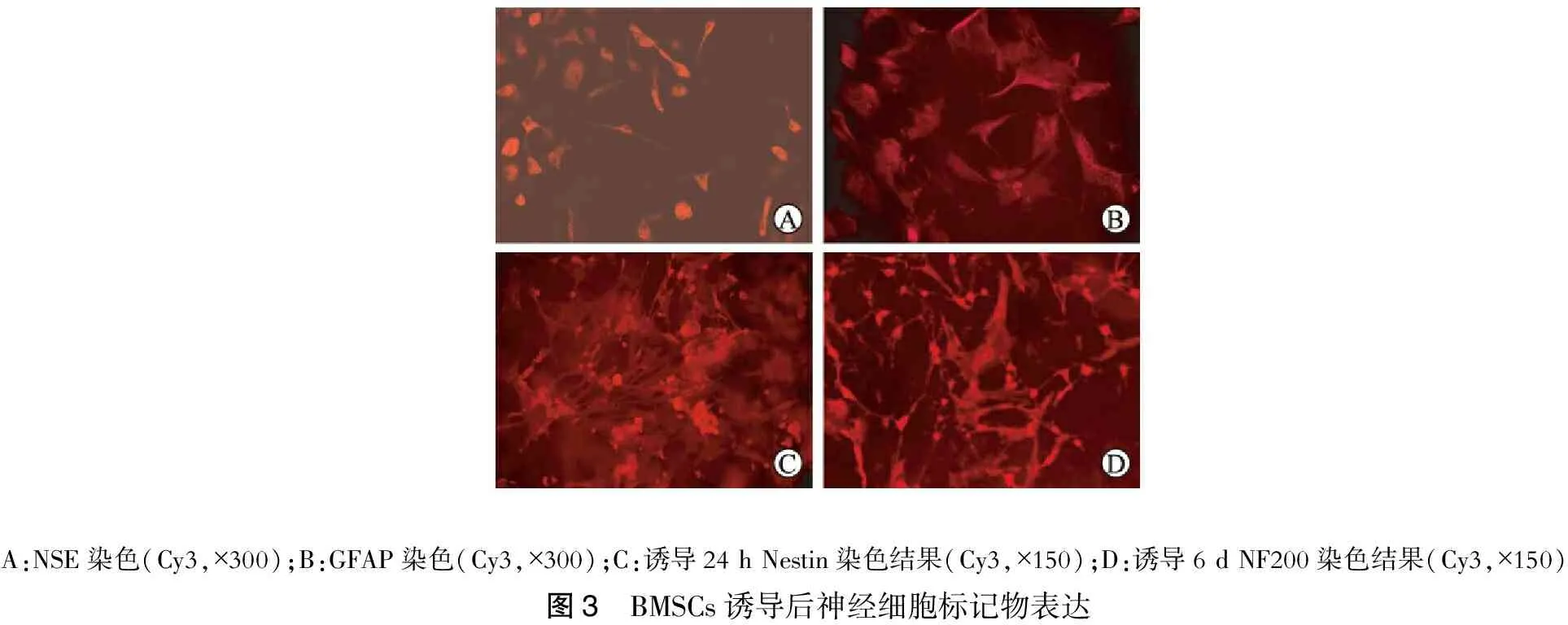
A:NSE染色(Cy3,×300);B:GFAP染色(Cy3,×300);C:诱导24hNestin染色结果(Cy3,×150);D:诱导6dNF200染色结果(Cy3,×150)图3 BMSCs诱导后神经细胞标记物表达
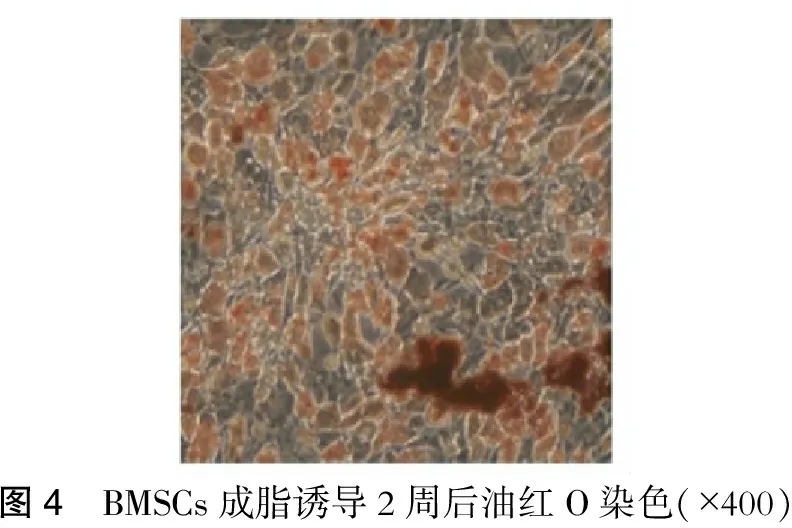
图4 BMSCs成脂诱导2周后油红O染色(×400)
二、Wnt3a/DKK-1对经典Wnt信号通路状态影响
BMSCs经200 ng/ml的Wnt3a(W组)、100 ng/ml的DKK-1(D组)处理24 h后,提取RNA行Real Time PCR检测经典Wnt信号通路下游分子β-catenin的转录水平,结果见表3。与对照组(C组)相比,W组β-catenin的转录水平显著升高,D组β-catenin的转录水平显著降低,差异有统计学意义(P<0.05)(图5),提示Wnt3a/DKK-1可以激活/阻断经典Wnt信号通路。
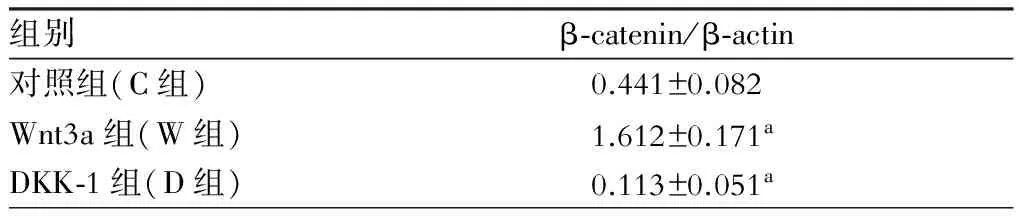
表3 Wnt3a/DKK-1处理后Real-Time PCR检测结果
注:与对照组比较,aP<0.05
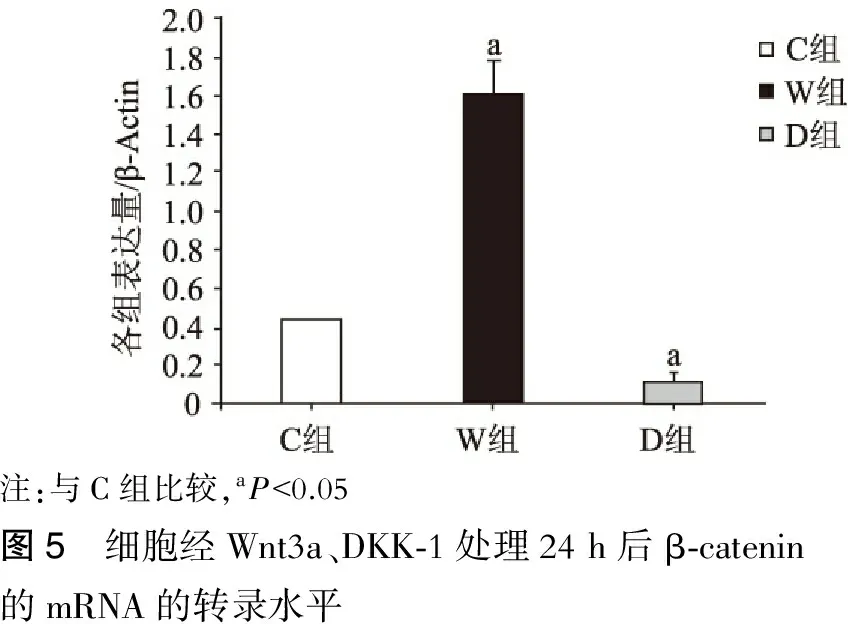
注:与C组比较,aP<0.05图5 细胞经Wnt3a、DKK⁃1处理24h后β⁃catenin的mRNA的转录水平
三、经典Wnt信号通路对BMSCs的CXCR4表达的影响
C组、W组、D组骨髓间充质干细胞CXCR4的mRNA转录水平,结果见表4。D组CXCR4的表达量升高,与C组相比,差异有统计学意义(图6,P<0.05);W组CXCR4的表达量有所下降,但与C组相比,差异无统计学意义,提示当经典Wnt信号通路被激活时,BMSCs表面CXCR4的表达量下调;当经典Wnt信号通路被阻断时,BMSCs表面CXCR4的表达量上调。
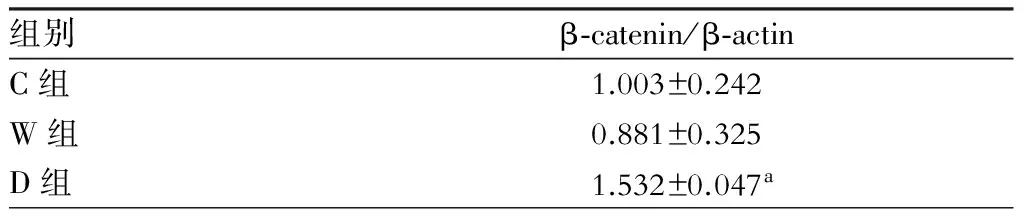
表4 Wnt3a/DKK-1处理后BMSCs的CXCR4的mRNA转录水平
注:与C组比较,aP<0.05
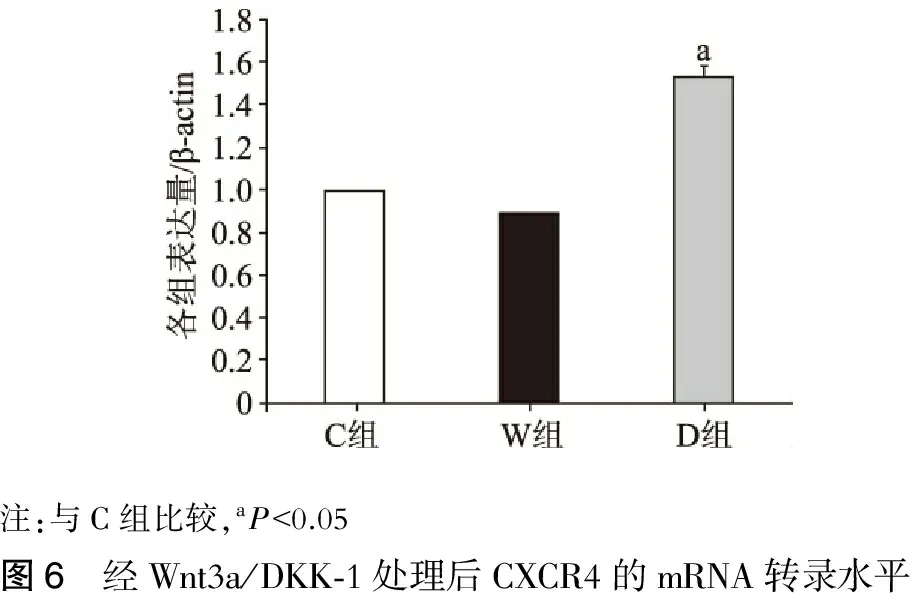
注:与C组比较,aP<0.05图6 经Wnt3a/DKK⁃1处理后CXCR4的mRNA转录水平
讨 论
干细胞治疗蒸蒸日上,正以转化医学这一新角度新途径,从基础医学研究走向临床及公共卫生防治,并已经取得显著进展。已经证实BMSCs可用于多种疾病的细胞治疗,如移植可以减少蛋白尿、减少肾小球损伤、分化为肾脏固有细胞,并调节免疫反应[6-8];移植后能够促进内源性胰岛细胞增殖、胰岛干细胞的分化,促进胰岛再生[9];分化为神经细胞,移植后能改善阿尔茨海默病等[10]。然而,无论静脉、动脉或者多次器官内移植,均面临BMSCs移植后靶向迁移数量少这一缺点,导致了BMSCs向损伤组织的归巢的不充分性[11],而间充质干细胞向受损组织充分的迁移对于疗效而言非常重要。因此,提高BMSCs靶向迁移能力对于提高BMSCs在糖尿病肾病中的治疗具有至关重要的作用。多种分子机制参与调节细胞在循环系统中的迁移。已经证明,BMSCs表面表达多种黏附分子及整合素,其中许多都被认为与细胞迁移有关。细胞因子及其受体是免疫监督、炎症、发育过程中调节细胞迁移的关键介质。CXCR4选择性地与SDF-1结合,已经被证明在肿瘤发生、增生、代谢、血管生成、细胞迁移中发挥重要作用。已经有报道BMSCs表面表达CXCR4,在BMSCs体外扩增的过程中,其CXCR4的表达量显著降低,导致了其向SDF-1的迁移量减少,推测可能由于BMSCs表面表达CXCR4减少导致了BMSCs迁移效率的下降[12-13]。经典Wnt信号通路即Wnt/GSK-3/β-catenin信号通路,是胚胎发育、组织形成过程中,决定细胞命运的关键性信号通路,它能够编码、分泌多种细胞因子,影响胚胎及组织发育过程中细胞的增殖、极化、分化、老化、凋亡,对肾脏、肾小球的发育有至关重要的作用,经典Wnt信号通路参与调控胰腺发育,调控胰岛β细胞的增殖及胰岛素功能的发挥,其突变或异常可引发包括纤维化、糖尿病肾病等在内的多种肾脏病变[14-15]。研究证实,体外应用Wnt配体可以实现对经典Wnt信号通路的激活,应用DKK家族可以抑制经典Wnt信号通路。本研究应用200 ng/ml的Wnt3a实现了对于经典Wnt信号通路的激活,应用100 ng/ml的DKK-1实现了对于经典Wnt信号通路的阻断,阻断效果可靠。通过上调干细胞表面CXCR4表达量促进干细胞的靶向归巢作用,从而促进干细胞发挥治疗作用,改善干细胞移植后的治疗效果,是近些年医学研究的热点之一。经典Wnt信号通路调节干细胞的转化、分化等多种属性,而且已经证实经典Wnt信号通路参与调控BMSCs向细胞外基质的迁移,然而其确切的机制与效应尚存在争议。本研究结果表明,应用100 ng/ml的DKK-1阻断经典Wnt信号通路可以提高体外培养的BMSCs的CXCR4的mRNA转录水平;相反,应用200 ng/ml的Wnt3a激活经典Wnt信号通路可以抑制体外培养的BMSCs的CXCR4的mRNA转录水平及蛋白翻译水平。因为CXCR4/SDF-1参与调控肿瘤细胞及干细胞的迁移[16-17]。因此,我们推测,经典Wnt信号通路有望通过CXCR4/SDF-1调控BMSCs移植后的归巢;阻断经典Wnt信号通路后促进干细胞的靶向迁移可能是干细胞移植发挥治疗作用的机制之一。
促进干细胞向受损部位的迁移,增加迁移的细胞数量,提升移植后治疗效果,这是提升干细胞治疗效果的一个新机制。然而,本研究只观察到经典Wnt信号通路状态改变与CXCR4/SDF-1表达量变化的对应关系,并未进行体外细胞、体内动物实验进一步验证,也未进一步探索产生这种变化的具体机制,故后续可以继续进行细胞迁移小室实验,探索当BMSCs胞内经典Wnt信号通路状态不同、引起CXCR4表达量改变时,BMSCs向SDF-1的趋化改变;干预经典Wnt信号通路后的BMSCs移植入糖尿病肾病大鼠体内后,观察体内示踪的时间,验证经典Wnt信号通路状态改变时对于移植的BMSCs靶向迁移、移植效果的影响。目前调控干细胞迁移的分子机制尚未明确,相关的信号通路也有待进一步研究探索,作为与干细胞迁移机制的新成员,无论CXCR4/SDF-1抑或经典Wnt信号通路,都将会促进间充质干细胞移植治疗的研究进展,改善干细胞移植后的治疗效果。
[1] Shyam H, Singh SK, Kant R, et al. Mesenchymal stem cells in regenerative medicine: a new paradigm for degenerative bonediseases[J]. Regen Med, 2017, 12(2): 111-114.
[2] Walczak P, Zhang J, Gilad AA, et al. Dual-modality monitoring of targeted intraarterial delivery of mesenchymal stem cells after transient ischemia[J]. Stroke, 2008, 39 (5): 1569-1574.
[3] Mouiseddine M, Francois S, Souidi M, et al. Intravenous human mesenchymal stem cells transplantation in NOD/SCID mice preserve liver integrity of irradiation damage[J]. Methods MolBiol, 2012, 826: 179-188.
[4] Mah AT, Yan KS, Kuo CJ. Wnt pathway regulation of intestinal stem cells[J]. J Physiol, 2016, 594(17): 4837-4847.
[5] Liu C, Weng Y, Yuan T, et al. CXCL12/CXCR4 signal axis plays an important role in mediating bone morphogenetic protein 9-induced osteogenic differentiation of mesenchymal stem cells[J]. Int J Med Sci, 2013, 10(9): 1181-1192.
[6] Lv S, Cheng J, Sun A, et al. Mesenchymal stem cells transplantation ameliorates glomerular injury in streptozotocin-induced diabetic nephropathy in rats via inhibiting oxidative stress[J]. Diabetes Res ClinPract, 2014, 104(1): 143-154.
[7] Volarevic V, Arsenijevic N, Lukic ML, et al. Concise review: mesenchymal stem cell treatment of the complications of diabetes mellitus[J]. Stem Cells, 2011, 29 (1): 5-10.
[8] Chen Y, Chen J, Wan J, et al.Bone marrow-derived mesenchymal stem cells ameliorate nephrosis through repair of impaired podocytes[J]. Clin Invest Med. 2017, 40(1): E13-E24.
[9] 孙吉平, 尹爱萍, 吕晶, 等. 骨髓间充质干细胞移植对糖尿病大鼠的治疗作用[J]. 中华器官移植杂志,2010, 31(1): 46-49.
[10] Robinson AM, Rahman AA, Miller S, et al. The neuroprotective effects of humanbone marrow mesenchymal stem cells are dose-dependent in TNBS colitis[J]. Stem Cell Res Ther, 2017, 8(1): 87.
[11] Gong J, Meng HB, Hua J, et al. The SDF-1/CXCR4 axis regulates migration oftransplanted bone marrow mesenchymal stem cellstowards the pancreas in rats with acute pancreatitis[J]. Mol Med Rep, 2014, 9(5): 1575-1582.
[12] Ponte AL, Marais E, Gallay N, et al. The in vitro migration capacity of human bone marrow mesenchymal stem cells: comparison of chemokine and growth factor chemotactic activities[J]. Stem Cells, 2007, 25 (7): 1737-1745.
[13] Ryser MF, Ugarte F, Thieme S, et al. mRNA transfection of CXCR4-GFP fusion--simply generated by PCR-results in efficient migration of primary human mesenchymal stem cells[J]. Tissue Eng Part C Methods, 2008, 14 (3): 179-184.
[14] Xu Z, Robitaille AM, Berndt JD, et al. Wnt/β-catenin signaling promotes self-renewal andinhibits the primed state transition in naïve human embryonic stem cells[J]. ProcNatlAcadSci USA, 2016, 113(42): E6382-E6390.
[15] Guo H, Xing Y, Liu Y, et al. Wnt/β-catenin signaling pathway activates melanocytestem cells in vitro and in vivo[J]. J DermatolSci, 2016, 83(1): 45-51.
[16] Liu N, Tian J, Cheng J, et al. Migration of CXCR4 gene-modified bone marrow-derived mesenchymal stem cells to the acute injured kidney[J].J Cell Biochem, 2013, 114(12): 2677-2689.
[17] Jones GN, Moschidou D, Lay K, et al. Upregulating CXCR4 in human fetal mesenchymalstem cells enhances engraftment and bonemechanics in a mouse model of osteogenesisimperfecta[J]. Stem Cells Transl Med, 2012, 1(1): 70-78.
TheeffectsofcanonicalWntsignalingpathwaysontheCXCR4expressionofbonemarrowderivedmesenchymalstemcells
SUNJi-ping,MAYing,ZHANGWen-jing,LVJia,YINAi-ping.
DepartmentofNephrology,TheFirstAffiliatedHospitalofMedicalCollege,Xi'anJiaotongUniversity,Xi'an710061,China
YINAi-ping,E-mail:jipingsundwy@126.com
ObjectiveTo evaluate the effects of Wnt signaling pathways on the CXCR4 expression of bone marrow mesenchymal stem cells(BMSCs), and to investigate the possible regulation mechanisms of the Wnt signaling pathways on the migration ability of BMSCs.MethodsBMSCs were obtained from the femurs, tibias, humeri and radius of adult male SD rats. The expression of Wnt signaling pathway downstream target gene β-catenin was detected via RT-PCR and western-blotting after activating and blocking Wnt signaling pathway of BMSs. Meanwhile, expression of CXCR4 was also detected via RT-PCR and western-blotting after activating and blocking Wnt signaling pathway of BMSCs.Results(1)Dentification of BMSCs: BMSCs could expression CD29 and CD90, which were both marker of mesenchymal stem cells. Besides, BMSCs could express nerve culluar marker such as NSE, GFAP, and could be induced to differentiate into adipocytic cells, suggesting multi-directional differentiation.(2)Wnt3a (200 ng/ml) could fully activate Wnt signaling pathway in 24 h, with high expression level of β-catenin(compared with control group,P<0.05). While DKK-1 (100 ng/ml) could fully blockade Wnt signaling pathway in 24 h (compared with control group,P<0.05). (3)When the Wnt signaling pathway was blockaded, expression levels of CXCR4 in BMSCs was obviously increased (compared with control group,P<0.05); while the activated of such signaling pathway could decrease the expression of CXCR4 of BMSCs (compared with control group,P<0.05).ConclusionsWnt signaling pathway could regulate the expression of CXCR4 of BMSCs, and such regulation may promote the migration of BMSCs to kidney.
Bone Mesenchymal stem cells; Canonical Wnt signaling pathway; β-catenin; CXCR4
10.3969/j.issn.1671-2390.2017.12.010
国家自然科学基金资助项目(No.81200528)
710061 西安,西安交通大学医学院第一附属医院肾内科
尹爱萍,E-mail:jipingsundwy@126.com
2017-12-04
2017-12-07)

