花生茎腐病病原菌的鉴定及生物学特性研究
张建航,张幸果,刘 婷,和小燕,王 允,马兴立,殷冬梅
(河南农业大学农学院,河南 郑州 450002)
花生茎腐病病原菌的鉴定及生物学特性研究
张建航,张幸果,刘 婷,和小燕,王 允,马兴立,殷冬梅
(河南农业大学农学院,河南 郑州 450002)
为减少花生茎腐病在花生生产上造成的损失,以河南省不同花生产区采集的花生茎腐病病株为材料分离病原菌,并进行病原菌的生物学特性研究及不同药剂对该菌的室内抑菌试验。结果表明:河南省花生茎腐病的病原菌为可可毛色二孢(Lasiodiplodiatheobromae),该菌在 pH=8的PDA培养基上生长最快,菌丝的致死温度为56 ℃(10 min)。经不同的药剂处理,25%戊唑醇可湿性粉剂处理抑制效果最好;60%唑醚代森联水分散粒剂次之;70%甲基托布津可湿性粉剂、80%多菌灵进口原药及50%醚菌酯水分散粒剂与对照无显著差异。
花生茎腐病;可可毛色二孢;抑菌作用
花生(ArachishypogaeaL.)为豆科落花生属一年生草本植物,内含大量的蛋白质及脂肪等多种营养成分,具有很高的营养价值,有助于延缓人体衰老,故又称为“长生果”。近年来,花生在农业和社会生产中占有越来越重要的地位,其需求量呈现逐年快速增长的趋势。花生作为重要的油料作物和经济作物,其种植面积仅次于油菜[1]。近年来,河南的花生产量一直保持着稳定的增长。随着花生种植面积逐渐扩大,更多农业生产者为减少麻烦而选择连作,病害也逐渐增多。花生茎腐病是危害较为严重的一种病害,驻马店、新乡、信阳等地均有发生。花生茎腐病是中国各花生产区的主要病害之一,一般发生在花生生育期的中后期,在花生茎基部出现水渍状病斑,发病后约15 d全株枯死。该病原菌寄主范围广泛,可以侵染多种植物并导致作物发生病害[2]。对可可毛色二孢报道较多的是该菌在热带、亚热带地区水果上引起的病害。多数研究是针对由可可毛色二孢引起的肉桂枯枝病[3-6]、芒果蒂腐病[7-8]、龙眼焦腐病[9-10]等。
近年来,在中国北方地区有关于可可毛色二孢的报道,如北京的板栗黑斑病[11],山东的花生茎腐病[12],黑龙江的黑木耳“黑皮病”[13]等,说明此病菌可适应温带气候,对中国北方作物也存在着威胁。而国外也多次报道了由Lasiodiplodiatheobromae引起的花生茎腐病,MILLER等[14]首次报道了花生茎腐病,1998年,PHIPPS等[15]对花生茎腐病进行了详细研究,认为该病是由可可毛色二孢(Lasiodiplodiatheobromae)引起的。该病原菌影响范围广泛,作者从河南省不同花生产区采集花生茎腐病病株,分离病原菌并进一步研究,经过形态学及ITS鉴定,认为该病害病原菌为可可毛色二孢(Lasiodiplodiatheobromae)。目前,常用的杀菌剂多为甲基托布津、戊唑醇、唑醚代森联、多菌灵等药剂,为更有效地防治花生茎腐病,本研究选取5种不同的药剂进行室内抑菌试验,比较这5种药剂对病原菌的抑制效果。
1 材料与方法
1.1 材料
2015—2016年花生生育期间,从河南省不同花生产区采集的花生茎腐病病株上分离病原菌。
1.1.1 燕麦培养基 燕麦片30 g加水煮1 h,用双层纱布过滤后加入17 g琼脂,补足至1 000 mL,121 ℃下高压灭菌20 min。
1.1.2 大豆培养基 大豆汁10 mL,琼脂2 g,去离子水90 mL。大豆汁的制备方法是先将60 g干的大豆种子用水清洗,浸泡过夜,浸泡过的大豆与330 mL去离子水混合,用组织捣碎机破碎2 min,经单层纱布过滤去渣,滤液为大豆汁。
1.1.3 麦粒培养基 先将30 g麦粒浸泡过夜,第2天加水煮沸,沸腾后20 min麦粒变得透亮,压碎再煮10 min,双层纱布过滤,加琼脂3 g,加水补足至200 mL。
1.1.4 花生秆培养基 取30 g干的花生杆剪成小段,加水煮沸1 h,滤液补足至200 mL,再加入4 g葡萄糖和4 g琼脂,高压灭菌20 min 。
1.1.5 PDA培养基 取200 g马铃薯加水煮沸20 min,双层纱布过滤除渣,加入葡萄糖和琼脂各20 g,加水补足至1 000 mL,高压灭菌后备用。
1.1.6 MEA培养基 麦芽浸膏30 g,大豆蛋白胨3 g,琼脂15 g,加蒸馏水配制1 000 mL,高压灭菌后备用。
1.1.7 化学药剂 选用5种药剂,均按照药剂田间喷施要求稀释:50%醚菌酯水分散粒剂(巴斯夫(中国)有限公司)稀释为0.35 g·L-1的药剂;60%唑醚代森联水分散粒剂(巴斯夫(中国)有限公司)稀释成1.70 g·L-1;25%戊唑醇可湿性粉剂(江苏剑牌农化股份有限公司)稀释成0.50 g·L-1;70%甲基托布津可湿性粉剂(江西龙灯化学有限公司)稀释成2.00 g·L-1;80%多菌灵进口原药(美国广丰生物科技有限公司)稀释成1.70 g·L-1。
1.2 病原菌的分离纯化
将带病斑的花生茎腐病根茎切成大小约0.2 cm×0.2 cm组织块进行消毒:75%的乙醇约40 s,无菌水清洗1次,0.1%的升汞4 min,无菌水洗5次,最后将组织块放于无菌滤纸上吸干表面水分,接种于含硫酸链霉素质量浓度为1 mg·mL-1的PDA培养基上(硫酸链霉素可抑制细菌生长)[16]。25 ℃ 培养 48~72 h,挑取在组织小块周围生长的菌丝,接种于新的PDA平板上纯化3~5次; 根据菌落形态和颜色,挑取单菌落在新的PDA平板上转接纯化3~5次。将纯化好的真菌分离物接种于PDA斜面试管内,28 ℃培养3 d后,放于4 ℃冰箱中保存备用。
1.3 病原菌的鉴定
1.3.1 病原菌的形态观察 将直径7 mm的菌丝块接种于PDA平板中央25 ℃倒置培养,每天观察并记录菌落大小和特征。
1.3.2 ITS鉴定 在菌落边缘打取直径7 mm的菌块接种于新的PDA培养基上,待菌丝长满培养基后刮取菌丝,利用Fungal DNA Min Kit(购自宝生物工程(大连)有限公司)提取真菌基因组DNA。
使用真菌通用引物ITS4:5′-TAATCCGCTTATTGATATGC-3′和ITS5:5′-GGAAGTAAGTGCTAACAAGG-3′对所提取的真菌DNA进行PCR扩增,扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃保温10 min,凝胶成像系统观察后将PCR产物送至北京六合华大基因科技股份有限公司测序。
1.4 病原菌的致病性测定
供试花生品种为8789、花416、9102,将麦粒煮至透亮后高压灭菌,接种菌丝28 ℃培养2 d,在花生团棵期后将接过菌丝的麦粒均匀撒到花生周围,观察花生植株的发病情况。植株发病后,从感病植株上分离菌株与接种菌株进行对比。
1.5 病原菌的生物学特性研究
1.5.1 不同培养基对菌丝生长的影响 将菌丝接种于马铃薯葡萄糖培养基PDA、燕麦培养基、花生杆培养基、大豆培养基、MEA、LB、麦粒培养基7种不同的培养基上,每种培养基重复3次,用十字交叉法记录菌落扩展直径。
1.5.2 不同pH值对菌丝生长的影响 配制好的马铃薯葡萄糖培养基分装,分别调酸碱度至pH值为3~12,高压灭菌后分别倒入无菌培养皿中制成平板,待培养基凝固后接种直径7 mm的菌块,共9个处理(pH=3时培养基不凝固),每处理重复3次。
1.5.3 菌丝的致死温度 设50~66 ℃共17个处理,在菌落边缘打取直径7 mm的菌丝块放入加过灭菌水的无菌试管中,恒温水浴10 min后接种于PDA培养基上,25 ℃暗培养,记录菌落的扩展直径。
1.6 不同药剂对病原菌的抑制作用
药品的配制:(取50% 醚菌酯水分散粒剂0.1 g用300 mL无菌水溶解;60%唑醚代森联水分散粒剂0.1 g用60 mL无菌水溶解;25%戊唑醇可湿性粉剂0.1 g用200 mL无菌水溶解;70%甲基托布津可湿性粉剂0.1 g用60 mL无菌水溶解;80%多菌灵进口原药0.12 g用60 mL无菌水溶解,均配制于灭菌锥形瓶中。)在超净工作台上取药剂200 μL均匀涂布于PDA培养基上,涂好后将菌丝块接种于培养基中央,无菌水作对照,每处理重复5次,25 ℃培养48 h后采用十字交叉法量取菌落扩展直径。
2 结果与分析
2.1 病原菌的形态鉴定
菌落在PDA培养基上呈圆形或近圆形,质地疏松,菌丝絮状,初浅白色,3 d长满直径9 cm的培养皿,气生菌丝发达,后期菌落变为灰黑色。发病植株病部小黑点即病原菌的分生孢子器,常突出于体表,黑色,近球形,直径220~230 μm,顶端孔口呈乳头状突起。挑取发病植株病斑部位黑色凸起制成临时玻片,在显微镜镜下观察,分生孢子椭圆形、长圆形或卵圆形,基部平截,端部钝圆,单胞,初无色,双层壁,大小(22.75~30.25)μm×(12.5~15.1)μm。
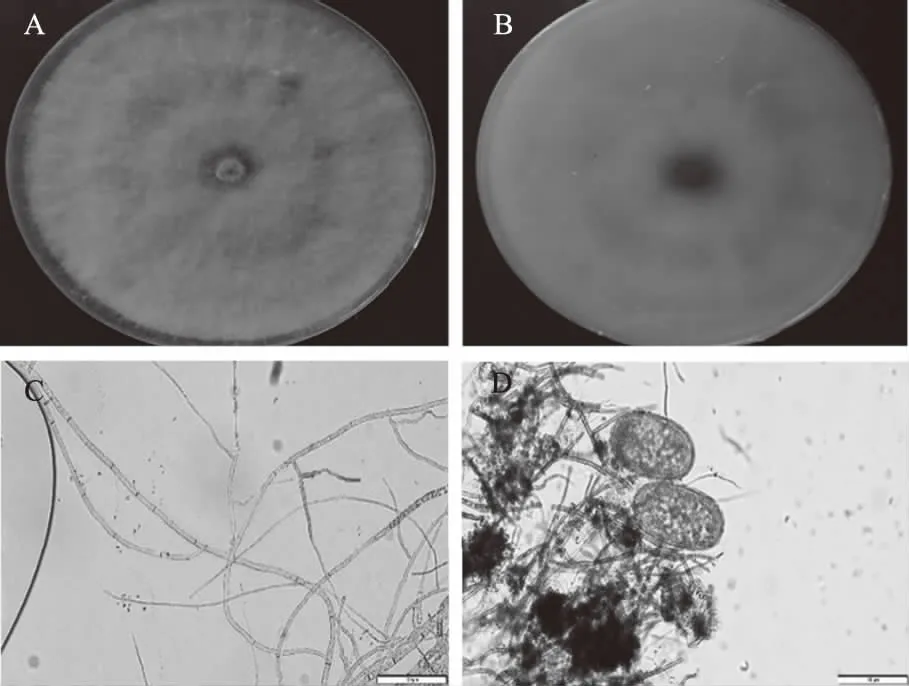
注:A:病原真菌在PDA平板上的正面菌落形态;B:菌株反面形态;C:菌丝体(标尺为100 μm),D:孢子体(标尺为100 μm)。
Note:A: The face colony characteristic of fungal pathogens on PDA; B:The reverse side of colony of strain; C: Mycelium(The scale is 100 μm); D: Sporophore(The scale is 100 μm) .
图1病原菌的形态特征
Fig.1Morphologicalcharacteristicsofpathogenicfungus
2.2 病原菌的分子鉴定
分离得到的菌株DNA进行PCR扩增,用凝胶成像系统观察可知,产物序列大小在600 bp左右(图2)。随机选取其中5条序列,分别为XY.7、ZMD.6、XX.2、ZZ.3、AY.4,测序后的结果用DNAMAN进行比对,结果显示5条序列相似性极高为99.89%。将5条序列与NCBI中已有的可可毛色二孢属(Lasiodiplodia)DNA序列进行比对,相似度高达99.73%。
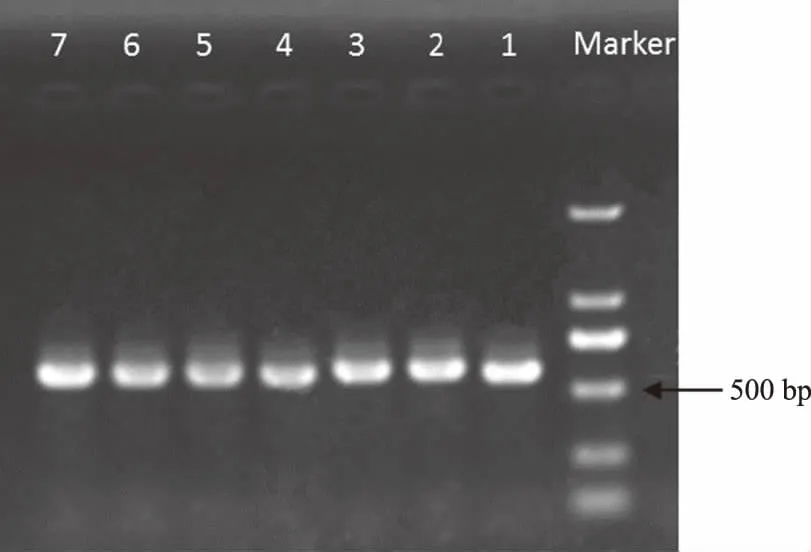
注:Marker:DL2000;1~7:不同菌落的PCR结果。 Note: Marker:DL2000; 1~7: Amplification with individual bacterial as template.
2.3 病原菌的致病性
花生植株接种病菌4 d后出现病症,叶片萎蔫,15 d后病株枯死(图3)。从病株上分离获得的菌株与接种菌株相同,可知该菌株为花生茎腐病病原菌。

图3 病原菌菌株的致病性测定 Fig.3 Pathogenicity of pathogenic strains
2.4 病原菌的生物学特性
2.4.1 不同培养基对菌丝生长的影响 病原菌生长初期菌落形态为白色絮状,在MEA和花生杆培养基上菌落扩展速度较快,菌丝致密,麦粒和大豆培养基次之,PDA和燕麦上菌落生长较慢,且燕麦培养基上菌丝稀薄(图4)。从培养第1天来看,麦粒培养基、花生杆培养基与MEA菌落扩展速度无差异,与大豆培养基、PDA存在差异性,与燕麦培养基有显著差异。但第2天生长速度发生了变化,麦粒、大豆培养基和MEA、PDA的菌落扩展速度无差异,与燕麦、花生杆培养基存在差异。
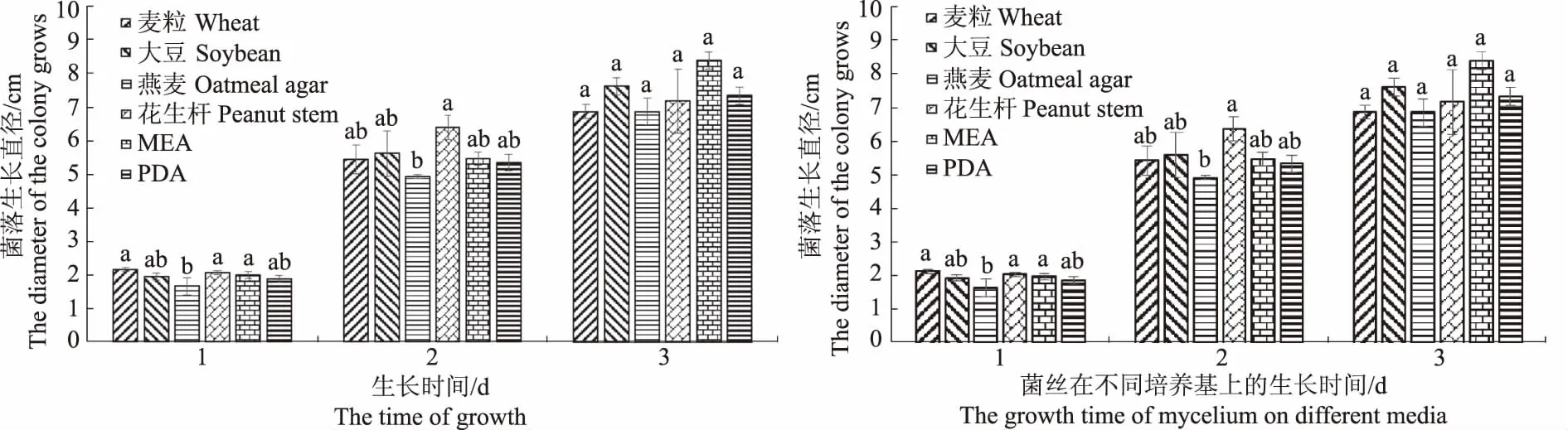
图4 不同培养基对菌丝生长的影响 Fig.4 Effects of different media on mycelium growth
2.4.2 不同pH值对菌丝生长的影响 PDA培养基在pH值为3时不凝固,菌落正常生长,pH值为8时,菌落在PDA培养基上扩展速度最快,4 d长满整个培养基, pH值为6时次之,pH值为11时菌落生长最慢,pH值为12时菌落不生长(图5)。菌丝的扩展速度每天都存在差异,从第4天菌丝的扩展速度来看,pH8与pH9、pH11存在显著差异;pH4、pH5、pH7、pH10之间无差异,与pH6、pH11无显著差异。

图5 不同pH值对菌丝生长的影响 Fig.5 Effects of different PH on mycelial growth
2.4.3 菌丝的致死温度 菌丝块经不同温度水浴加热10 min后接种到PDA培养基上, 50 ℃处理的菌丝生长最快,55 ℃处理的菌丝生长最慢(图6),当处理温度≥56 ℃时菌丝停止生长,说明该菌的致死温度为56 ℃(10 min)。菌丝生长第1天,50 ℃处理与51、52、53、55 ℃菌丝生长速度均存在差异,与54 ℃处理存在显著差异,之后的2 d菌丝的生长速度无显著差异。
2.5 不同药剂对病原菌的抑制作用
由图7可知,50%醚菌酯水分散粒剂等5种不同的药剂处理后,25%戊唑醇可湿性粉剂处理后病原菌菌落生长最慢,与对照存在显著差异,抑制效果最好;60%唑醚代森联水分散粒剂次之;70%甲基托布津可湿性粉剂、80%多菌灵进口原药及50%醚菌酯水分散粒剂与对照无显著差异。
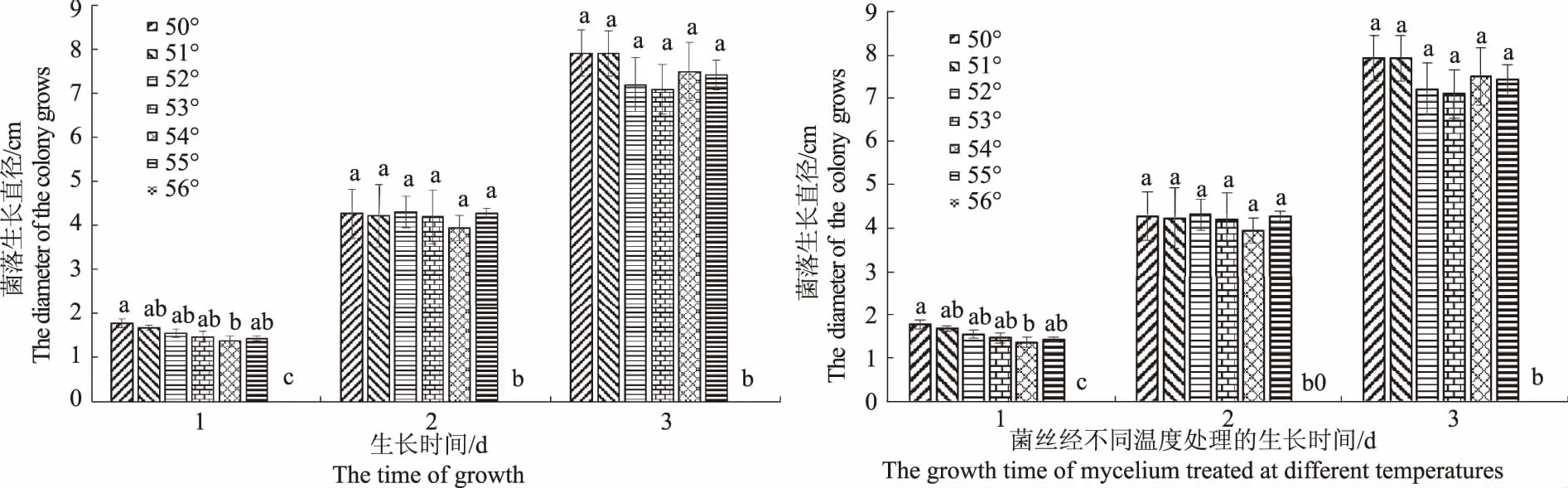
图6 菌丝经不同温度水浴加热后的生长速度 Fig.6 The growth rate of hyphae after heating in different temperature water baths
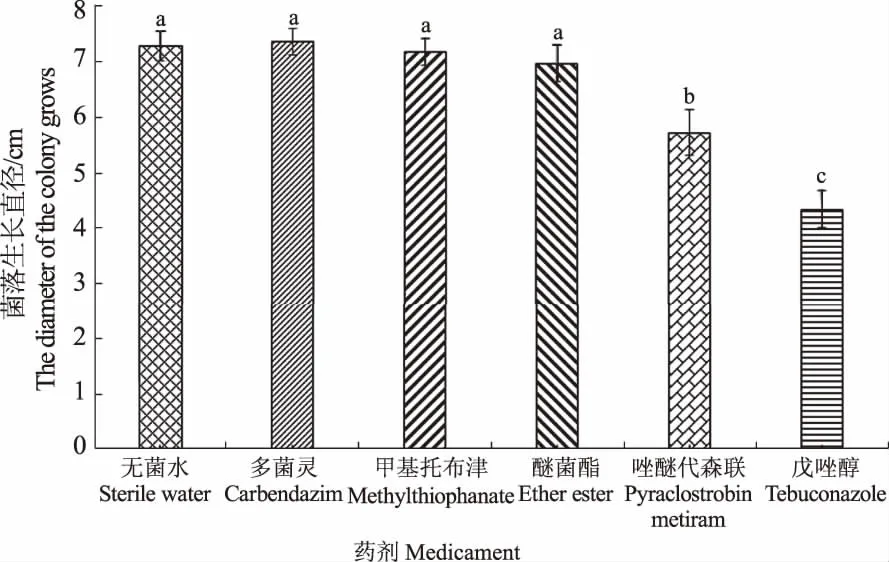
图7 不同药剂对病原菌的抑制作用 Fig.7 Inhbitory effect of different medicaments
3 结论与讨论
可可毛色二孢广泛分布在热带和亚热带地区,可以导致寄主的发病症状包括:梢枯、根腐、果腐、枯萎、叶斑、丛枝等,寄主范围目前已知达500种之多[17]。花生茎腐病病原菌可分为2种:在报道花生茎腐病病原菌时,多数国内学者认为花生茎腐病是由棉色二孢(Diplodiagossypina)引起的[18-20],李君彦等[16]通过研究陕西省花生茎腐病,分离出可可毛色二孢(Lasiodiplodiatheobromae)等多种色二孢,但认为病原菌为棉色二孢(Diplodiagossypina)。侯绪友等[21]通过对花生茎腐病的研究,认为该病害病原菌为DiplodiaFr,其种名尚待今后研究。
国外也有报道由可可毛色二孢引起的花生茎腐病、藤回枯病等[22]。NGUYEN等[23]报道了花生茎腐病,病原菌为可可毛色二孢(Lasiodiplodiatheobromae),并且认为棉色二孢(Diplodiagossypina)、蒂腐色二孢(D.natalensis)、可可球二孢(B.theobromae)是可可毛色二孢(L.theobromae)的同物异名。 本研究通过对花生病原菌的形态学观察及分子鉴定认为,可可毛色二孢与棉色二孢是同物异名[15]。
目前,对花生病害的防治多为化学防治,农药的使用较为频繁。本研究选取的5种农药均为常用杀菌剂,仅测定了不同药剂对病原菌菌丝生长的影响,5种药剂对病原菌菌丝的生长有不同程度的抑制作用。为更彻底地防治花生茎腐病,后续研究将进行田间药剂防治试验,将花生生产中因茎腐病的危害导致的损失降到最低。
[1] 陈明娜,迟晓元,潘丽娟,等.中国花生育种的发展历程与展望[J].中国农学通报,2014,30(9):1-6.
[2] LO J Y,CLARK C A.Sources of inoculum and infection courts ofDiplodiagossypinaon sweet potato [J].Phytopathology,1988,78(11):1442-1446.
[3] 文新,张毓如,吴泽文,等.肉桂枯枝病病原研究[J].微生物学报,1995,35(3):181-185.
[4] 王军,苏海,李若英,等.致伤类型与树皮含水量对肉桂枯枝病发病程度的影响[J].中国森林病虫,2001,20(1):5-7.
[5] 王军,李若英.肉桂枯枝病菌毒素的研究[J].林业科学研究,2002,15(4):387-393.
[6] 薛振楠,黄式玲,李孝忠.肉桂枯枝病菌及其生物学特性研究[J].广西农业生物科学,2003,22(4):275-279.
[7] 罗远婵,黄思良,黎起秦.芒果蒂腐病菌Diplodinasp.生物学特性的研究[J].石河子大学学报(自然科学版),2004,22(Z1):164-168.
[8] 师超,胡美姣,李敏,等.多种杀菌剂对抗多菌灵的芒果蒂腐病病菌菌株的毒力测定[J].农药研究与应用,2010,14(3):30-34.
[9] 张居念,林河通,谢联辉,等.龙眼焦腐病菌及其生物学特性[J].福建农林大学学报(自然科学版),2005,34(4):425-429.
[10] 董小梅.龙眼焦腐病菌细胞壁降解酶及其致病机理的研究[D].福州:福建农林大学,2010.
[11] 李文生,冯晓元,闫国华,等.板栗贮藏中的主要病害及其防治[J].中国农学通报,2006,22(11):327-329.
[12] 郭洪参,张悦丽,齐军山,等.山东花生茎腐病病原菌研究[J].中国油料作物学报,2014,36(4):524-528.
[13] 刘佳宁,马银鹏,王玉文,等.黑木耳“黑皮病”病原菌鉴定[J].黑龙江科学,2015,6(1):4-6.
[14] MILLER J H,HARVEY H W.Peanut wilt in Georgia[J].Phytopathology ,1932,22:371-383.
[15] PHIPPS P M,PORTER D M.Collar rot of peanut caused byLasiodiplodiateobromae[J].Plant Dis,1998,82:1205-1209.
[16] 李君彦,王千红,杨兆森.花生茎腐病的病原鉴定[J].花生科技,1990(3):5-8.
[17] ALVES A ,CROUS P W,CORREIA A,et al.Morphological and molecular data reveal cryptic speciation inLasiodiplodiatheobromae[J].Fungal Diversity,2008,28(2):1-13.
[18] 董金皋,李洪连,王建明,等.农业植物病理学[M].北京:中国农业出版社,2000.
[19] 张明厚.油料作物病害[M].北京:中国农业出版社, 1995.
[20] 张广民.山东省花生病害的发生及防治技术[J].农药,1997,36(4):6-8.
[21] 侯绪友,王家绍.花生茎腐病的研究[J].植物保护,1979,5(2):7-11.
[22] WOOD P M,WOOD C E.Cane dieback of dawn seedless table grapevines (Vitis vinifera) in Western Australia caused byBotryosphaeriarhodina[J].Australasian Plant Pathology,2005,34(3):393-395.
[23] NGUYEN C M T,DANG T T V,NGUYEN H X,et al.Collar rot of groundnut caused byLasiodiplodiatheobromaein North Vietnam [J].International Arachis Newsletter,2006,26: 20-25.
Identificationofpathogenofpeanutstemrotanditsbiologicalcharacteristicsresearch
ZHANG Jianhang,ZHANG Xingguo,LIU Ting,HE Xiaoyan,WANG Yun,MA Xingli,YIN Dongmei
(College of Agronomy,Henan Agricultural University,Zhengzhou 45002,China)
In order to reduce the loss of peanut stem rot in peanut production,the pathogen was isolated from the peanut stem rot disease plants collected from different peanut growing areas in Henan Province.The biological characteristics of pathogens and different agents on the bacteria indoor were studied.The results showed that the pathogen of peanut stem rot in Henan Province wasLasiodiplodiatheobromae,which was the fastest growing in the medium of pH=8,and the lethal temperature was 56 ℃(10 min).After treatment with different agents,25% tebuconazole WP had the best inhibitory effect; 60% pyraclostrobin metiram water dispersible granules followed; 70% wettable powder,80% carbendazim imported products and 50% kresoxim methyl WDG had no significant difference from the CK.
stem rot of peanut;Lasiodiplodiatheobromae; fungistatic action
2017-03-03
河南省重大科技专项(161100111000);河南省现代农业产业技术体系(S2012-05-03)。
张建航(1991-),女,河南安阳人,硕士研究生,主要从事花生的遗传育种研究。
殷冬梅(1972-),女,河南方城人,教授,博士。
1000-2340(2017)06-0822-06
S435.6
A
蒋国良)

