银杏叶提取物对糖尿病肾病大鼠NLRP3炎性体的影响*
张素英 李瑞静 赵晶晶 韩 雷 刘光义 李瑞杰(河北省新乐市中医医院,河北 新乐 050700)
2型糖尿病(T2DM)是代谢和内分泌功能紊乱常见的综合征,其主要病理学改变是胰岛素抵抗和β细胞功能障碍。糖尿病的发病率在全球迅速增加,预计到2025年将达到3亿人,其中约1/3将发展为糖尿病肾病(DN)[1-2],是终末期肾病(ESRD)的主要原因[3]。 至今为止,有关DN病因和发病机制尚未明确,因此,对于DN的治疗,临床上方法有限。目前,DN的主要治疗方法主要是通过抑制肾素-血管紧张素系统降低血糖和血压水平。然而,这些方法仅仅延缓了DN进程,从而延缓ESRD的进展,但不能阻止进展到ESRD[4-5]。
高血糖刺激后NLRP3炎性体活化后可激活Caspase-1,促使白细胞介素-1β(IL-1β)分泌,而 IL-1β水平的增加是2型糖尿病进展及胰岛素抵抗的重要危险因素[6],对其活化的抑制可以显着减弱大鼠的肾组织的炎性反应和改善肾功能[7]。因此,在DN发病及进展过程中NLRP3炎性体起着关键作用。研究表明,银杏叶提取物黄酮酸苷和银杏内酯具有抗氧化应激和减弱炎症反应等[8-9]多重功效,有延缓糖尿病肾病的进展的治疗作用。所以我们以NLRP3炎性体和继发的炎性反应为研究切入点,来探讨银杏叶提取物可能通过抑制NLRP3炎性体活性来发挥肾脏保护作用,为临床提供延缓DN发生发展的治疗理论依据。现报告如下。
1 材料与方法
1.1 实验动物 成年雄性Wistar大鼠72只,体质量为 200~250 g(6~8 周龄),SPF 级,购自广东省医学实验动物中心,合格证号:(粤)2010-0009。动物饲养在SPF级环境的笼子中,12 h明暗循环,恒温(25±2)℃,自由进食和饮水。
1.2 药物与试剂 银杏叶提取物(浙江康恩贝制药股份有限公司,批号:Z20027963);链脲佐菌素、5-二苯基四氮唑溴盐(Sigma公司);DMEM培养基(Gibco公司);Caspase-1、IL-1β、白细胞介素-18(IL-18)、肿瘤坏死因子-α(TNF-α)试剂盒(Cell Signaling Technology公司)。
1.3 造模及分组 适应性喂养5 d后,随机分为对照组、DM组与DM+GBE组各24只。将链脲佐菌素溶于0.1 mmol/L,pH为4.5的枸橼酸缓冲液中,DM组及DM+GBE组均在实验开始第1日腹腔注射上述方法配制的链脲佐菌素,剂量为60mg/kg。DM+GBE组给予GBE干预,灌胃前使用0.9%氯化钠注射液将药物稀释,剂量为 96 mg/(kg·d),每日 1 次灌胃,连续 12周。对照组、DM组均以0.9%氯化钠注射液以同等剂量灌胃[10]。采用强生公司血糖仪进行机测血糖的监测,每周检测1次,共12周。糖尿病模型大鼠的诊断标准:72 h后静脉采血血糖浓度≥16.7 mmol/L时可确定建模成功,将大鼠纳入DM模型范畴中,此模型在构建过程中具有胰岛素抵抗、高血脂、高血糖及典型糖尿病肾病的特点[9]。
1.4 一般情况观察 在饲养及模型建立过程中观察动物的一般活动情况,每日饮水及进食情况,精神状态及活动,并每周测量体质量1次
1.5 标本采集及检测 研究开始及每周取尾尖血用快速血糖仪监测血糖水平。治疗结束后全部试验大鼠经腹腔注射2%戊巴比妥钠50 mg/kg麻醉,开胸,经心脏抽全血,抗凝、离心,分离血清和红细胞,将血清至于EP管,ELISA技术检测血清TNF-α、IL-1β水平。部分血液培养于含有10%FBS和抗生素(100 U/mL青霉素100μg/mL链霉素)DMEM培养基中,过夜后去除上清液,获得巯基醋酸盐诱导的巨噬细胞,用Trizol试剂提取总RNA,逆转录为cDNA,用定量PCR检测NLRP3、ASC、IL-1βmRNA表达。心脏取血后,迅速取出双肾,经预冷的9%氯化钠注射液灌洗,至整个肾颜色变苍白后,游离、去除包膜,称重;取右肾,按冠状位纵行剖开,取肾皮质4%多聚甲醛常规灌注固定,蜡块制作,切片,贴片后严格按试剂盒操作步骤进行,采用免疫组化 ABC 法检测 Caspase-1、IL-1β、IL-18,行半定量分析。
1.6 统计学处理 应用SPSS 17.0统计软件。计量资料以(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况观察 模型建立及银杏叶干预过程中,对照组大鼠体质量增加迅速,进食饮水状态可,自主活动良好及反应能力灵敏,精神状态佳,毛有光泽。DM组:进食及饮食较对照组增加,但反应能力较迟钝,自主活动减少,毛色差。DM+GBE组:自主活动及反应能力较DM组好转,毛色较晦暗。
2.2 各组大鼠造模及治疗期间体质量比较 见表1。研究开始时,各组体质量差异无统计学意义(P>0.05),在第6周时,DM组大鼠体质量降低,但与对照组差异无统计学意义(P>0.05),在12周时与对照组相比较,DM组大鼠体重明显降低(P<0.01);与DM组相比较,DM+GBE组体质量明显增加(P<0.05)。
表1 各组大鼠造模及治疗期间体质量比较(g,±s)
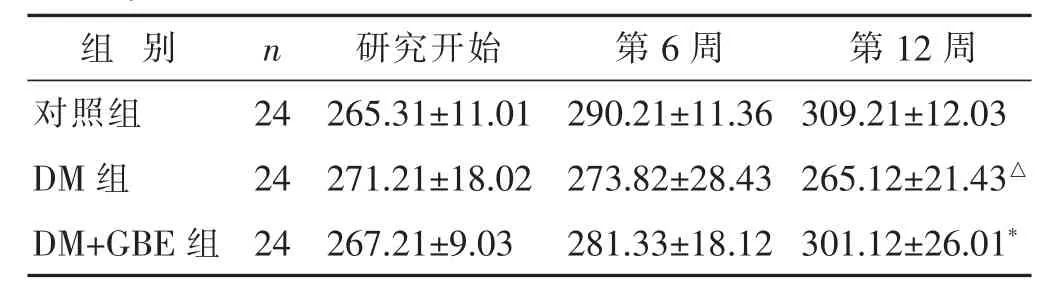
表1 各组大鼠造模及治疗期间体质量比较(g,±s)
与对照组相比较,△P<0.05;与 DM 组相比较,*P<0.05,**P<0.01,※P>0.05。下同。
n 研究开始24 265.31±11.01 DM 组 273.82±28.43 265.12±21.43△组 别 第6周 第12周对照组 290.21±11.36 309.21±12.03 24 271.21±18.02 DM+GBE 组 24 267.21±9.03 281.33±18.12 301.12±26.01*
2.2 各组血糖水平比较 见表2。血糖水平在研究开始各组间差异无统计学意义(P>0.05)。与对照组相比较,第6周及第12周时,血糖水平明显升高(P<0.01)。与DM组相比较,DM+GBE组血糖水平降低(P<0.05)。
表2 各组血糖水平比较(±s)
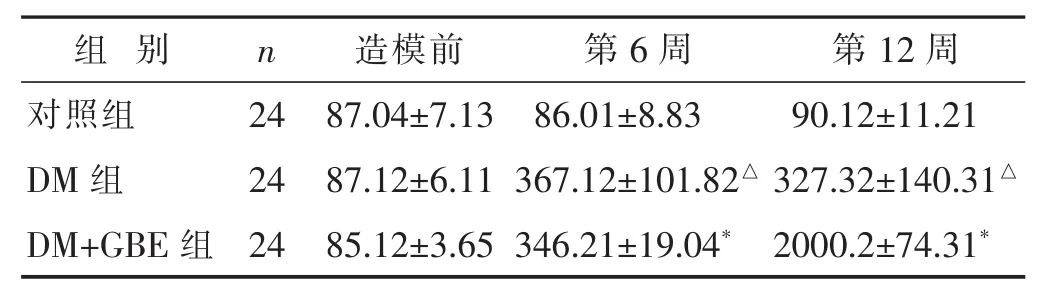
表2 各组血糖水平比较(±s)
n 造模前24 87.04±7.13 DM 组 367.12±101.82△ 327.32±140.31△组 别 第6周 第12周对照组 86.01±8.83 90.12±11.21 24 87.12±6.11 DM+GBE 组 24 85.12±3.65 346.21±19.04* 2000.2±74.31*
2.3 各组肾皮质IL-1β、IL-18和Caspase-1水平比较组间Caspase-1的水平相比较差异无统计学意义 (P>0.05)。但是与对照组相比较,DM组大鼠IL-1β、IL-18的水平均升高,差异有统计学意义(P<0.05)。与DM组相比较,DM+GBE组大鼠IL-1β、IL-18水平明显下降(P<0.05或P<0.01)。
表3 各组肾皮质IL-1β、Caspase-1和IL-18水平比较(pg/mL,±s)
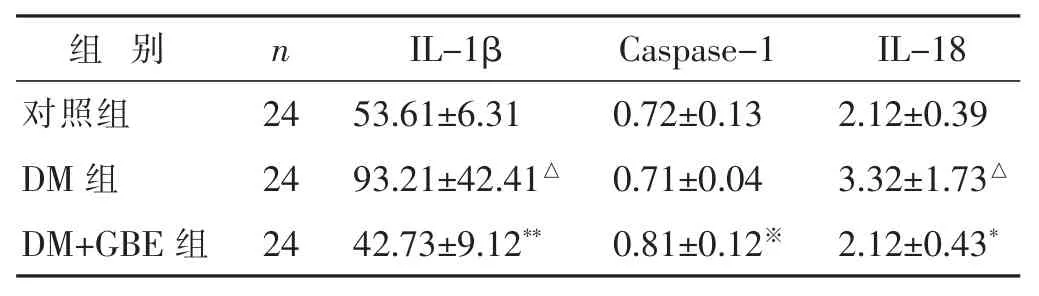
表3 各组肾皮质IL-1β、Caspase-1和IL-18水平比较(pg/mL,±s)
n IL-1β 24 53.61±6.31 DM 组 0.71±0.04 3.32±1.73△组 别 Caspase-1 IL-18对照组 0.72±0.13 2.12±0.39 24 93.21±42.41△DM+GBE 组 24 42.73±9.12** 0.81±0.12※ 2.12±0.43*
2.4 各组NLRP3炎性体相关分子表达水平的比较见表 4。与对照组相比较,DM 组 NlRP3、ASC、IL-1β 的mRNA 表达升高(P<0.05);与 DM组相比较,DM+GBE组 NlRP3、ASC、IL-1β 的 mRNA 表达降低(P<0.01)。
表4 各组NLRP3炎性体相关分子表达水平比较(pg/mL,±s)
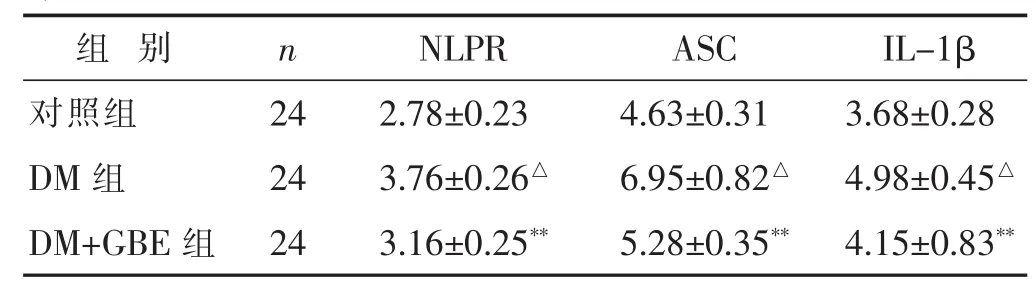
表4 各组NLRP3炎性体相关分子表达水平比较(pg/mL,±s)
n NLPR 24 2.78±0.23 DM 组 6.95±0.82△ 4.98±0.45△组 别 ASC IL-1β对照组 4.63±0.31 3.68±0.28 24 3.76±0.26△DM+GBE 组 24 3.16±0.25** 5.28±0.35** 4.15±0.83**
2.5 各组大鼠血清TNF-α、IL-1β水平的比较 见表5。与对照组相比较,DM组TNF-α、IL-1β水平均升高(P<0.05); 与 DM 组相比较,DM+GBE 组 TNF-α、IL-1β 水平均下降(P<0.05)。
表5 各组大鼠血清 TNF-α、IL-1β 水平比较(pg/mL,±s)
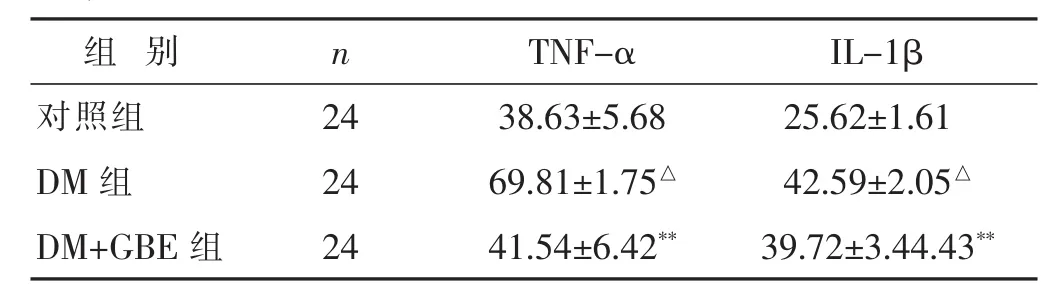
表5 各组大鼠血清 TNF-α、IL-1β 水平比较(pg/mL,±s)
组 别 IL-1β对照组 25.62±1.61 n TNF-α 24 38.63±5.68 DM 组 42.59±2.05△24 69.81±1.75△DM+GBE 组 24 41.54±6.42** 39.72±3.44.43**
3 讨 论
糖尿病肾病是糖尿病微血管并发症之一,2型糖尿病患者中50%在诊断为糖尿病同时就存在肾脏损害,糖尿病肾病是导致终末期肾病的主要原因之一。主要治疗措施是早期干预各种危险因素及终末期的肾脏替代治疗。所以如何早期控制血糖,减缓糖尿病肾病进程,保护肾脏是目前研究的热点。
糖尿病肾病的明确发病机制目前尚不清楚,近几年研究表明NLRP3炎性体的激活参与了糖尿病肾病的病理过程。NLRP3是活化Caspase-1的分子平台,能够调控IL-1β、IL-18等促炎细胞因子的成熟和分泌[11-12],IL-1β细胞因子是糖尿病肾病炎症反应的主要调节器,表达增加近端小管上皮细胞产生透明质酸增多,进而导致血管上皮细胞的渗透性增加,与糖尿病各种慢性并发症具有直接关系。既往研究证明高糖可以促进人足细胞及链脲佐菌素(STZ)诱导的DN小鼠模型NLRP3炎性小体的表达及激活,沉默NLRP3/ASC基因或抑制Caspase-1的活性均可阻止高糖诱导的足细胞NLRP3炎性小体激活和损伤,由此可以看出NLRP3炎性小体可以引起DN患者的肾小球损伤[13]。这些证据提示NLRP3 mRNA的水平和肾功能的高低明显相关,阻止病理性炎性体的激活应是未来治疗肾脏病的一种重要手段。
本研究中,造模后DM组大鼠较对照组血糖增高,体质量降低,提示造模成功,经银杏叶提取物干预后,血糖水平下降,体重较DM组增加,提示银杏叶提取物有有降低血糖、改善糖耐量的作用。对肾皮质IL-1β、IL-18和Caspase-1进行了分析,我们发现,DM组IL-1β、IL-18水平较对照组增加,经银杏叶提取物干预后水平下降,提示银杏叶提取物有减弱炎性反应的作用,但在试验中,Caspase-1组间比较无变化,值得进一步研究。为了进一步研究银杏叶肾脏保护的机制,我们对NlRP3、ASC、IL-1β的mRNA表达及血清TNF-α、IL-1β进行了分析,研究中DM组大鼠Nl-RP3、ASC、IL-1β 及血清中 TNF-α、IL-1β 表达均增高,与既往研究一致,提示炎性复合物参与了糖尿病肾病的发病及进展,经银杏叶提取物干预后炎性复合体表达下降,提示银杏叶提取物有减弱炎性反应的作用。
银杏叶提取物是一种常见的中药活性成分,用于治疗多种疾病。GEB的主要活性成分有黄酮苷和银杏内酯,有抗血小板聚集、改善血流动力学、抗氧化应激、抑制肾小管上皮细胞调亡等作用[14-15]。本研究表明,银杏叶提取物可降低糖尿病大鼠的血糖水平,增加糖尿病大鼠体质量,能减弱糖尿病大鼠炎性反应,起到保护肾脏的作用。这可能是银杏叶提取物延缓糖尿病肾病进展的机制之一。
综上所述,NLRP3相关炎性因子的表达及分化可能参与DN的发生及进展,经银杏叶提取物干预后,炎症减轻,提示银杏叶提取物肾脏保护机制可能是通过抑制NLRP3的活性来实现的。为临床治疗DN提供了新途径,应用前景广阔,值得进一步研究、开发。
[1]Patil R,Nasrin Nisha A,Datta SS,et al.Popular misconceptions regarding the diabetes management:where should we focusour attention[J].Journal of Clinical and Diagnostic Research,2013,(4):1477-1486.
[2]Ryu EY,Park AJ,Park SY,et al.Inhibitory effects of Ginkgo biloba extract on inflammatory mediator production by Porphyromonas gingivalis lipopolysaccharide in murine macrophages via Nr-2mediated heme oxygenase-1 signaling pathways[J].Inflammation,2012,35(4):1477-1486.
[3]Collins AJ,Foley RN,Chavers B.et al.United states renaldata dystem 2011 annual data report:atlas of chronic kidney disease&end-stage renal disease in the United States[J].American Journal of Kidney Diseases,vol,2011,59(1):7.
[4]Gallagher H,Suckling RJ.Diabetic nephropathy: where are we on the journey from pathophysiology to treatment[J].Diabetes, Obesity and Metabolism,2016,18(7):641-647.
[5]Lewis EJ,Lewis JB.Treatment of diabetic nephropathy with angiotensin Ⅱ receptor antagonist[J].Clinical and Experimental Nephrology,2003,7(1):1-8.
[6]徐玲玲,杨俊伟.NLRP3炎性体与肾脏疾病[J].肾脏病与透析肾移植杂志,2011,20(6):555-558.
[7]Wang C,Pan Y,Zhang QY,et al.Quercetin and allopurinol ameliorate kidney injury in STZtreated ratswith regulation of renal NLRP3 in ammasome activation and lipid accumulation[J].PLoSONE,2012,7(6):e38285.
[8]Tulsulkar J,Shah ZA.Ginkgo biloba prevents transient global ischemia-induced delayed hippocampal neuronaleath through antioxidant and anti-inflammatory mechanism[J].Neurochem Int,2013,62(2):189-197.
[9]Ryu EY,Park AJ,Park SY,et al.Inhibitory effects of ginkgo biloba extract on inflammatory mediator production by porphyromonas gingivalis lipopolysaccharide in murine macrophages via Nr-2mediated heme oxygenase-1 signaling pathways[J].Inflammation,2012,35(4):1477-1486.
[10]刘光义,张素英.银杏叶提取物对糖尿病肾病模型大鼠氧化应激及炎症系统的影响[J].中医药导报,2015,21(3):31-32.
[11]Schroder K,Tschopp J.The inflammasomes[J].Cell,2010,140(6):821-832.
[12]Martinon F,Mayor A,Tschopp J.The inflammasomes: guardians of the body[J].AnnuRev Immunol,2009(27):229-265.
[13]王晓宇,王秋月.NLRP3炎性小体与糖尿病肾病相关性研究进展[J].医学研究杂志,2015,44(5):180-181.
[14]WANG yan,Jihuai-xue,XIAO shu-hua.Effect of gination on renal tubular epithelial cell apoptosis induced by renal ischenmia/reperfusion[J].Chin Pharmacol Bull,2007,23(8):923-931.
[15]Chan pc,xiao Q,Fu pp.Ginkgo biloba leave exract:biological,medicinal,and toxicological effects[J].J Environ sci Health C Enbiron Carcinog Ecotoxicol Rev,2007,25 (3):211-244.

