灯盏花素对脑外伤大鼠皮质神经元自噬、炎症损伤及TLR4/NF-κB信号通路的影响*
童军卫 刘补兴 胡小铭 李 烨 刘正敏 蔡清风△
[1.浙江省台州恩泽医疗中心(集团)恩泽医院,浙江 台州 318050;2.浙江省台州医院,浙江台州 317000]
脑外伤(TBI)属于神经外科疾病,其致死致残率占全身创伤的首位[1]。TBI常见的治疗方法是开颅手术治疗,术后的会引发颅内感染,因此探寻降低颅内感染的药物成为研究的重点[2]。灯盏花素具有扩张脑血管、降低脑血管阻力、增加脑血流量、改善微循环、抗血小板聚集等作用[3]。近年来,不少学者将灯盏花素应用于TBI的治疗中,研究表明,灯盏花素可以提高重度脑损伤患者生活质量,减少并发症和后遗症的发生[4]。然而灯盏花素对TBI大鼠神经元自噬和炎症损伤的影响及其分子机制尚未见报道。本研究通过建立TBI大鼠模型,探究灯盏花素对神经元自噬和炎症损伤的影响及其作用机制。现报告如下。
1 材料与方法
1.1 实验动物 SD雄性大鼠70只,SPF级,8~10周龄,体质量(150±20)g,购自中国医学科学院医学实验动物研究所,许可证号:SYXK(京)2015-0037。
1.2 试药与仪器 灯盏花素(国药准字Z20053907,昆明龙津药业股份有限公司,批号20160604,规格20 mg/支);米诺环素(批号0209833,日本昭和发酵工业株式会社);RNA提取和反转录试剂盒购自天根生化科技有限公司;TaqDNA聚合酶购自NEB公司;兔抗大鼠Beclin1多克隆抗、白细胞介素-6(IL-6)和TNF-αELISA试剂盒购自上海赛默科技生物发展有限公司;引物由苏州金唯智生物科技有限公司合成。
1.3 分组与造模 将造模成功的大鼠随机分成5组,每组10只,分别命名为为模型组、米诺环素组(45mg/kg)、灯盏花素低剂量组 (0.1 mg/kg)、灯盏花素中剂量组(0.5 mg/kg)、灯盏花素高剂量组(1 mg/kg),假手术组及模型组注射等量容积0.9%氯化钠注射液,持续治疗2周。脑外伤动物模型建立:依据文献[5],将大鼠腹腔注射4%水合氯醛进行麻醉,剪毛消毒后将大鼠固定,于头皮正中切开,剥离右侧颅顶骨膜,用颅骨钻刺1个4mm的骨窗,剥开硬脑膜,在脑表面放置1枚垫片,从20 cm高度落下40 g的祛码撞击垫片,建立脑外伤模型;假手术组仅切开头皮、左顶部开骨窗,不致脑外伤,模型组和假手术组均用牙科水泥固定骨孔处,缝合头皮,然后将大鼠收回饲养。
1.4 标本采集与检测 大脑皮层组织分离:持续治疗2周后,将大鼠麻醉,消毒后用剪刀剪开头皮及颅骨,取出全脑,用10%甲醛溶液室温下固定24 h,然后去除脑膜及血管,从中分离大脑皮层组织,置于-80℃冰箱,备用。1)甲苯胺蓝染色检测皮质神经元存活率:在冰冻切片机将大脑皮层组织切成8μm的薄片,室温干燥后,用PBS漂洗,干燥后用1%甲苯胺蓝染色20 min,水洗后放入0.5%盐酸乙醇溶液中分化,经梯度乙醇溶液脱水,二甲苯透明(25min),以中性树胶封片。计录存活神经元数量,计算皮质神经元存活率。2)qRT-PCR检测Beclin1 mRNA表达情况:提取大脑皮层组织总RNA,并将其反转成cDNA,引物序列:F:5′-TGGATCTGGACCAGG-3′。R:5′-CAAATAATTAAATC CTTCCACATCT-3′,以GAPDH为内参,进行qRTPCR。 反应体系:5×缓冲液 10μL,TaqDNA聚合酶1 μL,F 2 μL,R 2 μL,10 mM dNTPmix 1 μL,cDNA 1μL,ddH2O 33μL。 反应条件:95℃ 预变性 5 min,95℃变性30 s,59℃延伸15 s,40个循环,延伸时读取光密度(D)值,计算Beclin1 mRNA的相对表达量。3)免疫组化检测Beclin1蛋白的表达:制作大脑皮层石蜡切片(不超过5 mm),将组织切片在92~98℃条件下存放20 min,滴加正常山羊血清后,在组织玻片上分别滴加Beclin1一抗,于4℃过夜放置,复温后在组织玻片上滴加二抗,显色后,用苏木素复染,观察Beclin1在大脑皮层组织中的表达情况。4)ELSA检测血清中炎症因子IL-6、肿瘤坏死因子-α(TNF-α)表达情况:采集各组大鼠眼眶静脉血,离心分离血清。采用IL-6和TNF-αELISA试剂盒检测血清中IL-6和TNF-α的表达情况。5)Western blot检测TLR4和核因子-κB(NF-κB)表达情况:取大脑皮层组织,加入细胞裂解液提取细胞总蛋白,以GAPDH为内参,进行聚丙烯酰胺凝胶电泳,每孔上样体积20μL,电泳结束后,半干转膜仪转膜50 min,分别滴加兔抗鼠TLR4和NF-κB多克隆抗体,置于4℃下过夜,滴加二抗37℃放置1 h。加入ECL发光剂进行显影,利用自动凝胶成像系统采集图像。采用Gel-Pro analyzer4软件对SDSPAGE电泳图目的条带进行扫描,分析TLR4和NF-κB表达水平。
1.5 统计学处理 应用SPSS20.0统计软件。计量资料以(±s)表示,多组采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组甲苯胺蓝染色检测皮质神经元存活率比较见表1。模型组皮质神经元存活率显著低于假手术组(P<0.05);米诺环素组和灯盏花素组皮质神经元存活率显著高于模型组(P<0.05);随灯盏花素剂量增加,皮质神经元存活率提高,呈剂量依赖性。
表1 各组甲苯胺蓝染色检测皮质神经元存活率比较(±s)
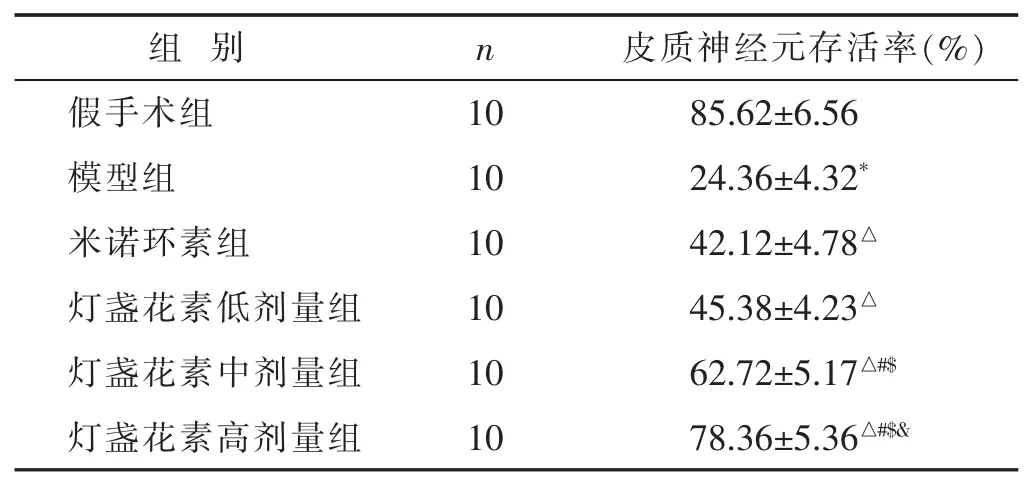
表1 各组甲苯胺蓝染色检测皮质神经元存活率比较(±s)
与假手术组比较,*P<0.05;与模型组比较,△P<0.05;与米诺环素组比较,#P<0.05;与灯盏花素低剂量组比较,$P<0.05;与灯盏花素中剂量组比较,&P<0.05。
组 别 n假手术组 10模型组 10米诺环素组 10皮质神经元存活率(%)85.62±6.56 24.36±4.32*42.12±4.78△灯盏花素低剂量组 10 45.38±4.23△灯盏花素中剂量组 10 62.72±5.17△#$灯盏花素高剂量组 10 78.36±5.36△#$&
2.2 各组qRT-PCR检测Beclin1 mRNA表达情况比较 见表2。模型组Beclin1mRNA表达水平显著高于假手术组(P<0.05);米诺环素组和灯盏花素组Beclin1 mRNA表达水平显著低于模型组(P<0.05);随灯盏花素剂量增加,Beclin1mRNA表达水平降低,呈剂量依赖性。
表2 各组qRT-PCR检测大脑皮层Beclin1mRNA表达情况比较(±s)
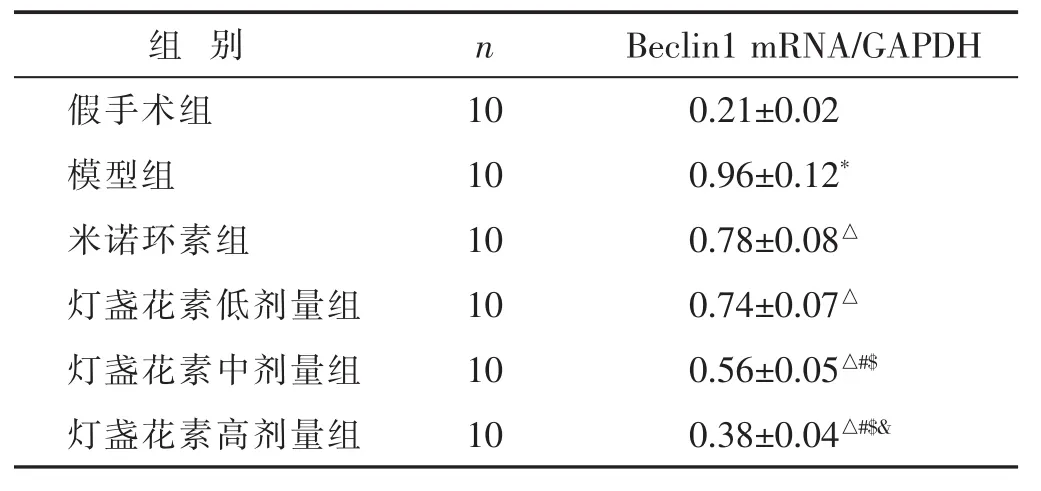
表2 各组qRT-PCR检测大脑皮层Beclin1mRNA表达情况比较(±s)
组 别 n假手术组 10模型组 10米诺环素组 10 Beclin1mRNA/GAPDH 0.21±0.02 0.96±0.12*0.78±0.08△灯盏花素低剂量组 10 0.74±0.07△灯盏花素中剂量组 10 0.56±0.05△#$灯盏花素高剂量组 10 0.38±0.04△#$&
2.3 各组免疫组化检测Beclin1蛋白表达情况比较见图1。模型组Beclin1的表达水平高于假手术组;米诺环素组和灯盏花素组Beclin1的表达水平低于模型组;随灯盏花素剂量的增加,Beclin1的表达水平降低,呈剂量依赖性。

图1 免疫组化检测大脑皮层Beclin1蛋白的表达水平(200倍)
2.4 各组ELSA检测血清中炎症因子IL-6、TNF-α表达情况比较 见表3。模型组IL-6、TNF-α表达水平显著高于假手术组(P<0.05);米诺环素组和灯盏花素组IL-6和TNF-α表达水平显著低于模型组 (P<0.05);随灯盏花素剂量的增加,IL-6和TNF-α表达水平显著降低,呈剂量依赖性。
2.5 各组 Western blot检测大脑皮层 TLR4、NF-κB表达情况比较 见表4。模型组TLR4和NF-κB表达水平显著高于假手术组(P<0.05);米诺环素组和灯盏花素组TLR4、NF-κB表达水平显著低于模型组 (P<0.05); 随灯盏花素剂量增加,TLR4、NF-κB表达水平降低,呈剂量依赖性。
表3 各组ELSA检测血清中炎症因子IL-6和TNF-α表达情况比较(μg/L,±s)

表3 各组ELSA检测血清中炎症因子IL-6和TNF-α表达情况比较(μg/L,±s)
组 别 n假手术组 10模型组 10米诺环素组 10灯盏花素低剂量组 10灯盏花素中剂量组 10灯盏花素高剂量组 10 IL-6 TNF-α 0.67±0.14 0.56±0.11 3.18±0.24* 2.98±0.24*2.78±0.17△ 2.72±0.19△2.76±0.17△ 2.71±0.17△1.75±0.14△#$ 1.58±0.14△#$0.97±0.12△#$& 0.83±0.13△#$&
表4 各组Western blot检测TLR4和NF-κB表达情况比较(±s)
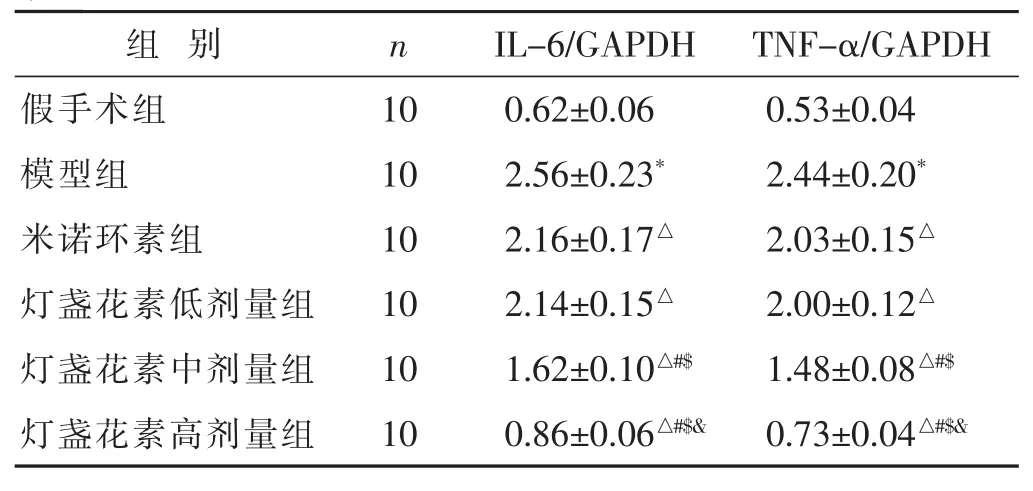
表4 各组Western blot检测TLR4和NF-κB表达情况比较(±s)
组 别 n假手术组 10模型组 10米诺环素组 10灯盏花素低剂量组 10灯盏花素中剂量组 10灯盏花素高剂量组 10 IL-6/GAPDH TNF-α/GAPDH 0.62±0.06 0.53±0.04 2.56±0.23* 2.44±0.20*2.16±0.17△ 2.03±0.15△2.14±0.15△ 2.00±0.12△1.62±0.10△#$ 1.48±0.08△#$0.86±0.06△#$& 0.73±0.04△#$&
3 讨 论
脑外伤是指脑部因暴力所伤,导致血络受损[6]。基于此理论,本研究采用祛码撞击的方法建立脑外伤大鼠模型,并以此为研究对象探究灯盏花素对脑外伤大鼠神经元自的噬影响。研究表明,灯盏花素注射液能够降低脑外伤患者血液黏度,疏通微循环[7]。然而灯盏花素对脑外伤大鼠神经元自的噬影响尚未见报道。Beclin1是判断自噬活性的重要指标。Ng G研究表明,Beclin1和Bcl-2共同参与组成Ⅲ型PI3复合物调控自噬[8]。张志雄研究表明,下调 Beclin1基因的表达可以抑制大鼠海马神经元自噬[9]。本研究表明,灯盏花素能够提高脑外伤大鼠皮质神经元的存活率,且随灯盏花素剂量增加,皮质神经元的存活效率增加;同时,灯盏花素能够降低大脑皮层中Beclin1表达水平,且随灯盏花素剂量增加,Beclin1的表达水平显著降低。
脑外伤出血部位和周围的炎症反应是引发脑损伤的重要环节[10],其中参与炎症反应的炎症因子有IL-6、TNF-α,因此TNF-α和IL-6是评估脑外伤患者炎症反应的重要指标[11-12]。有研究表明,脑外伤大鼠大脑组织中TNF-α和IL-6表达水平显著升高,下调TNF-α和IL-6表达可以减少大鼠组织细胞的损伤,进而发挥对脑组织的保护作用[13]。本研究表明,模型组大鼠血清中IL-6、TNF-α表达水平显著高于假手术组,提示脑外伤会引发严重的炎症反应综合征;灯盏花素组血清中IL-6和TNF-α表达水平显著低于模型组,且呈剂量依赖性,提示灯盏花素能减弱脑外伤大鼠的炎症反应。
TLRs能够介导炎症反应[14]。 研究表明,IL-6和TNF-α是由TLR4/NF-κB信号通路调控的,当细胞内TLR4被激活时,能够与热休克蛋白60(HSP 60)结合,进而激活 NF-κB[15]。 汪春研究表明,蛛网膜下腔出血可引发TLR4和NF-κB上调表达,同时可介导炎症因子增加[16]。本研究表明,灯盏花素能够抑制TLR4/NF-κB信号通路中TLR4和NF-κB蛋白的表达水平,且随灯盏花素剂量增加,TLR4和NF-κB表达水平显著降低,且呈剂量依赖性。
综上所述,灯盏花素能够减弱脑外伤大鼠皮质神经元自噬和炎症损伤,推测这一作用是通过抑制TLR4/NF-κB信号通路来实现的,为脑外伤靶向药物的开发提供一定的理论基础。
[1]Bragge P,Chau M,Pitt VJ,et al.A fluid percussion model of experimental brain injury in the rat[J].JNeurosurg,1987,67(1):110-119.
[2]陈贤斌,苏志鹏,朱丹华,等.脑外伤术后继发颅内感染的相关因素分析[J].中华医院感染学杂志,2012,22(8):175-176.
[3]周贵玉,刘春旺,朱传华.灯盏花素注射液临床疗效观察[J].中国药业,1999,8(4):55-56.
[4]李宏伟,郑俊宁,张永福,等.灯盏细辛注射液对血流动力学影响的实验研究[J].世界医学杂志,2001,5(6):83-84.
[5]Florian B,Vintilescu R,Balseanu AT,et al.Long-term hypothermia reduces infarct volume in aged rats after focal ischemia[J].Neuroscience Letters,2008,438(2):180-185.
[6]汪春,郭知学,李鸥,等.中药早期介入对脑外伤后患者认知功能的影响[J].中国康复理论与实践,2012,17(2):123-125.
[7]渠敬峰,周炳华,徐锋.颅脑外伤早期使用灯盏花素的血液流变学、甲襞微循环观察[J].临床医学,2002,22(8):9-10.
[8]Ng G,Huang J.The Significance of autophagy in cancer[J].Mol Carcinog,2005,43(4):183-187.
[9]张志雄.慢病毒介导Beclin1基因RNAi对体外培养的大鼠原代海马神经元自噬相关蛋白表达的影响及银杏酮酯在其中的作用[C].中国生理学会全国会员代表大会暨生理学学术大会,2014.
[10]Aronowski J, Zhao X.Molecular pathophysiology of cerebral hemorrhage: secondary brain injury [J].Stroke,2011,42:1781-1786.
[11]王佳,张红玉.不同程度颅脑损伤后炎症因子的表达及其临床意义[J].中国现代医学杂志,2016,26(3):72-75.
[12]李方,王璐,木塔里甫·买合木提,等.鼠神经生长因子对重症脑出血患者的疗效及对炎症因子、氧化应激的影响[J].海南医学院学报,2016,22(9):889-891.
[13]董晓巧,俞文华,张祖勇,等.氧化苦参碱对脑外伤大鼠脑组织 IL-1β、TNF-α 和 IL-6水平的影响[J].浙江中西医结合杂志,2012,22(7):508-510.
[14]钟琪.TLR4在小鼠脑出血炎症损伤中的作用及机制初步研究[D].重庆:第三军医大学,2012.
[15]LiGZ,Zhang Y,Zhao JB,et al.Expression of myeloid differentiation primary response protein 88 (Myd88)in the cerebral cortex after experimental traumatic brain injury in rats[J].Brain Research,2011,1396(1):96-104.
[16]Wang Z,Zuo G,Shi XY,et al.Progesterone administration modulates cortical TLR4/NF-κB signaling pathway after subarachnoid hemorrhage in male rats[J].Mediators of inflammation,2011,2011(2011):848309-848309.

