免疫增强剂对血鹦鹉鱼非特异性免疫的影响
邢 薇,姜 娜,李铁梁,罗 琳,袁 丁,周 云,王 姝,马志宏*
(1.北京市水产科学研究所,北京 100068;2.北京市水产技术推广站,北京 100021)
免疫增强剂对血鹦鹉鱼非特异性免疫的影响
邢 薇1,姜 娜1,李铁梁1,罗 琳1,袁 丁1,周 云1,王 姝2,马志宏1*
(1.北京市水产科学研究所,北京 100068;2.北京市水产技术推广站,北京 100021)
【目的】研究菌蜕、壳聚糖、天蚕素、左旋咪唑4种免疫增强剂对血鹦鹉鱼非特异性免疫的影响。【方法】实验分为4个实验组和1个对照组,每个组设3个平行。实验组分别投喂添加5%菌蜕、2‰壳聚糖、1‰天蚕素和0.25‰左旋咪唑的饲料,对照组为未添加免疫增强剂的基础饲料,连续投喂血鹦鹉鱼56d。分别于7d、14d、21d、28d、56d每个平行组中随机取3尾鱼,检测血鹦鹉鱼血浆中溶菌酶(LZM)、超氧化物歧化酶(SOD)、碱性磷酸酶(ALP)、补体C3和血液中呼吸暴发(NBT)活性。【结果】投喂血鹦鹉鱼菌蜕组分别在7d、21d、56d的呼吸暴发活性显著高于对照组,在21dLZM活性显著高于对照组,在56dALP的活性显著高于对照组(P<0.05)。壳聚糖组在56d的呼吸暴发活性显著高于对照组,在21dALP活性显著高于对照组(P<0.05)。天蚕素组和左旋咪唑组只在56d呼吸暴发活性显著高于对照组(P<0.05)。【结论】在这4种免疫增强剂中,菌蜕能更好地提高血鹦鹉鱼呼吸暴发、LZM、ALP活性,整体非特异性免疫效果要好于壳聚糖、左旋咪唑及天蚕素。
血鹦鹉鱼;菌蜕;壳聚糖;天蚕素;左旋咪唑;非特异性免疫
血鹦鹉鱼(Cichlasoma synspilum×C.citrine)是由雌性紫红火口鱼(Cichlasoma synspilum)和慈鲷科的雄性红魔鬼鱼(Cichlasoma citrinellum)杂交而来,属淡水热带观赏鱼类。其嘴型似鸟喙,全身血红亮丽,体态丰腴多样,性情温和,品种丰富等特点备受大家青睐,在观赏鱼市场中也占有着重要的一席之地[1]。近年来血鹦鹉的养殖规模不断增大,但由于养殖技术不够成熟,导致细菌性疾病和寄生虫性疾病不断发生,已严重威胁着血鹦鹉鱼产业的健康发展,因此做好血鹦鹉病害防治技术工作至关重要。
对血鹦鹉等观赏鱼的病害应该以预防为主,才能更好地增加其观赏价值。国内外学者对鱼类免疫机制及其病害防治方法已进行了大量研究,其中免疫增强剂因能增强机体抗疾病感染的能力,其免疫增强作用所需时间较短,且没有记忆成分,被认为是一种提高鱼体免疫活性及疾病抵抗力的有效方法,具有重要的应用价值。免疫增强剂是指一些化学物质、药物、应激原或某些能引起特异、非特异性免疫反应活动、增强动物对病毒、细菌、真菌、寄生虫等抵抗的物质。目前免疫增强剂的种类可分为人工合成制剂、微生物来源制剂、动植物来源制剂、营养因子类物质和生物活性因子类物质等五大类[2]。鱼类免疫增强剂主要通过增强非特异性免疫应答而发挥作用,如促进补体、溶菌酶、蛋白酶抑制剂、C-反应蛋白、天然溶血素、凝聚素、巨球蛋白、巨噬细胞活化因子和干扰素等的合成,活化巨噬细胞、嗜中性粒细胞、非特异性细胞毒性细胞的吞噬杀菌功能。另外,免疫增强剂也能提高鱼体IgM抗体水平,增强鱼类特异性免疫应答水平[3-4]。
口服免疫方式一直是研究的热点,有研究者认为口服免疫更适合在生产中得到推广应用[5-6]。本研究分别将菌蜕、壳聚糖、左旋咪唑、天蚕素4种免疫增强剂添加到饲料中,进行血鹦鹉鱼投喂实验,然后检测血浆中溶菌酶(LZM)、超氧化物歧化酶(SOD)、碱性磷酸酶(ALP)、补体C3和血液中呼吸暴发(NBT)活性变化。旨在为免疫增强剂应用于血鹦鹉鱼养殖业提供一定的科学依据。
1 材料和方法
1.1 材料
1.1.1 实验鱼
血鹦鹉鱼由北京京朝花园养殖场提供。挑选体格健康、大小均匀的血鹦鹉鱼225尾,平均体重为(90.14±3.82)g。
1.1.2 实验饲料
血鹦鹉鱼饲料购自北京友谊恒远科技有限公司(该饲料为以鱼粉和豆粕为主要蛋白源的商品化饲料,其中粗蛋白含量为40%、粗脂肪含量为6%)。
菌蜕组菌蜕的添加量根据前期实验结果,采用5%浓度的维氏气单胞菌(Aeromonas veronii)菌蜕(本实验室制备的维氏气单胞菌菌蜕,2.2×108cell/mL CLGS)的添加量。其他实验组按照试剂说明推荐用量,分别是:壳聚糖组加2‰壳聚糖(青岛海之源生物科技有限公司);左旋咪唑组加0.25‰左旋咪唑(山东仁和堂药业有限公司);天蚕素组加1‰天蚕素(北京中农颖泰生物技术有限公司)。将上述免疫增强剂分别添加到饲料中,搅拌均匀,阴干,作为实验组。对照组为普通血鹦鹉鱼饲料。
1.1.3 主要试剂及仪器
四氮唑蓝(nitroblue tetrazolium,NBT)试剂(Amresco公司);超氧化物歧化酶(SOD)测试盒(北京华英生物技术研究所);补体蛋白3(C3)酶联免疫检测试剂盒(山东潍坊生物工程集团有限公司);溶菌酶活力(LZM)试剂盒(南京建成生物工程研究所);碱性磷酸酶(ALP)试剂盒(德国罗氏诊断有限公司)。
罗氏全自动电化学发光仪检测(德国,ROCHE/E601);全自动生化仪(日本 HITACHI,7160型);酶标仪(美国BioTek);微孔板分光光度计(日本,Power WaveXS2);台式高速冷冻离心机(德国SiGmA3-18K);涡旋混匀器(美国 IKA 2V S025)。
1.2 投喂实验
实验分为4个实验组和1个对照组,每组设3个平行,每个平行组放置15尾血鹦鹉鱼,在循环水养殖系统中暂养1周,水温27℃,持续充氧。实验正式开始后,每日于 9∶00、13∶00 和17∶00 定时投喂 3次,按2%的投饵率进行投喂。养殖水温控制在26℃±1℃,每天排污和换水各1次。24h不间断充氧。实验养殖桶容量为200 L。
1.3 样品采集
分别在投喂免疫增强剂后的 7、14、21、28和56d时从每个平行组中随机捞取3尾鱼,进行尾静脉采血。将血液放入1.5mL的离心管中(含有1.5%EDTA-Na2)上下颠倒混匀,然后取出100μL的抗凝血放入PCR管中,用于NBT的测定。剩余血液4℃,3 000r/min,离心10min,取上清置PCR管中,-80℃保存,用于 C3、LZM、SOD、ALP 的测定。
1.4 非特异性免疫指标的测定
1.4.1 呼吸暴发(NBT)
全血呼吸暴发活性的测定按硝基四氮唑蓝(nitroblue tetrazolium,NBT)方法[7]进行。
1.4.2 碱性磷酸酶(ALP)
采用比色法测定,用常规生化检测法,德国罗氏全自动电化学发光仪检测。
1.4.3 溶菌酶活力(LZM)
采用透光度比色法测定,在一定浓度的混浊菌液中,由于溶菌酶能水解细菌细胞壁上肽聚糖使细胞裂解而浓度降低,透光度增强,在530nm处根据透光度的变化计算溶菌酶的含量。
1.4.4 补体C3测定
采用免疫比浊法测定,样本中的补体C3与其相应的抗体在液相中结合,立即形成抗原-抗体复合物,并形成一定的浊度,利用全自动生化分析仪(波长340nm)测定C3浓度。
1.4.5 超氧化酶歧化酶(SOD)
采用比色法测定,利用邻苯三酚在弱碱性环境中发生自氧化反应,生成超氧阴离子自由基(O2-·),并在其自氧化过程中产生有色中间产物,在450nm处比色测定此产物的生成量,推算出SOD的活力。
1.5 数据处理
采用STATISTIC 7.0统计软件对数据进行统计分析,采用双因素交互分析(Factorial ANOVA),利用Duncan’s法进行差异显著性检验,显著水平为P<0.05。
2 结果
2.1 免疫增强剂对呼吸暴发(NBT)的影响
在整个实验过程中,呼吸暴发活性在各组均呈下降趋势(见图1);其中在7、21、56d时菌蜕组呼吸暴发活性显著高于对照组(P<0.05),壳聚糖组、左旋咪唑组和天蚕素组的呼吸暴发活性仅在56d时显著高于对照组(P<0.05)。
2.2 免疫增强剂对血浆中ALP活性的影响
在整个实验过程中,碱性磷酸酶(ALP)变化没有显著趋势(见图2)。实验壳聚糖组的ALP活性在21d时出现峰值,显著高于对照组(P<0.05)。菌蜕组的ALP活性在56d时出现峰值,显著高于对照组(P<0.05)。
2.3 免疫增强剂对血浆中LZM活性的影响
在整个实验过程中,溶菌酶(LZM)活性变化趋势不显著(见图3)。实验21d时,菌蜕组的LZM活性显著高于对照组(P<0.05)。
2.4 免疫增强剂对血鹦鹉鱼血浆中补体C3水平的影响
实验结果见图4。在整个实验周期内,各实验组血鹦鹉鱼血浆中的C3水平与对照组没有显著性差异(P>0.05)。
2.5 免疫增强剂对血鹦鹉鱼血浆SOD中活性的影响
在整个实验过程中,各组的超氧化物歧化酶(SOD)活性没有显著变化的趋势(见图5)。28d时,菌蜕组的SOD活性显著低于对照组(P<0.05)。
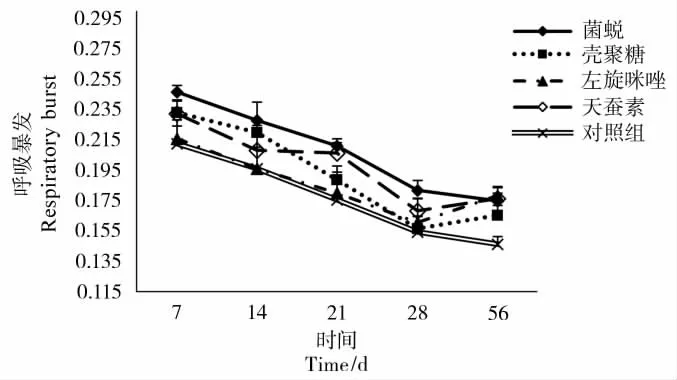
图1 免疫增强剂对血鹦鹉呼吸暴发的影响Figure 1 Effect of immunostimulants on respiratory burst in Blood Parrot
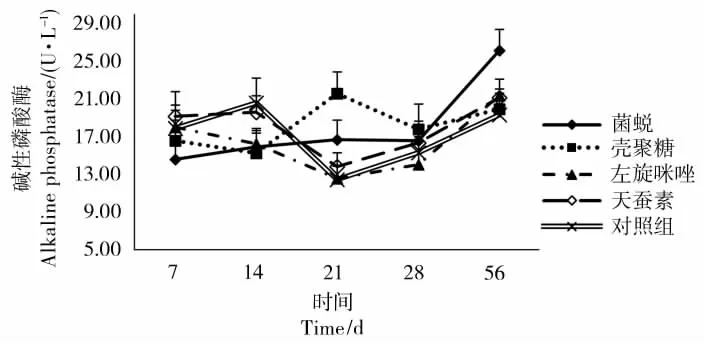
图2 免疫增强剂对血浆中ALP活性的影响Figure 2 Effect of immunostimulants on ALP in Blood Parrot

图3 免疫增强剂对血浆中LZM的影响Figure 3 Effect of immunostimulants on LZM in Blood Parrot
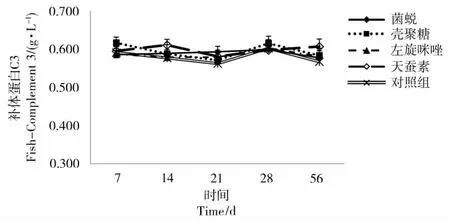
图4 免疫增强剂对血浆中补体C3水平的影响Figure 4 Effect of immunostimulants on C3 in Blood Parrot
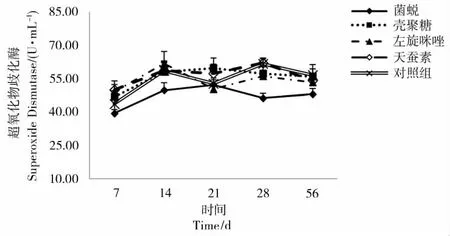
图5 免疫增强剂对血浆中SOD活性的影响Figure 5 Effect of immunostimulants on SOD in Blood Parrot
3 讨论
鱼类属于较低等的变温脊椎动物,其特异性免疫应答能力相对低下,因此,非特异性免疫在其免疫防御中具有重要意义[8-9]。本研究中的这4种免疫增强剂都能提高血鹦鹉鱼的呼吸暴发活性,其中尤以菌蜕对鱼体呼吸暴发的提高作用最为显著和持久。另外,只有菌蜕提高了鱼体LZM的活性,菌蜕和壳聚糖提高了鱼体ALP的活性。在整个实验期间,所有实验组的C3活性与对照组相比都没有显著性差异。
鱼体内存在各种具有吞噬功能的细胞,如吞噬细胞、中性粒细胞和巨噬细胞,它们能够利用活性氧来杀伤分子,将侵入机体的病原菌吞噬后,其膜内结合的NAD(P)H氧化酶可以将分子氧转化为超氧阴离子(O2-·),这个过程称之为呼吸暴发[10]。这种活性氧对于侵入机体的外来异物有很大的杀伤力,它可以独立地与其他溶酶体酶类系统发挥作用[11]。呼吸暴发活性是衡量吞噬细胞杀菌能力的一个直观指标,它与鱼类非特异性免疫能力正相关[12]。在整个实验过程中,各个实验组和对照组的呼吸暴发整体呈下降趋势,其原因目前不清楚,有待进一步研究。但是,在整体下降的过程中,菌蜕组的呼吸暴发活性在7、21、56d时显著高于对照组(P<0.05)。由于呼吸暴发是鱼体各种吞噬细胞吞噬过程的表观反应指标,其活性的增加意味着体内细胞免疫作用的增强;这与本研究中菌蜕组的LZM活性在21d时显著高于对照组(P<0.05)结果相一致;因此推测菌蜕是通过激发细胞免疫,继而激发出体液免疫因子(如LZM)的活性。壳聚糖组、左旋咪唑组和天蚕素组仅在56d显著高于对照组(P<0.05),与Lin等[13]在锦鲤中对壳聚糖的研究结果一致。整体来看,菌蜕能够明显加强机体吞噬细胞的吞噬作用,提升细胞免疫能力。
碱性磷酸酶(ALP)是一种重要的非特异性磷酸水解酶,是重要的解毒体系,并与一些营养物质的消化吸收有关[14]。鱼类血液中的碱性磷酸酶对防御外界微生物入侵有积极意义。本研究中,壳聚糖组和菌蜕组分别在21、56d时能显著增强血鹦鹉鱼血浆中ALP的活性(P<0.05),只是壳聚糖对鱼体ALP的作用早一些,而菌蜕要晚一些。壳聚糖对血鹦鹉鱼ALP的影响与仇高登[15]和刘云[16]的结果相同,仇高登发现复方乌梅壳聚糖在13~21d之间能显著提高草鱼血清碱性磷酸酶活性,刘云等用壳聚糖投喂刺参后15d的ALP活性极显著高于对照组。张梁[17]等用蛭弧菌口服免疫草鱼测定相关酶活性发现,实验组血清ALP活性在42d时显著高于对照组;且谢俊[18]等用灭活诺卡氏菌腹腔注射免疫乌鳢,6d到9d血清ALP显著升高,且均显著高于对照组;这些结果与本研究中的菌蜕结果基本一致。推测原因:鱼类肠道中存在条件致病菌和各类益生菌,曾勇[19]曾发现健康草鱼肠道中的气单胞菌能够分泌胞外酶,如淀粉酶,从而促进鱼体对营养物质的消化吸收;本研究所用即为气单胞菌的菌蜕,因此可能正是通过胞外酶促进了鱼体的ALP活性。
溶菌酶(LZM)是鱼类天然免疫系统中重要的非特异性免疫防御因子,在抵抗病原微生物感染中作用极为重要[20-22],它能破坏细菌细胞壁结构、使细菌内容物溢出,从而杀死细菌,亦可诱导其他免疫因子的合成和分泌[23-24]。目前大多数学者认为,水生动物的非特异性免疫功能中,LZM活力与免疫功能呈线性正相关[25-26]。本实验中,菌蜕组在21d LZM活性显著高于对照组(P<0.05),与A.siwicki等[27]、安利国等[28]和Ackerman等[29]一致。A.siwicki等用产碱假单胞菌(Pseudomonas alcaligenes)和点状气单胞菌(Aeromonas punctata)感染7~14d时鲤鱼血清LZM活力显著升高;安利国等用豚鼠气单胞菌灭活苗腹腔注射鲤鱼1~7d后血清LZM活性显著高于对照组;Ackerman等用微囊包裹的灭活细菌腹腔注射免疫虹鳟幼鱼,5周后LZM活性显著高于对照组。其原因可能是菌蜕能够保留完整的外膜蛋白、菌毛、脂多糖、肽聚糖等免疫刺激成分[30],能刺激吞噬细胞数量增加,提高吞噬功能,并将其释放到外周血液中,增强活化的中性粒细胞向抗原部位的迁移[27],吞噬细胞能够合成和释放出更多的LZM从而使LZM活性升高,提高了血鹦鹉鱼的免疫功能[31]。
补体系统是机体非特异性免疫的重要组成部分。补体C3是连接补体经典和旁路激活途径的枢纽,能发挥溶菌杀菌、免疫调节、免疫复合物溶解等生物学功效,对于鱼类是一种重要的防御机制[32-35]。本实验中,各实验组及对照组的补体C3活性之间无显著性差异(P>0.05),与周显青等[36]研究结果相同。周显青等发现维生素C只有在一定剂量范围内才能促进补体C3的合成,低于此范围对补体的产生无影响,高于此范围则产生抑制作用,且此剂量范围在不同动物间存在一定差异。作者认为,本实验补体C3的研究结果有可能与免疫增强剂的添加量有关。
超氧化物歧化酶(SOD)是动物机体内重要的抗氧化酶[37],是超氧自由基的天然消除剂,可以清除体内多余的自由基,使自由基的形成与消除处于一种动态平衡,从而免除自由基对生物分子的损伤。SOD活性与动物机体的免疫水平密切相关,可用它们的活性变化作为机体非特异性免疫指标。本实验中,菌蜕组的SOD活性在28d时显著低于对照组(P<0.05),与艾春香等[38]结论相同,添加VC后,河蟹不同组织中的SOD活性显著降低了。艾春香等认为这是由于VC在河蟹机体内也能很好地发挥抗氧化作用,使自由基在尚未发挥作用前就被清除了,导致诱导性酶SOD活性降低。作者认为关于水产动物机体中SOD酶活性受有关物质影响的变化结果不一。正常健康机体内自由基的形成和清除是处于一种动态平衡中,自由基不单有破坏作用,还有其对机体有利的一方面。而自由基的形成有生理性和病理性两方面,自由基的清除由小分子和大分子自由基清除剂完成[39]。菌蜕的添加有可能激发鱼体的其他自由基清除剂的产生,而导致SOD活性下降。该设想有待进一步试验验证。
[1] YANG H Y,MU X D,LUO D,et al.Sodium taurocholate,anovel effective feed-additive for promoting absorption and pigmentation ofastaxanthin in blood parrot(Cichlasoma synspilum♀×Cichlasoma citrinellum♂)[J].Aquaculture,2012(350-353):42-45.
[2] ANDERSON D P.Immunostimulants,adjuvants,and vaccine carriers in fish:Applications to aquaculture[J].Annual Review of Fish Disease,1992,2(92):281-307.
[3] 张照红,林旋,张伟妮,等.复方中草药对奥尼罗非鱼血液非特异性免疫功能的影响[J].水产科学,2011,30(1):1-5.
[4] 王国惠,陈明波,张静雯,等.免疫增强剂对鲤鱼非特异性免疫及抗病力的影响[J].科学养鱼,2014(9):67-69.
[5] VERLHAC V,OBACH A,GABAUDAN J,et al.Immunomodulation by dietary vitamin C and glucan in rainbow trout(Oncorhynchus mykiss)[J].Fish and Shellfish Immunology,1998,8(6):409-424.
[6] VILLAMIL L,FIGUERAS A,NOVOA B.Immunomodulatory effects of nisin in turbot(Scopthalmus maximus L.)[J].Fish and Shellfish Immunology,2003,14(2):157-169.
[7] ANDERSON D P,SIWICKI A K.Basic haematology and serology for fish health programs[J].Diseases in Asian Aquaculture II,1995(2):185-202.
[8] LANDOT M L.The relationship between diet and the immune response of fish[J].Aquaculture,1989,79(1-4):193-206.
[9] BERGLJOT MAGNADOTTIR.Innate immunity of fish(overview)[J].Fish and Shellfish Immunology,2006,20(2):137-151.
[10] BABIOR B M,KIPNES R S,CURNUTTE J T.Biological defense mechanisms:the production by leukocytes of superoxide,a potential bactericidal agent[J].Journal of Clinical Investigation,1973,52(3):741-744.
[11] GRANT J J,LOAKE G J.Role of reactive oxygen intermediates and cognate redox signaling in disease resistance[J].Plant Physiology,2000,124(1):21-29.
[12] GILLESPIE J P,BAILEY A M,COBB B,et al.Fungi as elicitors of insect immune responses[J].Archives of Insect Biochemistry and Physiology,2000,44(2):49-68.
[13] LIN S,MAO S,GUAN Y,et al.Effects of dietary chitosan oligosaccharides and Bacillus coagulans on the growth,innate immunity and resistance of koi(Cyprinus carpio koi)[J].Aquaculture,2012,342-343(1):36-41.
[14] ZHANG R Q,CHEN Q X,ZHENG W Z,et al.Inhibition kinetics of green crab(Scylla serrata)alkaline phosphatase activity by dithiothreitol or 2-mercaptoethanol[J].The International Journal of Biochemistry and Cell Biology,2000,32(8):865-872.
[15] 仇登高.不同免疫增强剂对鱼类免疫功能影响的研究[D].重庆:西南大学,2009:20.
[16] 刘云,孔伟丽,姜国良,等.2种免疫多糖对刺参组织主要免疫酶活性的影响[J].中国水产科学,2008,15(5):787-793.
[17] 张梁,沈建忠,敖茂权,等.蛭弧菌对草鱼免疫相关酶活性的影响[J].江西农业大学学报,2006,28(2):296-299.
[18] 解俊,彭程远,金珊,等.灭活鱼诺卡氏菌对乌鳢非特异性免疫指标的影响[J].渔业科学进展,2013,34(4):71-76.
[19] 曾勇,袁明雄.健康草鱼肠道气单胞菌季节变化及胞外酶调查[J].中国水产科学,1999,6(2):79-81.
[20] 黄旭雄,周洪琪,宋理平.急性感染对中国明对虾非特异免疫水平的影响[J].水生生物学报,2007,31(3):325-331.
[21] DUNIER M,SIWICKI A K,DEMAEL A.Effects of organophosphorus insecticides:Effects of trichlorfon and dichlorvos on the immune response of carp(Cyprinus carpio):III.In Vitro effects on lymphocyte proliferation and phagocytosis and in Vivo effects on humoralresponse[J].Ecotoxicology and Environmental Safety,1991,22(1):79-87.
[22] SIMSER J A,MACALUSO K R,MULENGA A,et al.Immuneresponsive lysozymes from hemocytes of the American dog tick,Dermacentor variabilis and an embryonic cell line of the Rocky Mountain wood tick,D.andersoni[J].Insect Biochemistry and Molecular Biology,2004,34(12):1235-1246.
[23] 汪成竹,姚鹃,吴凡,等.免疫多糖(酵母细胞壁)对中华鳖非特异性免疫功能的影响[J].华中农业大学学报,2006,25(4):421-425.
[24] BENKERROUM N.Antimicrobial activity of lysozyme with special relevance to milk[J].African Journal of Biotechnology,2008,7(25):4856-4867.
[25] 汪晓路,刘树青,张朝辉,等.多糖对中国对虾免疫功能的影响[J].中国水产科学,1999,6(1):66-68.
[26] CRONIN M A,CULLOTY S C,MULCAHY M F.Lysozyme activity and protein concentration in the haemolymph of the flat oyster Ostreaedulis(L.)[J].Fish and Shellfish Immunology,2001,11(7):611-622.
[27] SIWICKI A,STUDNICKA M.The phagocytic ability of neutrophils and serum lysozyme activity in experimentally infected carp,Cyprinuscarpio L[J].Journal of Fish Biology,1987,31(Supplement A):57-60.
[28] 安利国,冯程强,邢维贤,等.灭活疫苗对鲤鱼血清溶菌酶和腹腔吞噬细胞活性的作用[J].山东师范大学学报(自然科学版),1999,14(2):175-179.
[29] ACKERMAN P A,IWAMA G K,THORNTON J C.Physiological and immunological effects of adjuvanted Aeromonassalmonicida vaccines on juvenile rainbow trout[J].Journal of Aquatic Animal Health,2000,12(2):157-164.
[30] TIMO L,VERENA J K,ABBAS M,et al.The bacterial ghost platform system Production and applications[J].Bioengineered Bugs,2010,1(5):326-336.
[31] OLIVIER G,EVELYN TP,LALLIER R.Immunity to Aeromonassalmonicida in coho salmon(Oncorhynchus kisutch)induced by modified freund's complete adjuvant:its non-specific nature and the probable role of macrophages in the phenomenon[J].Developmental and Comparative Immunology,1985,9(3):419-432.
[32] NDONG D,CHEN Y Y,LIN Y H,et al.The immune response of tilapia Oreochromis mossambicus and its susceptibility to Streptococcus iniae under stress in low and high temperatures[J].Fish and Shellfish Immunology,2007,22(6):686-694.
[33] 王志平,张士璀,王光锋.鱼类补体系统成分及补体特异性和功能的研究进展[J].水生生物学报,2008,32(5):760-769.
[34] 汪进益,范慧敏,刘中民,等.体外循环围术期患者血浆补体C3、C4水平变化及临床意义[J].同济大学学报(医学版),2006,27(4):21-23.
[35] KATIA D R T,PANAGIOTIS A T,IOANNIS K Z,et al.Expression of the third component of complement,C3,in regenerating limb blastema cells of urodeles[J].Jounal of Immunology,1998,161(12):6819-6824.
[36] 周显青,牛翠娟,孙儒泳.维生素C和酸应激对中华鳖幼鳖血浆补体 C3和C4含量的影响[J].动物学报,2003,49(6):769-774.
[37] 林庆斌,廖升荣,熊亚红,等.超氧化物歧化酶(SOD)的研究和应用进展[J].化学世界,2006,47(6):378-381.
[38] 艾春香,陈立侨,高露姣,等.Vc对河蟹血清和组织中超氧化物歧化酶及磷酸酶活性的影响[J].台湾海峡,2002,21(4):431-43.
[39] 李文杰.超氧化物歧化酶在治疗超氧阴离子自由基所引起的疾病上的应用[J].生化药物杂志,1988(2):9-16.
Effects of Immunostimulants on Non-specific Immune Response in Blood Parrot(Cichlasoma synspilum♀×Cichlasoma citrinellum♂)
XING Wei1,JING Na1,LI Tie-liang1,LUO Lin1,YUAN Ding1,ZHOU Yun1,WANG Shu2,MA Zhi-hong1*
(1.Beijing Fisheries Research Institute,Beijing 100068,China;2.Beijing Fisheries Technical Extension Station,Beijing 100021,China)
【Objective】A feeding experiment was carried out to determine the effects of four immunostimulants including bacteria ghosts,chitosan,cecropin and levamisole on the non-specific immune response of Blood Parrot(Cichlasoma synspilum♀×Cichlasoma citrinellum♂).【Method】The experiment was consisted of five treatments and conducted in cylindrical fiberglass tanks(200 L/tank):bacteria ghosts(CLGs)group with 5%CL0901 bacteria ghost,chitosan group with 2‰ chitosan;cecropin group with 1‰cecropin;levamisole group with 0.25‰ levamisole and the control group with normal feed.Nine fish in each group were sampled for blood at 7,14,21,28 and 56 days,in order to test lysozyme(LZM)activity,superoxide dismutase(SOD)activity,alkaline phosphatase(ALP)activity,complement 3(C3)activity and respiratory burst(NBT)activity.【Results】The respiratory burst in CLGs group on 7,21,and 56d were significantly higher than the control group (P<0.05),LZM activity of CLGs group on 21d and ALP activity of CLGs group on 56d were significantly higher than the control group(P<0.05).The respiratory burst in chitosan group on 56d and ALP on 21d were significantly higher than the control group(P<0.05).The respiratory burst in cecropin group and levamisole group on 56d were significantly higher than the control group(P<0.05).【Conclusions】These results indicated that the CLGs could enhance respiratory burst,lysozyme and alkaline phosphatase of Blood Parrot.Consequently,effect of the non-specific immunity of CLGs is better than that of chitosan,cecropin and levamisole.
Blood Parrot;bacteria ghost;chitosan;cecropin;levamisole;non-specific immunity
S965.8
A
1000-2650(2017)01-0099-07
10.16036/j.issn.1000-2650.2017.01.015
2016-11-17
现代农业产业技术体系北京市观赏鱼创新团队(BAIC03-2017);北京市自然科学基金(6152006)。
邢薇,女,大学本科,工程师,主要从事水产动物营养与病害研究,E-mail:xingwei2008cool@163.com;姜娜,女,研究生,高级工程师,主要从事水产动物免疫研究,E-mail:lidiaj0@126.com。姜娜与邢薇对本研究贡献相同。*
马志宏,女,大学本科,高级工程师,主要从事水产动物病害研究与防治技术研究,E-mail:mzh255@sohu.com。
(本文审稿:耿 毅;责任编辑:秦碧雯;英文审稿:刘益平)

