DBP和BPA对MCF-7细胞的联合效应及机制
胥志祥,刘 君,罗 闹,吴昕昊,慕凯琳,潘学军 (昆明理工大学环境科学与工程学院,云南 昆明 650500)
塑料制品(如玩具制造、医疗器材和食品包装等)广泛应用于人类日常生活生产中,而邻苯二甲酸酯类化合物(PAEs)和双酚 A(BPA)则常用于聚碳酸酯塑料制品的工业生产.邻苯二甲酸二丁酯(DBP)作为一种增塑剂,在医疗用品和化妆品中普遍存在,由于其潜在的危害已被美国、欧盟以及中国列入优先控制的污染物名单[1-2].DBP和BPA广泛存在于水体、土壤及沉积物等环境介质中[1],其中DBP在我国长江、珠江等自然水体中普遍检出,且其浓度高达 9.48~218.8μg/L[3].课题组前期研究也表明BPA是滇池流域环境介质中普遍存在的烷基酚类内分泌干扰物(EDCs)之一,其在滇池地表水、表层沉积物、环滇河流、污水处理厂进水和滇池特有鱼类高背鲫鱼中的平均浓度分别为 71.25~366.45ng/L、2.33~132.48ng/g dw、35.28~1080.97ng/L、458.58~1324.66ng/L 和 10.1~83.5ng/g dw[4].然而,传统的生物处理并不能完全将其有效去除,并通过直接作用或生物富集进入生物体内,最终引起多种组织和器官的毒性反应[5-7].由于长期暴露于环境中,DBP和BPA在人体组织和体液中也被广泛检出,主要包括尿液、血液、母乳及孕期胎盘组织和羊水等,其浓度范围为几至几十纳摩尔[8-9].近期研究发现PAEs和BPA表现出类似的内分泌干扰效应和毒性效应,如肝脏毒性、生殖毒性、神经毒性及致癌性等[10-12].DBP和BPA作为两种典型外源雌激素(XEs),其可通过基因组途径和非基因组途径,诱发多种癌症的发生[13-14].然而,不同 XEs所产生影响的性质、程度和信号通路方式等都可能不同,因此关于DBP和BPA不同暴露浓度下的联合效应有待开展进一步的研究.常用的毒性评价方法包括动物模型和体外模型两种,相比于动物模型,体外研究中的细胞培养实验具有高通量、低成本的优点,并可通过研究化合物诱导下细胞的增殖情况研究其雌激素效应[15].
基于此,本研究选取经典乳腺癌细胞系MCF-7为研究对象,探讨DBP和BPA单一和联合作用下的雌激素效应和毒性效应,并从细胞周期、细胞凋亡、活性氧自由基(ROS)产生以及雌激素受体(ER)表达等分子层面探讨其可能的效应机制,以期为环境中两种XEs复合污染下的潜在环境健康风险评估和预防提供理论指导.
1 材料与方法
1.1 实验试剂与仪器设备
实验试剂:DBP、BPA 标准品(分析纯,Sigma-Aldrich);胎牛血清(FBS)、含酚红 RPMI 1640培养基、无酚红RPMI 1640培养基、PBS
缓冲溶液(Gibco);去激素胎牛血清(CD-FBS,Gemini Bio-products);青霉素-链霉素双抗、胰酶细胞消化液、MTT细胞增殖及细胞毒性试剂盒、ROS试剂盒、细胞周期和细胞凋亡试剂盒(Beyotime).RNA 提取试剂盒(RNAiso Plus)、反转录试剂盒(PrimeScriptTM RT Reagent Kit with gDNA Eraser)和荧光染料试剂盒(SYBR®Premix Ex TaqTM Ⅱ)均购于Takara公司.
仪器设备:细胞培养箱(Cell Culture, ESCO);生物安全柜(Airstream A2型II级, ESCO);倒置荧光显微镜(IX73, OLYMPUS);酶标仪(SpectraMax M5, Molecular Devices);微量紫外可见分光光度计(NanoDrop 1000, NanoDrop);流式细胞仪(Guava easyCyte 6HT-2L, Merck Millipore);实时荧光定量 PCR仪(StepOnePlus, Thermo Fisher Scientific).
1.2 实验方法
1.2.1 细胞培养 MCF-7细胞购自中国科学院上海生命科学研究院生物化学和细胞生物学研究所,并使用含酚红 RPMI 1640完全培养液(含10% FBS、1% 青霉素-链霉素),置于37℃、5%CO2培养箱中传代培养.为了消除内源雌激素对细胞生长的影响,待细胞融合度>70%,换为无酚红RPMI 1640培养液(含10% CD-FBS、1% 青霉素-链霉素)去激素培养 48h后用于后续研究.实验用细胞均处于对数生长期,且整个实验过程中细胞代数<20代[16].
1.2.2 溶液配制 分别称取一定量的 DBP和BPA标准品并溶于DMSO中,配置成0.1mol/L储备液于-20℃低温、避光保存,临用前使用无酚红RPMI 1640培养液(含5% CD-FBS)稀释至实验所需浓度,并保证DMSO浓度小于0.1%[17].
1.2.3 细胞活力检测 研究采用 MTT试剂盒测定不同浓度DBP和BPA,单一或联合刺激不同时间的细胞活力.取对数生长期 MCF-7细胞,采用 0.25%胰酶消化液消化后,以 10000/孔的细胞密度接种到96孔细胞培养板中,并设置空白组、溶剂对照组和样品处理组,每组设置5个复孔.细胞贴壁培养24h后,小心吸取上清液并使用PBS清洗孔板,于每孔分别加入 200μL含不同浓度DBP 和 BPA(10-9~10-4mol/L)的培养液;分别刺激24,48,72h后加入含MTT A液的细胞培养液并继续培养4h;培养结束后,吸取孔内MTT A液,并加入150μL MTT B液,充分溶解后使用酶标仪测定570nm下的OD值,其可间接反映活细胞数量.在单一刺激的基础上,选取优化后的细胞活力时间和物质浓度,开展其联合效应研究.细胞活力(CA)= (OD处理组—OD空白)/(OD对照组—OD空白) × 100%[18].
1.2.4 活性氧自由基测定 取对数生长期的细胞,以 5×104/孔的密度接种至 24 孔培养板贴壁培养 24h后加药(同 1.2.3)处理 48h,每组设置3个复孔,移除细胞培养液并加入按照1:1000用无血清培养液稀释后的浓度为 10μmol/L的DCFH- DA 荧光探针,置于细胞培养箱内 37℃避光孵育 30min.用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA 探针,在酶标仪下使用 488nm 波长激发,检测525nm处发射的荧光强度,并根据荧光强度确定细胞内ROS水平.
1.2.5 细胞周期和凋亡测定 取对数生长期细胞,以3×105/孔的密度接种至6 孔培养板贴壁培养24h, 加药(同1.2.3)处理48h,每组设置3个复孔,然后分别采用细胞周期(PI单染)和细胞凋亡(PI, Annexin V-FITC双染)试剂盒,并按照试剂盒说明书操作,使用流式细胞仪测定细胞周期分布和细胞凋亡情况.其中细胞周期分为 Sub-G0、G0/G1、S和G2/M,细胞增殖指数(PI)= S+G2/M;细胞凋亡包括早期凋亡(Annexin V-FITC(+),PI(-))和晚期凋亡(Annexin V-FITC(+), PI(+)).
1.2.6 RT-QPCR测定细胞内受体表达 雌激素核受体(ERα和ERβ)和G蛋白偶联雌激素受体(GPR30) mRNA转录水平采用RT-QPCR进行分析.细胞加药(同 1.2.3)处理后,采用 RNA 提取试剂盒提取细胞RNA并测定其浓度;取1 μg RNA样品,并使用反转录试剂盒,于冰上配置反转录试剂,混合均匀后进行反转录反应合成 cDNA;采用荧光染料试剂盒,使用 StepOnePlus荧光定量PCR进行mRNA的测定,每个样本组设置3个平行样.RT-QPCR 反应条件为:(1)预变性: 95℃,30s,1个循环;(2)PCR反应:95 ℃, 5s→60 ℃, 30s,40个循环 ;(3)溶 解 曲 线 :95℃ ,5s→60℃ ,1min,1个 循环.mRNA 表达水平采用 R=2-ΔΔCt公式计算[19],其中ΔΔCt =(Ct, target—Ct, β-actin)处理组—(Ct,target—Ct, β-actin)对照组.目的基因(ERα、ERβ 和GPR30)和内参基因(β-actin)引物如表1所示.

表1 RT-QPCR引物系列Table 1 Primer series used in RT-QPCR
1.2.7 数据处理 实验数据采用平均值±标准误差表示,采用SPSS 18.0统计分析软件进行单因素方差分析(ANOVA),采用 Tukey法进行多重比较,P<0.05表示具有显著性差异,用Origin 9.0绘图.
2 结果与分析
2.1 细胞形态变化观察

图1 DBP和BPA暴露诱导MCF-7细胞形态变化(×100)Fig.1 Morphological changes of MCF-7cells treated with DBP and BPA
如图1所示,在低浓度 DBP和 BPA刺激下,MCF-7细胞形态并未发生变化,但随着刺激时间的增加,细胞密度也相应增大,间接反映低浓度 DBP和 BPA可促进细胞增殖.而在高浓度(10-4mol/L)刺激下细胞形态发生了相应的变化,主要表现为:细胞处理 24h后细胞未完全伸展开且细胞间隙增大、细胞出现皱缩,培养 72h后细胞贴壁率严重降低、部分细胞膜结构被破坏、细胞大量皱缩.
2.2 DBP和BPA对MCF-7细胞活力的影响
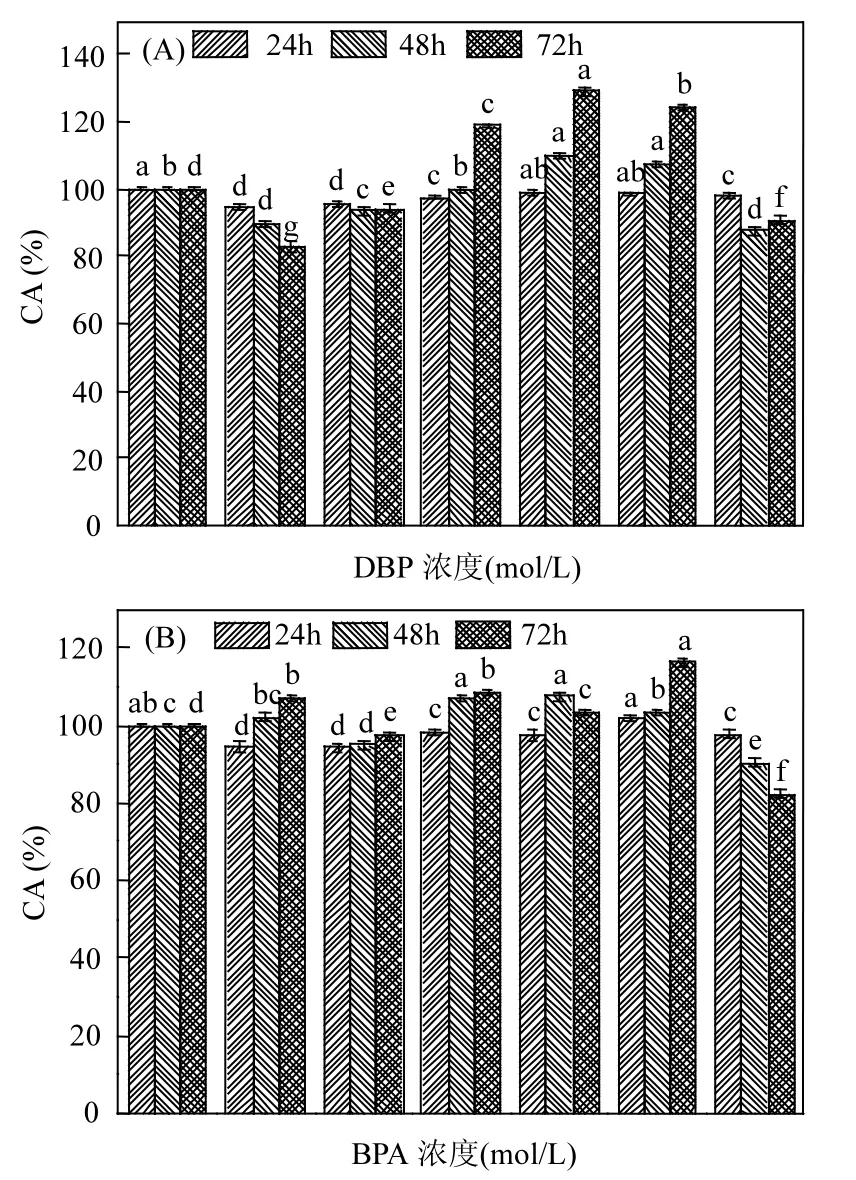
图2 DBP(A)和BPA(B)单一暴露对MCF-7细胞活力的影响Fig.2 Individual effects of DBP (A) and BPA (B) on cell activity of MCF-7
DBP和BPA对MCF-7细胞活力的影响如图2和图3所示,DBP和BPA可引起MCF-7细胞不同程度的增殖(毒性)效应.对于单一暴露,如图2所示,随着DBP和BPA刺激浓度的增加,细胞活力呈现“倒 U”型,即随浓度的增加,细胞活力先增后减,并分别在浓度为10-6,10-7mol/L时其细胞活力最大,随后其促增殖效应降低,并均在 10-4mol/L时抑制细胞增殖.为此,分别选取 DBP(10-6,10-4mol/L)和BPA(10-7,10-4mol/L)开展后续实验.
除此之外,细胞活力也呈现时间依赖性.总体上,随着暴露时间的增加,溶剂对照组和加药组的OD570均呈现逐渐增加的趋势,DBP和BPA分别遵循72h>48h>24h和72h≈48h>24h的规律.DBP和BPA作用于MCF-7细胞24h并未出现增殖效应;当作用 48h时除个别剂量外均表现为增殖效应,DBP和 BPA分别在浓度为 10-6mol/L和10-7mol/L时其增殖效应最强;随着暴露时间的延长,其累积效应越来越明显.相对而言,DBP的整体增殖效应较 BPA 强.综合考虑,后续实验选取48h为最优刺激时间.
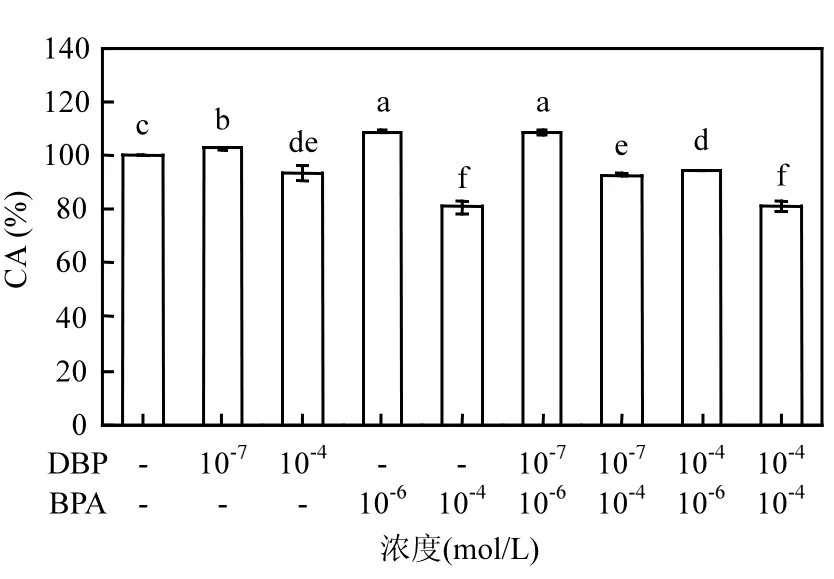
图3 DBP和BPA联合暴露对MCF-7细胞活力的影响Fig.3 Combined effects of DBP and BPA on cell viability of MCF-7
DBP和BPA联合暴露对MCF-7细胞的增殖效应如图3所示.效应叠加法(ES)是最常用联合效应评估模型,其多用于评估多种XEs联合暴露下的综合效应[20].效应叠加指数(ESI)为联合暴露效应与单一暴露效应均值的比值,其中 ESI=1,ESI>1和ESI<1分别表示联合效应为加和、协同和拮抗.通过计算可得:ESIBPA(-7)+DBP(-6)、ESIBPA(-7)+DBP(-4)、 ESIBPA(-4)+DBP(-6)、ESIBPA(-4)+DBP(-4)分别为 1.0279±0.0156、1.0140±0.0119、0.9340±0.0174、0.9312±0.0238,由此可推断低浓度BPA联合DBP暴露,其刺激作用表现为加和作用;高浓度BPA联合DBP暴露,其刺激作用表现为拮抗作用.
2.3 DBP和BPA对MCF-7细胞ROS的影响
如图4所示,药物刺激48h后,对于单一暴露,低浓度DBP和BPA暴露抑制ROS产生但与对照组无显著差异,而高浓度暴露则显著诱导ROS的生成.对于联合暴露,低浓度联合暴露相对于低浓度单一暴露,ROS生成有一定增加,但差异性不显著;低浓度+高浓度联合暴露相对于低浓度单一暴露无显著差异,而相对于高浓度单一暴露其ROS生成则受到明显抑制;高浓度联合暴露能显著诱导ROS的生成,但相对于单一暴露其ROS生成有所降低,间接表明高浓度DBP和BPA联合暴露表现为拮抗作用.

图4 DBP和BPA暴露对MCF-7细胞ROS生成的影响Fig.4 ROS formation in MCF-7cells treated with DBP and BPA
2.4 DBP和BPA对MCF-7细胞周期阻滞的影响
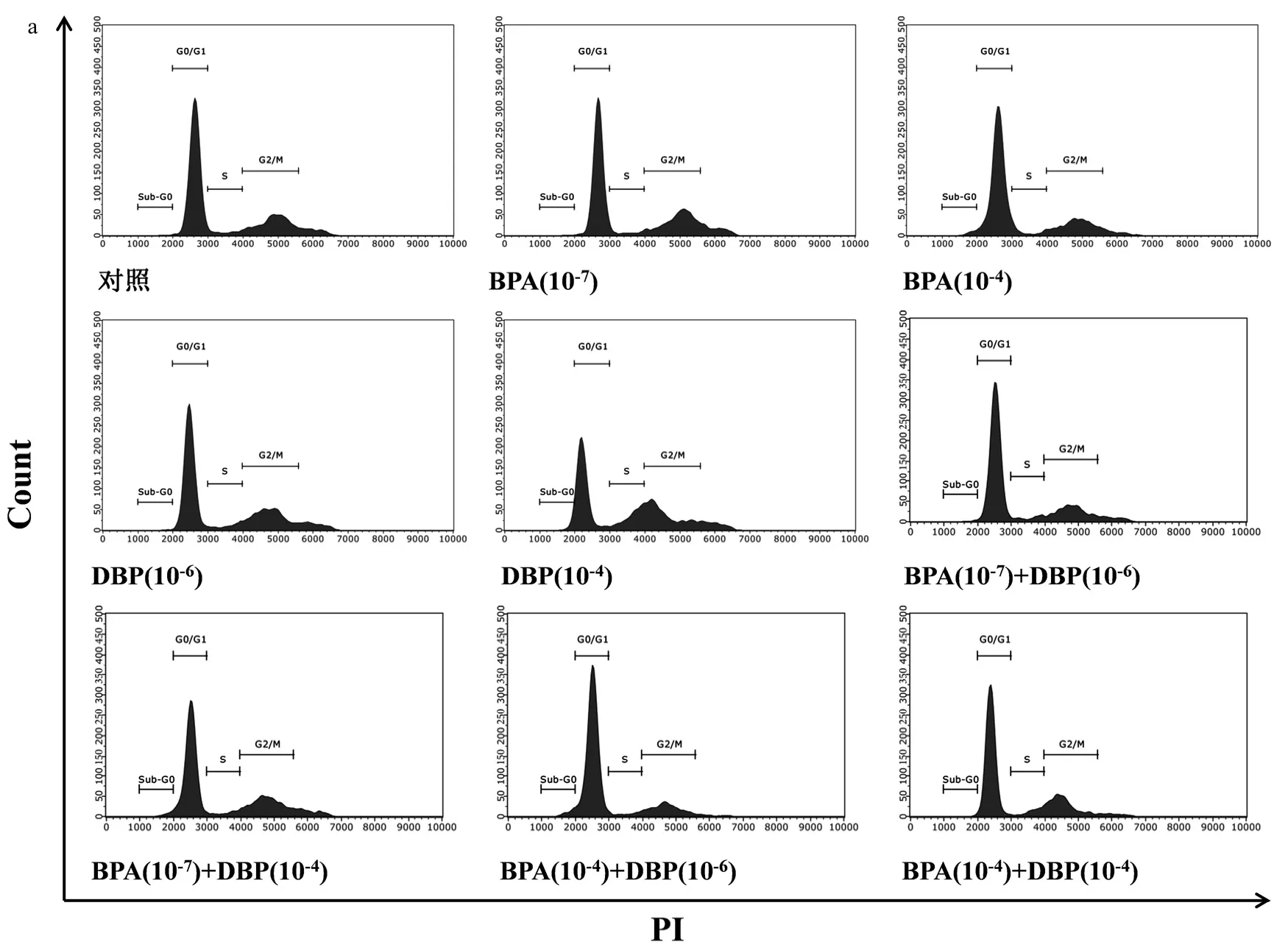
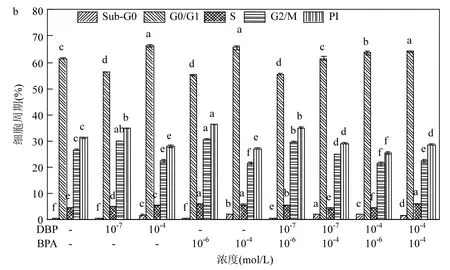
图5 DBP和BPA暴露对MCF-7细胞周期分布的影响Fig.5 Cell cycle distribution in MCF-7cells treated with DBP and BPA
如图5所示,对于单一暴露,低浓度 DBP和BPA刺激下,MCF-7细胞S期和G2/M期细胞分布比例明显高于对照组,表明低浓度暴露可促使细胞由G0/G1期向S期推进,促进细胞DNA的合成;高浓度DBP和BPA刺激时,细胞周期阻滞于G0/G1期,而G2/M期细胞比例低于对照组,从而抑制细胞 DNA的合成.对于联合暴露,相比于单一暴露,低浓度联合暴露 G2/M 期细胞比例显著增高,而高浓度联合暴露细胞周期被阻滞于G0/G1期,与单一暴露和对照组均具有显著差异.细胞增殖指数结果再次表明,DBP和BPA联合暴露在低浓度下对细胞周期调节表现为加和作用,而在高浓度下则表现为拮抗作用.
2.5 DBP和BPA对MCF-7细胞凋亡的影响


图6 DBP和BPA暴露对MCF-7细胞凋亡的影响Fig.6 Cell apoptosis in MCF-7cells treated with DBP and BPA
如图6所示,对于单一暴露,低浓度 DBP和BPA刺激下,凋亡细胞比例与对照组相比具有统计学差异性,表明其可抑制细胞凋亡;高浓度暴露则可诱导细胞凋亡,且主要以诱导细胞早期凋亡为主.对于联合暴露,相比于单一暴露,低浓度联合暴露也能抑制细胞早期凋亡并与对照组具有统计学差异,但与单一暴露相比差异性不显著;低浓度+高浓度联合暴露可诱导细胞凋亡并与对照组相比具有统计学差异,相对于单一高剂量暴露,其早期凋亡比例有所下降但差异性不显著;高浓度联合暴露也明显诱导细胞凋亡,相对于单一高剂量暴露,其诱导凋亡的比例有所降低,表明高浓度DBP和BPA对细胞凋亡也表现为拮抗作用.然而,高浓度联合暴露时细胞坏死也明显增多,这与前文细胞形态观察结果具有一致性.
2.6 DBP和 BPA对 MCF-7细胞雌激素受体mRNA转录的影响
如图7所示,无论是单一暴露还是联合暴露,低浓度 DBP和 BPA可诱导 ERα和 GPR30 mRNA 转录,而高浓度暴露则可抑制 ERα mRNA转录.然而,DBP和BPA对ERβ mRNA的转录无显著差异性.DBP和 BPA低浓度联合暴露诱导ERα和GPR30mRNA转录表现为加和作用,而高浓度联合暴露抑制 ERα mRNA转录则表现为拮抗作用.
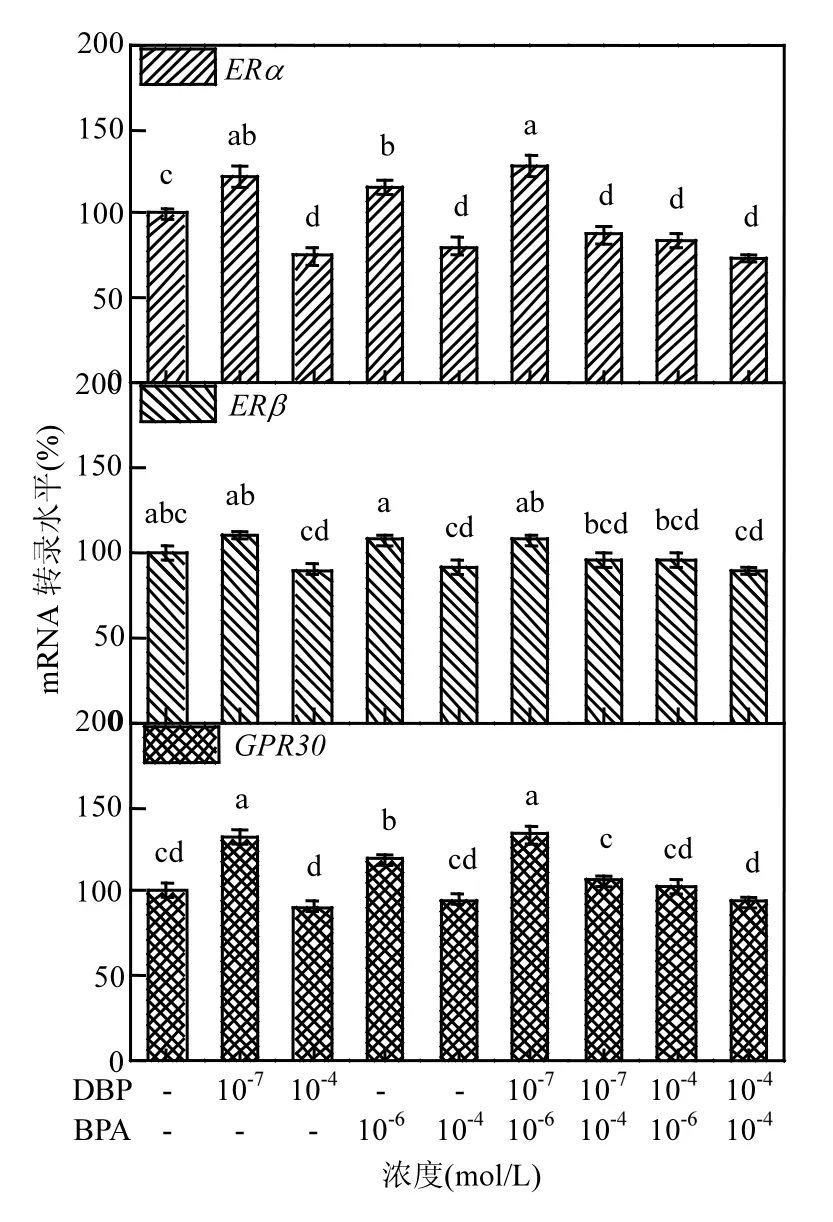
图7 DBP和BPA暴露对MCF-7细胞ERα、ERβ和GPR30 mRNA转录的影响Fig.7 mRNA transcription levels of ERα, ERβ and GPR30 in MCF-7cells treated with DBP and BPA
3 讨论
传统毒理学研究认为,污染物达到一定暴露剂量即可对生物体产生毒性效应,而低于安全阈值则不具有相应的毒性;EDCs作为一类典型的污染物,其在低浓度下能产生内分泌干扰效应[21].大多数 EDCs具有雌激素活性,因此也被称为XEs. XEs可通过ER信号通路发挥雌激素效应,而 MCF-7对雌激素活性物质较为敏感,为此MCF-7细胞增殖试验模型常用于外源物质的雌激素活性评价[15].DBP和BPA作为2种典型的XEs,在塑料制品的生产和使用过程中被释放到环境中,并在不同环境介质中迁移和转化,最终可能通过生物途径或非生物途径进入生物体内,因此存在不可忽视的健康风险.本研究 MTT实验结果发现DBP和BPA在低浓度下促进MCF-7细胞增殖,而在高浓度下则表现为抑制细胞增殖的毒性效应,并且随浓度的升高,其增殖率或抑制率也相应的增加,总体呈现“倒U”型剂量-效应关系,这与其他研究结果类似[22-23].与对照组相比,生理浓度 BPA刺激下,MCF-7细胞的增殖无显著性差异,其他研究也得出类似结果[24],但这与部分研究中生理浓度BPA刺激细胞增殖存在出入[25].本研究中BPA在浓度为10-7mol/L时增殖效应最强,而其他研究发现 BPA在浓度为10-5mol/L时增殖效应最强[22,26],这可能是细胞培养条件和时间不同,或细胞在长期培养过程中细胞内雌激素受体缺失引起的细胞本身差异所致.本研究中DBP在浓度为10-6mol/L时其促增殖效应最强并与 10-5mol/L下的细胞活力差不多,这与Kim等[27]研究发现,DBP在浓度为10-5mol/L能显著促进细胞增殖具有相似性.
另外,细胞活力表现出时间依赖性.对于DBP,即无论是低浓度下的细胞增殖效应,或是高浓度下的细胞毒性效应,其效应均表现为72h>48h>24h. Chen 等[23]研究表明,在 DBP 刺激下,细胞增殖效应表现为 48h>72h>24h,这可能由于细胞培养方式差异性所致,即本研究在整个实验研究过程中均使用含CD-FBS的培养基,为细胞生长提供了必须的营养元素,而 Chen等[23]的研究在加药处理前对细胞进行了无血清饥饿处理.对于 BPA,其增殖效应表现为 72h≈48h>24h,与DBP的刺激结果存在一定差异.
在单一细胞活力的基础上,深入探讨DBP和BPA复合污染下的联合效应更具有指导意义.在不同环境体系中,2种XEs的浓度配比不同,为此研究分别选取了 2种浓度下的 DBP (10-6和10-4mol/L)和 BPA (10-7和 10-4mol/L),研究采用ESI法分析了DBP和BPA的联合作用方式,结果表明低浓度联合暴露下其刺激作用表现为加和作用,而高浓度联合暴露下其抑制作用表现为拮抗作用;Christen等[17]以MDA-kb2细胞为研究模型,并指出DBP和BPA具有抗雄激素作用,其在低剂量时表现为拮抗效应,但在高剂量时却表现为协同效应,产生这一不同结果的原因可能是细胞、组织差异性所致.
MTT细胞活力只能从宏观层面描述外源暴露对 MCF-7细胞的增殖活性,而不能深层次阐述其(抗)增殖的根本原因.因此,本研究在细胞活力的基础上,从ROS生成、细胞周期分布和细胞凋亡调节等分子层面探讨其促进增殖/诱导凋亡的本质原因所在.ROS作为细胞内第二信使,可通过DNA损伤、癌基因及周期调节蛋白表达诱导等方式刺激/抑制细胞增殖[28].大量研究表明内源性雌激素或外源雌激素活性物质暴露可诱导 ROS生成,并最终调节细胞增殖/凋亡过程[29-30].本研究中,低浓度DBP和BPA可促进细胞增殖但其ROS生成无统计学差异性,而高浓度暴露则显著诱导ROS生成并最终抑制细胞增殖,导致这种结果的原因可能是高浓度暴露产生更多的ROS,可能引起DNA损伤或诱导细胞凋亡/坏死,从而产生增殖毒性[30].另外,XEs还可通过改变周期和凋亡相关基因(如CDKs、Cyclin D1、Bcl-2、Bax等)转录调节细胞增殖.Lee等[26]研究表明BPA可诱导Cyclin D1表达而抑制P21表达,促进细胞周期由G0/G1期向S期转化,最终诱导MCF-7细胞增殖.本研究中,低浓度DBP和BPA暴露下,细胞周期由G0/G1期向S期和G2/M期推进,从而诱导细胞增殖,高浓度暴露下细胞周期则被阻滞于G0/G1期,这和Lee等的研究结果有相似性.除此之外,Kim 等[27]研究发现 DBP可显著促进 MCF-7增殖,并且能通过增加胞内Bcl-2/Bax比例来抑制TAM诱导的凋亡.本研究中,低浓度DBP和BPA刺激下,凋亡细胞相对于对照组有所降低;高浓度暴露则可诱导细胞凋亡,且以诱导细胞早期凋亡为主.
由于BPA在化学结构上与内源雌激素雌二醇(E2)类似,故可干扰多重内分泌相关途径,诱导各种疾病的发生和发展[11].Singh等[10]研究发现PAEs和BPA可同时与影响体内89种基因/蛋白结合,诱导相关生理效应,其中就包括了两种经典核雌激素受体ERα和ERβ. ERα作为一种转录激活因子,可通过调节胞内细胞周期因子或其他生长因子影响细胞增殖,在乳腺癌的发生、发展中起着重要作用[26,31].不同类型的XEs与ER的亲和力具有很大差异,且 ERα的促增殖效应可被ERβ拮抗,最终调节细胞的增殖效应[14].BPA 和DBP作为ERα/β的激动剂,其可通过与受体结合发挥雌激素效应,但两者的活性 BPA>DBP[9].本研究RT-QRCR结果发现高浓度DBP和BPA均可抑制ERα mRNA水平的转录,而低浓度暴露则可促进 ERα mRNA 转录;然而,DBP和 BPA 对ERβ mRNA转录无显著影响.同时,低浓度XEs能通过GPR30激活非基因组途径,诱导基因表达和细胞增殖[32].本研究也指出低浓度 DBP和 BPA可诱导GPR30mRNA的转录.Lillo等[24]研究也表明,尽管生理浓度下(10-8mol/L)的BPA不能明显诱导MCF-7细胞增殖和雌激素效应基因的表达,但其可通过膜受体信号通路直接调节 SOX2转录活性以增强肿瘤干细胞样细胞活性,从而维持癌症的发展.Chen等[23]研究发现低浓度 DBP(10-8mol/L)可显著诱导 p-ERα的表达而降低ERβ的表达,最终促进 MCF-7细胞的增殖.Song等[33]表明10-8mol/L浓度的BPA可通过ERK1/2/ERRγ通路诱导MCF-7细胞增殖.Lei等[30]研究指出低剂量BPA衍生物硫代二苯酚(TDP)通过ERα和 GPR30信号通路之间的串扰作用增加胞内ROS和Ca2+水平,激活PI3K/AKT和ERK信号通路,最终诱导MCF-7细胞增殖.为此,关于经典雌激素核受体和膜受体的交互作用在 XEs诱导细胞雌激素效应方面有待进一步研究.
本研究采用体外模型研究了 DBP和 BPA的联合效应,这为开展多种 XEs在不同浓度联合暴露产生的效应研究提供了指导.然而,环境介质中同时存在多种酞酸酯类和烷基酚类XEs,其可能通过不同的作用模式(相加、协同和拮抗)发挥相应的生物效应.此外,XEs在生命活动代谢过程中,会产生各种不同活性的代谢中间产物,这些代谢产物的生物效应也有待开展进一步研究,然而体外研究模型则很难模拟 XEs在生物体内的这一复杂生物效应.为此,今后的研究应将体外模型和体内实验相结合,开展多种XEs的综合效应研究,以便更好地为环境生态风险评估和预防提供指导.
4 结论
4.1 对于单一暴露,低浓度DBP和BPA可促进MCF-7细胞增殖,而高浓度DBP和BPA则诱导细胞凋亡.
4.2 对于联合暴露,DBP和BPA低浓度下其联合作用模式表现为加和作用,而在高浓度下表现为拮抗作用.
4.3 低浓度DBP和BPA单一或联合暴露促进细胞增殖,其与推进细胞周期从G0/G1期向S期、G2/M期转化,以及诱导ERα和GPR30表达相关.
4.4 高浓度DBP和BPA单一或联合暴露可通过ROS增加、G0/G1期阻滞、细胞早期凋亡增加和ERα mRNA转录抑制等方式诱导细胞凋亡.
[1] Zhang Y, Liang Q, Gao R, et al. Contamination of phthalate esters(PAEs) in typical wastewater-irrigated agricultural soils in Hebei,North China [J]. PLoS One, 2015,10(9):e0137998.
[2] 周文敏,傅德黔,孙宗光.水中优先控制污染物黑名单 [J]. 中国环境监测, 1990,64(4):1-3.
[3] 陈济安,邱志群,舒为群,等.我国水环境中邻苯二甲酸酯污染现状及其生物降解研究进展 [J]. 癌变⋅畸变⋅突变, 2007,19(3):212-214.
[4] 王 彬.酚类环境内分泌干扰物分析方法及滇池水系污染特征研究 [D]. 昆明:昆明理工大学, 2012.
[5] Wormuth M, Scheringer M, Vollenweider M, et al. What are the sources of exposure to eight frequently used phthalic acid estersin Europeans? [J]. Risk Analysis, 2006,26(3):803-824.
[6] Liu J, Wang R, Huang B, et al. Biological effects and bioaccumulation of steroidal and phenolic endocrine disrupting chemicals in high-back crucian carp exposed to wastewater treatment plant effluents [J].Environmental Pollution, 2012,162:325-331.
[7] 周林军,古 文,刘济宁,等.11种邻苯二甲酸酯在好氧污水处理系统中的归趋 [J]. 环境科学, 2017,38(5):1972-1981.
[8] Vandenberg L N, Hauser R, Marcus M, et al. Human exposure to bisphenol A (BPA) [J]. Reproductive Toxicology, 2007,24(2):139-177.
[9] Högberg J, Hanberg A, Berglund M, et al. Phthalate diesters and their metabolites in human breast milk, blood or serum, and urine as biomarkers of exposure in vulnerable populations [J].Environmental Health Perspectives, 2008,116(3):334-339.
[10] Singh S, Li S S-L. Bisphenol A and phthalates exhibit similar toxicogenomics and health effects [J]. Gene, 2012,494(1):85-91.
[11] Rezg R, El-Fazaa S, Gharbi N, et al. Bisphenol A and human chronic diseases: current evidences, possible mechanisms, and future perspectives [J]. Environment International, 2014,64:83-90.
[12] Yolton K, Xu Y y, Strauss D, et al. Prenatal exposure to bisphenol A and phthalates and infant neurobehavior [J]. Neurotoxicology and Teratology, 2011,33(5):558-566.
[13] Alonso-Magdalena P, Ropero A B, Soriano S, et al. Bisphenol-A acts as a potent estrogen via non-classical estrogen triggered pathways [J]. Molecular and Cellular Endocrinology, 2012,355(2)201-207.
[14] Xu Z X, Liu J, Gu L P, et al. Biological effects of xenoestrogens and the functional mechanisms via genomic and nongenomic pathways [J]. Environmental Reviews, 2017,25(3):306-322.
[15] Xu Z X, Liu J, Wu X H, et al. Nonmonotonic responses to low doses of xenoestrogens:A review [J]. Environmental Research,2017,155:199-207.
[16] Potratz S, Tarnow P, Jungnickel H, et al. Combination of metabolomics with cellular assays reveals new biomarkers and mechanistic insights on xenoestrogenic exposures in MCF-7cells[J]. Chemical Research in Toxicology, 2017,30(4):883-892.
[17] Christen V, Crettaz P, Oberli-Schrammli P, et al. Antiandrogenic activity of phthalate mixtures: validity of concentration addition [J].Toxicology and Applied Pharmacology, 2012,259(2):169-176.
[18] Zhong H, Ding Q, Chen W, et al. Vorinostat, a HDAC inhibitor,showed anti-osteoarthritic activities through inhibition of iNOS and MMP expression, p38and ERK phosphorylation and blocking NF-κB nuclear translocation [J]. International Immunopharmacology,2013,17(2):329-335.
[19] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2- ΔΔCT method[J]. Methods, 2001,25(4):402-408.
[20] Kortenkamp A, Altenburger R. Synergisms with mixtures of xenoestrogens: A reevaluation using the method of isoboles [J].Science of the Total Environment, 1998,221(1):59-73.
[21] 刘 君,胥志祥,黄 斌,等.外源雌激素的低剂量非线性效应研究进展 [J]. 生态学杂志, 2015,34(9):2673-2680.
[22] 文 育,雷炳莉,康 佳,等.双酚 A 类同系物的雌激素效应及对MCF-7细胞的毒性 [J]. 上海大学学报, 2015,21(4):515-524.
[23] Chen F P, Chien M H. Lower concentrations of phthalates induce proliferation in human breast cancer cells [J]. Climacteric, 2014,17(4):377-384.
[24] Lillo M A, Nichols C, Seagroves T N, et al. Bisphenol A induces Sox2in ER+ breast cancer stem-like cells [J]. Hormones and Cancer, 2017,8(2):90-99.
[25] 卫 立,王 斌,刘树深,等.低剂量双酚 A 与 17β 雌二醇对MCF-7细胞增殖作用的剂量效应关系及其联合作用探索 [J].环境科学学报, 2006,26(6):968-972.
[26] Lee H R, Hwang K A, Park M A, et al. Treatment with bisphenol A and methoxychlor results in the growth of human breast cancer cells and alteration of the expression of cell cycle-related genes,cyclin D1and p21, via an estrogen receptor-dependent signaling pathway [J]. International Journal of Molecular Medicine, 2012,29(5):883-890.
[27] Kim I Y, Han S Y, Moon A. Phthalates inhibit tamoxifen-induced apoptosis in MCF-7human breast cancer cells [J]. Journal of Toxicology and Environmental Health, Part A, 2004,67(23/24):2025-2035.
[28] Ruiz-Ramos R, Lopez-Carrillo L, Rios-Perez A D, et al. Sodium arsenite induces ROS generation, DNA oxidative damage, HO-1 and c-Myc proteins, NF-κB activation and cell proliferation in human breast cancer MCF-7cells [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2009,674(1/2):109-115.
[29] Rishi A, Mahalingaiah P K S, Singh K P. Chronic oxidative stress increases growth and tumorigenic potential of MCF-7breast cancer cells [J]. PLoS One, 2014,9(1):e87371.
[30] Lei B, Peng W, Xu G, et al. Activation of G protein-coupled receptor 30by thiodiphenol promotes proliferation of estrogen receptor alpha-positive breast cancer cells [J]. Chemosphere,2017,169:204-211.
[31] Moghadam S J, Hanks A M, Keyomarsi K. Breaking the cycle:An insight into the role of ERα in eukaryotic cell cycles [J].Journal of Carcinogenesis, 2011,10(1):25.
[32] Pupo M, Pisano A, Lappano R, et al. Bisphenol A induces gene expression changes and proliferative effects through GPER in breast cancer cells and cancer-associated fibroblasts [J].Environmental Health Perspectives, 2012,120(8):1177-1182.
[33] Song H, Zhang T, Yang P, et al. Low doses of bisphenol A stimulate the proliferation of breast cancer cells via ERK1/2/ERRγ signals [J]. Toxicology in Vitro, 2015,30(1):521-528.

