Anammox菌干粉菌剂制备与保藏技术
张 千,徐晓晨,王 超,王晓静,杨凤林 (大连理工大学环境学院,工业生态与环境工程教育部重点实验室,辽宁 大连 116024)
与传统的脱氮工艺相比,厌氧氨氧化工艺具有不需添加有机碳源、不需曝气、剩余污泥量小、节省成本的优点,已逐渐被应用到废水脱氮领域中[1].但因厌氧氨氧化(anammox)菌倍增时间长(约 10.5d),增长缓慢,纯种培养难以进行,导致应用于实际废水处理启动周期过长.世界上第一个工业化厌氧氨氧化工艺处理氨氮废水装置用时长达3.5a之久[2].因此培养保藏厌氧氨氧化菌,建立菌种储库,为污水处理应用提供足够量的菌种成为工业化规模应用的关键.
菌种保藏的方法主要有液体石蜡法、沙土保藏法、液氮法、冷藏法、冷冻法、冻干法及凝胶包埋法等[3].这些保藏方法的原理主要是根据微生物的生理生化特点,人为创造低温、干燥或缺氧条件,抑制微生物的代谢作用,使其生命活动降至最低程度或处于休眠状态,使菌株很少发生突变,以达到保持纯种的目的[4].
目前,厌氧氨氧化菌种保藏的方法集中于冷藏法、冷冻法及冻干法[5],同时添加低温保护剂(如二甲亚砜、海藻糖、甘油、葡萄糖、聚乙烯醇、海藻酸钠等)、保藏基质(NH4+-N、NO2--N 等)或缓冲液(钼酸盐、NO3--N 等)[6-13].但冷藏法保藏效果较差,菌体死亡率较高;冷冻法和冻干法设备成本高且操作繁琐,同时不利于大规模的工业化应用.因此对于anammox菌的保藏仍未得到一种经济、有效、简单的方法来应用到实践中,仍需对anammox菌的保藏技术进行深一步的探索与研究.
本研究首次提出采用高温法对anammox进行干法保藏,通过真空干燥法对anammox菌进行干燥,并对聚乙烯醇(PVA)、羧甲基纤维素钠(CMC)、海藻酸钠(SA)、海藻糖和去离子水五种烘干保护剂种类进行筛选及实验条件优化.
1 材料与方法
1.1 厌氧氨氧化菌种
实验所用的 anammox菌种取自大连理工大学环境污染控制研究室长期培养的厌氧氨氧化反应器.反应器类型为连续搅拌釜式反应器(CSTR),有效容积为 80L.所培养菌群呈红褐色、絮状、密度大、活性高.进水总氮(TN)最高可达550mg/L,去除率最高为92%.其混合液悬浮固体(SS)浓度约为 7000mg/L,挥发性悬浮固体浓度(VSS)约为 4000mg/L.进水采用人工模拟废水,成分除氨氮与亚硝氮外,还包括碳酸氢钾450mg/L、磷酸二氢钾 45mg/L,微量元素 I和 II各1mL/L.其中微量元素成分参考Graff等[14]的文献.
1.2 干粉菌剂的制备
将取出的anammox菌用0.01mol/L PBS缓冲溶液(pH=7.0)清洗,涡旋器涡旋5min,然后用离心机(6000r/min,10min)去除上清液,重复 3次.将称量后的污泥与定量的保护剂溶液在培养皿(经高温灭菌)平面内于氮气吹扫下混合均匀,然后置于真空干燥箱中,设置烘干温度,21kPa条件下进行干燥,达到干粉状态时停止干燥(含水率为(20±5)%).然后将干粉用真空包装机抽真空密封,置于4℃冰箱中恒温避光保存.
1.3 菌体复壮实验
将保藏1个月的干粉取出,用PBS缓冲溶液洗涤3次,方法同1.2中清洗方法.所用模拟废水成分同 1.1中模拟废水,除氨氮和亚硝氮浓度变化外,其他成分浓度不变,pH值为7.5~7.8.批式实验中,在血清瓶中加入100mL模拟废水和0.3g干粉,使血清瓶内的 VSS约为3000mg/L,用丁基橡胶塞塞紧瓶口并用铝盖加固,然后充氮气置换其中的空气 20min.将血清瓶置于恒温摇床中于37℃、160r/min条件下进行复壮,每24h取样测定 NH4+-N、NO2--N、NO3--N浓度及其他活性指标,每个样品设置2个平行;在连续实验中,同样加入干粉使反应器内的 VSS约为 3000mg/L,然后启动反应器进行为期 1个月的复壮实验,连续实验反应器的流程图如图1所示.反应器的有效容积为 500mL,水力停留时间 HRT=24h,并采用间歇式曝气除氧.

图1 连续实验反应器工艺流程示意Fig.1 Process flow-chart of continuous experiment reactor
1.4 分析方法
实验过程中,氨氮(NH4+-N)、亚硝酸氮(NO2--N)、硝酸氮(NO3--N)采用标准方法分析[15];菌体存活率及杂菌情况采用 PI单染-流式细胞仪检测[16];微生物活性测试测量采用批式实验的方法测定[17];微生物形态表征采用扫描电子显微镜(SEM)[18];菌群定性及定量分析采用荧光原位杂交(FISH)并结合 Image-Pro Plus软件进行分析[19].
2 结果与讨论
2.1 烘干保护剂的筛选
配制 5种保护剂溶液,浓度均为 2%(m/v),将anammox菌放在不同保护剂中于40℃下进行真空干燥并真空密封,之后放置在 4℃恒温避光冰箱中保藏,保藏1个月后进行不同保护剂下anammox菌的存活率、复壮性能及菌群变化实验.
2.1.1 不同保护剂下菌体的存活率 配制培养基将洗净保护剂残留的 5种菌剂复水 24h,利用PI单染-流式细胞仪检测干粉菌剂的存活率,结果如图2所示,5种保护剂下制备的干粉菌剂,其存活率从高到低的顺序为:海藻酸钠>羧甲基纤维素钠>海藻糖>去离子水>聚乙烯醇.同时发现,5种条件下得到的菌体存活率均在98%以上,由此推断在 40℃温度下进行真空干燥对anammox菌伤害较小.

图2 保藏30d后干粉菌剂的存活率Fig.2 Survival rate of dry powder agents after preservation for 30days
2.1.2 不同保护剂下菌体的复壮性能 采用批式实验确定5种保护剂的复壮活性,参考指标为总氮(TN)去除率,如图3所示.实验结果表明聚乙烯醇、羧甲基纤维素钠及海藻酸钠的TN去除率较高,但结合氨氮及亚硝氮的去除率可知,以聚乙烯醇作为保护剂的氨氮去除率平均值为9.0%,而亚硝氮的去除率平均值达 71.4%,说明其反硝化作用较强,而并不是表现出较强的厌氧氨氧化活性.
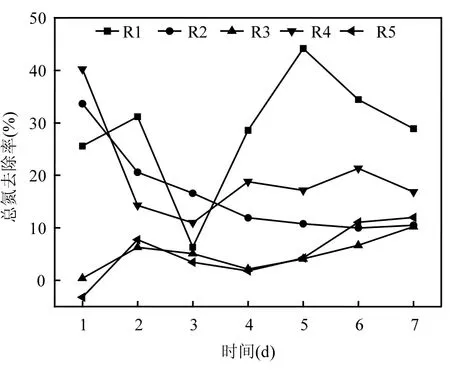
图3 5种保护剂的批式实验的总氮去除率Fig.3 TN removal efficiency of batch tests of five protective agents
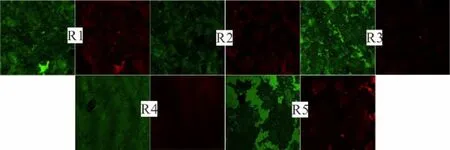
图4 菌体复壮后的FISH图像Fig.4 FISH pictures of anammox sludge after reactivation绿色:全菌 红色:anammox 菌
2.1.3 菌群变化实验 在干粉菌剂保藏过程中菌体的死亡或杂菌的增殖,以及复壮过程中对环境适应性的不同会造成菌群的变化,故在批式实验结束后,取血清瓶内的菌悬液进行 FISH实验,利用真细菌探针EUB338[20]标记全菌、AMX820[21]标记anammox菌,以anammox菌在全菌中的占比来判断各保护剂下菌体的复壮效果.结果如图4所示,聚乙烯醇、羧甲基纤维素钠、去离子水、海藻酸钠及海藻糖5种保护剂复壮7d后,anammox菌所占全菌的比例依次为25.3%、45.4%、23.1%、47.5%及27.4%.由海藻酸钠作为保护剂,anammox菌在复壮后占比最高.
在测定菌体存活率中,存活率最高的为海藻酸钠;而且在 7d的批式复壮实验中,海藻酸钠的TN去除率除较特殊的聚乙烯醇外,在复壮的第4~7d最高;同时根据FISH图像分析anammox菌占比的结果来看,海藻酸钠的anammox菌占比最高.由此可知,海藻酸钠为 5种保护剂中最适宜anammox菌保藏的保护剂.
2.2 烘干温度条件优化
在筛选出烘干保护剂为海藻酸钠之后,制备烘干温度为 40,45,50,55,60,65℃,海藻酸钠浓度为2%(m/v)的干粉菌剂,并进行真空密封4℃恒温避光保藏,保藏30d后进行相关分析实验.
首先利用PI单染-流式细胞仪检测保藏后干粉菌剂的杂菌情况,在复水 24h后测定.二维点图FSC-SSC可观察细胞的大小和粒度,其中FSC反映颗粒的大小尺寸,SSC反映颗粒的内部结构复杂程度,图中以积分面积作为信号的表现方式反映细胞荧光的总和[22].结果如图5所示,在 60℃及 65℃下制备的干粉菌剂的杂菌比例少于在40~55℃范围内制备的杂菌比例.分析可能原因是:在较低温度条件下烘干时,真空干燥箱内的其他微生物未被杀死且提供了其滋生的温床,而且海藻酸钠由于微生物的滋生而腐败发出臭味,由此造成杂菌的生长;当温度达到 60℃及以上时,周围微生物被杀死,而包裹在海藻酸钠中的 anammox菌得到保护,巴氏灭菌方法指出一般细菌的致死点均为温度 68℃,这种杀菌方法通过急剧的热与冷变化促使细菌的死亡[23].
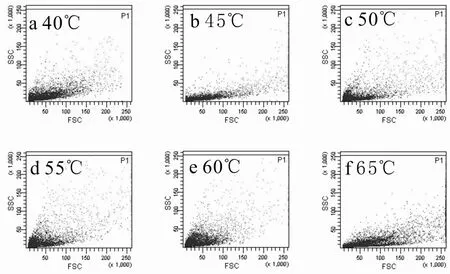
图5 保藏30d后各烘干温度下的干粉菌剂的杂菌情况Fig.5 Condition of sundry bacteria of dry powder agents at different drying temperatures after preservation for 30days

表1 烘干温度条件优化结果Table 1 Results of optimization of drying temperature
同时,进行了不同烘干温度下制备的干粉菌剂在不同干燥时间的存活率实验与批式复壮活性实验,实验结果汇总如表1.表中菌体水解期是指在利用保藏的厌氧氨氧化污泥进行批式复壮实验时需经历的第一个阶段,由于菌体自溶而出现氨氮去除率小于0的情况[24],其长短可反映菌体的死亡情况.
随着烘干温度的升高,烘干时间降低,而菌体存活率也随之降低,但在 60℃时出现极值点.考虑到工业化应用,烘干时间越短经济型越强.而且60℃时,菌体的水解期仅为1d,TN去除率平均值最大.再升高温度到 65℃时,菌体存活率下降,水解期变长,TN去除率急剧下降.因此,确定最佳的烘干温度为60℃.
2.3 保护剂浓度条件优化
确定最佳烘干温度为60℃之后,对保护剂海藻酸钠的浓度进行优化,分别制备海藻酸钠浓度为1%、2%及3%的干粉菌剂,烘干温度采用优化结果60℃,保藏30d后进行相关分析实验.
首先,对保藏的菌剂复水 24h后利用 SEM进行菌落形态的观察,如图6所示.Anammox菌正常的菌落结构呈现花椰菜状[25],在本研究中对 3种浓度下制备的菌体:浓度为 1%海藻酸钠和 2%海藻酸钠制备的干粉菌剂的菌落遭到较为严重的破坏,而在 3%海藻酸钠保护下的菌体结构较为完整,仍能观察到花椰菜的聚集状菌落形态.

图6 不同海藻酸钠浓度下制备的干粉菌剂扫描电镜图像Fig.6 SEM images of dry powder agents at different concentrations of SA

图7 不同浓度海藻酸钠的连续实验TN去除率的变化Fig.7 Changes on TN removal efficiency of continous experiment of different concentrations of SA
之后利用连续反应器进行为期 30d的复壮实验,复壮过程中的TN去除率如图7所示.TN去除率均呈现先上升后下降再上升的趋势,这是因为由于菌体自溶释放出有机物导致反硝化菌的增殖,使进水中的大量亚硝氮得到去除.而随着菌体自溶减弱,反硝化作用也随之减弱,而此时厌氧氨氧化活性仍未得到及时恢复,造成 TN去除率的降低.随后厌氧氨氧化活性的复苏使 TN去除率开始回升.在回升阶段,TN去除率由高到低的顺序为3%>2%>1%.
在连续实验过程中分别在运行的第 10、20、30d进行了比厌氧氨氧化活性(SAA)的测定.厌氧氨氧化反应的基质消耗速率与污泥浓度之比称为 SAA,它是反映 anammox菌脱氮性能的重要指标,单位为 kg N/(kg VSS·d),结果如图8所示.由图可知,随着运行时间的延长,anammox菌复壮的 SAA均不断提高.在启动反应器的第10d,2%海藻酸钠制备的干粉菌剂的 SAA最高,而后3 %海藻酸钠制备的干粉菌剂的SAA后者居上,在运行 30d结束时达到 0.16kg N/(kg VSS·d),为新鲜菌液SAA的41.0%,而在1%及2%海藻酸钠条件下分别达28.2%及33.3%.
根据以上实验结果,可以确定最佳的海藻酸钠浓度为3%.

图8 不同海藻酸钠浓度下制备的干粉菌剂的SAA的变化Fig.8 Changes on SAA of different concentrations of SA
2.4 技术优势
与已报道的anammox菌保藏方法不同的是,本研究创新性地采用高温即热干燥法对anammox菌进行干法保藏,意在探求出一种经济、有效、简单的方法实现菌种的有效保藏.冷冻干燥法、冷藏法及热干燥法的比较如表2所示.

表2 保藏方法对比Table 2 Table of comparison of storage methods
在此研究中,本实验最终的优化结果显示干燥时间可控制在6h左右,并可通过真空干燥箱及4℃保藏温度实现 anammox菌的短期保藏.但可取得较好保藏效果的冷冻干燥法其设备投资高、干燥时间长,而本研究采用的热干燥法可实现保藏效果与经济性的双赢,对于厌氧氨氧化工艺的工业化应用在投产方面具有很大的优势.
3 结论
3.1 在聚乙烯醇、羧甲基纤维素钠、去离子水、海藻酸钠、海藻糖 5种备选烘干保护剂中,最适宜anammox菌的保护剂为海藻酸钠:其存活率在5种保护剂中最高,达99.8%;批式实验中TN去除率在7d内的平均值达19.5%;而且在结束7d的批式实验后,anammox菌占全菌的比例在5种保护剂中最高值.
3.2 在对烘干温度进行优化时,60℃时杂菌较少、存活率较高为96.4%、烘干时间较短为6h、菌体水解期为 1d,TN去除率平均值达 36.1%,因此是最适宜的烘干温度.在对海藻酸钠的浓度进行优化时,3%海藻酸钠在保藏30d后的菌落形态破坏程度最小、连续实验复壮时的TN去除率最高,而且其活性恢复至 41%,故成为最适宜的海藻酸钠作为anammox菌烘干保护剂的浓度条件.本论文只是探讨了保护剂种类及浓度、烘干温度的影响,后续还可对保藏基质、保藏温度、保藏时间等进行研究,以此来进一步优化保藏方案.
3.3 在烘干温度为 60℃、浓度为 3%的海藻酸钠条件下制备的anammox菌干粉菌剂并于4℃保藏 30d,其经过 30d的连续实验活性恢复至41%,还需要进一步研究提高活性的恢复方法.
[1] Ma B, Wang S, Cao S, et al. Biological nitrogen removal from sewage via anammox: Recent advances [J]. Bioresource Technology, 2016,200:981-990.
[2] Wr V D S, Abma W R, Blommers D, et al. Startup of reactors for anoxic ammonium oxidation: experiences from the first full-scale anammox reactor in Rotterdam [J]. Water Research, 2007,41(18):4149-4163.
[3] 董 昧.微生物菌种保藏方法 [J]. 煤炭与化工, 2009,32(7):34-35.
[4] 付美红,王耀耀,朱研研,等.微生物菌种的保藏方法 [J]. 煤炭与化工, 2010,33(4):33-34.
[5] Michael J, Rorhrock Jr, Matias B, et al. Long-term preservation of anammox bacteria [J]. Applied Microbiology and Biotechnology, 2011,92:147.
[6] Vlaeminck S E, Geets J, Vervaeren H, et al. Reactivation of aerobic and anaerobic ammonium oxidizers in OLAND biomass after long-term storage [J]. Applied Microbiology and Biotechnology, 2007,74(6):1376-1384.
[7] Heylen K, Ettwig K, Hu Z, et al. Rapid and simple cryopreservation of anaerobic ammonium-oxidizing bacteria [J].Applied & Environmental Microbiology, 2012,78(8):3010-3013.
[8] Ali M, Oshiki M, Okabe S. Simple, rapid and effective preservation and reactivation of anaerobic ammonium oxidizing bacterium “Candidatus, Brocadia sinica” [J]. Water Research,2014,57(5):215-222.
[9] 汪彩华,郑 平,蔡 靖,等.厌氧氨氧化菌混培物保藏方法的研究 [J]. 中国环境科学, 2013,33(8):1474-1482.
[10] 金仁村,姬玉欣,彭亭瑜,等.海藻糖在厌氧氨氧化颗粒污泥保存中的应用:中国, 201410031291.0 [P]. 2014-4-20.
[11] Ji Y X, Jin R C. Effect of different preservation conditions on the reactivation performance of anammox sludge [J]. Separation &Purification Technology, 2014,133(36):32—39.
[12] Xing B S, Guo Q, Jiang X Y, et al. Long-term starvation and subsequent reactivation of anaerobic ammonium oxidation(anammox) granules [J]. Chemical Engineering Journal, 2015,287:575-584.
[13] Xing B S, Guo Q, Jiang X Y, et al. Influence of preservation temperature on the characteristics of anaerobic ammonium oxidation (anammox) granular sludge [J]. Applied Microbiology and Biotechnology, 2016,(10):1-13.
[14] Graaf A A V D. Autotrophic growth of anaerobic ammoniumoxidizing micro-organisms in a fluidized bed reactor [J].Microbiology, 1996,142(8):2187-2196.
[15] 刘思彤.电/磁场强化厌氧氨氧化及多菌群协同自养生物脱氮[D]. 大连:大连理工大学, 2009.
[16] 刘新星,霍转转,云 慧,等.流式细胞术在细菌快速检测中的应用 [J]. 微生物学通报, 2014,41(1):161-168.
[17] Tang C J, Zheng P, Mahmood Q, et al. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge [J]. Journal of Industrial Microbiology & Biotechnology,2009,36(8):1093-1100.
[18] 王 栋.AnHA-SNAD 耦合工艺处理城镇污水研究 [D]. 大连:大连理工大学, 2015.
[19] Shi Y, Wells G, Morgenroth E. Microbial activity balance in size fractionated suspended growth biomass from full-scale sidestream combined nitritation-anammox reactors [J].Bioresource Technology, 2016,218:38.
[20] Fromm J, Rockel B S, Windeisen E, et al. Lignin distribution in wood cell walls determined by TEM and backscattered SEM techniques [J]. Journal of Structural Biology, 2003,143(1):77-84.
[21] Schmid M, Schmitz-Esser S, Jetten M, et al. 16S-23S rDNA intergenic spacer and 23S rDNA of anaerobic ammoniumoxidizing bacteria: implications for phylogeny and in situ detection [J]. Environmental Microbiology, 2001,3(7):450-459.
[22] 陈朱波,曹雪涛.流式细胞术:原理、操作及应用 [M]. 北京:科学出版社, 2014.
[23] 范允实.冷饮生产技术 [M]. 北京:中国轻工业出版社, 2008.
[24] 丁 爽.厌氧氨氧化关键技术及其机理的研究 [D]. 杭州:浙江大学, 2014.
[25] Van N L, Geerts W J, van Donselaar E G, et al. Linking ultrastructure and function in four genera of anaerobic ammonium-oxidizing bacteria: cell plan, glycogen storage, and localization of cytochrome C proteins [J]. Journal of Bacteriology,2008,190(2):708.

