沸石曝气生物滤池短程硝化特性及其机制
杨永愿,汪晓军,赵 爽,陈振国 (华南理工大学环境与能源学院,广东 广州 510006)
与传统脱氮工艺相比,以短程硝化为基础的自养脱氮技术具有诸多优势[1-3].在高氨氮废水处理中常常利用游离氨(FA)对氨氮氧化菌(AOB)和亚硝酸盐氧化菌(NOB)的抑制差异性实现短程硝化[4-5]. FA浓度取决于氨氮浓度pH值和温度,与温度和 pH值相比,控制进水氨氮浓度更容易获得适合的FA浓度实现短程硝化[6-7].但FA浓度并不稳定,在氨氮氧化过程中,FA浓度会随之下降,导致仅以 FA作为控制因素难以获得稳定的短程硝化.
曝气生物滤池(BAF)利用填料上的微生物能够有效去除氨氮.Li等[8]研究发现,以沸石作为生物载体能够实现 AOB的富集.然而用沸石曝气生物滤池(ZBAF)实现短程硝化的研究鲜有报道.本试验采用沸石曝气生物滤池处理氨氮废水,通过控制反应器内 FA浓度来实现短程硝化,改变进水氨氮容积负荷与氨氮浓度,分析ZBAF中氮元素的迁移转化,研究实现短程硝化的机理以及动力学特性,对ZBAF中的微生物群落结构进行分析,为短程硝化处理低碳氮比氨氮废水的工程化应用提供理论依据.
1 材料与方法
1.1 试验流程和反应装置
本试验装置采用沸石曝气生物滤池反应器(ZBAF)(图1),其材质为有机玻璃,反应器内径为100mm,高1.20m,填料采用粒径为1~2mm的天然沸石,平均粒径为 1.80mm,比密度为 2.64g/m3,比表面积为16.20m2/g,装填高度为1.00m,反应器采用上流式进水,承托层以上每隔 0.15m设一个取样口,共6个.ZBAF底部曝气管连续供氧,底部设有进水以及反冲洗布水管,反应器外壁覆盖加热套及保温套进行加热保温.

图1 ZBAF装置示意Fig.1 Schematic diagram of the ZBAF reactor
1.2 接种污泥
接种污泥为实验室培养成熟的硝化污泥,接种量为500mL,其中污泥浓度MLSS为5.0g/L,污泥容积指数(SVI)为40mL/g.
1.3 试验进水
试验进水为自来水配制的模拟废水,以硫酸铵作为氮源,碳酸氢钠提供碱度,并添加磷酸二氢钾、氯化钙、硫酸镁等微生物所需的营养元素及其他微量元素,不添加任何有机碳源,试验中进水NH4+-N 浓度为 150~550mg/L, pH 值控制在8.3~8.5.
FA 和游离亚硝酸(FNA)浓度由 Anthonisen等[6]提出的公式计算:

1.4 分析方法
氨氮、纳氏试剂分光光度法;亚硝酸盐氮,N-(1萘基)-乙二胺分光光度法;硝酸盐氮,紫外分光光度法;pH值,PHS-3C型 pH计;溶解氧,HQ30d 溶解氧仪;微生物群落结构,高通量基因测序技术.
1.5 试验方法
反应器采用上流式进水方式,模拟废水由蠕动泵打入反应器底部经布水管进入反应器与填料层接触从上方出水口排出,反应器内溶解氧浓度通过气体流量计调节曝气量来控制.反冲洗采用气水联合反冲方式,反冲洗周期为7d 1次.

表1 ZBAF在不同运行阶段下的运行条件Table 1 Detailed operational conditions during different stages of ZBAF
试验开始前对ZBAF反应器进行挂膜培养,首先配以3.5L氨氮浓度为150mg/L的模拟废水,以及投加接种污泥,然后在溶解氧为4~6mg/L条件下进行闷曝培养,每隔24h更换进水,闷曝挂膜共进行3d.
系统闷曝结束后开始连续进水试验,按运行方式试验可分为4个阶段,不同阶段的运行条件见表1.第 1阶段为全程硝化阶段,进水氨氮浓度为150mg/L,此阶段通过逐步缩短水力停留时间(HRT)来提高反应器的氨氮容积负荷(NLR),目的是为了实现反应器氨氮处理能力最大化;第2阶段为短程硝化阶段,通过提高进水氨氮浓度来提高反应器内的游离氨浓度从而实现短程硝化;第3阶段,考察系统在不同NLR下的短程硝化性能;第4阶段维持系统的 NLR不变,考察系统在不同氨氮进水浓度下的短程硝化性能.整个试验水温为(25±1)℃,水中溶解氧浓度为4~6mg/L,碱度与氨氮比为8.92.
1.6 短程硝化模型建立

采用上流式填料床建立短程硝化反应动力学模型,取填料层任意薄层进行物料衡算:式中:A为填料床的横截面积;ΔZ为薄层厚度;V为体积流量;Cz为 Z断面的亚硝氮浓度;γ为硝化反应表观速度.
2 结果与讨论
2.1 短程硝化的建立及处理氨氮模拟废水特性
试验第1阶段,由图2可以看出,出水无亚硝氮积累,经过 28d运行后,亚硝氮产率(NPR)为(0.430±0.01)kg/(m3⋅d),氨 氮 去 除 率 (ARE)为(83.6±1.9)%,说明系统在曝气条件下,硝化细菌的增殖速度很快.第2阶段通过提高进水氨氮来实现短程硝化.如图2所示,进水氨氮浓度提高至250mg/L后经过约12d,出水NO3--N逐渐降至 2.0mg/L,而出水 NO2--N逐渐升高,在25d后稳定在189.5mg/L,表明ZBAF在12d起实现短程硝化,稳定阶段平均NPR为0.640kg/(m3⋅d),亚硝氮积累率(NAR)高于98%;进水氨氮浓度提高至 350mg/L后,NPR逐渐增加至 0.740kg/(m3⋅d)(图2b),说明AOB不仅适应氨氮负荷的提升,而且可能由于底物浓度的增加,硝化速率更接近最大比基质消耗速率 Vmax值,硝化作用进一步增强[9].

图2 ZBAF在不同阶段下的表现Fig.2 The overall operational performance of ZBAF
研究表明[10-11],过高的氨氮浓度对硝化细菌具有一定的抑制作用,第3阶段和第4阶段分别考察了不同NLR和进水氨氮浓度对ZBAF短程硝化性能的影响,此阶段曝气速率等条件维持恒定.图2显示,第3阶段当NLR由 1.195kg/(m3⋅d)提高至 1.400kg/(m3⋅d)时,NPR 从 0.770kg/(m3⋅d)下降至0.680kg/(m3⋅d),并维持稳定,说明AOB的活性受到一定程度的抑制,但这种抑制作用并未造成系统的崩溃;当 NLR提高至 1.680kg/(m3⋅d)时,NPR在4d内迅速下降至0.110kg/(m3⋅d), AOB的活性受到严重的抑制.为了避免系统的崩溃,停止进水并且闷曝 3d以恢复系统短程硝化性能,闷曝结束后重新进水,第 4d后 NPR恢复至0.760kg/(m3⋅d),反映了 ZBAF 良好的恢复能力.第4阶段,在不同进水氨氮浓度下运行,在稳定条件下ZBAF的NPR稳定在0.760kg/(m3⋅d),说明NLR不变时,进水氨氮浓度在350~550mg/L范围内变化不影响系统的短程硝化性能.
2.2 ZBAF中氮元素的迁移转化
常规推流式硝化反应器中,氨氮浓度会随着硝化反应的进行沿水流方向逐渐降低,氨氮大部分转化为亚硝氮或硝氮,只有少部分被微生物同化,因此总氮浓度在反应器内并不会明显改变[12].如图3a,当进水氨氮浓度为150mg/L时,ZBAF上高度为0.15m处氨氮浓度为(29.0±0.2)mg/L,而在其他位置上氨氮浓度为(24.0±0.5)mg/L;高度为0.15m 处总氮浓度为(46.0±0.4)mg/L,沿水流方向总氮浓度呈线性增加,出水总氮浓度为(146.0±0.3)mg/L.ZBAF属于推流式硝化反应器的一种,但是氨氮与总氮在反应器内的分布规律与其他常规推流式硝化反应器不同,基质浓度分布类似于完全混合反应器.
在ZBAF中,沸石扮演双重角色:离子交换和生物膜载体,反应器内主要发生氨氮的离子交换吸附以及硝化反应.在短程硝化稳定阶段,硝化反应停留在亚硝化阶段,ZBAF内氮元素的迁移转化可进一步简化.由于沸石对氨氮具有很强的吸附能力,所以当氨氮进入反应器后快速被沸石所吸附, Z·Na+形态向 Z·NH4+转变,随着亚硝化反应(4)的进行,离子交换平衡向右发生氨氮的解析(5),Z·NH4+再生为 Z·Na+形态[13];在稳定条件下整个反应器同时发生氨氮的快速吸附以及缓慢的解析,因此反应器内的氨氮浓度基本不变,而氨氮沿水流方向不断转化亚硝氮,从而导致亚硝氮和总氮沿水流方向线性增加(如图3b).

图3 ZBAF中氮元素的沿程变化Fig.3 Concentrations of nitrogen compounds at different height of ZBAF
亚硝化:

解析:

2.3 ZBAF实现短程硝化的影响因素
硝化过程是由AOB和NOB两类独立细菌来完成,短程硝化主要通过抑制 NOB的活性而不影响 AOB的活性实现的.影响 AOB和 NOB活性的因素有很多,主要有温度、溶解氧、pH值、FA和FNA等[14].在整个试验过程,反应器内水温控制为(25.0±1.0)℃,此温度范围并不会导致AOB和NOB生长代谢速率的差异[15-16].此外,水中溶解氧浓度控制为 4.0~6.0mg/L,此溶解氧浓度范围对AOB和NOB均是充足的[17].也有研究表明,在厚生物膜系统,由于氧传递阻力的影响,生物膜内溶解氧会出现低溶解氧区,NOB的活性受到限制从而导致亚硝氮的积累[18].试验配水无有机碳源,微生物生长速率慢,因此生物膜厚度造成的溶解氧差异可以忽略,且溶解氧浓度在4.0~6.0mg/L波动,并不造成NPR的变化,进一步说明了溶解氧不影响亚硝氮的产生[19].pH值是实现短程硝化的重要控制因素,pH 值在 7.9~8.2内有利于AOB的生长,而对于NOB,最佳pH值范围为7.2~7.6, pH7.5~8.5有利于抑制NOB的活性[20-21].在本试验,进水碱度(碳酸钙碱度)氨氮比为8.92,试验测定ZBAF的沿程pH值变化(图4),结果显示在阶段1ZBAF内,pH值沿程缓慢下降,进出水pH值分别为8.4和7.6,出水没有亚硝氮积累;当进水氨氮提高至 250mg/L时,进出水 pH值分别为 8.4和 7.5,此时出水亚硝氮积累率达98.0%,说明本试验pH值并不是实现短程硝化的主要原因,但是维持适合AOB生长的pH值范围有利于缩短实现短程硝化的时间.由于进水碱度充足,ZBAF内pH值维持在较高水平,FNA浓度远低于抑制AOB和NOB活性的最低浓度,所以本试验FNA的影响可忽略.

图4 典型运行条件下ZBAF内pH值、FA和FNA的沿程变化Fig.4 Typical profiles of pH value, FA and FNA concentrations under operational condition
在本试验中,如2.2分析FA浓度受氨氮浓度和pH值影响,ZBAF内氨氮浓度约等于出水氨氮浓度,随着硝化反应的进行,沿程pH值逐渐下降.分析ZBAF内FA浓度对硝化细菌以及短程硝化性能的影响(图4):当进水氨氮为 150mg/L时,进水FA浓度为27.74mg/L,高于NOB的抑制浓度(0.1~1.0mg/L),处于 AOB 的抑制浓度范围(10~150mg/L),而在ZBAF内,由于沸石的吸附作用以及硝化反应产生的H+,导致从0.15m到0.90m处FA浓度由5.36mg/L下降至0.60mg/L,此时出水无亚硝氮积累,此FA浓度范围下NOB的活性没有受到明显抑制;当进水氨氮浓度为 250mg/L时,ZBAF内氨氮和FA浓度都明显提高,其中FA浓度从0.15m到0.90m处由15.19mg/L下降至3.48mg/L,此时出水亚硝氮积累率达 98.3%,说明高FA浓度对NOB的活性产生了抑制,从而实现了亚硝氮的积累;研究指出高 FA可以实现短程硝化,但是当FA浓度高于一定水平时,AOB的活性也会受到一定程度的抑制,从而导致短程硝化性能的下降[22-23].阶段3,当 NLR 由1.200kg/(m3⋅d)提高至 1.400kg/(m3⋅d)时,ZBAF内 FA 浓度范围为 17.35~35.51mg/L, NPR 从 0.760kg/(m3⋅d)下降至 0.680kg/(m3⋅d),说明 AOB的活性受到一定程度的抑制;当 NLR进一步提高至 1.680kg/(m3⋅d)时,NPR在4d后迅速下降至0.110kg/(m3⋅d),表明AOB的活性受到严重的抑制,此时FA浓度范围为 28.78~40.87mg/L.阶段 4维持进水负荷恒定,在不同进水氨氮浓度下系统 NPR为 0.770kg/(m3⋅d),表明硝化速率不受进水氨氮浓度的影响,分析原因为:ZBAF的沸石填料具有吸附氨氮能力,反应器近似于基质完全混合式反应器,基质瞬间由进水浓度降低为出水浓度,避免了过高的FA浓度限制AOB的活性.
2.4 ZBAF短程硝化动力学特性
选择亚硝氮产生模型,对阶段 4进水氨氮浓度为550mg/L时的ZBAF进行短程硝化动力学分析.在稳定状态下,进水流量、基质浓度和生物量并不随时间而变化,因此,等式(3)可变为微分形式:

图5拟合结果显示,在短程硝化阶段,亚硝氮浓度与水力停留时间具有良好的线性关系,亚硝氮浓度随水力停留时间的增加而线性增加,说明ZBAF中亚硝酸盐氮的产生遵循零级反应动力学方程,亚硝化动力学方程为:
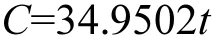
ZBAF中的亚硝化反应是典型的生物膜反应,亚硝化反应是传质动力学与生物膜亚硝化动力学综合的结果,因此亚硝化表观反应速率大小取决于物质传递速率和亚硝化反应速率.表明传质动力学与亚硝化反应动力学均为零级.由于沸石具有吸附氨氮作用,沸石表面以及生物膜周围氨氮浓度较高,传质动力学视为零级;此外,动力学分析结果显示,亚硝化表观反应速率并不受ZBAF沿程基质浓度的影响,表明基质浓度远远大于其氧化半饱和常数(Ka),同时FA对AOB的抑制作用也不存在.

图5 ZBAF短程硝化动力学分析Fig.5 Kinetic study of partial nitrification in ZBAF
2.5 微生物群落分析
采用高通量测序技术对接种污泥与 ZBAF运行 120d后的生物沸石进行微生物群落分析.基于 16S rRNA基因序列分析,从接种污泥和生物沸石中分别获得 593OTUs(操作分类单元)和1041OTUs,为分析ZBAF实现短程硝化的生物作用机制,对序列在门、纲、种的水平进行分类.结果如图6所示,显示 3个生物沸石样品(H1、H2和 H3)具有高度的相似性,说明 ZBAF中微生物群落不随高度而发生改变.在门水平上,接种污泥与生物沸石群落区别明显,接种污泥优势菌门为Bacteroidetes(32.56%)、Proteobacteria (30.94%)和 Chlorobi(9.76%),而 3个生物沸石样品优势菌为 Proteobacteria(92.61%,95.47%,96.61%)、Bacteroidetes(3.45%,3.00%,2.09%)和Acidobacteria(1.37%,0.52%,0.41%).Proteobacteria是与硝化作用密切相关的菌门[24],在ZBAF长期运行下得到增殖,这与ZBAF具有较强的硝化作用相一致,此外,Bacteroidetes被认为是以硝化细菌的代谢产物作为有机碳源的潜在异养型微生物,这种异养型微生物有利于维持微生物系统的稳定[25].样品进一步在纲水平进行比较.如图,生物沸石样品中Betaproteobacteria相对丰度明显提高,Chen等[26]试验也发现以亚硝化反应为主的硝化系统中Betaproteobacteria为优势菌纲.

图6 接种污泥与ZBAF样品的微生物群落分析Fig.6 Microbial community analysis of seed sludge and ZBAF samples
在物种水平上硝化细菌的分类结果见表2,接种污泥样品中,2.20%OTUs为硝化细菌,其中Nitrosomoadaceae (AOB)占 1.50%, Nitrospire和Nitrobacter (NOB)分别占0.30%和0.40%;在3个生物沸石样品中(H1、H2和H3), Nitrosomoadaceae(AOB)的相对丰度分别为 61.20%、61.70%和61.80%,检测不出 Nitrospire和 Nitrobacter(NOB),结果表明在 ZBAF中 AOB得到了快速增殖,而NOB的生长受到严重的抑制,这解释了ZBAF的高氨氮去除能力以及稳定的短程硝化.

表2 接种污泥与ZBAF样品AOB与NOB相对丰度(%)Table 2 Relative abundance of AOB and NOB of seedsludge sample and three ZBAF samples (%)
3 结论
3.1 在进水氨氮浓度为250mg/L时开始实现短程硝化,平均NAR高达98.0%;NLR的提高能导致AOB活性的抑制;维持NLR不变,进水氨氮浓度350~550mg/L时,AOB的活性不受影响.
3.2 沸石的吸附性能使得氨氮在ZBAF柱内浓度均匀分布,在短程硝化阶段,亚硝氮和总氮沿水流方向线性增加.
3.3 FA对NOB的抑制是实现ZBAF短程硝化的关键因素,沸石的吸附作用有利于获得适合的游离氨浓度从而抑制 NOB的活性而不对 AOB活性产生影响.
3.4 动力学分析表明亚硝氮的产生符合零级动力学模型,ZBAF内AOB的活性不受基质浓度以及游离氨的影响.
3.5 ZBAF中以Proteobacteria为优势菌群;接种污泥中的脱氮菌群包括 Nitrospire、Nitrobacter和 Nitrosomoadaceae,而 ZBAF中脱氮菌群仅有Nitrosomoadaceae,其相对丰度高于61%.
[1] 王 琳,徐新阳,张铭川.间歇曝气对化肥废水的短程硝化性能影响 [J]. 中国环境科学, 2017,37(1):146-153.
[2] 程 军,张 亮,张树军,等.氨氮负荷波动对城市污水短程硝化-厌氧氨氧化工艺硝态氮的影响 [J]. 中国环境科学, 2017,37(2):520-525.
[3] Tang C J, Zheng P, Chen T T, et al. Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process. [J]. Water Research, 2011,45(1):201-10.
[4] Sinha B, Annachhatre A P. Partial nitrification—operational parameters and microorganisms involved [J]. Reviews inEnvironmental Science and Bio/Technology, 2007,6(4):285-313.
[5] 杨延栋,黄 京,韩晓宇,等.一体式厌氧氨氧化工艺处理高氨氮污泥消化液的启动 [J]. 中国环境科学, 2015,35(4):1082-1087.
[6] Anthonisen A C, Loehr R C, Prakasam T B, et al. Inhibition of nitrification by ammonia and nitrous acid. [J]. Journal - Water Pollution Control Federation, 1976,48(5):835.
[7] Wei D, Xue X, Yan L, et al. Effect of influent ammonium concentration on the shift of full nitritation to partial nitrification in a sequencing batch reactor at ambient temperature [J].Chemical Engineering Journal, 2014,235(1):19-26.
[8] Li Q, Sun S, Guo T, et al. Short-cut nitrification in biological aerated filters with modified zeolite and nitrifying sludge. [J].Bioresource Technology, 2013,136C(3):148-154.
[9] Park S, Bae W, Rittmann B E. Operational boundaries for nitrite accumulation in nitrification based on minimum/maximum substrate concentrations that include effects of oxygen limitation,pH, and free ammonia and free nitrous acid inhibition. [J].Environmental Science & Technology, 2010,44(1):335-342.
[10] Li-Yuan C, Mohammad A, Xiao-Bo M, et al. Partial nitrification in an air-lift reactor with long-term feeding of increasing ammonium concentrations [J]. Bioresource Technology, 2015,185(3/4):134-42.
[11] Rostron W M, Stuckey D C, Young A A. Nitrification of high strength ammonia wastewaters: comparative study of immobilisation media [J]. Water Research, 2001,35(5):1169-1178.
[12] 范荣桂,范 彬,栾兆坤.深床过滤中的生物硝化动力学研究 [J].中国给水排水, 2007,23(15):101-104.
[13] Lahav O, Green M. Bioregenerated ion-exchange process: The effect of the biofilm on ion-exchange capacity and kinetics [J].Water S A, 2000,26(1):51-57.
[14] Ge S, Wang S, Yang X, et al. Detection of nitrifiers and evaluation of partial nitrification for wastewater treatment: A review. [J].Chemosphere, 2015,140:85—98.
[15] Gabarró J, Ganigué R, Gich F, et al. Effect of temperature on AOB activity of a partial nitritation SBR treating landfill leachate with extremely high nitrogen concentration [J]. Bioresource Technology, 2012,126(6):283-289.
[16] 赵昕燕,卞 伟,侯爱月,等.季节性温度对短程硝化系统微生物群落的影响 [J]. 中国环境科学, 2017,37(4):1366-1374.
[17] Wang J, Yang N. Partial nitrification under limited dissolved oxygen conditions [J]. Process Biochemistry, 2004,39(10):1223-1229.
[18] Zheng Z, Li Z, Jing M, et al. The nitritation performance of biofilm reactor for treating domestic wastewater under high dissolved oxygen [J]. Journal of Environmental Sciences,2016,42(4):267-274.
[19] 吴 军,张 悦,徐 婷,等.AOB 溶解氧亲和力低于 NOB 条件下序批反应器中 NOB淘汰的实现机制 [J]. 中国环境科学,2016,36(12):3583-3590.
[20] 李 娜,胡筱敏,李国德,等.MBBR中HRT与pH对短程硝化反硝化的影响 [J]. 工业水处理, 2016,36(10):20-23.
[21] Ciudad G, González R, Bornhardt C, et al. Modes of operation and pH control as enhancement factors for partial nitrification with oxygen transport limitation [J]. Water Research, 2007,41(20):4621-4629.
[22] Aslan S, Dahab M. Nitritation and denitritation of ammoniumrich wastewater using fluidized-bed biofilm reactors [J]. Journal of Hazardous Materials, 2008,156(1—3):56-63.
[23] Li-Yuan C, Mohammad A, Xiao-Bo M, et al. Partial nitrification in an air-lift reactor with long-term feeding of increasing ammonium concentrations [J]. Bioresource Technology, 2015,185(3/4):134-42.
[24] Ramirezvargas R, Serranosilva N, Navarronoya Y E, et al.454Pyrosequencing-based characterization of the bacterial consortia in a well established nitrifying reactor. [J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2015,72(6):990-997.
[25] Kindaichi T, Ito T, Okabe S. Ecophysiological Interaction between Nitrifying Bacteria and Heterotrophic Bacteria in Autotrophic Nitrifying Biofilms as Determined by Microautoradiography-Fluorescence In Situ Hybridization [J].Applied & Environmental Microbiology, 2004,70(3):1641.
[26] Chen Z, Wang X, Yang Y Y, et al. Partial nitrification and denitrification of mature landfill leachate using a pilot-scale continuous activated sludge process at low dissolved oxygen [J].Bioresource Technology, 2016,218:580-588.
致谢:感谢陈晓坤、王永庆、陈静等在试验期间给予的支持与帮助.

