子宫内膜癌组织中CA125和EpCAM的表达及与临床特征的关系
脱勋元,龙丽霞,韩岚,党云,陈珂瑶,王琰
(1.甘肃省妇幼保健院妇瘤科;2.甘肃省妇幼保健院生殖中心,甘肃 兰州 730000)
子宫内膜癌组织中CA125和EpCAM的表达及与临床特征的关系
脱勋元1,龙丽霞1,韩岚1,党云1,陈珂瑶1,王琰2
(1.甘肃省妇幼保健院妇瘤科;2.甘肃省妇幼保健院生殖中心,甘肃 兰州 730000)
目的探讨子宫内膜癌组织中CA125和EpCAM的表达及与临床特征的关系。方法选取本院2015年1月至2017年1月行手术治疗的45例子宫内膜癌患者标本,同时选取同期子宫内膜增生病例标本30例及正常子宫内膜标本10例作为对照研究。采用免疫组化学染色法检测子宫内膜病变组织中CA125及EpCAM表达情况,分析CA125及EpCAM的表达与子宫内膜癌患者临床病理特征的关系。结果正常对照组、子宫内膜增生组及子宫内膜癌组3组间CA125及EpCAM阳性表达率比较差异有统计学意义(P1=0.002,P2=0.006)。CA125及EpCAM在子宫内膜高组织分化程度、肌层侵袭深度≥1/2及FIGO分期Ⅲ-Ⅳ期患者中的阳性表达率均明显高于中低组织分化程度、肌层侵袭深度<1/2及FIGO分期Ⅰ-Ⅱ期患者(P<0.05)。CA125及EpCAM的阳性表达率在不同年龄患者、不同淋巴转移情况等临床特征中比较无显著性差异(P>0.05)。CA125与EpCAM的表达呈现正相关性(r=0.297,P=0.011)。结论CA125和EpCAM的表达与子宫内膜病变进展有关,临床可通过监测患者癌组织中CA125和EpCAM的表达情况,对判定患者癌病进展及预后有一定的指导意义。
CA125;EpCAM;子宫内膜癌;临床病理特征
子宫内膜癌是存在于子宫内膜上皮的恶性肿瘤,作为女性常见恶性肿瘤之一,其临床发病率及死亡率均呈现出上升的趋势[1]。目前虽然对于子宫内膜癌可以通过CT、MRI及病理实验等手段进行诊断,但是对于监测子宫内膜癌变组织病情进展的相关生物学指标却很少[2]。癌抗原125(CA125)作为目前临床上恶性肿瘤重要标志物之一,其临床诊断及监测价值也得到肯定[3]。与CA125类似,上皮细胞黏附分子(EpCAM)作为一种跨膜蛋白分子,仅在上皮细胞内及表面表达,研究显示,EpCAM在肿瘤细胞的增值、分化、代谢调节以及信号传导等过程均有重要的作用[4]。本研究通过对CA125和EpCAM在子宫内膜癌组织中的表达以及同患者临床病理特征的关系进行分析,探讨CA125和EpCAM在监测子宫内膜癌变组织进展及预后的意义。现报告如下。
1 资料与方法
1.1 一般资料
选取本院2015年1月至2017年1月行手术治疗的45例子宫内膜癌患者标本,所有患者术后经病理证实为子宫内膜癌。所选患者手术前均未接受激素类药物、化疗、放疗及其他辅助治疗,排除有凝血功能障碍、栓塞及其他干扰因素。患者年龄37~69岁,平均年龄52.37岁,患者癌组织分化程度:高分化31例,中低分化14例。根据FIGO法临床分期为:Ⅰ期20例,Ⅱ期11例,Ⅲ期11例,Ⅳ期3例。肌层深度侵袭(≥1/2)28例,肌层浅度侵袭(<1/2)17例。淋巴结转移14例,淋巴结未转移31例。另外,选取本院同期子宫内膜增生病例标本30例(包括单纯增生19例,复合增生11例)及正常子宫内膜标本10例为对照研究。
1.2 方法
标本采用10%甲醛固定标本,石蜡包埋、常规切片[5]。采用免疫组织化学染色法对癌组织中CA125及EpCAM表达进行检测,检测方法严格按照操作说明书进行。所有检验试剂、CA125及EpCAM单克隆抗体、免疫显色试剂盒等均购买于上海酶联生物科技有限公司。
1.3 免疫组染色结果评价
CA125及EpCAM阳性结果显色:细胞质或细胞膜显棕黄色或者棕褐色颗粒物状。参照魏莉等报道对免疫染色结果的评价方法[6]进行结果判断:高倍显微镜下任意选取5个高倍视野,对视野中阳性细胞及总细胞个数进行计数,按照阳性细胞所占细胞总数的百分比例的平均数对结果进行判定。阴性(-):细胞不着色或着色细胞数所占比例低于15%或者阳性细胞所占比例低于10%。弱阳性(+):细胞表现出不连续浅着色或者阳性细胞所占比例在10%~30%。阳性(++):细胞着色连续且中等着色或者阳性细胞所占比例在30%~50%。强阳性(+++):细胞着色连续且颜色较深或者阳性细胞所占比例在50%以上。其中(++)及(+++)定义为阳性表达,阳性表达率=[(++)+(+++)]/总例数×100%。
1.4 统计学分析
采用统计学软件SPSS 19.0对数据进行分析处理,两组及多组率(%)比较采用χ2检验。CA125与EpCAM表达的关系采用Spearman分析,比较结果均以P<0.05表示差异有统计学意义。
2 结果
2.1 不同子宫内膜病变组织中CA125及EpCAM的表达情况
正常对照组CA125阳性表达1例(10.00%);子宫内膜增生组CA125阳性表达17例(46.67%);子宫内膜癌组CA125阳性表达27例(60.00%),3组间阳性表达率比较差异显著(P=0.014),比较结果有统计学意义(P<0.05)。正常对照组EpCAM阳性表达率为1例(10.00%);宫内膜增生组EpCAM阳性表达13例(43.33%);子宫内膜癌组CA125阳性表达26例(57.78%),3组间阳性表达率比较差异显著(P=0.021),比较结果有统计学意义(P<0.05)。见图1及表1。
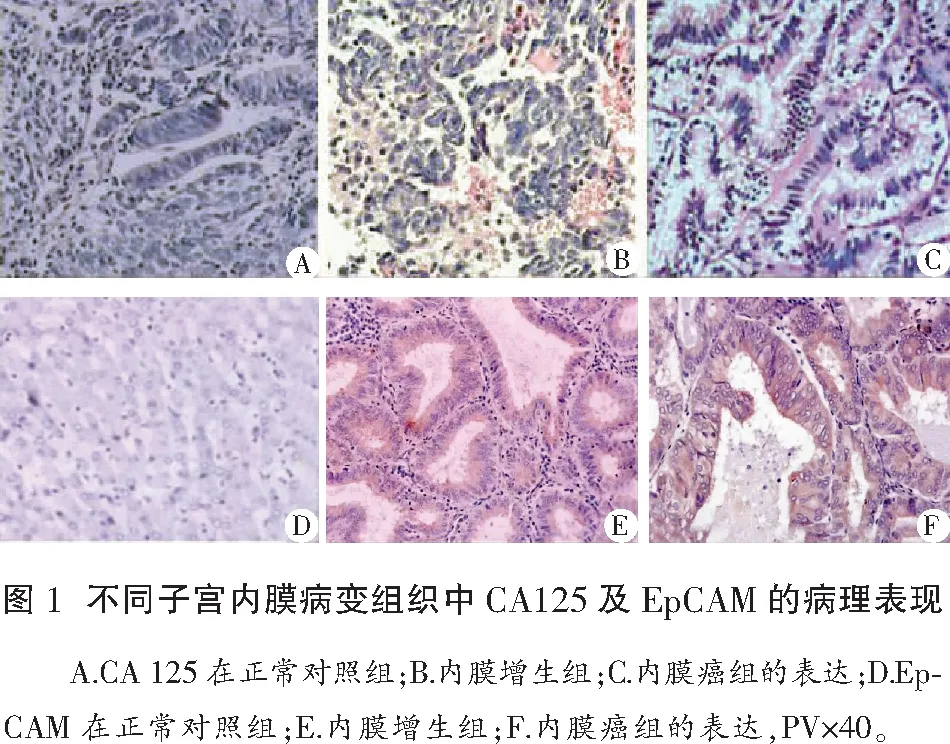
2.2 CA125在子宫内膜癌组织中的表达与临床特征的关系
在子宫内膜癌组织中,分别以患者年龄、癌组织分化程度、肌层侵袭深度、淋巴结转移及FIGO分期等临床特征进行分组比较,结果显示,CA125在高分化癌组织中阳性表达率显著高于中低分化癌组织(P<0.05)。FIGO分期Ⅲ-Ⅳ期患者阳性表达率明显高于Ⅰ-Ⅱ期患者(P<0.05)。肌层侵袭深度≥1/2患者阳性表达率及强阳性表达率均明显高于肌层侵袭深度<1/2患者(P<0.05)。CA125在子宫内膜癌组织中的表达与患者年龄及淋巴转移情况等临床特征比较差异无统计学意义(P>0.05)。见表2。
表1不同子宫内膜病变组织中CA125及EpCAM的表达情况比较[n(%)]

组别例数CA125阳性表达率P值EpCAM阳性表达率P值正常对照组101(10.00)1(10.00)子宫内膜增生组3017(46.67)∗0.01413(43.33)∗0.021子宫内膜癌组4527(60.00)∗#26(57.78)∗#
*P<0.05,与正常对照组比较;#P<0.05,与其他两组比较。
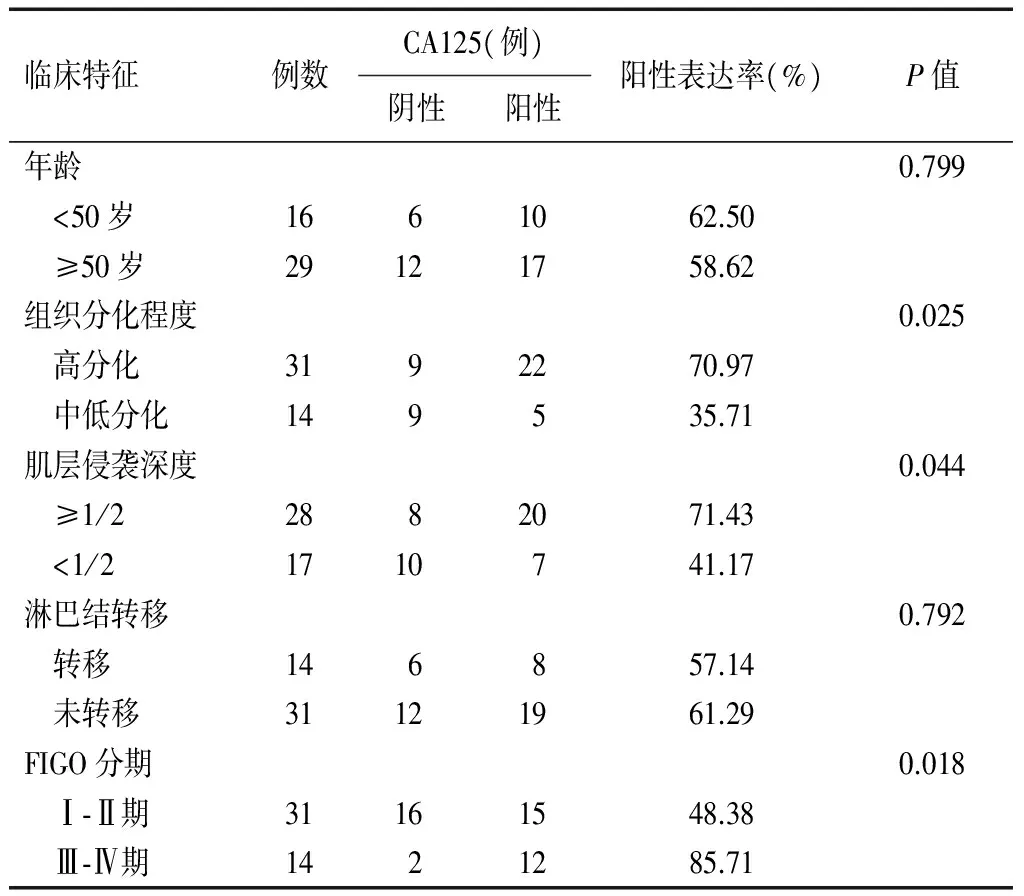
表2 CA125在子宫内膜癌组织中的表达与临床特征的关系
2.3 EpCAM在子宫内膜癌组织中的表达与临床特征的关系
EpCAM在高分化癌组织中阳性表达率显著高于中低分化癌组织(P<0.05)。FIGO分期Ⅲ-Ⅳ期患者阳性表达率明显高于Ⅰ-Ⅱ期患者(P<0.05)。肌层侵袭深度≥1/2患者阳性表达率明显高于肌层侵袭深度<1/2患者(P<0.05)。EpCAM在子宫内膜癌组织中的表达与患者年龄及淋巴转移情况等临床特征中比较无明显差异(P>0.05)。见表3。
2.4 CA125与EpCAM在子宫内膜癌组织中表达的关系
CA125阴性表达18例,阳性表达27例;EpCAM阴性表达19例,阳性表达26例。其中CA125与EpCAM同时阴性表达14例,同时阳性表达22例,对CA125与EpCAM的表达进行Spearman相关性分析结果(r=0.297,P=0.011),二者呈现正相关性,见表4。
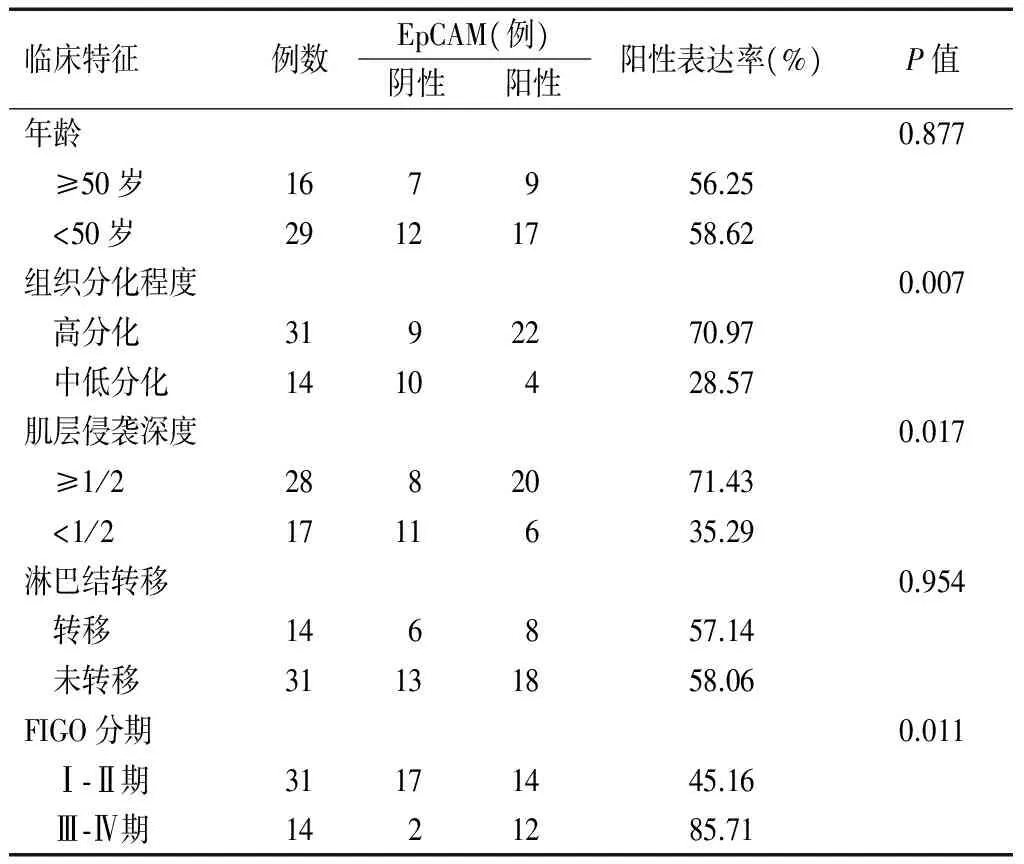
表3 EpCAM在子宫内膜癌组织中的表达与临床特征的关系

表4 CA125与EpCAM在子宫内膜癌组织中表达的关系
3 讨论
子宫内膜癌的发生是多因素共同作用的结果,目前临床上对于子宫内膜癌的发病机制尚不完全清楚。癌变过程是一个复杂的、多基因变化生物学过程,临床上单单通过组织学上的变化或者单个组织相关因子来判断这种癌变行为并不足够,因此,通过检测多个具有代表性的生物组织因子变得非常必要。
CA125作为一种糖蛋白,广泛存在于子宫内膜及卵巢等各种由胚胎腔体上皮分化而成的组织或细胞中,在良性、恶性肿瘤均有表达。有研究显示,CA125的表达水平与子宫内膜病变的进展存在密切的关联,内膜肿瘤组织恶性程度越高,CA125的表达越高[7]。本研究结果证实,随着子宫内膜癌组织分化程度越高,CA125的癌组织中阳性表达也随之增强,同时,在临床分期越高以及侵袭深度越深的患者癌组织中,CA125的阳性表达越高。结果表明,CA125参与了子宫内膜癌变的进展过程,与患者病情进展和病情程度存在密切关系。结果与Frimer等[8-9]相关报道相符。究其原因,我们推测可能与不同侵袭深度度及不同分化程度下癌组织中具有分泌功能的腺细胞减少有关,在分化程度较低的子宫内膜癌组织中癌细胞多显实体性线状排列,而却未出现具有分泌功能的腺细胞结构,从而导致腺细胞分泌CA125的能力逐渐丧失,造成CA125阳性率的降低[10]。因此,CA125可作为评价子宫内膜癌进展情况的重要诊断指标,对患者的预后具有重要价值。
EpCAM是由GA-733基因编码的一类被高度糖基化的细胞跨膜蛋白,广泛存在于上皮组织中,尤其是在各类肿瘤病变细胞连接处表达极高[11]。研究显示,EpCAM作为一种上皮细胞粘附分子,在肿瘤细胞的增值、分化、代谢调节以及信号传导等过程均有重要的作用,其在恶性病变组织或上皮细胞中的表达要远远高于正常组织及细胞[12]。相关报道显示,EpCAM在子宫内膜癌、乳腺癌及卵巢癌等组织中的阳性表达率均在80%以上,认为EpCAM与肿瘤病变组织或细胞的分化、增值以及肿瘤进展过程有密切的关系,可作为临床预后指标[13]。本研究结果中,EpCAM在子宫内膜正常组、增生组及内膜癌阳性表达依次上升,同时EpCAM的表达随着癌组织分化程度、肌层侵袭深度以及FIGO分期的升高逐渐增强。推测:EpCAM可能是子宫内膜增生组织向癌变过程中重要的启动子,参与到β-连环蛋白依赖的Wnt级联反应中,从而激活c-myc、cyclinA/E等原癌基因的表达而具有致癌作用,同时通过调节胞内EpCAM蛋白因子的降解来激活EpCAM作为有丝分裂信号传导期的功能[14-15]。因此,本研究表明,EpCAM可作为子宫内膜癌变过程的重要指示因子,与患者癌组织进展密切相关,通过检测子宫内膜癌组织中其表达情况,对患者病情进展的诊断及预后具有重要的指导价值。
综上所述,CA125和EpCAM作为两种不同的糖蛋白因子,在不同子宫内膜病变组织中均有不同程度的表达,尤其在癌组织的分化程度、侵袭深度及癌组织进展分期等临床特征的表达有明显差异,临床上可以通过检测CA125和EpCAM两者在子宫内膜癌变组织中的表达,为监测患者癌变组织病情进展、临床治疗及预后提供一定的指导依据。
[1] Yanokura M,Banno K,Iida M,etal.MicroRNAS in endometrial cancer:recent advances and potential clinical applications[J].Excli Journal,2015,14(5):190-198.
[2] Matulonis U,Vergote I,Backes F,etal.Phase II study of the PI3K inhibitor pilaralisib in patients with advanced or recurrent endometrial carcinoma[J].Gynecologic Oncology,2015,136(2):246-253.
[3] Fawzy A,Mohamed MR,Ali MA,etal.Tissue CA125 and HE4 Gene Expression Levels Offer Superior Accuracy in Discriminating Benign from Malignant Pelvic Masses[J].Asian Pacific Journal of Cancer Prevention Apjcp,2016,17(1):323-323.
[4] Wen KC,Wang PH,Sung PL,etal.Abstract 5171:EpCAM expression governs tumor growth or distant metastasis of human endometrial cancer:grow or go theory[J].Cancer Research,2015,75(15):5171-5173.
[5] 秦维香,张晓艳,马媛媛.免疫组化法用于肿瘤患者病理诊断的效果评价[J].中国实用医药,2016,11(11):31-32.
[6] 魏莉,颜磊,张辉,等.精子相关抗原9在子宫平滑肌肉瘤中的表达及临床意义[J].现代妇产科进展,2012,21(5):357-360.
[7] Mei-Ling LI,Zeng SM,Xiao-Dan JI,etal.Expression of miR-181a and CA125 and their correlation in human type Ⅰ and Ⅱ endometrial carcinoma[J].Medical Journal of Chinese Peoples Liberation Army,2016,41(1):26-30.
[8] Frimer M,Hou JY,Mcandrew TC,etal.The clinical relevance of rising CA-125 levels within the normal range in patients with uterine papillary serous cancer[J].Reproductive Sciences,2013,20(4):449-449.
[9] Povolotskaya N,Das N,Dhar K,etal.Utility of Preoperative CA125 Assay in the Management Planning of Women Diagnosed with Uterine Cancer.[J].Surgery Research and Practice,2014,14(1):477-478.
[10] Zhang YX,Ren HW,Liu CL,etal.Clinical application of serum NGAL and CA125 combined detection in endometrial carcinoma[J].Journal of Hainan Medical University,2015,92(2):424-429.
[11] Bryan RT,Regan HL,Pirrie SJ,etal.Protein shedding in urothelial bladder cancer: prognostic implications of soluble urinary EGFR and EpCAM[J].British Journal of Cancer,2015,112(6):1052-1058.
[12] Satelli A,Brownlee Z,Mitra A,etal.Circulating tumor cell enumeration with a combination of epithelial cell adhesion molecule-and cell-surface vimentin-based methods for monitoring breast cancer therapeutic response[J].Clinical Chemistry,2015,61(1):259-259.
[13] Maremanda NG,Roy K,Kanwar RK,etal.Quick chip assay using locked nucleic acid modified epithelial cell adhesion molecule and nucleolin aptamers for the capture of circulating tumor cells[J].Biomicrofluidics,2015,9(5):103-110.
[14] Schneck H,Gierke B,Uppenkamp F,etal.Correction: EpCAM-Independent Enrichment of Circulating Tumor Cells in Metastatic Breast Cancer[J].Plos One,2016,11(2):e0149315.
[15] 李斌,张志强,盛黎黎,等.肿瘤干细胞标记物CD133和EpCAM在子宫内膜癌中的表达及意义[J].中国肿瘤临床,2012,39(17):1281-1284.
ExpressionofCA125andEpCAMinendometrialcarcinomaanditsrelationshipwithclinicalfeatures
DE Xun-yuan1,LONG Li-xia1,HAN Lan1,DANG Yun1,CHEN Ke-yao1,WANG Yan2
(1.DepartmentofGynecologyandOncology;2.ReproductiveCenter,GansuMaternalandChildHealthCareHospital,Lanzhou730000,Gansu,China)
Objective:To investigate the expression of CA125 and EpCAM in endometrial carcinoma and its relationship with clinical features.MethodsA total of 45 patients with endometrial carcinoma who underwent surgical treatment in our hospital from January 2015 to January 2017 were selected.At the same time,30 cases of endometrial hyperplasia and 10 cases of normal endometrium were selected as control study.Immunohistochemical staining method was used to detect the expression of CA125 and EpCAM in endometrial lesions,and to analyze the relationship between the expression of CA125 and EpCAM and the clinicopathological features of endometrial carcinoma.ResultsThe positive expression rates of CA125 and EpCAM in the normal control group,endometrial hyperplasia group and endometrial carcinoma group were significantly different (P1=0.002,P2=0.006).CA125 and EpCAM in endometrial tissue of high differentiation,muscular layer invasion depth more than 1/2 positive expression and FIGO stage III-IV stage patients were significantly higher than the low rate of tissue differentiation, myometrial invasion depth <1/2 and FIGO stage I-II patients (P<0.05).In patients with different age and lymphatic metastasis,there was no significant difference in the positive expression rates of CA125 and EpCAM (P>0.05).The expression of CA125 was positively correlated with the expression of EpCAM (r=0.297,P=0.011).ConclusionThe expression of CA125 and EpCAM is related to the progression of endometrial lesions,by monitoring the expression of CA125 and EpCAM in patients with cancer,it has certain guiding significance for the diagnosis of cancer progression and prognosis.
CA125;EpCAM;Endometrial cancer;Clinicopathological features
10.3969/j.issn.1005-3697.2017.06.009
甘肃省自然科学基金(1506RJVA159)
2017-07-10
脱勋元(1982-),男,硕士,主治医师。
王琰, E-mail:longlixia8269@163.com
时间: 2017-12-27 16∶44网络出版地址http://kns.cnki.net/kcms/detail/51.1254.R.20171227.1643.018.html
1005-3697(2017)06-0842-04
R711.74
A
(学术编辑:刘曙光)

