微生物源性抗氧化剂对高脂诱导的妊娠母鼠抗氧化能力和产仔能力的影响
赵 森,李少华,徐 雪,钟丘实,张 京,徐维娜,徐建雄
(上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海 200240)
微生物源性抗氧化剂对高脂诱导的妊娠母鼠抗氧化能力和产仔能力的影响
赵 森,李少华,徐 雪,钟丘实,张 京,徐维娜,徐建雄*
(上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海 200240)
【目的】探讨微生物源性抗氧化剂对高脂诱导的氧化应激孕鼠抗氧化能力和产仔能力的影响。【方法】选择18只清洁级体重相近的SD孕鼠,随机分成3组,每组6只(重复),分别为基础日粮组、高脂日粮组和高脂日粮添加2%微生物源性抗氧化剂组(修复组)。试验从妊娠第1天始至分娩结束,记录相关生产性能指标,收集母鼠分娩时血液分离血浆,测定抗氧化指标。【结果】与基础组相比,高脂组母鼠末重和日增重无显著变化(P>0.05),日平均采食量显著降低(P<0.05),产仔数、初生重和初生窝重没有显著变化(P>0.05);与高脂组相比,修复组母鼠末重、日平均采食量和日增重极显著降低(P<0.01),产仔数和初生窝重无显著变化(P>0.05),初生重显著降低(P<0.05)。与基础组相比,高脂组母鼠血浆中抑制羟基自由基能力、SOD和CAT活性显著降低(P<0.05)、MDA和蛋白羰基含量显著提高(P<0.05),血浆中T-AOC和GSH-Px降低极显著(P<0.01);与高脂组相比,修复组极显著降低母鼠血浆中MDA和蛋白羰基含量(P<0.01),极显著地提高母鼠血浆T-AOC、CAT和GSH-Px活性(P<0.01),显著地提高了SOD活性和抑制羟基自由基能力(P<0.05)。【结论】高脂日粮加剧了妊娠母鼠的氧化应激,微生物源性抗氧化剂提高了高脂诱导的妊娠母鼠的抗氧化能力,缓解机体的氧化损伤,促进母鼠繁殖机能的发挥。
微生物源性抗氧化剂;抗氧化能力;氧化损伤;妊娠;大鼠
妊娠是一个高代谢的生理阶段,胎儿正常的生长发育需要母体为胎儿提供更多的能量及营养物质[1]。而伴随着代谢的提高,机体对氧的需求量增加,从而产生过量的ROS[2],超出机体清除自由基的能力,产生氧化应激。吴永霞等[3]发现,妊娠期过量的活性氧易攻击生物膜系统,使细胞发生脂质过氧化并加速其凋亡,引起奶牛免疫能力的下降,引发一系列围产期高发的代谢病,如奶牛乳房炎、胎衣滞留等。本课题组的前期研究也发现,繁殖母羊随着妊娠日龄的增加会出现严重的氧化应激,且随着母羊胎次的增加氧化损伤加剧[1]。J.M.Morris等[4]和R.E.Little等[5]发现,孕期妇女血清中的脂质过氧化和MDA水平要明显高于未妊娠妇女。医学研究证明,氧化应激与一系列妊娠并发症有关,比如子痫前期、妊娠高血压综合征、妊娠期糖尿病等[6]。孕妇摄入高脂膳食成为当今社会普遍特点[7]。Z.Yida等[8]人研究发现,高脂饮食也可以诱导氧化应激。微生物源性抗氧化剂是由多种微生物如乳酸杆菌、枯草芽孢杆菌等发酵提取的抗氧化剂,含有维生素C、维生素E、异黄酮等[9]。与常见的抗氧化剂维生素C、维生素E、L-硫辛酸等相比,微生物源性抗氧化剂对氧自由基及氮自由基都有较好的清除自由基作用[10],微生物源性抗氧化剂体外清除羟自由基、超氧阴离子自由基、DPPH自由基能力的半数有效量(EC50)分别为184.5、48.75、66.15 μg,能有效减缓高脂(纯葵花籽油)日粮诱导大鼠的氧化应激和脂多糖(LPS)诱导的母鼠氧化应激[11-12]。本试验通过在孕鼠饲粮中添加高脂(猪油)构建高脂氧化损伤模型,观察微生物源抗氧化剂对模型孕鼠抗氧化能力和产仔能力的影响,为减少妊娠动物氧化损伤,促进胎儿健康发育提供试验依据。
1 材料和方法
1.1 材料
1.1.1 试验动物
18只体重在(280±10)g的SD雌性清洁级健康未经产大鼠,9只体重在(320±10)g的清洁级健康SD成年雄性大鼠,均购于上海杰思捷实验动物有限公司,许可证号:SCXK(沪)2013-0006。
1.1.2 微生物源性抗氧化剂
由江瀚生物科技(上海)有限公司提供,产品由乳酸杆菌、枯草芽孢杆菌、酵母菌等发酵生产,含有来源于这些菌及其培养物的胡萝卜素、维生素B1、B2、B12、还原型维生素C、槲皮酮-3-D吡喃葡萄糖(栎素)、槲皮酮(类黄酮)、肌醇和多种微量元素的金属衍生物。
1.1.3 试验试剂
血浆中丙二醛(MDA)、蛋白羰基含量、总抗氧化能力(T-AOC)和抑制羟基自由基能力、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活性测定试剂盒购自南京建成生物工程研究所。戊巴比妥钠购于默克化工技术有限公司。
1.1.4 试验饲粮
试验使用的基础饲粮由苏州双狮实验动物饲料科技有限公司生产,基础饲料由玉米、豆粕、面粉、鱼粉、植物油、苜蓿草粉、各种维生素和矿物质组成,粗蛋白21.72%,粗脂肪4.57%,碳水化合物52.96%。高脂饲粮中添加的猪油由市场购买的板油炼制。
1.2 方法
1.2.1 动物分组与处理
试验前期,18只雌性大鼠与9只雄性大鼠按照2∶1的比例合笼饲养,每次下午6:00合笼,次日早上8:00,将其重新分开。次日早上,检查阴栓,有阴栓作为妊娠第1天,雌性大鼠受孕后,随机分为3组,分别为基础日粮组,高脂日粮组(80%基础日粮+20%猪油)和修复组(78%基础日粮+20%猪油+2%微生物源抗氧化剂,2%微生物源性抗氧化剂的添加量参考陈小连等[13]的研究),每组6个重复,每个重复1只。孕鼠单笼喂养于25cm×40cm上加不锈钢盖的特制塑料盒中,温度为20~25℃,相对湿度50%~60%,光照明暗各12 h,自由饮水与采食,操作符合相关动物试验法规,试验至母鼠分娩结束。
1.2.2 测定指标与方法
1.2.2.1 体重和采食量
雌性大鼠受孕成功作为妊娠开始,母鼠分娩当天作为妊娠结束,记录妊娠开始和结束时的体重、产仔数和初生重,从妊娠开始,称量投喂饲料重,然后隔天定时称量剩余饲料重并适当补料,把隔天饲料重的差值作为妊娠期母鼠的隔天采食量,计算总采食量最后除以妊娠天数得到妊娠期母鼠的日平均采食量。
1.2.2.2 血样的采集、处理和测定
母鼠分娩后24h内,麻醉(戊巴比妥钠,45mg/kg),心脏采血,血液收集于肝素钠抗凝管中,冰上静置30 min,4℃ 3500 r/min离心10 min,小心吸取上清液并分装于1.5 mL冻存管中,置于-80℃冰箱待用。
按照试剂盒说明书测定血浆中丙二醛(MDA)、蛋白羰基含量、总抗氧化能力(T-AOC)、过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性。
1.3 数据分析
应用SPSS 17.0软件进行统计学分析,采用单因素方差分析(one-way ANOVA)进行统计,组间差异比较采用LSD法,所有数据均以“平均值±标准差”表示。
2 结果与分析
2.1 母鼠的体重变化和采食量
由表1可见,与基础组相比,高脂组母鼠日平均采食量显著降低(P<0.05),末重、日增重无显著变化(P>0.05);与高脂组相比,修复组母鼠的末重、日增重和日平均采食量降低极显著(P<0.01)。
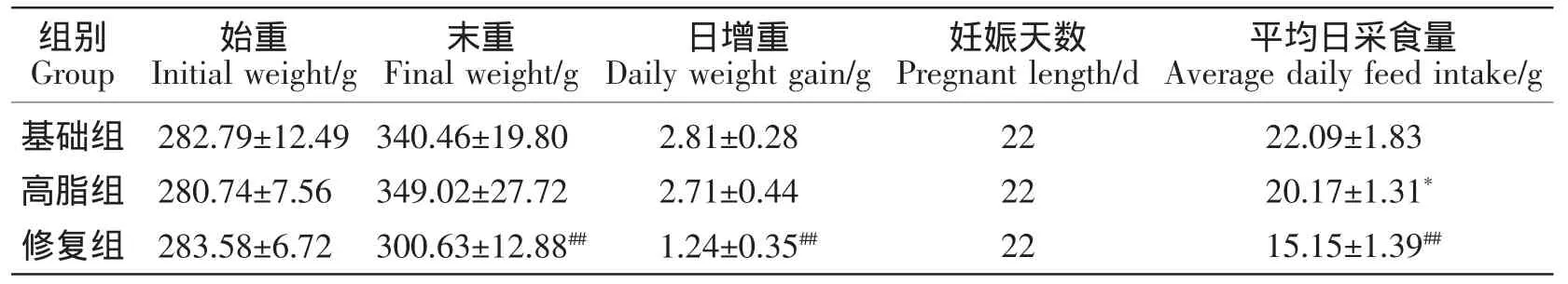
表1 母鼠的体重和采食量Table1 Weight and feed intake of female rats
2.2 产仔数和初生重、初生窝重
由表2可知,与基础组相比,高脂组母鼠的初生重、产仔数和初生窝重无显著变化(P>0.05);与高脂组相比,修复组母鼠产仔数和初生窝重无显著变化(P>0.05),初生重则显著降低(P<0.05)。
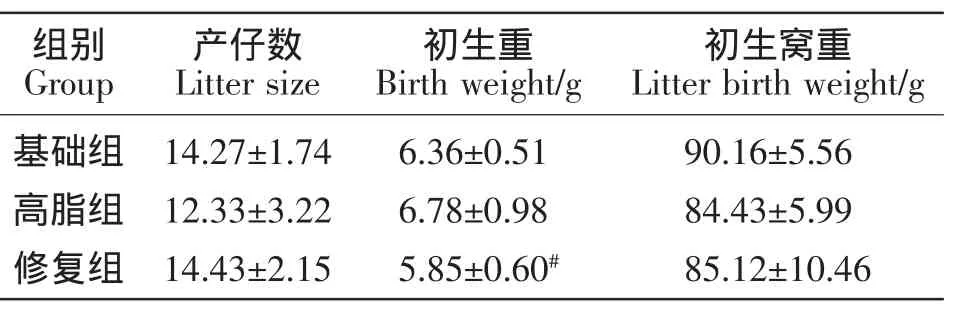
表2 产仔数和初生重、初生窝重Table2 Litter size and birth weight,birth litter weight
2.3 母鼠血浆抗氧化能力
由表3可以看出,与基础组相比,高脂组血浆中T-AOC、抑制羟基自由基能力、SOD和CAT活性显著降低(P<0.05),MDA 和蛋白羰基含量显著提高(P<0.05),血浆中 GSH-Px活性降低极显著(P<0.01);与高脂组相比,修复组极显著降低母鼠血浆中MDA和蛋白羰基的含量(P<0.01),显著提高了SOD活性和抑制羟基自由基能力(P<0.05),极显著提高母鼠血浆 T-AOC、CAT和GSH-Px活性(P<0.01)。
3 分析
3.1 高脂日粮加剧了妊娠母鼠的氧化应激
在妊娠过程中,胎儿对氧的需求量增加,细胞线粒体呼吸链中氧利用率升高,母体和胎儿ROS的产生增加[14]。MDA是氧自由基攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化而形成的脂质过氧化产物[15],是反映氧化损伤的最简单、可靠的指标之一[16],其含量的多少可以反映组织的脂质过氧化速率或强度[17]。蛋白质羰基是由于ROS通过金属催化氧化等方式氧化蛋白质侧链的残基或者是ROS通过α过酰胺化途径和谷氨酰基残基氧化途径,诱导蛋白质肽链断裂,造成蛋白质损伤[18],其含量反映蛋白质氧化损伤的程度。T-AOC是机体总抗氧化能力的反映,是一个敏感性较高的评价机体是否受到氧化损伤的指标[19]。抑制羟自由基的能力间接反映了羟自由基的水平[20]。SOD是体内氧自由基的特异性清除剂,能够将超氧阴离子自由基歧化生成过氧化氢和水,为机体抵抗氧化损伤的保护屏障之一[21-23],SOD的高低可以间接反映机体清除氧自由基的能力。CAT可以将SOD歧化生成的过氧化氢生成水和氧分子,保护机体免受自由基的损伤。GSH-Px分布在线粒体和细胞质中,是机体内广泛存在的一种重要的催化过氧化氢分解的酶,可以起到保护细胞膜结构和功能完整的作用[24]。自由基学说认为,自由基的一个重要危害主要表现在ROS能攻击生物膜上的多不和脂肪酸,引发膜脂质过氧化链式反应,导致自由基的扩增和膜脂质过氧化加深,过氧化脂质经过氧化物酶分解,生成MDA,MDA与蛋白质、肽类或脂类聚合、交联形成脂褐质,从而引起膜结构和功能的改变,加剧细胞的损伤[11]。
猪油含有40%~52%的油酸,10%左右的亚油酸,2.5%左右的亚麻酸,3%左右的花生四烯酸[25-26]。单不饱和脂肪酸主要是油酸,多不饱和脂肪酸有亚油酸、亚麻酸、花生四烯酸等[11]。龚灵芝等研究发现[11],饲喂高脂饲料会引起机体MDA含量增加、SOD和GSH-Px活力降低,与本试验结果相一致。本试验通过在饲粮中添加20%的猪油诱导孕鼠,血浆中T-AOC显著降低、MDA和蛋白羰基的含量显著提高(P<0.05),血浆中GSH-Px的活性降低极显著(P<0.01),抑制羟基自由基的能力、SOD和CAT的活力显著降低(P<0.05),表明孕鼠高脂氧化损伤模型建立成功。本试验还发现,高脂组的日增重、产仔数和初生窝重与基础组相比差异不显著而有降低的趋势,母鼠末重有增加的趋势,说明了高脂饲喂对孕鼠的体重和产仔能力带来的影响有限。

表3 母鼠血浆抗氧化指标Table3 Antioxidant indexes in plasma of female rats
3.2 微生物源性抗氧化剂提高了高脂诱导的妊娠母鼠的抗氧化能力,缓解了机体的氧化损伤
微生物源性抗氧化剂(micro-derived antioxidants,MA)是一种复合抗氧化剂,由多种微生物如乳酸杆菌、枯草芽胞杆菌、啤酒酵母等发酵底物提取的抗氧化剂,含有来源于这些菌及其培养物的胡萝卜素、维生素 B1、B2、B12、还原型维生素 C、槲皮酮-3-D 吡喃葡萄糖(栎素)、槲皮酮(类黄酮)、肌醇和多种微量元素的金属衍生物等[9]。
有研究发现,类黄酮能清除体内的自由基和抗脂质过氧化作用[26-27],胡萝卜素、维生素C等均为抗氧化性维生素,作为脂质过氧化自由基的清除剂,保护生物膜上的多不饱和脂肪酸及其他蛋白质巯基免受自由基攻击[27-28]。本试验发现,与高脂组相比,修复组极显著降低母鼠血浆中MDA的含量和蛋白羰基的含量(P<0.01),显著地提高了SOD的活性和抑制羟基自由基的能力(P<0.05),极显著地提高母鼠血浆的 T-AOC、CAT 和 GSH-Px的活性(P<0.01),表明机体的氧化损伤得到了缓解。之前的研究也表明,微生物源性抗氧化剂能提高妊娠母猪、肉鸡、LPS诱导氧化损伤大鼠的抗氧化能力,减轻了机体的氧化损伤[12,29-30],这与本试验研究结果一致,表明微生物源性抗氧化剂提高了高脂诱导的妊娠母鼠的抗氧化能力,缓解了机体的氧化损伤。本试验研究还发现,与高脂组相比,修复组母鼠的采食量极显著降低,这可能是微生物源性抗氧化剂影响了饲料的适口性,但在采食量降低的条件下,母鼠增重和仔鼠初生重下降,而产仔数和初生窝重不受影响,说明母鼠具有自身调节保证胎儿营养需要的能力,微生物源性抗氧化剂通过缓解机体氧化损伤,促进了母鼠繁殖机能的发挥。母鼠采食量降低,是否是因为微生物源性抗氧化剂适口性差所致,需要进一步研究。
4 结论
微生物源性抗氧化剂可以缓解高脂日粮诱导的妊娠母鼠的氧化损伤,提高机体的抗氧化能力,促进母鼠繁殖机能的发挥。
[1]余思佳,施东辉,朱勇,等.繁殖母羊的氧化应激和氧化损伤研究[J].动物营养学报,2017(3):814-823.
[2]MYATT L,CUI X.Oxidative stress in the placenta[J].Histochemistry and Cell Biology,2004,122(4):369-382.
[3]吴永霞,董国忠,贾亚伟.氧化应激对奶牛的危害及其防治[J].中国饲料,2011(4):32-35.
[4]MORRIS J M,GOPAUL N K,ENDRESEN M J R,et al.Circulating markers of oxidative stress are raised in normal pregnancy and pre-eclampsia[J].BJOG:An International Journal of Obstetrics&Gynaecology,1998,105(11):1195-1199.
[5]LITTLE R E,GLADEN B C.Levels of lipid peroxides in uncomplicated pregnancy:a review of the literature[J].Reproductive Toxicology,1999,13(5):347-352.
[6]MIN J,PARK B,KIM Y J,et al.Effect of oxidative stress on birth sizes:consideration of window from mid pregnancy to delivery[J].Placenta,2009,30(5):418-423.
[7]卓勇,吴德,林燕,等.高脂日粮对孕鼠胎盘养分转运及胎鼠宫内生长的影响[J].营养学报,2010(5):451-455.
[8]YIDA Z,IMAM M U,ISMAIL M,et al.High fat diet-induced inflammation and oxidative stress are attenuated by N-acetylneuraminic acid in rats[J].Journal of Biomedical Science,2015,22(1):96.
[9]谷娟,陈小连,李杏,等.微生物源性抗氧化剂对小鼠抗氧化性能及免疫功能的影响[J].生物技术通报,2012(9):16.
[10]蔡旋,陈小连,杨帆,等.微生物源性抗氧化剂体外抗氧化能力的初步研究[J].生物技术,2011,21(6):84-87.
[11]龚灵芝,陈小连,徐建雄.微生物源性抗氧化剂对高不饱和脂肪酸饲料致大鼠自由基损伤模型的影响[J].饲料工业,2008,29(20):32-34.
[12]陈小连,孙婷婷,徐建雄.微生物源性抗氧化剂对大鼠抗氧化及损伤修复的作用[J].中国饲料,2010(22):11-15.
[13]陈小连,龚灵芝,徐建雄.微生物源性抗氧化剂对氧化应激大鼠抗氧化能力和肝细胞DNA损伤的作用研究[J].饲料工业,2012,33(1):14-17.
[14]MUTINATI M,PICCINNO M,RONCETTI M,et al.Oxidative stress during pregnancy in the sheep[J].Reproduction in Domestic Animals,2013,48(3):353-357.
[15]王友令,张胜,唐兆新.氨基胍对内毒素血症肉鸡肝线粒体自由基代谢的影响[J].中国兽医科学,2006,36(2):143-146.
[16]FANG Y Z,ZHENG R L.Theory and application of free radical biology[M].Beijing:The Science Publishing House,2002:23-48.
[17]ZHENG R L,HUANG Z Y.Basics of free radical medicine and agriculture[M].Beijing:China Higher Education Press,2001:105-143.
[18]STADTMAN E R,LEVINE R L.Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J].Amino Acids,2003,25(3/4):207-218.
[19]李桂玲.产程中静脉补充能量的效果研究[J].中国医药科学,2011,1(10):79-79.
[20]LUO Z,ZHU W,GUO Q,et al.Weaning induced hepatic oxidative stress,apoptosis,and aminotransferases through MAPK signaling pathways in piglets[J].Oxidative Medicine and Cellular Longevity,2016,Article ID 4768541,10 pages,2016.doi:10.1155/2016/4768541.
[21]VAZIRI N D,LIN C Y,FARMAND F,et al.Superoxide dismutase,catalase,glutathione peroxidase and NADPH oxidase in lead-induced hypertension[J].Kidney Int,2003(63):186-194.
[22]FUKAI T,FOLZ R J,LANDMESSER U,et al.Extracellular superoxide dismutase and cardiovascular disease[J].Cardiovasc Res,2002(55):239-249.
[23]MALECKA A,JARMUSZKIEWICZ W,TOMASZEWSKA B.Antioxidative defense to lead stress in subcellular compartments of pea root cells[J].Acta Biochimica Pilonica,2001,48(3):687-698.
[24]金婧.LPS致新生大鼠急性肺损伤促炎性细胞因子、抗炎性细胞因子和NF-κB变化及N-乙酰半胱氨酸干预作用的研究[D].沈阳:中国医科大学,2004.
[25]华聘聘.猪油的改性和利用[J].粮食与食品工业,1997(4):10.
[26]姚蒙正.精细化工产品合成原理[M].2版,北京:中国石化出版社,2000:595-597.
[27]ESTERBAUER H,GEBICKI J,PUHL H,et al.The role of lipid peroxidation and antioxidants in oxidative modification of LDL[J].Free Radical Biology and Medicine,1992,13(4):341-390.
[28]MATES J M.Effects of antioxidant enzymes in the molecular control of reactive oxygen species toxicology[J].Toxicology,2000,153(1):83-104.
[29]孙婷婷,徐建雄.微生物源性抗氧化剂对母猪繁殖性能和自由基代谢的影响[J].上海交通大学学报(农业科学版),2007,25(4):342-346.
[30]李杏,陈小连,朱丽慧,等.微生物源性抗氧化剂对肉鸡抗氧化性能和免疫功能的影响[J].饲料研究,2012(2):7-10.
Effects of Micro-Derived Antioxidants on Antioxidant Capacity and Litter Size in High Fat Diet-Induced Pregnant Rats
ZHAOSen,LIShao-hua,XUXue,ZHONGQiu-shi,ZHANGJing,XUWei-na,XUJian-xiong*
(Shanghai Key Laboratory of Veterinary and Biotechnology,School of Agriculture and Biology,Shanghai200240,China)
【Objective】The aim of this study was to investigate the effects of micro-derived antioxidants(MA)on the antioxidant capacity and reproductive performance of high fat diet-induced oxidative stress in pregnant rats.【Methods】Eighteen pregnant SD rats with similar body weight were randomly divided into 3 groups(6 rats in each group),the control group(C),high fat diet group(HF)and high fat diet with 2%MA group(repair group,R).The experiment was started from the first day of pregnancy to the end of delivery,and the data of reproductive performance were recorded.Maternal blood were collected after delivery,andplasmawereseparatedto determine antioxidant indexes.【Results】Compare with the C group,there was no significant difference between weight and daily gain(P>0.05)in HF group.The average daily feed intake in the HF group was significantly lower than that of the C group(P<0.05),but the litter size,the litter weight and the primary weight did not show significant difference(P>0.05).Compared with the HF group,the litter weight,average daily feed intake and daily gain were extremely decreased in the R group(P<0.01).However,no significant difference of the litter size and litter weight were observed(P>0.05).Compared with the C group,HF group significantly decreased the activities of the inhibitory hydroxyl ability(IHA),SOD and CAT(P<0.05),and the contents of MDA and protein carbonyl were significantly increased(P<0.05),the T-AOC and GSH-Px in plasma was extremely decreased(P<0.01);Compared with the HF group,the R group extremely increased the activity of T-AOC,CAT and GSH-Px(P<0.01)in plasma,significantly increased the activity of SOD and IHA(P<0.05).【Conclusion】MA improved the antioxidant capacity reversed the high fat-induced oxidative damage,enhance the female rat reproductive performance.
micro-derived antioxidants;antioxidant capacity;oxidative damage;pregnant;rats
S816.7
A
1000-2650(2017)04-0594-05
10.16036/j.issn.1000-2650.2017.04.021
2017-05-18
上海市闵行区产学研合作计划项目(2016MH280)。
赵森,硕士研究生。*责任作者:徐建雄,教授,主要从事动物营养学研究,E-mail:jxxu1962@sjtu.edu.cn。
(本文审稿:曾长军;责任编辑:秦碧雯;英文编辑:刘益平)

