巨噬细胞移动抑制因子在肾癌中的表达及对肾癌细胞侵袭能力的影响*
孙连桃,肖伟利
(1.包头医学院医学技术学院,内蒙古包头 014040;2.内蒙古自治区人民医院检验科,呼和浩特 010017)
·论著·
巨噬细胞移动抑制因子在肾癌中的表达及对肾癌细胞侵袭能力的影响*
孙连桃1,肖伟利2
(1.包头医学院医学技术学院,内蒙古包头 014040;2.内蒙古自治区人民医院检验科,呼和浩特 010017)
目的探讨巨噬细胞移动抑制因子(MIF)在肾癌组织中的表达及对肾癌细胞侵袭能力的影响。方法以内蒙古自治区人民医院和包头市肿瘤医院2013年3月至2015年3月病理室确诊的49例肾癌患者为研究对象,采用蛋白质印迹法(Western blot)及反转录(RT)-PCR法检测肾癌组织及癌旁正常组织、肾癌细胞株及正常肾小管上皮细胞HK-2中MIF蛋白及mRNA表达;利用脂质体将siRNA MIF及siRNA NC转染到肾癌细胞中,Western blot及RT-PCR检测转染效果,噻唑蓝(MTT)法检测细胞活力,Transwell法检测细胞侵袭能力,Western blot检测细胞中缺氧诱导因子-1α(HIF-1α)及基质金属蛋白酶9(MMP9)的表达。结果肾癌组织中MIF蛋白及mRNA表达水平明显高于癌旁正常组织(0.89±0.09vs. 0.18±0.02,1.19±0.04vs. 0.19±0.01,P<0.05),肾癌细胞株ACHN、769-p、786-O、Caki-1中MIF蛋白及mRNA表达水平明显高于肾小管上皮细胞HK-2(P<0.05)。与siRNA NC组比较,siRNA MIF组中MIF蛋白及mRNA表达水平明显下调(P<0.05),细胞活力及侵袭能力降低(P<0.05),HIF-1α及MMP9表达水平下调(P<0.05)。结论MIF在肾癌中高表达,下调MIF表达能明显抑制肾癌细胞的侵袭能力,可能与抑制HIF-1α/MMP9信号通路有关。
肾肿瘤;巨噬细胞移动抑制因子;侵袭
肾细胞癌又称为肾癌,是泌尿生殖系统中常见的恶性肿瘤,仅次于膀胱癌,其中肾透明细胞癌是最常见的病理类型。近些年来虽然随着医学影像技术手段的不断发展,肾癌的早期诊断率大大提高,但是有部分患者在早期诊断时就发现转移性病灶,使得5年生存率不足10%[1-2]。因此,寻找更为高效、特异性的早期标记物及探讨肾癌的发病机制对于肾癌的诊断及治疗将具有积极意义。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种来源于活化的T淋巴细胞、单核/巨噬细胞的多功能因子,受下丘脑垂体控制。近些年研究表明MIF不仅参与机体免疫反应、炎性反应,还在众多肿瘤的发生、发展中起着促进作用,并与肿瘤的侵袭、浸润呈正相关,推测MIF是一个潜在的肿瘤标记物[3-5]。另外,有研究表明肾癌患者血清MIF表达水平显著高于健康对照[6]。本课题组前期也采用免疫组织化学法证实MIF在肾癌组织中高表达,并与肿瘤的分化程度、淋巴结转移密切相关,但对于MIF在肾癌发生、发展中的具体作用机制尚未见报道。因此,本研究将采用蛋白质印迹法(Western blot)及实时荧光定量PCR进一步检测癌组织及癌细胞株中MIF的表达,并探讨MIF在肾癌中的作用机制。
1 材料与方法
1.1标本来源 以内蒙古自治区人民医院和包头市肿瘤医院泌尿外科2013年3月至2015年3月病理室确诊的49例肾癌患者为研究对象,男30例,女19例;年龄40~74岁,中位年龄57岁,<60岁者20例,≥60岁者29例。收集所有患者肿瘤组织石蜡标本(均为肾透明细胞癌),另外取相应的肾癌旁正常组织作为对照。所有患者术前均未接受过任何的化疗、放疗、靶向治疗及免疫治疗。
1.2细胞株 人肾癌细胞株ACHN及769-p,人肾透明细胞癌细胞株786-O及Caki-1,肾小管上皮细胞HK-2均购自中国科学院细胞库。
1.3仪器与试剂 噻唑蓝(MTT),DMEM培养基均购自美国Hyclone公司;二喹啉甲酸(BCA)蛋白水平测定试剂盒,辣根过氧化物酶标记山羊抗兔IgG(H+L)均购自上海碧云天生物技术有限公司;trizol试剂盒,一步法反转录(RT)-PCR试剂盒,LipofectamineTM2000均购自大连宝生生物技术有限公司;siRNA MIF及siRNA NC均购自广州锐博生物技术有限公司;兔抗人MIF,缺氧诱导因子-1α(HIF-1α),基质金属蛋白酶9(MMP9)及3-磷酸甘油醛脱氢酶(GAPDH)多克隆抗体均购自美国Abcam公司。MK3酶标仪购自美国Thermo公司;TS100倒置荧光显微镜购自日本Nikon公司;2720型PCR仪购自美国ABI公司;DYCZ-25D型双垂直电泳仪,DYCZ-25D型转印电泳仪均购自北京六一生物科技有限公司;ChemiDocTM XRS凝胶成像系统购自美国Bio-Rad公司。
1.4方法
1.4.1细胞转染 当肾癌细胞汇合度达到50%左右时,利用LipofectamineTM2000脂质体将siRNA MIF及siRNA NC转染到细胞中,6 h以后换液;继续培养48 h。Western blot及实时荧光定量PCR法检测细胞中MIF蛋白及mRNA水平。
1.4.2RT-PCR检测MIF mRNA表达 采用trizol试剂盒提取细胞总RNA,并检测总RNA纯度,以260 nm与280 nm处吸光度值比值(A260/A280)说明RNA纯度的良好;接着一步法RT-PCR试剂盒将RNA反转录,最后进行实时荧光定量PCR扩增,扩增结果利用2-ΔΔCT法进行分析。MIF上游引物:5′-CAC TGA AGC GGG AAG GGA CT-3′,下游引物:5′-GCG GCG ATA CCG TAA AGC AC-3′;GAPDH上游引物:5′-AGC CAC ATC GCT CAG ACA-3′,下游引物:5′-TGG ACT CCA CGA CGT ACT-3′。
1.4.3Western blot检测MIF、HIF-1α及MMP9蛋白的表达 在获得的组织或细胞中加入细胞裂解液,裂解30 min,4 ℃条件下离心得到的上清液就是总蛋白。接着采用BCA试剂盒测定蛋白水平。蛋白煮沸10 min变性,上样,进行十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳1~2 h,湿法转膜30~50 min。5%脱脂奶粉封闭1 h,一抗溶液(兔抗人MIF、HIF-1α、MMP9及GAPDH多克隆抗,稀释度为1∶100)孵育,4 ℃过夜;二抗溶液[辣根过氧化物酶标记山羊抗兔IgG (H+L),稀释度1∶200]室温孵育1~2 h。于凝胶成像系统中曝光。用Quantity one软件分析各抗体条带灰度值。
1.4.4MTT法检测细胞活力 将肾癌细胞接种到96孔板,培养24 h后,按1.4.1方法进行转染,继续培养48 h后,加入20 μL MTT,继续培养4 h,将96孔板中的上清液弃去,再加入150 μL二甲基亚砜,震荡使结晶物溶解,于酶标仪560 nm波长处测A值,A值即代表细胞活力。
1.4.5Transwell法检测细胞侵袭能力 将Transwell小室铺上Matrigel备用。将肾癌细胞接种到6孔板,24 h后,按1.4.1方法进行转染,继续培养48 h后,细胞消化并接种到Transwell上室,而下室仅含有DMEM培养基,继续培养48 h后,将小室取出,用多聚甲醛固定,结晶紫染色,最后在倒置显微镜下观察细胞侵袭情况,并对下室的5个视野中的细胞数目进行计数,取平均值,即为细胞的侵袭数目。
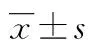
2 结 果
2.1MIF在肾癌组织及癌旁正常组织中的表达 如图1所示,Western blot结果显示肾癌组织中MIF蛋白表达水平(0.89±0.09)明显高于癌旁正常组织(0.18±0.02),差异有统计学意义(P<0.05)。如图2所示,RT-PCR结果显示肾癌组织中MIF mRNA表达水平(1.19±0.04)明显高于癌旁正常组织(0.19±0.01),差异有统计学意义(P<0.05)。
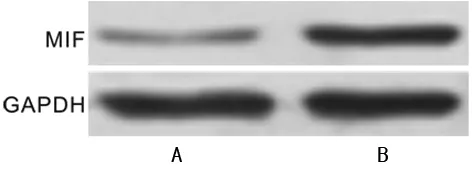
A:癌旁正常组织;B:肾癌组织
图1肾癌组织及癌旁正常组织中MIF蛋白的表达
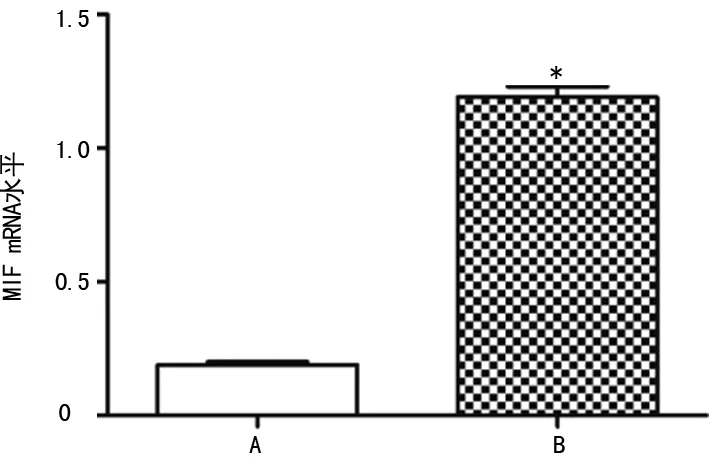
A:癌旁正常组织;B:肾癌组织;*:P<0.05,与癌旁正常组织比较
图2肾癌组织及癌旁正常组织中MIF mRNA的表达
2.2MIF在肾癌细胞株及肾小管上皮细胞HK-2中的表达 如图3所示,Western blot结果显示肾癌细胞株ACHN(0.92±0.09),769-p(0.88±0.09),786-O(0.80±0.09),Caki-1(1.15±0.10)中MIF蛋白表达水平明显高于肾小管上皮细胞HK-2(0.17±0.02),差异有统计学意义(P<0.05)。如图4所示,RT-PCR结果显示肾癌细胞株ACHN(0.59±0.13),769-p(0.63±0.09),786-O(1.03±0.09),Caki-1(1.24±0.09)中MIF mRNA表达水平明显高于肾小管上皮细胞HK-2(0.18±0.02),差异有统计学意义(P<0.05)。
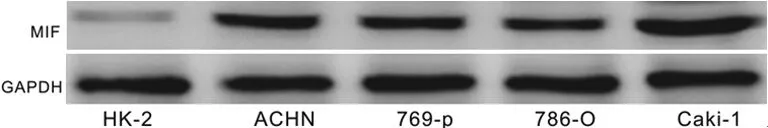
图3 肾癌细胞株及肾小管上皮细胞HK-2中 MIF蛋白的表达
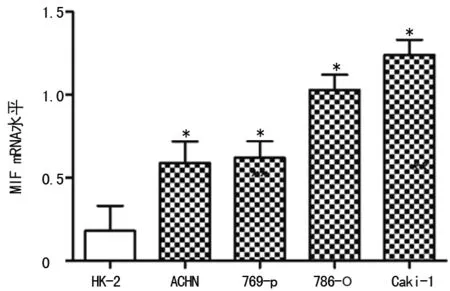
*:P<0.05,与HK-2比较
图4肾癌细胞株及肾小管上皮细胞HK-2中MIF mRNA的表达
2.3siRNA转染效果的测定 肾癌细胞Caki-1转染siRNA MIF及siRNA NC 48 h后,Western blot结果显示与siRNA NC组(0.97±0.10)比较,siRNA MIF组(0.16±0.01)中MIF蛋白表达水平明显降低(P<0.05),见图5;RT-PCR结果显示与siRNA NC组(1.15±0.15)比较,siRNA MIF组(0.36±0.03)中MIF mRNA表达水平明显降低(P<0.05),见图6。
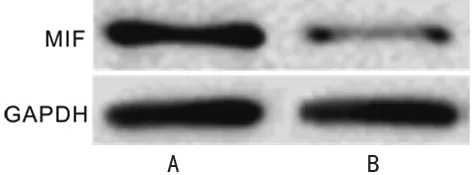
A:siRNA NC组;B:siRNA MIF组
图5 siRNA转染后肾癌细胞Caki-1中MIF蛋白的表达
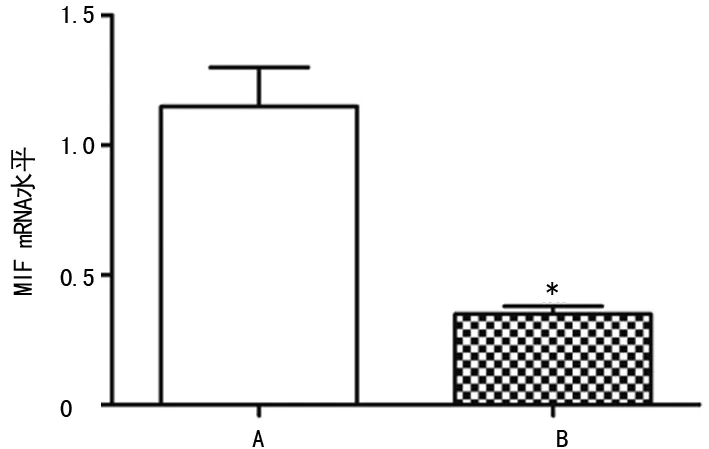
A:siRNA NC组;B:siRNA MIF组;*:P<0.01,与siRNA NC组比较
图6 siRNA转染后肾癌细胞Caki-1中MIF mRNA的表达
2.4siRNA MIF对肾癌细胞活力的影响 肾癌细胞株Caki-1转染siRNA MIF及siRNA NC 48 h后,MTT法检测结果显示与siRNA NC组(0.68±0.06)比较,siRNA MIF组(0.32±0.03)细胞活力明显降低(P<0.05),见图7。
2.5siRNA MIF对肾癌细胞侵袭能力的影响 肾癌细胞株Caki-1转染siRNA MIF及siRNA NC 48 h后,Transwell实验结果显示与siRNA NC组(138.95±13.40)比较,siRNA MIF组(42.19±4.21)细胞迁移数目明显减少(P<0.05),见图8。
2.6siRNA MIF对肾癌细胞中HIF-1α及MMP9表达的影响 肾癌细胞株Caki-1转染siRNA MIF及siRNA NC 48 h后,Western blot结果显示与siRNA NC组比较,siRNA MIF组HIF-1α[(0.73±0.06)vs.(0.18±0.02)]及MMP9[(0.70±0.07)vs.(0.20±0.02)]表达水平明显下调(P<0.05),见图9。
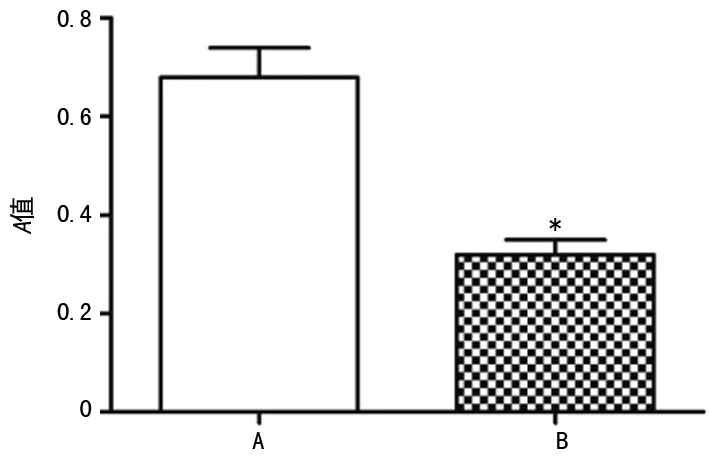
A:siRNA NC组;B:siRNA MIF组;*:P<0.01,与siRNA NC组比较
图7 siRNA MIF对肾癌细胞活力的影响
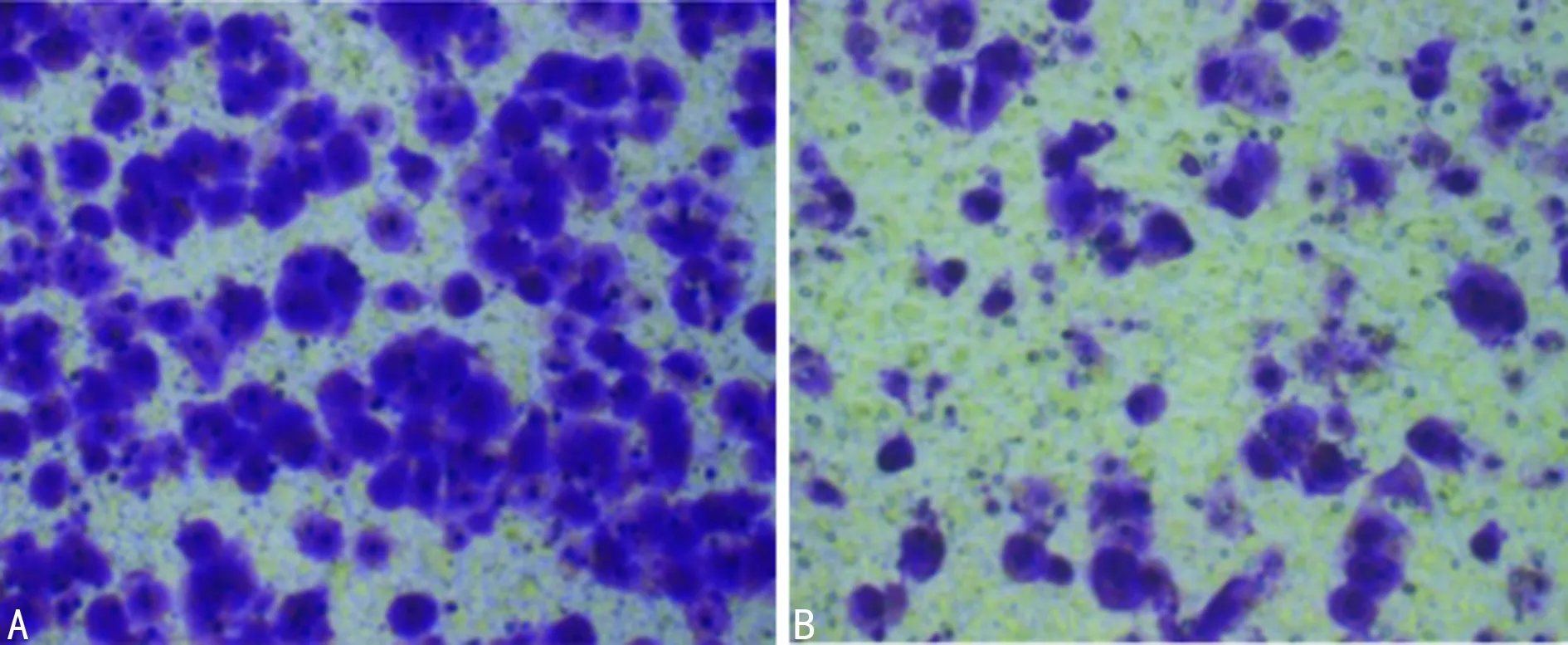
A:siRNA NC组;B:siRNA MIF组
图8 siRNA MIF对肾癌细胞侵袭能力的影响
(结晶紫染色,×200)
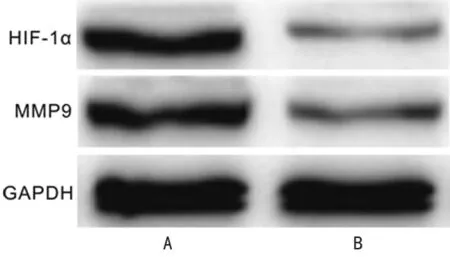
A:siRNA NC组;B:siRNA MIF组
图9 siRNA MIF对肾癌细胞中HIF-1α及MMP9表达的影响
3 讨 论
MIF是1970年学者在迟发型反应研究中发现的一种能够抑制巨噬细胞移动的因子,位于人第22号染色体上。MIF来源于活化的T淋巴细胞,能够表达于肾小管上皮细胞、肝细胞、表皮细胞等,能通过内分泌或者旁分泌促进多种细胞因子的分泌,进而引起各种免疫或炎性反应[3-4]。近年来,研究还证实MIF在肝癌、胃癌、大肠癌、乳腺癌等多种肿瘤组织中高表达,对肿瘤的发生、发展起着促进作用,被认为是一种促癌因子[7-9]。另外,2013年Du等[6]利用酶联免疫吸附试验(ELISA)证实了肾透明细胞癌患者血清中MIF表达水平显著高于健康对照组。本研究前期免疫组织化学结果也证实肾癌组织中MIF阳性表达率显著高于癌旁正常组织,而且MIF的表达与肿瘤分化程度、临床分期、淋巴结转移密切相关。提示MIF在肾癌的发生、发展中也起着推动作用,可能是肾癌潜在的早期标记物,但是MIF在肾癌的发生、发展中的作用机制尚未见报道,所以本课题组对此展开研究。本研究首先采用Western blot及RT-PCR法检测肾癌及癌旁正常组织中MIF蛋白及mRNA的表达,结果与本课题组前期免疫组织化学结果及Du等[6]研究结果一致,MIF在肾癌组织中高表达。接着,继续采用Western blot及实时荧光定量PCR法检测肾癌细胞株及正常肾小管细胞HK-2中MIF的表达,结果表明肾癌细胞株中MIF蛋白及mRNA表达水平均明显高于HK-2,与MIF在组织中的表达趋势一致[7-9]。进一步说明MIF在肾癌的发生、发展中起着促进作用,提示通过干扰并下调肾癌中MIF的表达进而抑制肾癌的发生、发展。因此,本研究首先利用脂质体将siRNA MIF及siRNA NC转染到肾癌细胞Caki-1中,并证实转染成功。接着利用MTT法证实siRNA MIF能显著降低Caki-1细胞活力,与Du等[6]采用发夹RNA干扰肾癌细胞中MIF表达,能显著降低细胞活力及细胞克隆形成能力的研究结果一致。从而说明下调肾癌细胞中MIF表达,能显著抑制肾癌细胞的增殖。
随着肿瘤恶性程度的加深,肿瘤细胞代谢越加旺盛,进而使得肿瘤细胞处于缺血、缺氧的微环境中,因此为了使细胞能够适应此微环境,肿瘤内部会对低氧环境做出反应以满足细胞稳定快速的生长。其中HIF-1α是一种为适应缺氧微环境而产生的核转录调控因子,在正常氧环境下,HIF-1α被降解,表达水平极低,而在低氧环境下,HIF-1α呈倍数的增长,并结合于靶基因的低氧反应元件,调控靶基因的转录活性,进而促进肿瘤的糖代谢,血管生成,细胞增殖及侵袭转移等[10-11]。研究已经显示,HIF-1α在众多肿瘤组织中高表达,并且MIF的存在能够抑制HIF-1α的降解及突变,进而促进肿瘤细胞的快速生长与浸润[10-11]。另外肿瘤的侵袭转移是影响肾癌患者术后预后的重要因素之一,而肿瘤的侵袭转移涉及肿瘤细胞穿过细胞外基质、血管壁基膜等过程,而MMPs是介导细胞外基质降解,促使肿瘤细胞穿膜的最为主要的蛋白水解酶[12-13]。其中MMP9是MMPs家族最大的水解酶,能够降解包括Ⅳ型胶原在内的最为重要的基质成分。而且研究表明,MMP9基因的5′UTR区域存在着HIF-1α的结合位点,HIF-1α对于MMP9具有显著的调控作用,如研究证实通过调控HIF-1α/MMP9途径能够显著抑制胃癌的生长及侵袭[14]。同时研究还表明,MIF能直接调控MMPs表达进而影响肿瘤细胞的侵袭转移,如RNA干扰口腔鳞状细胞Tca8113、HN5及SCC25中MIF表达,能显著下调MMP9表达,继而抑制癌细胞侵袭[15]。说明MIF可能通过调控HIF-1α/MMP9通路进而影响肾癌细胞的生长侵袭。所以本研究继续利用Western blot检测siRNA MIF对Caki-1细胞中HIF-1α、MMP9表达水平的影响,结果表明siRNA能显著下调HIF-1α及MMP9表达。
综上所述,MIF在肾癌组织及肾癌细胞(ACHN、769-p、786-O、Caki-1)中高表达,利用RNA干扰Caki-1肾癌细胞中MIF表达,能显著下调MIF蛋白及mRNA表达,并降低细胞活力及侵袭能力,可能与抑制HIF-1α/MMP9信号通路有关。
[1]Speed JM,Trinh QD,Choueiri TK,et al.Recurrence in localized renal cell carcinoma:a systematic review of contemporary data[J].Curr Urol Rep,2017,18(2):15.
[2]Shen J,Chen Z,Zhuang Q,et al.Prognostic value of serum lactate dehydrogenase in renal cell carcinoma:a systematic review and meta-analysis[J].PLoS One,2016,11(11):e0166482.
[3]赵然,姚伟娟.巨噬细胞迁移抑制因子的功能及临床研究进展[J].生理科学进展,2014,45(2):93-99.
[4]樊根涛.巨噬细胞移动抑制因子在肿瘤发病机制中的研究进展[J].医学研究生学报,2013,26(1):77-79.
[5]王苗锋,熊茂明,李火友,等.大肠癌组织中VEGF、MIF的表达及临床意义[J].重庆医学,2015,44(11):1478-1480.
[6]Du W,Wright BM,Li X,et al.Tumor-derived macrophage migration inhibitory factor promotes an autocrine loop that enhances renal cell carcinoma[J].Oncogene,2013,32(11):1469-1474.
[7]马宁,周云.胃癌组织中miR-451与MIF的表达及与临床病理的关系[J].中国老年学杂志,2015,35(3):655-656.
[8]张珺,吴奎,肖峻,等.膀胱尿路上皮癌中MIF与VEGF的表达及其临床意义[J].安徽医科大学学报,2014,49(3):354-358.
[9]Richard V,Kindt N,Saussez S.Macrophage migration inhibitory factor involvement in breast cancer (Review)[J].Int J Oncol,2015,47(5):1627-1633.
[10]付彪,李永翔,赵志杰.HIF-1α、M ACC1、FOXO4与胃癌病理和预后的关系[J].重庆医学,2015,44(9):1180-1183.
[11]李启荣,师永红.缺氧诱导因子1降解-泛素化研究进展[J].中华肿瘤防治杂志,2013,20(17):1371-1374.
[12]Bolster F,Durcan L,Barrett C,et al.Renal cell carcinoma:accuracy of multidetector computed tomography in the assessment of renal sinus fat invasion[J].J Comput Assist Tomogr,2016,40(6):851-855.
[13]Santoni M,Massari F,Amantini C,et al.Emerging role of tumor-associated macrophages as therapeutic targets in patients with metastatic renal cell carcinoma[J].Cancer Immunol Immunother,2013,62(12):1757-1768.
[14]何丽琳,沈永祥,周中银,等.姜黄素下调HIF-1α/MMP-9通路抑制人胃癌裸鼠移植瘤生长[J].肿瘤防治研究,2013,40(8):737-742.
[15]Zeng J,Quan JJ,Xia XF.Transient transfection of macrophage migration inhibitory factor small interfering RNA disrupts the biological behavior of oral squamous carcinoma cells[J].Mol Med Rep,2016,13(1):174-180.
Expressionofmacrophagemigrationinhibitoryfactorinrenalcarcinomaanditseffectoninvasionabilityofrenalcarcinomacell*
SunLiantao1,XiaoWeili2
(1.SchoolofMedicalTechnology,BaotouMedicalColloge,Baotou,InnerMongolia014040,China;2.DepartmentofClinicalLaboratory,InnerMongoliaAutonomousRegionPeople′sHospital,Hohhot,InnerMongolia010017,China)
ObjectiveTo explore the expression of macrophage migration inhibitory factor (MIF) in renal carcinoma tissue and its effect on invasion of renal carcinoma cell.MethodsForty-eight cases of patients definitely diagnosed with renal cancer in the Department of Pathology,the Inner Mongolia Autonomous Region People′s Hospital and Baotou Municipal Tumor Hospital from March 2013 to March 2015 served as the research subjects.The expressions of MIF protein and mRNA in renal carcinoma tissues and adjacent normal tissues,renal carcinoma cell lines and normal renal tubular epithelial cells HK-2 were detected by adopting the Western blot and RT-PCR.siRNA MIF and siRNA NC were transfected into renal carcinoma cells by liposome.The transfection effect was detected by Western blot and RT-PCR.The cell viability and invasion ability were measured by MTT and Transwell method respectively.The expression of hypoxia inducible factor 1-alpha (HIF-1α) and matrix metalloproteinase 9 (MMP9) was measured by Western blot.ResultsThe expression levels of MIF protein and mRNA in renal carcinoma tissues were significantly higher than those in adjacent normal tissues (0.89±0.09vs. 0.18±0.02,1.19±0.04vs. 0.19±0.01,P<0.05).The expression levels of MIF protein and mRNA in renal cancer cell line ACHN,769-p,786-O,Caki-1 cells were higher than those in renal tubular epithelial HK-2 cells (P<0.05).Compared with the siRNA NC group,the expression levels of MIF protein and mRNA in siRNA MIF group were significantly down-regulated (P<0.05),the cell viability and invasion ability were reduced (P<0.05),and the expressions of HIF-1α and MMP9 were down regulated (P<0.05).ConclusionMIF is highly expressed in renal carcinoma,down-regulating MIF expression can significantly inhibit the renal cancer cell invasion,which might be related with inhibiting HIF-1α/MMP9 signaling pathway.
kidney neoplasms;macrophage migration inhibitory factor;invasion
10.3969/j.issn.1671-8348.2017.35.001
内蒙古自治区自然科学基金(2014MS0807)。
孙连桃(1972-),副教授,硕士,主要从事医学检验研究。
R737.11
A
1671-8348(2017)35-4897-04
2017-06-26
2017-09-12)

