3株分离自高寒草甸根际芽孢杆菌的分子鉴定及其生物活性
吴晓晖,谢永丽,Renato D′Ovidio, 张 英,芦光新,辛总秀, Stefania Masci
(1.青海大学农牧学院 高原草地资源与生态省部共建重点实验室,青海 西宁 810016;2.意大利Tuscia大学农学院农业生物学和农业化学实验室,意大利 Viterbo 01100)
3株分离自高寒草甸根际芽孢杆菌的分子鉴定及其生物活性
吴晓晖1,谢永丽1,Renato D′Ovidio2, 张 英1,芦光新1,辛总秀1, Stefania Masci2
(1.青海大学农牧学院 高原草地资源与生态省部共建重点实验室,青海 西宁 810016;2.意大利Tuscia大学农学院农业生物学和农业化学实验室,意大利 Viterbo 01100)
为青海省退化草地植被恢复、提高地上生物量筛选优良的生防芽孢杆菌菌源,采用16S rDNA及gyrB基因序列分析法,鉴定分离自青海省黄南州高寒草甸高山嵩草(Kobresiapygmaea)根围的3株芽孢杆菌菌株;平板对峙试验检测菌株拮抗病原真菌活性;菌悬液(细胞浓度为106cfu·mL-1)浸种以检测菌株对植物催芽及促生效果;CMC、Gram染色法及DNS法检测菌株降解纤维素活性,并扩增菌株降解纤维素酶编码基因。结果表明,菌株HNC3被鉴定为短小芽孢杆菌(Bacilluspumilus),菌株HNC8、HNC11被鉴定为苏云金芽孢杆菌(Bacillusthuringiensis);3株菌株对小麦赤霉病菌(Fusariumgraminearum)、瓜类枯萎病菌(Fusariumoxysporum)具有明显的拮抗活性(抑菌圈平均直径均≥11 mm);3株菌株对小麦(Triticumaestivum)种子具有明显的催芽及促生效果;小麦种子经菌株HNC3菌悬液处理后,芽长、根长增加率分别达55%、80%;菌株HNC3降解纤维素酶活高达367.51 U·mL-1,并在该菌株中扩增到地衣聚糖酶(Lichenase,blg1S)、甘露糖苷酶(mannosidase,ManSig)、木聚糖酶(xylanase,xynD、xynB)4个纤维素酶编码基因。分离自青藏高原高寒草甸根围的3株芽孢杆菌兼具拮抗、催芽、促生及降解纤维素活性,在高原草地植被恢复、生态农牧业中具有一定的研究及应用潜力。
高寒草甸;生防芽孢杆菌;分子鉴定;催芽促生
高寒草甸是青藏高原典型生境,是三江源区主要草地类型。青藏高原海拔高、温度低、紫外线强,特殊生境使高寒牧草普遍生长缓慢[1]。近年来,由于鼠虫危害、过度放牧、对草地缺乏科学管理等因素,致使优良牧草退化,滋生了大量毒杂草,高寒草甸草皮剥落严重,土壤裸露,生态环境日益恶化,草地退化为“黑土滩”[2]。大面积“黑土滩”退化草地的形成影响了该地区牧民和家畜的生存发展,也威胁着三江源中下游地区的生态平衡[3]。因此,加速牧草生长、恢复生态植被、提高草地生物量,在高原草地生态环境恢复及治理中尤为重要。
草地土壤微生物推动着草地生态系统的能量流动和物质循环,维持着草地生态系统正常运转,是草业研究领域的热点[4]。芽孢杆菌(Bacillus)是一类重要的植物根围促生菌(plant growth-promoting rhizobacteria, PGPR),生理特征丰富多样,能产生对紫外线、干旱、低温、盐碱等逆境有抗性的芽孢,环境适应性强,被广泛应用于农业、食品加工、环保、医药等多个方面[5]。部分芽孢杆菌可通过多途径促生机制的相互作用提高植物抗病性,从而促进植物生长。芽孢杆菌可通过定殖在植物根际、体表及体内,与病原菌竞争植物周围的营养,分泌抗菌物质以抑制病原菌生长,同时诱导植物防御系统抵御病原菌入侵,通过与病原菌竞争根围营养和根部侵染空间位点、分泌抗菌物质抑制病原菌的生长和扩展或激发植物诱导系统抗性,从而达到使植物抵御病原菌侵染的目的,使芽孢杆菌在植物病害生物防治中具有潜在的应用价值[6]。芽孢杆菌在生命活动中的代谢产物对于调节植物生长、改善植物营养状况有良好的作用,这对于草地植被恢复和草地生物量的提高有重要的意义,是具有应用前景的生物农药和生物菌肥的研发菌源[7]。此外,相关报道也证实部分芽孢杆菌可以产生胞外纤维素酶、半纤维素酶、内切木聚糖酶等,可以有效降解木质纤维素[8]。若将可产生降解木质纤维素酶类的生防芽孢杆菌应用于秸秆还田,可通过其分泌的纤维素降解酶来降解草料及秸秆中的木质纤维素,有效地释放养分[9]。同时,秸秆还田会将秸秆中的大量及微量元素释放到土壤中,能有效改善土壤物理性状,增加土壤养分含量,有利于土壤中有机质的积累[10]。
近年来,随着核酸技术的发展,16S rDNA和gyrB基因常被用于细菌鉴定。核糖体16S rDNA基因序列全长约1 550 bp,由交替的保守区和可变区组成,利用保守区域设计引物,该引物几乎能与所有种属的核糖靶位点结合,但16S rDNA分子内的变异程度并不能区分亲缘关系十分接近的细菌[11]。gyrB即促旋酶(gyrase)的B亚单位基因,属信息通路中与DNA复制、限制、修饰或修复有关的蛋白编码基因。由于其固有的遗传密码子兼并性使得DNA序列可发生较多的变异而不改变氨基酸序列,使gyrB基因序列在区分和鉴定细菌近缘种方面,比非蛋白编码基因16S rDNA具有更高的分辨率[12]。
本研究以分离自青海省黄南州高寒草甸高山嵩草(Kobresiapygmaea)根围的芽孢杆菌为供试菌株,通过16S rDNA及gyrB基因序列分析鉴定菌株;通过平板对峙法检测菌株拮抗活性;测定菌株对高原植物的催芽及促生效用;并测定菌株降解纤维素的活性,对菌株可产生的解纤维素酶进行基因扩增及序列分析;以期为高原草地植被恢复、治理“黑土滩”及生态畜牧业提供适应高原生态环境的生物菌肥和生物农药的研发菌源。
1 材料与方法
1.1 采样点简介
青海省黄南州地势南高北低,海拔在3 500 m以上,属高原大陆性气候,热量不足,无霜期短,降水变率大,时空分布不均;光照时间长,太阳辐射强;冷季漫长干冷,气候环境独特,因此孕育着丰富而独特的低温微生物资源[13]。
1.2 试验材料及供试菌株
病原指示菌:小麦赤霉病菌(Fusariumgraminearum)、瓜类枯萎病菌(Fusariumoxysporum)由青海大学高原草地资源与生态省部共建实验室保存。
小麦(Triticumaestivum)种子(品种为青春38号、红秃头)由青海省农林科学院馈赠。
细菌培养基:LB(Luria-Bertani) 培养基参考谢永丽和高学文[14]方法配制,真菌培养(potato dextrose agar,PDA)培养基参考李振东等[15]方法配制,CMC-Na培养基配制参考张霞等[16]方法配制。引物由南京金斯瑞生物技术有限公司合成;PCR扩增反应试剂购自北京天根生化科技有限公司;测序由上海生工生物工程股份有限公司完成。
1.3 芽孢杆菌分子鉴定
1.3.116S rDNA基因序列分析 通过16S rDNA基因序列分析鉴定菌株,以菌株基因组DNA为模板扩增16S rDNA基因,正向引物127F:5′-AGAGTTTGATCMTGGCTCAG-3′,反向引物1492R:5′-GCYTACCTTGTTACGACTT-3′,PCR扩增条件:95 ℃ 4 min;98 ℃ 10 s,62 ℃ 1 min,72 ℃ 2 min,共30个循环;72 ℃ 8 min。将16S rDNA扩增产物测序,所得序列通过NCBI数据库进行BLAST比对[17]。
1.3.2gyrB基因序列分析 通过gyrB基因序列分析鉴定菌株,以菌株基因组DNA为模板扩增gyrB基因,正向引物gyrB-For:5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′,反向引物gyrB-Rev:5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′。PCR扩增条件:95 ℃ 4 min;98 ℃ 10 s,62 ℃ 1 min,72 ℃ 2 min,共30个循环;72 ℃ 8 min。将gyrB扩增产物测序,所得序列通过NCBI数据库进行BLAST比对[18]。
1.4 拮抗病原真菌活性测定
分别将在26 ℃培养箱中活化好的小麦赤霉病菌、瓜类枯萎病菌PDA平板边缘选取直径为0.7 cm的菌碟, 接种在新的PDA平板中央。在距离菌块2.5 cm处,呈“十”字形分布的4个接种点,放置直径4 mm滤纸小圆片,37 ℃,200 r·min-1条件下培养14 h后,吸取5 μL菌液,接种于滤纸片,每个处理重复3次,放入26 ℃恒温培养箱中培养2~3 d后,取出观测并记录抑菌结果[17]。
1.5 芽孢杆菌促生特性
1.5.1促种子萌发 选择种皮完好的小麦种子在20%次氯酸钠溶液中消毒处理20 min,用无菌水冲洗3~4次,去除种子表面残留的次氯酸钠;将植物种子在芽孢杆菌菌悬液中浸种24 h(菌悬液稀释浓度106cfu·mL-1),无菌水处理作对照;将浸种后的种子播于铺有滤纸的培养皿中,置于光照培养箱中培养(28 ℃,光周期16 h/8 h),培养5 d后测定种子的萌发情况,测定芽长和根长,统计芽孢杆菌对植物的催芽效果;每个处理3个重复,每个重复选50粒种子进行测定和记录[18]。
1.5.2促幼苗生长 选择种皮完好的小麦种子在20%次氯酸钠溶液中消毒处理20 min,消毒后用无菌水冲洗3~4次;将小麦种子先用无菌水浸种24 h后,以芽孢杆菌菌悬液(菌悬液稀释浓度106cfu·mL-1)浸种24 h,无菌水处理作对照;用湿润滤纸吸干植物种子表面多余的水分,将植物种子包裹于15 cm定性滤纸中,每张滤纸包裹8枚种子,滤纸卷竖直放入盛有水的塑料杯子中,水面不超过种子所在位置,在光照培养箱中培养(28 ℃,光周期16 h/8 h);培养10 d后调查幼苗株高和根长,每个处理3次重复,每个重复以8株幼苗为测定单位,统计芽孢杆菌对植物的促生效果[18]。
之所以说眼前的一铵市场,暗流涌动,自我感觉是这样的:一是各大港口硫磺价格开始上涨,幅度还相当可观,厂家要看成本的呀!二是磷铵厂家库存普遍很低,你尽管观望,我们耗得起。三是秋高气爽时,谁还不找个新话题,冬储可以提前拿上日程表来聊聊。四是作为磷复肥行业的盛会,“2018中国磷复肥工业展览会暨第十九届国产高浓度磷复肥产销会”将于11月9-11日在浙江宁波召开,终归有点表现吧,至于市场认不认账,那是另外一回事,每年感觉都有这么似曾相识的一幕。五是……不说了,托您的福,雅您的思,磷酸一铵市场,暗流涌动,我们大家都Get到了。
1.6 降解纤维素活性测定
在CMC-Na筛选培养基平板上,呈“十”字形分布的4个接种点,放置直径4 mm滤纸小圆片。将供试菌株在 LB液体培养基中,37 ℃、200 r·min-1条件下培养12 h后,取待测菌液5 μL点于滤纸片中央,每个处理重复3次,将平板倒置于37 ℃恒温培养箱中培养2 d后,将革兰氏碘染液(Gram Iodime)注入并淹没平板表面,盖上平皿盖,静置4 min后,倒去染液,观测并记录试验结果。测定并记录透明圈直径和菌落直径,并计算二者比值A[15]。
1.7 解纤维素酶类编码基因分析
根据已报道的芽孢杆菌所编码的纤维素酶编码基因序列,设计引物扩增菌株HCN3的纤维素酶编码基因,引物序列如表1所列。

表1 纤维素酶编码基因扩增引物Table 1 Oligo DNA primers used for cellulose coding genes amplifying
PCR扩增条件:95 ℃ 4 min;98 ℃ 10 s,62 ℃ 1 min,72 ℃ 2 min,共30个循环;72 ℃ 8 min。将扩增产物测序,所得序列通过NCBI数据库进行BLAST比对。
1.8 胞外酶酶活测定
将芽孢杆菌菌液以2%的接菌量转接至CMC诱导产酶培养基中,37 ℃、200 r·min-1培养48 h;将培养液在4 000 r·min-1,4 ℃离心10 min,上清液即视为粗酶液。取灭菌2 mL离心管,分别加入200 μL 1%的CMC-Na(溶于pH 7.0 PBS)作为反应底物(测定各菌株的胞外内切纤维素酶活)。将各反应底物在37 ℃金属浴中保温,吸取200 μL上述稀释至合适浓度的粗酶液分别与不同底物涡旋混合,于37 ℃金属浴上精确反应30 min;取出后立即加入500 μL DNS试剂终止反应,并于沸水中煮沸5 min,冷却后,加入1 mL ddH2O;将反应液移至紫光分光分度计中测定OD540;按照绘制的葡萄糖标准曲线,计算出反应液中对应还原糖的含量,根据酶活公式,计算得出各菌株的两种酶活力。以每分钟催化生成1 μmol还原糖作为1个酶活单位,记作1 U。每个样品测定5次,取平均值[19]。
2 结果与分析
2.1 16S rDNA序列分析鉴定
以菌株HNC3、HNC8、HNC11基因组DNA为模板扩增16S rDNA基因,扩增到大小约1 500 bp的PCR特征性条带,与芽孢杆菌16S rDNA的理论值基本相符。将测序结果在NCBI上与GenBank中已知序列进行BLAST比对。比对结果表明:菌株HNC3与Bacillussp.序列(登录号:GQ199764.1)相同(或一致)性为98%;菌株HNC8与B.thuringiensisL14(登录号:KU179330.1)的16S rDNA序列相同(或一致)性为99%;菌株HNC11与B.thuringiensisZLynn500-22 (登录号:KY316414.1)的16S rDNA序列相同(或一致)性为99%(表2)。
2.2 gyrB序列分析鉴定
以菌株HNC3、HNC8、HNC11基因组DNA为模板扩增gyrB基因,扩增到大小约1 300 bp的PCR特征性条带,与芽孢杆菌gyrB的理论值基本相符。将测序结果在NCBI上与GenBank中已知序列进行BLAST比对。比对结果表明:菌株HNC3与B.pumilusATCC27142(登录号:AY167870.1)的gyrB序列相同(或一致)性为98%;菌株HNC8与B.thuringiensisHD12(登录号:CP014847.1)的gyrB序列相同(或一致)性为93%;菌株HNC11与B.thuringiensisHD1002(登录号:CP009351.1)的gyrB序列相同(或一致)性为94%(表2)。

表2 分离菌株的16S rDNA及gyrB序列比对结果Table 2 List of isolates closest affiliation of 16S rDNA and gyrB gene sequencing
根据16S rDNA、gyrB基因序列比对分析结果,将菌株HNC3鉴定为短小芽孢杆菌B.pumilus,菌株HNC8、HNC11鉴定为苏云金芽孢杆菌B.thuringiensis。
2.3 拮抗病原真菌活性
通过平板对峙试验检测菌株拮抗活性,结果显示,菌株HNC3、HNC8、HNC11均对植物病原真菌小麦赤霉病菌、瓜类枯萎病菌具有较强的拮抗效果,抑菌圈平均直径均≥11 mm,表现明显的抑真菌效果(图1,表3)。
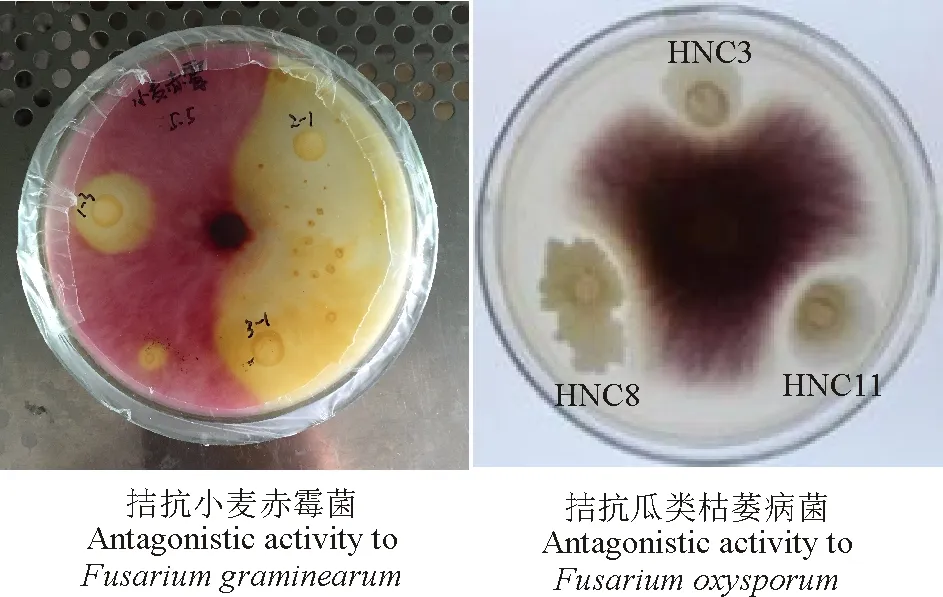
图1 拮抗病原真菌活性Fig. 1 Antagonistic activity to pathogenic fungi
2.4 芽孢杆菌促生特性
2.4.1促种子萌发 将不同品种小麦种子在菌株菌
悬液中浸种24 h(菌悬液浓度106cfu·mL-1),培养5 d后测定种子萌发效果。结果表明,菌株HNC3、HNC8、HNC11菌悬液处理小麦种子,萌发效率明显提高,与无菌水相比,种子萌发后芽长、根长均有增加;其中,菌株HNC8对红秃头小麦品种的根长具有显著的促生长作用(P<0.05),经处理的小麦种子萌发后,平均根长达到14.02 cm,与对照相比提高了31%;菌株HNC3对青春38号小麦根长和芽长具有显著的促生长作用(P<0.05),经处理的小麦种子萌发后,平均芽长达到14.21 cm,与对照相比增加55%;平均根长达到13.90 cm,与对照相比增加80%(图2、表4)。
2.4.2促幼苗生长 将不同品种小麦种子经芽孢杆菌菌悬液浸种24 h(菌悬液浓度106cfu·mL-1),培养10 d后,测定生防芽孢杆菌对小麦幼苗的促生效果。结果表明,3株供试菌株菌悬液对小麦幼苗均有不同程度的促生效果。其中,菌株HNC3对红秃头小麦幼苗的促生长作用尤为显著(P<0.05),经处理的小麦幼苗的平均株高达到18.36 cm,与对照相比增加了72%,平均根长达到6.90 cm,与对照组相比增加了50%(图3、表5);HNC11对青春38号小麦的促生长作用显著,经处理的小麦幼苗平均株高达到12.63 cm,与对照相比增加了45%,平均根长达到6.83 cm,与对照相比增加了63%(图3、表5)。
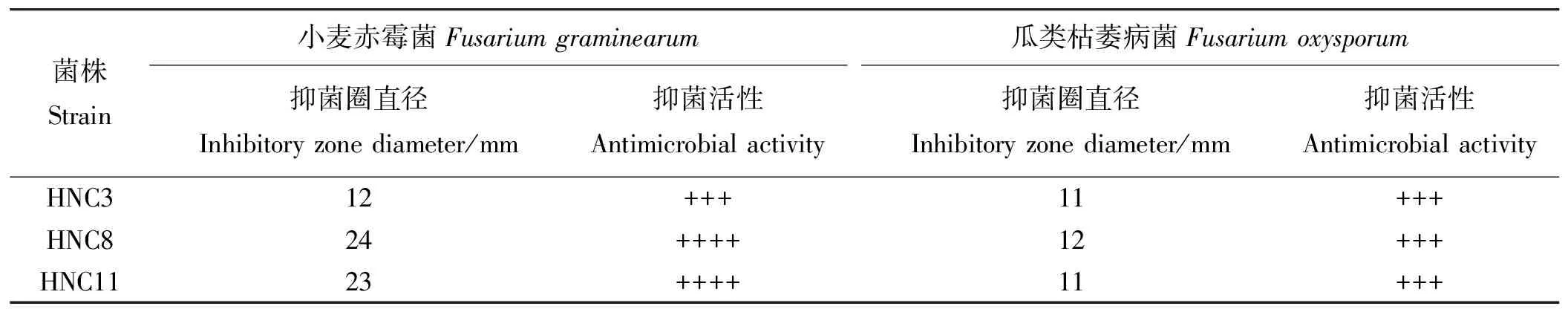
表3 芽孢杆菌拮抗病原真菌活性Table 3 Antagonistic activity to pathogenic fungi
注:+,抑菌圈半径0-5 mm;++,抑菌圈直径5-10 mm;+++,抑菌圈直径10-15 mm;++++,抑菌圈直径>15 mm。
Note:+, Inhibition zone radius 0-5 mm; ++, Inhibition zone radius 5-10 mm; +++, Inhibition zone radius 10-15 mm; ++++, Inhibition zone radius≥15 mm.
2.5 降解纤维素活性测定
将菌株在CMC-Na培养基上,37 ℃培养48 h后用Gram染液染色,测其透明圈的直径,结果显示(图4,表6):3株菌株所产生的透明圈直径分别为16、19和19 mm;D/d比值分别为3.20、3.80和3.80,降解纤维素的活性与透明圈直径D和菌落直径d之比呈正相关关系,即D/d值越大,菌株解纤维素活性越强。
以标准葡萄糖溶液中所含葡萄糖浓度为横坐标,以OD值为纵坐标绘制葡萄糖标准曲线,计算酶活性大小。结果显示,菌株HNC3的酶活在3株菌株中最高,达到367.51 U·mL-1,3株菌株酶活均在290~370 U·mL-1,具有较高的产酶能力(表6)。
2.6 纤维素酶编码基因扩增分析
以供试菌株HNC3基因组 DNA 为模板,以引物xynB、xynD扩增木聚糖酶编码基因,扩增到大小为1 183 bp的 PCR 特征性条带,所得序列通过NCBI数据库进行BLAST比对分析,结果显示,菌株HNC3中克隆到木聚糖酶(xylanase)编码基因;以引物blg1S扩增地衣聚糖酶编码基因,扩增到大小约为720 bp的PCR 特征性条带,所得序列通过NCBI数据库进行BLAST比对,结果显示成功克隆到地衣聚糖酶(lichenase)编码基因;以引物ManSig扩增甘露糖苷酶编码基因,扩增到大小约为1 000 bp的PCR 特征性条带,所得序列通过NCBI数据库进行BLAST比对,结果显示成功克隆到甘露糖苷酶(mannosidase)编码基因(图5)。
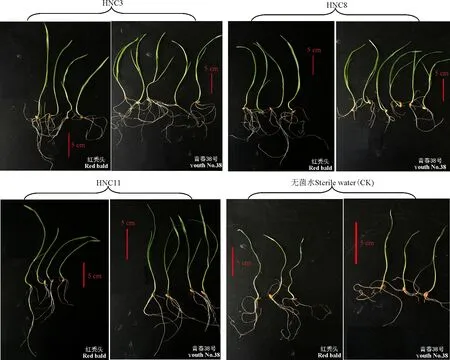
图2 芽孢杆菌促小麦种子萌发 Fig. 2 Germination-promoting activity of Bacillus suspension on wheat plant seeds
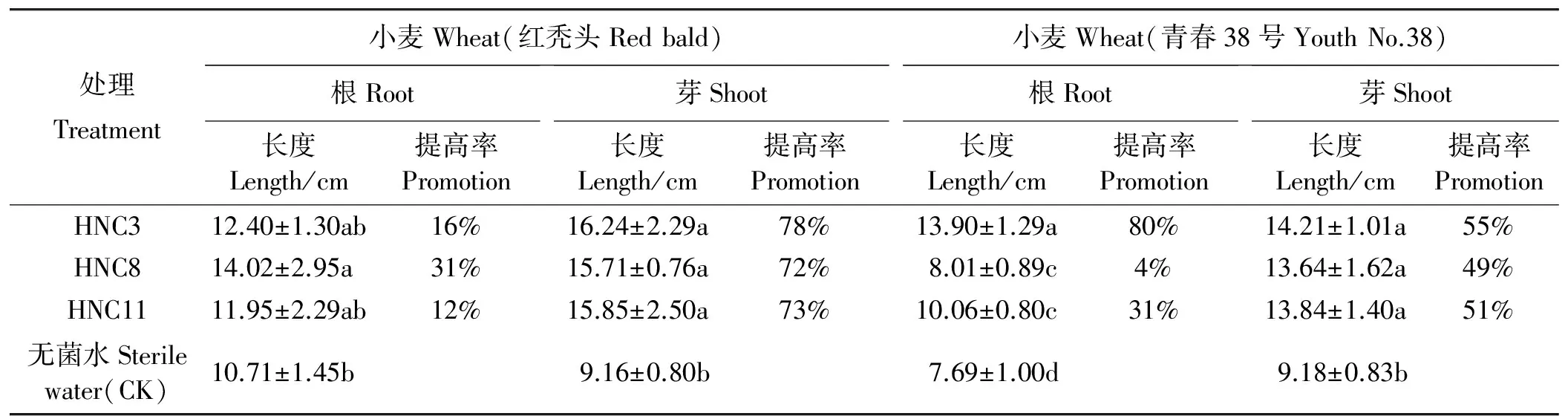
表4 芽孢杆菌促植物种子萌发Table 4 Germination-promoting activity of plant seed induced by Bacillus spp.
注:同列不同字母表示在0.05水平上有显著差异(P<0.05)。表5同。
Note:Different lower letters within the same column indicate significant differences among different treatments at the 0.05 level; similarly for Table 5.
3 讨论与结论
青藏高原特殊生境为生物多样性提供了栖息环境,孕育了特殊多样的微生物资源,芽孢杆菌以其独特生物学特性,在农牧业发展中有着广阔应用潜力。“取之于高原,用之于高原”,是符合生态理念研究及资源开发的应用途径。芽孢杆菌在多种极端环境中,适应性强、定殖速度快,有促生、抗病等生物学特性,对于高寒草地退化及农牧业生产具有重要的研究及应用价值[14]。芽孢杆菌通过多途径促生机制的相互作用提高植物抗病性,并促进植物生长,其促生机制复杂多样。直接促生作用为自身产生植物生长相关激素:赤霉素、生长素和细胞分裂素等[15];产生挥发性化合物(volatiles):2,3-丁二酮等物质直接促进植物生长;产生植酸酶、嗜铁素等促进植物对难溶性磷、铁等元素的吸收,从而提高植物根际养分的可利用性而促进植物生长[15];如,解淀粉芽孢杆菌FZB24可产生肌醇六磷酸酶(phytase),能降解肌醇六磷酸,形成的可溶性磷能被植物吸收利用。间接促生作用包括刺激植物产生诱导系统抗性(induced systemic resistance,ISR)或直接抑制植物病原菌的生长,降低植物病害的发生,从而促进植物生长[16]。

图3 芽孢杆菌促小麦幼苗生长Fig. 3 Growth-promoting effect of Bacillus suspension on wheat seeding
表5 芽孢杆菌促小麦幼苗生长效率Table 5 Effect of promotion by Bacillus spp. on plant seedlings
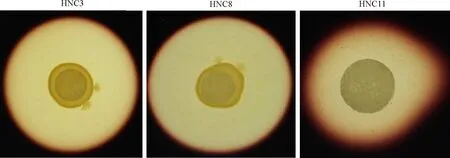
图4 芽孢杆菌降解纤维素活性 Fig. 4 Cellulose-degrading activity test of Bacillus strains
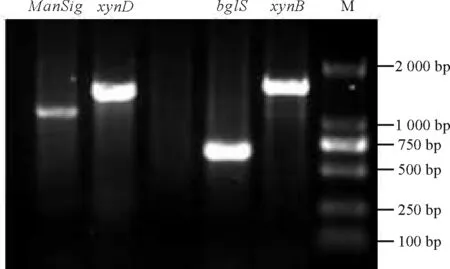
图5 纤维素酶编码基因扩增结果Fig. 5 The amplification results of different cellulose enzyme-coding genes
本研究以分离筛选自青海省黄南州高寒草甸根围的芽孢杆菌HNC3、HNC8、HNC11为供试菌株,以16S rDNA和gyrB基因序列分析将菌株HNC3鉴定为短小芽孢杆菌(Bacilluspumilus)、菌株HNC8、HNC11鉴定为苏云金芽孢杆菌(Bacillusthuringiensis);gyrB基因是16S rDNA基因以外适合细菌鉴别的又一理想靶基因,gyrB基因编码DNA解旋酶B亚单位,其基因进化率快,碱基替换频率高,在相似细菌的检测和鉴别方面比16S rDNA基因更具优越性和准确性[12]。芽孢杆菌对植物病原菌的拮抗作用表现在刺激植物产生诱导系统抗性(induced systemic resistance,ISR)或通过非核糖体肽途径产生抑菌活性物质,如,表面活性素(surfactin)、杆菌素D(bacillomycins D)和泛革素(fengycin)等,直接抑制植物病原菌生长,降低植物病害的发生[20-21]。本研究以小麦赤霉病菌、瓜类枯萎病菌为病原指示菌,测定菌株HNC3、HNC8、HNC11对病原真菌的拮抗活性,3株菌株所形成的抑菌圈平均直径均≥11 mm,均表现显著的抑病原真菌效果。以菌株菌悬液(菌悬液浓度106cfu·mL-1)对小麦种子浸种后的试验结果表明,菌悬液处理后的小麦种子萌发效率明显提高,其中菌株HNC3促生效果最为显著,与无菌水对照相比,青春38号小麦芽长增加率为55%,根长增加率为80%;以菌株菌悬液(菌悬液浓度106cfu·mL-1)对小麦种子浸种后对幼苗促生效果的试验结果表明:小麦幼苗株高显著提高,其中,红秃头小麦幼苗与对照组相比株高增加率为72%、根长增加率为50%。分离自黄南州高寒草甸的几株芽孢杆菌兼具对植物的促生、催芽作用及对病原菌的拮抗活性,适应高原生态环境,可作为促进牧草生长,提高草地地上生物量的生物菌肥的研发菌源,在退化草地恢复及生态农业中具有应用潜力。
青海省为重要的农牧业大省,畜牧业发展极为重要。在青贮饲料加工过程中,添加纤维素酶制剂,通过纤维素酶对植物细胞壁的分解,不仅可为青贮发酵提供充足的糖源,促进乳酸发酵,而且可降低青贮饲料中性洗涤纤维和酸性洗涤纤维含量,提高青贮饲料的消化率。此外,纤维素酶能够转化玉米芯、稻草、秸秆等粗饲料,把其中的一部分纤维素转化为糖、菌体蛋白、脂肪等,降低饲料中粗纤维含量,提高粗饲料营养价值,扩大饲料来源[22-23]。本研究通过CMC平板筛选及Gram染色法测定菌株HNC3、HNC8、HNC11的解纤维素活性,结果表明,3株菌株所产生的降解透明圈直径分别为16、19和19 mm,D/d比值分别为3.20、3.80和3.80,表现出显著的降解纤维素的活性;对菌株HNC3可产生的纤维素酶编码基因进行扩增分析,扩增到地衣聚糖酶基因(blg1S)、甘露糖苷酶基因(ManSig)、木聚糖酶基因(xynB、xynD),表明菌株HNC3可产生多种纤维素降解酶,在饲料加工或秸秆还田中具有一定的应用价值。如果利用可产生降解纤维素酶类的生防芽孢杆菌,应用于作物秸秆还田,对于农田土壤结构和肥力的改善有重要的意义。
References:
[1] 刘玉,马玉寿,施建军,王彦龙,李世雄,景美玲,闵星星.大通河上游高寒草甸植物群落的退化特征.草业科学,2013,30(7):1082-1088.
Liu Y,Ma Y S,Shi J J,Wang Y L,Li S X,Jing M L,Min X X.Community characteristics of alpine meadow under different degrees of degradation in the upper area of Datong River.Pratacultural Science,2013,30(7):1082-1088.(in Chinese)
[2] 马玉寿,张自和,董全民,施建军,王彦龙,盛丽.恢复生态学在“黑土型”退化草地植被改建中的应用.甘肃农业大学学报,2007,42(4):91-97.
Ma Y S,Zhang Z H,Dong Q M,Shi J J,Wang Y L,Sheng L.Application of restoration ecology in‘Black Soil Type’degraded grassland rebuilding.Journal of Gansu Agriculture University,2007,42(4):91-97.(in Chinese)
[3] 刘育红,李希来,魏卫东,芦光新,田丰,乔有明.高寒草甸“黑土滩”对土壤养分的影响.西北农业学报,2009,18(3):304-308.
Liu Y H,Li X L,Wei W D,Lu G X,Tian F,Qiao Y M.The influence of “Black Beach” to soils nutrient on alpine meadow.Acta Agriculturae Boreali-occidentalis Sinica,2009,18(3):304-308.(in Chinese)
[4] 董全民,施建军,马玉寿,王彦龙,盛丽,杨时海,李世雄,王柳英.人工调控措施下黑土滩人工草地的经济及生态效益分析.草地学报,2011,31(3):50-55.
Dong Q M,Shi J J,Ma Y S,Wang Y L,Sheng L,Yang S H,Li S X,Wang L Y.Analysis on economic and ecological benefit of Black-soi-l beach sown grassland.Acta Agrestia Sinica,2011,31(3):50-55.(in Chinese)
[5] 谢永丽,马莉贞,徐志伟,杜卓,高学文.青海柴达木极端干旱沙地分离芽孢杆菌的分子鉴定及拮抗活性分析.微生物学通报,2012,39(8):1079-1086.
Xie Y L,Ma L Z,Xu Z W,Du Z,Gao X W. Molecular identification ofBacillusstrains isolated from extreme dry-sand environment in Qinghai chaidamu region and its ipopeptide compound analysis.Microbiology China,2012,39(8):1079-1086.(in Chinese)
[6] 乔俊卿,张心宁,梁雪杰,刘永锋,刘邮洲.枯草芽孢杆菌PTS-394诱导番茄对灰霉病的系统抗性.中国生物防治学报,2017,33(2):219-225.
Qiao J Q,Zhang X N,Liang X J,Liu Y F,Liu Y Z.Plant system resistance triggered by root-colonizingBacillussubtilisPTS-394 and its control effect on tomato gray mold.Chinese Journal of Biological Control,2017,33(2):219-225.(in Chinese)
[7] 谢永丽,马莉贞,徐志伟,张英,李希来.冻土荒漠区分离低温适生PGPR菌的鉴定及其抗菌促生特性.中国生物防治学报,2014,30(1):94-100.
Xie Y L,Ma L Z,Xu Z W,Zhang Y,Li X L.Identification of low-temperature adapting PGPR strains isolated from frozen desert area and their antimicrobial and growth-promoting activity.Chinese Journal of Biological Control,2014,30(1):94-100.(in Chinese)
[8] 颜霞,秦魏.降解纤维素真菌的分离筛选及其环境适应性初探.中国农学通报,2008,24 (5):44-49.
Yan X,Qin W.Isolation and screening of cellulose-decom posing microorgansms and their adaptability to some environmental factors.Chinese Agricultural Science Bulletin,2008,24(5):44-49.(in Chinese)
[9] 崔海洋,程仕伟,黄田红,李秀娟,杨立红,陈国忠.产纤维素酶的解淀粉芽孢杆菌分离鉴定及酶学性质研究.食品科学技术学报,2014,32(3):43-47.
Cui H Y,Cheng S W,Huang T H,Li X J,Yang L H,Chen G Z.Screening and identifying ofBacillusamyloliquefaciensfor cellulase production and its enzymatic characters.Journal of Food Science and Technology,2014,32(3):43-47.(in Chinese)
[10] Wu H J,Wang S,Qiao J Q,Liu J,Zhan J,Gao X W.Expression of HpaGXooc protein inBacillussubtilisand its biological functions.Journal of Microbiology & Biotechnology,2009,19(2):194-203.
[11] 刘朝军,沈定霞.16S rDNA序列测定在细菌鉴定中的应用.军医进修学院学报,2011,32(7):774-776.
Liu Z J,Shen D X.Applicatiion of 16S rDNA sequencing for identification of bacteria.Chinese PLA Postgard Medical School,2011,22(7):774-776.(in Chinese)
[12] 安然,易图永,肖启明,邓子牛.gyrB基因在细菌分类和检测中的应用.江西农业学报,2010,22(4):18-24.
An R,Yi T Y,Xiao Q M,Deng Z N.Applicatiion ofgyrBgene in bacteria classification and detection.Acta Agriculture Jiangxi,2010,22(4):18-20.(in Chinese)
[13] 马正炳,苏呈文.黄南州畜草平衡状况分析与对策.青海草业,2009,18(4):27-29.
Ma Z B,Su C W.Analysis balance of livestock and grass in Huangnan Prefecture.Qinghai Prataculture,2009,18(4):27-29.(in Chinese)
[14] 谢永丽,高学文.高寒草甸根围拮抗芽孢杆菌筛选鉴定及脂肽化合物分析.中国生物防治学报,2012,28(3):367-374.
Xie Y L,Gao X W.Screening and identification of bio-control bacillus strains isolated from rhizosphere of altiplaino meadow and its lipopeptide compounds.Chinese Journal of Biological Control,2012,28(3):367-374.(in Chinese)
[15] 李振东,陈秀蓉,杨成德,李鹏.线叶嵩草内生产纤维素酶细菌分离及初步鉴定.草业科学,2014,31(1):48-55.
Li Z D,Chen X R,Yang C D,Li P.Isolation and identification of cellulose-decomposing microorganisms inKobreasiacapillifolia.Pratacultural Science,2014,31(1):48-55.(in Chinese)
[16] 张霞,唐文华,张力群.枯草芽孢杆菌B931防治植物病害和促进植物生长的作用.作物学报,2007,33(2):236-241.
Zhang X,Tang W H,Zhang L Q.Biological control of plant diseases and plant growth promotion byBacillussubtilisB931.Acta Agronomica Sinica,2007,33(2):236-241.(in Chinese)
[17] Bavykin S G,Lysov Y P,Zakhariev V,Kelly J J,Jackman J,Stahl D A,Cherni.A use of 16S rRNA,23S rRNA,andgyrBgene sequence analysis to determine phylogenetic relationships ofBacilluscereusgroup microorganisms.Journal of Clinical Microbiology,2004,42(8):3711-3730.
[18] 薛鹏琦,刘芳,乔俊卿,伍辉军,冯致科,高学文.油菜菌核病生防芽孢杆菌的分离鉴定及其脂肽化合物分析.植物保护学报,2011,38(2): 127-132.
Xue P Q,Liu F,Qiao J Q,Wu H J,Feng Z K,Gao X W.Screening ofBacillusstrains with high inhibition on rape sclerotinia disease and its lipopeptide compounds detection.Journal of Plant Protection,2011,38(2):127-132.(in Chinese)
[19] 陶晶,李辉,李春.芽孢杆菌组合BCL-8的筛选及其促生抗病效果.植物保护学报,2009,36(2):123-128.
Tao J,Li H,Li C.Screening ofBacillussp.combination BCL-8 for growth-promotion and disease control.Acta Phytophylacica Sinica,2009,36(2):123-128.(in Chinese)
[20] 杨琦瑶,索雅丽,郭荣君,李世东,许修宏.枯草芽孢杆菌B006对黄瓜枯萎病菌和辣椒疫霉病菌的抑制作用及其抗菌组分分析.中国生物防治学报,2012,28(2):235-242.
Yang Q Y,Suo Y L,Guo R J,Li S D,Xu X H.Antifungal activities and principal component analysis ofBacillussubtilisB006 againstFusariumoxysporumf. sp.cucumerinumandPhytophthoracapsici.Chinese Journal of Biological Control,2012,28(2):235-242.(in Chinese)
[21] 王静,赵廷昌,孔凡玉,何月秋,张成省.枯草芽孢杆菌SH7抑菌物质及其特性.植物保护学报,2007,34(4):443-444.
Wang J,Zhao T C,Kong F Y,He Y Q,Zhang C S.Characteristics of inhibitive substance produced byBacillussubtilisSH7.Acta Phytophylacica Sinica,2007,34(4):443-444.(in Chinese)
[22] Taechapoempol K,Sreethawong T,Rangsunvigit P,Namprohm W,Thamprajamchit B,Rengpipat S,Chavadej S.Cellulase-producing bacteria from Thai higher termites,Microcerotermessp.:Eenzymatic activities and ionic liquid tolerance.Applied Biochemistry and Biotechnology,2011,164(2):204-219.
[23] Khalid Mahmood,Yang W J,Kishwar N.Study of cellulolytic soil fungi and two nova species and new medium.Journal of Zhejiang University Science B,2006,7(6):459-466.
MolecularidentificationandbiologicalactivityofthreeBacillusstrainsisolatedfromanalpinemeadowrhizosphereinQinghaiProvince
Wu Xiao-hui1, Xie Yong-li1, Renato D′Ovidio2, Zhang Ying1, Lu Guang-xin1, Xin Zong-xiu1, Stefania Masci2
(1.College of Agriculture and Animal Husbandry, Qinghai University, Key Laboratory of Altiplaino Grassland Resource and Ecology Ministry, Xining 810016, Qinghai, China; 2. Faculty of Agriculture, University of Tuscia, Laboratory of Agricultural Biology and Agricultural Chemistry, Viterbo 01100, Italy)
For the purpose of restoring degraded vegetation and improving the aboveground biomass of grassland, the biological activity of three strains ofBacillusspp. bio-control agents were isolated and screened. Three strains isolated from an alpine meadow (Kobresiapygmaea) rhizosphere in Huangnan Autonomous Prefecture, Qinghai Province, were identified by 16S rDNA andgyrBpartial sequence analyses. Antagonistic activity of strains to pathogenic fungi were determined by the flat confrontation test, and the growth-promoting activities of strains were checked by soaking plant seeds in strain suspension (106cfu·mL-1of cell concentration). In addition, cellulose-degrading activities of strains were checked with carboxymethylcellulose (CMC) plate test, Gram staining, and 3,5-dinitrosalicylic acid (DNS) methods; moreover, cellulase coding genes of the strains were amplified and analyzed. The results showed that the isolate of HNC3 was identified asBacilluspumilus, and isolates of HNC8 and HNC11 were identified asB.thuringiensis. The three strains presented distinct antagonistic activity toFusariumgraminearumS andFusariumoxysporum(inhibition zone diameter ≥ 11 mm). Furthermore, the strains showed obvious germination and growth-promoting activity after soaking the wheat seeds inBacillussuspension. The effect of the isolate of HNC3 on the growth of wheat seedlings was significant; the rate of bud and root length growth increased by 55% and 80%, respectively. The cellulase activity of the isolate of HNC3 reached 367.51 U·mL-1, and its cellulase coding genes could be amplified including lichenase (blg1S), mannosidase (ManSig), and xylanase (xynD,xynB). The threeBacillusstrains used as bio-control agents all showed antagonistic, plant growth-promoting, and cellulose-degrading activities, which present future research opportunities into the potential of their application in the recovery of plateau grassland vegetation, as well as in the field of ecological animal husbandry.
alpine meadow;Bacillusbio-control agent; molecular identification; plant growth promotion
Xie Yong-li E-mail:986237342@qq.com
10.11829/j.issn.1001-0629.2017-0055
吴晓晖,谢永丽,Renato D′Ovidio,张英,芦光新,辛总秀,Stefania Masci.3株分离自高寒草甸根际芽孢杆菌的分子鉴定及其生物活性.草业科学,2017,34(12):2454-2463.
Wu X H,Xie Y L,D′Ovidio R,Zhamg Y,Lu G X,Xin Z X,Masci S.Molecular identification and biological activity of threeBacillusstrains isolated from an alpine meadow rhizosphere in Qinghai Province.Pratacultural Science,2017,34(12):2454-2463.
S812.29;S182
A
1001-0629(2017)12-2454-10
2017-02-06接受日期2017-09-14
青海省科技厅应用(基础)研究项目(2015-ZJ-732);青海省科技厅国际合作项目(2013-H-805); 国家自然基金项目(31660543)
吴晓晖(1994-),女,青海西宁人,在读硕士生,研究方向为资源微生物学。E-mail:377890164@qq.com
谢永丽(1971-),女,青海西宁人,副教授,博士,研究方向为资源微生物学。E-mail:986237342@qq.com
(责任编辑 王芳)

