海洋沉积物病毒荧光计数法的优化*
维 妙 徐奎栋①
(1. 中国科学院海洋研究所 青岛 266071; 2. 中国科学院大学 北京 100049)
病毒是海洋环境中丰度最高的生物组分, 且绝大多数是以原核生物为宿主的噬菌体以及噬藻体(Danovaroet al, 2008a)。病毒裂解其宿主释放出的可溶性有机物(DOM)可供原核生物再次利用, 从而减少了原核生物生产力和生物量向更高营养级的转移。这一由病毒引发的有机质流的转变被称为病毒回路(Wilhelmet al, 1999; Danovaroet al, 2008a)。在海洋水体及沉积物中, 由病毒引起的原核生物死亡率通常可达10%—30%(Danovaroet al, 2008a)。而在深海沉积物中, 高达 80%—100%的原核生物由病毒裂解致死, 由此释放的大量可溶性有机质支撑着深海底栖生态系统中较高的原核生物量和代谢水平(Danovaroet al, 2008a, b)。通过对宿主的感染及裂解,病毒在海洋生物群落构成、基因的水平转移、海洋生物多样性及碳、氮等元素的生物地球化学循环等方面起着重要作用(Suttle, 2005; Danovaroet al, 2008a; 张永雨等, 2011)。
对海洋沉积物中的病毒进行确切定量是研究其数量变动和生态作用的前提。对沉积物病毒的研究早期采用透射电子显微镜(TEM)观察计数, 但因费时、费力且成本较高, 因此除用于形态观察外, 在定量研究中现已很少使用。目前, 利用 SYBR Green I (或SYBR Gold)等高亮度荧光染色剂对沉积物病毒染色,以荧光显微镜进行观察计数的方法已成为主流。
目前国际上已有多份针对海洋沉积物病毒荧光染色计数法的研究, 初步建立了荧光计数法的流程(Danovaroet al, 2001; Heltonet al, 2006; Dell’Anno,et al, 2009; Danovaroet al, 2010; Suttleet al, 2010)。然而,对于一些处理方法的定量效能并未进行验证, 且不同研究者往往使用不同的处理方法。例如, 已有研究显示利用醛类固定并在4°C或-20°C条件下储存的方法易造成病毒数量的低估, 因而不适于沉积物病毒样品的保存(Danovaroet al, 2001; Duhamelet al, 2006;Heltonet al, 2006), 并由此建议使用液氮闪冻后置于-80°C 来 保 存 沉 积 物 样 品(Dell’Annoet al, 2009;Suttleet al, 2010; Danovaroet al, 2010)。但后者的保存效果仅在水体病毒的定量中得到验证(Brussaard,2004; Wenet al, 2004), 对其在沉积物病毒的保存效果尚待检验。又如, 在使用表面活性剂处理的步骤中,Danovaro等(2010)的研究表明, 使用5mmol/L终浓度焦磷酸钠处理的效果优于 10mmol/L终浓度。然而,后续研究中使用的浓度并未统一, 且这两种浓度是否为最佳浓度仍有待检验。此外, 对于超声处理样品时是否应进行冰浴也存在争议。Duhamel等(2006)研究发现, 在超声时添加冰块会导致获取的病毒及细菌丰度下降。而Danovaro等(2010)仍然提出, 在水浴中超声处理样品时, 应添加冰块以防止样品过热。不一而足, 由于沉积物病毒定量的许多处理方法并未进行实验验证, 导致不同的研究往往使用不同的处理方法, 而不同的处理往往产生不同的计数结果, 从而影响了对海洋沉积物病毒生态作用的评价。
我国对水体病毒的定量研究自21世纪开始起步,目前已对中国陆架海域(张喆等, 2008, 2017; 李洪波等, 2010; 卢龙飞等, 2013; 马玉等, 2016)、长江口(刘晶晶等, 2011)、港湾(赵苑等, 2010; 王海丽等, 2011)、海水养殖区(孙辉等, 2014)及淡水湖泊湿地(孙小磊等,2009)等生境中病毒数量的时空变化及生态特性有所报道。对水体病毒定量计数的方法也有多份研究(李娟, 2005; 潘洛安等, 2006; 白晓歌等, 2008; 李洪波等, 2010; 李胜男等, 2015), 技术流程日趋成熟。相较于此, 目前国内仅李清等(2016)对大连湾及大窑湾沉积物病毒丰度的季节变化及水平分布进行了研究,缺乏关于沉积物病毒定量计数方法的报道。我国现行的《海洋调查规范 第6部分: 海洋生物调查》(国家海洋局, 2007)国家标准中涉及了浮游生物以及大型和小型底栖生物等的技术规范。新近颁布实施的《海洋微型底栖生物调查规范》(HY/T 140–2011)规定了底栖细菌、微藻和原生动物的定量方法, 但仍缺沉积物病毒定量研究的技术规范(中国科学院海洋研究所,2011)。
本研究根据现行沉积物病毒荧光计数的基本流程(Danovaroet al, 2001, 2010), 利用沙质、泥沙质及泥质沉积物样品, 对海洋沉积物病毒荧光计数法进行了实验验证和条件优化。对沉积物样品的两种保存方法及效能进行了评估, 提出了焦磷酸钠处理的最优终浓度, 并将冰浴与常温超声处理效果进行了对比分析。同时, 还检验了离心对病毒定量造成的低估,测算了其在不同类型沉积物中的提取率, 提出了离心和稀释两种方法的适用条件。由于病毒的定量研究与原核生物丰度密不可分, 且原核生物也采用荧光计数法定量, 因此文中同时检验了上述条件对原核生物定量的影响, 从侧面佐证采用的实验条件对病毒定量的影响。据此, 本研究提出了改进的沉积物病毒荧光计数法的操作流程, 以期为行之有据、高效可靠的海洋沉积物病毒的定量分析提供依据。
1 材料与方法
1.1 沉积物样品采集与保存
为探索病毒荧光计数法的普适性, 本研究选取了沙质、泥沙质及泥质三种不同类型的沉积物。沙质沉积物(中值粒径约 200μm)采自青岛湾低潮带, 泥沙质沉积物(中值粒径约 145μm)采自青岛湾中潮带, 两采样点间相距约 80m。泥质沉积物(中值粒径约4.8—5.5μm)采自西太平洋雅浦海沟附近的深海平原(水深 4042m)。泥质沉积物因无法立即处理分析, 仅对其冷冻保存后进行了提取率的探究实验。
青岛湾潮间带样品: 用灭菌后的采样勺刮取表层0—1cm沉积物约50mL, 充分混匀后采集分样, 每个分样含沉积物0.5mL, 置于10mL的无菌离心管中,加入4.2mL无菌海水配置的2%福尔马林固定液后充分混匀。部分分样于采集后2h内进行提取条件及定量效能实验, 以SYBR Green I染色、制片后(Danovaroet al, 2001)用荧光显微镜观察计数, 换算为VLP/g沉积物干重(virus-like particles)。用于保存方式和保存时间影响实验的分样按下述相应方法进行保存及处理。
深海沉积物样品: 沉积物样品使用箱式采泥器采集, 从未受扰动的沉积物表层 0—4cm 采集分样,每个分样含沉积物0.5mL, 置于灭菌后的5mL冻存管中, 加入4.2mL无菌的海水配置的2%福尔马林固定液充分混匀, 于液氮中速冻后置于-80°C冰箱保存。
1.2 沉积物保存方式和保存时间对计数的影响
对制片后置于-20°C冰箱保存(简称制片保存)和经液氮速冻后于-80°C冰箱保存(简称冷冻保存)样品的两种保存方法进行了定量效能评估。从新鲜的沙质和泥沙质沉积物中各取 3个分样, 于 2h内进行分样的染色制片和镜检计数。计数后置于-20°C冰箱保存,并在保存30天及90天后再次进行计数。
冷冻保存的样品分别于保存7天、30天及60天后, 各取 3个分样进行处理。现有研究多在 37°C水浴中融化冷冻样品(Wenet al, 2004; Suttleet al, 2010),也有将样品于 35°C 融化(Brussaard, 2004)或室温(25°C)融化(Patelet al, 2007)的报道。经检验, 采用上述方式融化样品的定量结果均无差异。
1.3 焦磷酸钠浓度对计数的影响
采集新鲜的沙质和泥沙质沉积物各分为5组, 每组3个重复。在其他实验条件一致的情况下, 分别使用0.5、2、3、5和7mmol/L终浓度的焦磷酸钠溶液对每组样品进行孵育。封片后于当天镜检计数, 计数结果使用SPSS16.0的Kruskal-Wallis H检验进行组间差异性分析。
1.4 冰浴和常温超声对计数的影响
采集新鲜的沙质沉积物分成两组, 每组3个重复,一组在超声处理时在水浴中添加冰块, 另一组不添加,其他条件保持一致。封片后于当天镜检计数, 对比分析冰浴和常温条件下超声处理沉积物的定量效能。
1.5 离心与稀释的定量效能
在确定最优的焦磷酸钠浓度(3mmol/L)和(常温)超声处理条件后, 对离心和稀释两种方法的定量效能进行了对比。沙质和泥沙质沉积物经焦磷酸钠孵育和超声处理后充分混匀, 取悬液稀释(稀释倍率依病毒的丰度定)后染色制片。剩余部分经 800g×1min离心处理后, 取上清液过膜制片, 封片后于-20°C 冰箱保存并在一周内计数。
对于病毒丰度较低、沉积物颗粒较细密且腐殖质较多的沉积物, 必须进行离心处理时, 需测定提取率以弥补离心造成的丰度损失。从新鲜的沙质、泥沙质沉积物以及冷冻保存的泥质沉积物中各取 3个分样,经焦磷酸钠和超声处理并离心后, 取上清液染色制片。之后, 小心移除剩余上清液, 用 4.5mL无菌蒸馏水清洗余下的沉积物, 充分混匀后再次离心, 取上清液染色制片。依此重复清洗 4次后, 每个分样得到 5张封片, 计数全部封片后所得结果之和记为此分样中病毒颗粒的总丰度, 并分别计算每张封片所得结果占总丰度的百分比, 以确定适宜的清洗次数。之后, 从新鲜及冷冻保存的沙质、泥沙质沉积物以及冷冻保存的泥质沉积物中各取 5个分样测算提取率, 以第一次提取与数次清洗后所得丰度之和作为总丰度, 提取率以第一次提取所得丰度除以总丰度获得。结果使用SPSS16.0的Kruskal-Wallis H进行组间差异性分析, 并使用Mann-Whitney U检验对各组数据进行两两对比分析。
2 结果
2.1 沉积物保存方式和保存时间对计数的影响
制片保存的计数结果显示, 沙质沉积物病毒封片在保存 30天后计数所得丰度为制片后当天计数结果的81.6%, 保存90天后为122.4% (图1a)。泥沙质沉积物病毒封片在保存 30天后计数所得丰度为制片当天计数结果的64.3%, 保存90天后为95.4% (图1b)。
冷冻保存的计数结果显示, 沙质沉积物在保存 7天后病毒丰度为新鲜样品丰度的 28.6%, 保存 30天后仅为 5.6%(图 1a)。泥沙质沉积物存 7天后病毒丰度为新鲜样品丰度的93.9%, 保存30天为72.7%, 保存 60天后为40.0% (图1b)。

图1 沉积物冷冻保存和染色制片保存对沙质(a)和泥沙质(b)沉积物中病毒和原核生物计数的影响Fig.1 Effects of cryopreservation (-80°C) and prompt dye staining preservation (-20°C) on enumeration of viruses and prokaryotes in sandy (a) and muddy-sand (b) sediments
对保存后原核生物的计数结果显示, 沙质沉积物制片保存30天和90天后计数所得丰度均为制片当天计数结果的 104.4%, 泥沙质沉积物分别为 104.4%和 114.9% (图 1a)。冷冻保存结果显示, 沙质沉积物中原核生物在保存 7天和 30天后, 丰度分别为新鲜样品丰度的62.9%和20.3%。泥沙质沉积物中原核生物在保存7天、30天和60天后, 丰度分别为新鲜样品丰度的83.4%、71.2%及46.9%。
2.2 焦磷酸钠浓度对计数的影响
使用终浓度为 3mmol/L的焦磷酸钠孵育时, 沙质和泥沙质沉积物均计数到病毒丰度的最大值(图2)。统计学分析显示, 不同浓度焦磷酸钠对泥沙质沉积物病毒的定量效果有统计学差异(X2=13.5,P<0.05),而对沙质沉积物病毒的定量效果无统计学差异。
对原核生物的定量显示了同样的结果。使用3mmol/L焦磷酸钠孵育定量效果最佳(图 2), 不同浓度焦磷酸钠对对泥沙质沉积物原核生物的定量效果有统计学差异(X2=11.26,P<0.05), 对沙质沉积物原核生物的定量效果无统计学差异。

图2 焦磷酸钠终浓度对沙质(a)、泥沙质(b)中沉积物病毒和原核生物计数的影响Fig.2 Effect of final concentrations of tetrasodium pyrophosphate on enumeration of viruses and prokaryotes from sandy (a) and muddy-sand (b) sediments
2.3 冰浴和常温超声对计数的影响
对沙质沉积物进行冰浴及常温条件下超声处理的实验结果显示, 冰浴超声得到的病毒丰度为常温超声所得的62.8%, 原核生物丰度为常温超声所得的27.6%。这说明在水浴中添加冰块会降低超声提取的效能, 导致获取的病毒和原核生物丰度的下降, 且对原核生物提取的影响更大。
2.4 离心与稀释的定量效能
对离心和稀释两种方法的定量效能的对比分析显示, 沙质沉积物样品经离心处理后, 获得的病毒丰度仅为稀释处理所得丰度的58.3%; 泥沙质沉积物经离心处理后, 获得的病毒丰度仅为稀释处理所得丰度的51.7%(图3a)。离心对原核生物丰度的影响更大,经离心处理后两中沉积物中所获原核生物丰度仅为稀释处理所得丰度的18.7%及13.0%(图3b)。

图3 离心与稀释对沙质(a)和泥沙质(b)沉积物中病毒和原核生物计数的影响Fig.3 Effects of centrifugation and dilution on enumeration of viruses and prokaryotes from sandy (a) and muddy-sand (b) sediments
对新鲜和冷冻保存的沙质和泥沙质沉积物以及冷冻保存的泥质沉积物进行了提取率的测算。通过数次清洗的计数发现, 通过一次提取加两次清洗后, 新鲜的沙质和泥沙质沉积物以及冷冻的泥质沉积物中获取的病毒丰度分别达总丰度的 94.1%、91.8%及95.6%。新鲜的沙质和泥沙质沉积物中获取的原核生物丰度略低于 90%(分别为 88.3%和 83.5%), 冷冻泥质沉积物中原核生物提取率达到93.3%。据此, 可将一次提取加两次清洗所得的丰度计为样品中病毒及原核生物总丰度。
在此基础上, 对各种沉积物中病毒和原核生物的提取率进行了测算(图4)。结果显示, 新鲜的沙质、泥沙质沉积物病毒提取率分别为 76.4%和 81.8%, 显著高于冷冻后的 63.6%和 66.1%, 且新鲜沉积物的病毒提取率具有较低的标准差(表1)。统计分析发现, 在不同类型沉积物中测得的病毒提取率有显著差异(Kruskal-WallisH检验,X2=19.73,P<0.05)。通过Mann-WhitneyU检验两两对比发现, 新鲜沉积物样品与其对应的冷冻样品获得的病毒提取率均有显著差异(U=0.0,P<0.05), 新鲜的沙质和泥沙质沉积物间、冷冻的沙质和泥沙质沉积物间病毒的提取率无统计学差异, 而冷冻的泥质沉积物病毒提取率与除冷冻泥沙质沉积物之外的所有类型沉积物的病毒提取率均有显著差异(表2)。
除泥质冷冻沉积物外, 原核生物提取率均低于相应沉积物中的病毒提取率。与病毒提取率相同, 新鲜沉积物中的原核生物提取率相对冷冻沉积物也具有较小的标准差(表 1)。对原核生物提取率进行Kruskal-WallisH检验及Mann-WhitneyU两两对比检验, 结果均无显著差异(表 2)。将同类型沉积物测得的病毒和原核生物的提取率进行两两对比发现, 两种新鲜沉积物样品中病毒提取率与原核生物提取率之间有显著差异(U=0.0,P<0.05), 而三种冷冻样品的病毒提取率与原核生物提取率之间无统计学差异。据此, 计算所得沙质沉积物病毒转换系数为 1.31, 泥沙质沉积物病毒转换系数为1.22; 沙质沉积物原核生物转换系数为1.57, 泥沙质沉积物为1.51。

图4 不同海洋沉积物中病毒(a)及原核生物(b)提取率Fig.4 Extraction efficiency of viruses (a) and prokaryotes (b) in different marine sediments
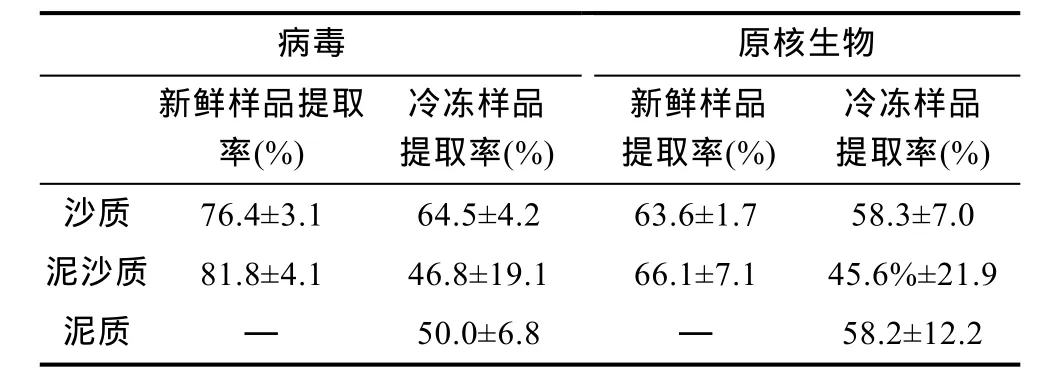
表1 不同类型海洋沉积物中病毒及原核生物的提取率Tab.1 The extraction efficiency of viruses and prokaryotes in different marine sediments
3 讨论
3.1 沉积物保存方式和保存时间对计数的影响
新鲜样品采集后立刻染色制片并于-20°C下保存是目前病毒定量中公认的最优保存手段(Henneset al, 1995; Brussaard, 2004; Wenet al, 2004; Patelet al,2007; Dell’Annoet al, 2009; Suttleet al, 2010)。但受条件所限, 野外采样常难以立即制片, 需经过一段时间的保存才能进行后续处理分析, 因此沉积物的有效保存对病毒的定量结果十分重要。
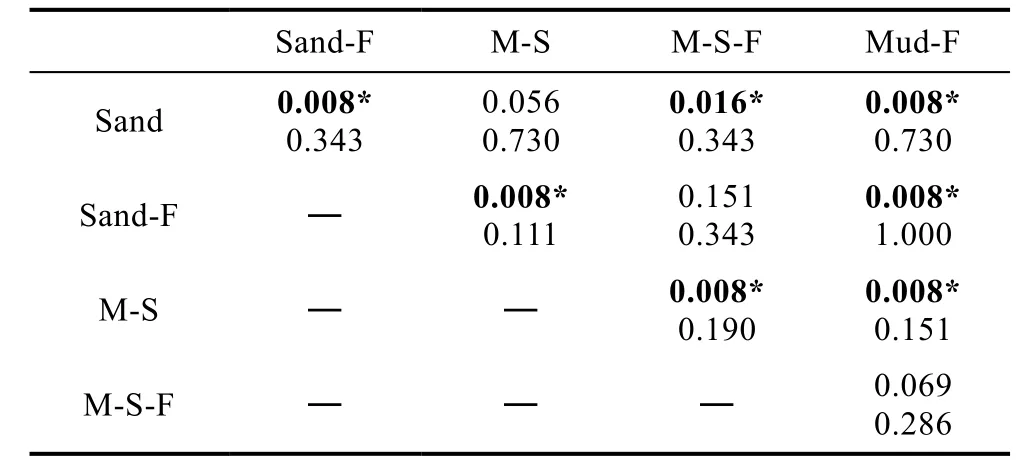
表2 不同类型海洋沉积物中病毒和原核生物提取率的两两对比检验Tab.2 Pairwise comparison test for extraction efficiency of viruses and prokaryotes from different marine sediments
目前较为有效的保存方法有两种, 即制片后于-20°C的制片保存及经液氮闪冻后-80°C冰箱的冷冻保存。本研究结果表明, 制片保存1个月后得到的病毒丰度低于当天计数所得丰度, 泥沙质沉积物封片所得丰度与当天计数相差较大(64.3%)。然而, 经3个月保存后, 泥沙质沉积物封片计数得到的病毒丰度则与当天计数相差无几(95.4%), 而沙质沉积物封片计数得到的病毒丰度还高于当天计数所得。这说明封片保存1个月后计数的降低并非丰度的损失, 实验条件和人为因素均可对计数结果产生影响。这可从原核生物的定量中获得佐证, 其丰度在制片保存1个月和3个月后均未降低, 说明封片经长时间保存后仍可有效计数, 证实制片保存可作为沉积物病毒和原核生物样品长期保存的手段。这一点与水体病毒保存方法的研究结果一致(Henneset al, 1995; Wenet al, 2004)。计数结果的差异可能主要是由于病毒和原核生物在封片上的不均匀分布造成的。因此, 在计数前应先通过低倍镜对封片上颗粒分布的均匀性进行评估, 选取分布较为均匀的区域进行计数, 颗粒分布过于不均的封片应舍弃。
冷冻保存在水体病毒的保存中被证明行之有效。Brussaard(2004)的研究表明, 水体病毒在保存 6个月后仍未见丰度的降低。而对于沉积物病毒, 实验显示了与已有研究不同的结果, 且对不同类型沉积物的冷冻保存效果差异明显。沙质沉积物在冷冻保存7天后, 病毒丰度即出现显著下降; 保存 30天后病毒丰度降低超过一个数量级, 表明对沙质沉积物而言冷冻保存效果不佳。泥沙质沉积物的冷冻保存效果明显优于沙质沉积物, 保存7天后的病毒丰度几乎未见变化(降低6.1%), 保存30天后病毒丰度有少许降低(约27%), 但在保存 60天后病毒丰度有明显降低, 表明泥沙质沉积物短期冷冻保存效果尚可, 但不宜超过30天。
在沙质沉积物中, 经 30天保存后原核生物丰度损失了约 69.7%, 明显低于病毒丰度的损失(约94.4%), 表明原核生物冷冻保存效果明显优于病毒。因此沙质沉积物经长期冷冻保存后, 其测得的病毒-原核生物比例(VPR or VBR)会被显著低估。泥沙质沉积物中病毒和原核生物的保存效果相差不大。
综上, 本研究表明冷冻保存不适合作为沉积物样品长期保存的方法, 这与水体病毒的保存方法研究的结论不一致(Brussaard, 2004; Wenet al, 2004)。对沙质沉积物而言, 样品采集后立刻制片是得到可靠丰度数据的唯一方法。对泥沙质沉积物而言, 在1个月以内冷冻保存的样品获得的丰度数据相对可靠,但保存2个月后的数据可信度便大大降低。本研究未对泥质沉积物样品进行保存效果的评估, 但据笔者后续的分析发现, 泥质沉积物的冷冻保存效果与泥沙质沉积物类似。沉积物颗粒性质的差异可能是造成不同类型沉积物保存效果差异的主要因素, 而病毒对沉积物颗粒的非特异性吸附作用是病毒丰度衰减的主要原因之一(Nobleet al, 1998; Danovaroet al,2008a), 因此。在对沉积物病毒进行定量研究时, 对于沙质沉积物应采取尽快制片保存的方法, 对于泥沙质和泥质沉积物病毒定量研究时可在短期内对样品进行冷冻保存, 若需要对样品长期保存则应选择制片保存。
3.2 焦磷酸钠浓度对计数的影响
应用表面活性剂对沉积物进行孵育是病毒颗粒提取中重要的一步, 旨在破坏病毒颗粒与沉积物颗粒之间的黏附作用, 从而使病毒颗粒从沉积物颗粒表面脱离。焦磷酸钠是目前使用最为广泛的表面活性剂(Danovaroet al, 2008a)。本研究对用于沙质和泥沙质沉积物中的焦磷酸钠浓度的实验结果显示, 使用终浓度为3mmol/L的焦磷酸钠对沉积物进行处理时,两种的类型沉积物中病毒均计数到最大丰度, 优于目前普遍使用的 5mmol/L焦磷酸钠浓度。泥沙质沉积物经不同终浓度焦磷酸钠处理所获得的丰度差异具有统计学差异, 说明焦磷酸钠终浓度对病毒与沉积物颗粒的分离效果具有重要作用。而沙质沉积物经处理后病毒丰度并无统计学差异, 表明焦磷酸钠对不同类型沉积物处理效果不同。对原核生物的处理结果与病毒相似, 也从侧面验证了不同浓度下焦磷酸钠对沉积物的定量效能。因此, 使用3mmol/L终浓度焦磷酸钠处理沉积物效果最好。
3.3 冰浴与常温超声对计数的影响
超声处理是病毒颗粒提取中非常重要的一步,可有效的将病毒颗粒与沉积物颗粒分离开来。Duhamel等(2006)的研究发现, 添加冰块会导致病毒计数的低估, 本研究结果验证了这一结论。研究还发现, 冰浴会对原核生物计数造成更大的低估。分析认为, 水浴可为沉积物样品提供一个良好的散热环境,在实际操作中也未发现样品出现过热现象; 而添加冰块可能会影响介质振动, 从而导致分离效果变差。
然而, 在已有的研究中, 不同的研究者并未对此进行统一。我们的结果显示冰浴会使超声处理的效果变差, 且由于冰浴超声对原核生物的影响更大, 从而导致求得的 VPR偏高。这不仅降低了不同研究之间数据的可比性, 也会影响对数据的分析。因此我们建议, 水浴超声时常温条件下即可, 不宜添加冰块。
3.4 离心与稀释的定量效能
离心处理是现行沉积物病毒荧光计数法中常用的手段, 可降低沉积物颗粒对观察计数的干扰。然而,经超声和焦磷酸钠处理后的沉积物颗粒上仍会有大量病毒和原核生物附着, 且离心时沉积物颗粒会连带许多悬浮的病毒及原核生物一同沉降, 导致计数结果偏低。
相较离心处理, 沉积物经超声和焦磷酸钠处理后再行稀释, 可避免离心处理造成的病毒和原核生物丰度损失, 且操作步骤更为简单。对这两种处理获得的数据比较显示, 直接稀释计数获得的丰度明显高于离心处理, 而且离心处理造成的原核生物丰度损失明显高于病毒的损失, 由此导致通过离心处理求得的 VPR也会显著高于稀释的结果。这一点从本研究结果和前人的工作中均得以证实(Fischeret al,2005; Danovaroet al, 2010)。这不仅降低了不同研究之间数据的可比性, 也会影响对病毒生态功能的探究。
因此, 对于沙质和泥沙质沉积物可直接进行稀释处理并计数, 所含的少许杂质通常也不会影响镜检结果(图5a, b)。但对于病毒丰度较低、沉积物颗粒较细密且腐殖质较多的沉积物样品(如深海泥质沉积物), 由于无法同时满足排除杂质干扰并保证稀释后足够的病毒丰度进行定量, 因此必须对样品进行离心处理(图5c, d)。

图5 直接稀释的沙质(a)、泥沙质(b)和泥质(c)沉积物及离心后稀释的泥质沉积物(d)中病毒(箭)及原核生物(箭头)的荧光显微照片Fig.5 Epifluorescence micrographs showing viruses (arrows) and prokaryotes (arrowheads) from directly diluted sandy (a),muddy-sand (b) and muddy (c) sediments and diluted muddy sediment after centrifugation (d)
对必须进行离心处理的样品, 离心造成的丰度损失可通过测算提取率以求得转换系数来补偿(Elleryet al, 1984; Danovaroet al, 2001)。Danovaro 等(2001)测得海洋沙质和泥沙质沉积物中病毒提取率约为60%, Helton等(2006)自河口沉积物获得的病毒提取率约为70%。本研究自5种不同处理的海洋沉积物获得的病毒提取率在47%—82%之间, 且自不同沉积物的病毒提取率差异较大, 无法使用统一的转换系数进行计算。研究还发现, 自新鲜沉积物获得的病毒和原核生物提取率较高, 而冷冻后的提取率则明显下降, 且实验误差增大, 这说明冷冻处理可能会改变沉积物和病毒颗粒及原核生物之间的非特异吸附作用(Nobleet al, 1998; Danovaroet al, 2008a)。由此建议,对不同类型沉积物的离心处理应单独测算提取率,对冷冻保存的样品处理应增加样品的重复数和洗涤次数以降低实验误差。对于原核生物的计数, 则应另外制片。由于原核生物颗粒较大, 荧光较亮(图5a, b),沉积物颗粒对原核生物计数的干扰程度不高, 因此对绝大多数类型的沉积物都可以采用稀释处理。
然而, 即便将离心所获的丰度经转换系数补偿后, 也可能与直接稀释的计数结果有较大差异。本研究显示, 沙质沉积物离心所获病毒丰度仅为稀释所获丰度的 76.3%, 泥沙质沉积物为 63.1%。所获沙质和泥沙质沉积物中原核生物的丰度分别仅为稀释所得的 28.3%和 19.7%。这说明, 即使通过本文所述的附加数次清洗的方法测得提取率, 也难以弥补离心处理造成的丰度损失。增加洗涤次数无疑有助于获得更为准确的丰度数据(Siem-Jørgensenet al, 2008), 但同时增加了样品处理的工作量和成本。因此, 建议在处理沉积物样品时应尽量用稀释的方法, 以获取更加准确的丰度数据。
4 病毒荧光计数法流程
基于Danovaro等(2001, 2010)建立的沉积物病毒荧光计数法, 并结合本研究的结果, 提出了如下优化的处理流程。
4.1 试剂配制及保存
实验所用玻璃器皿经10% HCl浸泡过夜、蒸馏水充分清洗后, 再以高压蒸汽(120°C, 20min)灭菌处理; 所用离心管、枪头等塑料耗材需用高压蒸汽(120°C, 20min)灭菌处理。
实验所用海水及蒸馏水需经0.22μm孔径的硝酸纤维素滤膜过滤(直径 25mm), 并经高压蒸汽(120°C,20min)灭菌后, 再以0.02μm孔径的Anodisc Al2O3滤膜(Whatman; 25mm直径)过滤, 装入灭菌处理后的蓝口瓶储存; 所用试剂均经无菌处理后的蒸馏水配制,再以0.22μm孔径针头式过滤器过滤。所用固定液应使用无菌处理后的海水配置。
焦磷酸钠储备液: 为方便后续操作, 将焦磷酸钠储备液浓度配制为50mmol/L的母液。称取0.532g焦磷酸钠(分子量265.90)溶于40mL无菌蒸馏水, 经0.22μm孔径针头式过滤器过滤, 于4°C避光冷藏保存。
荧光剂保护剂: 由 PBS(phosphate buffered saline)-甘油溶液和 10%(体积质量比)对苯二胺(p-phenylenediamine)溶液混合而成, 两部分需分开储存。称取 0.0425g氯化钠(NaCl)和0.09g磷酸氢二钠(Na2HPO4…12H2O)溶解于 5mL 无菌蒸馏水水中配成50% PBS溶液 (Na2HPO4终浓度0.05mol/L, NaCl质量分数为 0.85%), 再加入 5mL甘油充分混匀。所得PBS-甘油溶液经 0.22 µm孔径针头式过滤器过滤后,小份分装(990µL一份), -20°C冰箱保存; 称取0.1g对苯二胺盐酸盐(PDA)溶解于 1mL无菌蒸馏水中配成10%对苯二胺溶液, 经 0.22µm 孔径针头式过滤器过滤后, 小份分装并于-20°C冷冻暗保存。
临用前取 10%对苯二胺储备液融化, 摇匀后吸取 10µL 与 990µL PBS-甘油储备液混合, 制成工作液。工作液应避光冷藏待用, 未用完的工作液可于-20°C短期保存, 建议每次实验均使用新配置的荧光保护剂。未用完的10%对苯二胺储备液应立即再行冷冻, 但累计冻、融3次后须丢弃。新配置的对苯二胺储备液呈淡紫色, 冷冻后呈白色。若储备液或荧光保护剂工作液颜色变深则不可使用, 应重新配制。
荧光染色剂: 市售SYBR Green I (Sigma), 小份分装并于-20°C避光保存。临用前, 取出SYBR Green I储备液, 用无菌蒸馏水按1: 20稀释(如50µL储备液加到 950µL蒸馏水中)配制为工作液。未用完的工作液避光、4°C冷藏, 保存一个月后仍可使用。但使用时, 需加新配制的荧光保护剂, 否则观察时荧光亮度不足、淬灭较快。未用完的工作液不能再行冷冻, 反复冻融对染液影响较大, 因此在分装储备液时应根据实验需要合理控制分装体积。
需要指出的是, SYBR Gold也是海洋病毒定量中常用的荧光染色剂, 但价格较SYBR Green I更低, 故二者均可择用。Fischer等(2005)及Duhamel等(2006)提出SYBR Gold对沉积物病毒的染色效果较SYBR更好, 而Hewson等(2003)则认为SYBR Green I的效果略佳。
4.2 样品采集与保存
用灭菌后的采样勺刮取未受扰动的表层沉积物(目前普遍采取表层 0—1cm)约 50mL, 充分混匀后采集至少3个分样, 每个 0.5mL, 置于无菌10mL离心管中, 加入无菌海水配制的 2%醛类(甲醛或戊二醛)固定液4.2mL充分混匀, 经提取染色制片后计数或将封片于-20°C冰箱保存; 若无法立即制片, 则置于无菌5mL冻存管中, 加入无菌海水配制的2%醛类(甲醛或戊二醛)固定液 4.2mL充分混匀, 于避光处静置15—30min使样品充分固定, 之后经液氮闪冻后移至-80°C冰箱冷冻保存, 1个月内处理。
4.3 沉积物样品处理流程
(1) 融化: 采取37°C水浴及室温融化样品均可。
(2) 表面活性剂处理: 样品融化后充分摇匀, 加入300µL焦磷酸钠储备液(终浓度3mmol/L), 充分混匀后室温避光孵育15min。
(3) 超声处理: 孵育之后将样品充分摇匀, 置于水浴超声波细胞破碎仪中超声处理 3×1min。为避免样品过热, 每超声处理 1min后中断 30s并手动摇匀样品。
(4) 稀释: 采取梯度稀释的方法以防止因样品分布不均所造成的误差。例如稀释 1000倍, 可取 2个10mL离心管, 每管加入 4.5mL无菌的海水, 先从充分混匀后的样品管中取0.5mL悬液加入1号管充分混匀, 再从1号管取0.5mL悬液加入 2号管充分混匀,最后从2号管中取0.5mL悬液进行过滤。
(5) 离心: 对无法通过稀释降低沉积物颗粒干扰的样品应进行离心。样品摇匀后离心800g×1min, 对于颗粒较细、杂质较多的沉积可适当延长离心时间至3—5min, 离心后取上清液进行稀释。
(6) 提取率: 若在处理中加入离心步骤, 则应测算病毒提取率。小心移除剩余上清液, 在离心管中加入4.5mL无菌蒸馏水洗涤剩余沉积物, 充分混匀后再次离心, 取上清液制片。重复数次清步骤后, 计数所有封片的总丰度作为样品总丰度, 以第一次提取所得丰度除以总丰度计算提取率。
(7) 过滤: 滤筒用蒸馏水仔细清洗后高温灭菌。在过滤装置的滤板上放置孔径为 0.45µm 孔径的25mm微孔滤膜作为副膜, 加入无菌蒸馏水抽洗滤筒(若抽洗滤筒后副膜上有肉眼可见杂质, 则应更换副膜)。抽洗后将 Al2O3滤膜仔细覆盖于润湿的副膜上,注意 Al2O3滤膜与副膜之间不可有气泡, 否则过滤时液体将残留在 Al2O3滤膜上, 影响后续操作。在压力<250mm 汞柱条件下把样品抽滤至干, 卸下滤筒, 在真空泵开启状态下取下Al2O3滤膜。由于抽滤速度极慢, 过膜样品体积不可过多, 一般在0.5—1mL为宜。当天使用的滤器, 在各个样品过滤前抽洗一次, 抽洗时不必取下副膜。
(8) 干燥滤膜: 用低尘纸轻轻擦拭滤膜无样品面,擦去残留液体后置于低尘纸上避光静置至滤膜完全干燥(此时滤膜不透明, 无水迹)。
(9) 染色: 吸取20µL SYBR Green I染色剂工作液滴加在一次性培养皿中, 培养皿及染色剂需置于避光处; 用平头镊子夹取干燥后的滤膜, 无样品面朝下放在培养皿的染色液滴上避光染色20min。染色后用 0.5—1mL无菌蒸馏水冲洗滤膜上残留的染液, 以降低荧光背景干扰。冲洗后用前述方式干燥滤膜。
(10) 制片: 载玻片中央滴加 5µL荧光保护剂工作液。待滤膜完全干燥后, 置于载玻片上的液滴当中,并在盖玻片上滴加 25µL荧光保护剂工作液, 液面朝下盖紧滤膜(滤膜上下两面均不能有气泡)。
(11) 计数: 在荧光显微镜蓝色激发光道和油镜下, 视野中可见病毒颗粒呈针扎状、亮绿色。随机取不重复视野计数病毒颗粒数, 每张封片至少计数 400个病毒颗粒或40个视野。计数前应先通过低倍镜对封片上颗粒分布的均匀性进行评估, 选取分布较为均匀的区域进行计数, 颗粒分布过于不均的封片应舍弃。
原核生物丰度较高时也可从同一张封片上计数。在荧光显微镜蓝色激发光道和油镜下, 视野中可见原核生物颗粒呈明亮、规则的杆状或球状, 大小约为0.2—2μm。随机取不重复视野计数原核生物颗粒数,每个样品至少计数400个原核生物或40个视野。若样品经离心处理, 则建议原核生物另外制片计数。
(12) 病毒丰度计算公式:
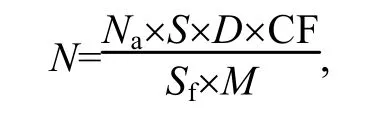
式中:
N —— 样品含病毒数, 单位为病毒样颗粒数每克沉积物干重(VLP/g);
Na——各视野平均病毒数, 单位为 VLP(virus like particles);
S —— 滤膜实际过滤面积, 单位为平方毫米(mm2);
Sf—— 显微镜视野面积, 单位为平方毫米(mm2);
M —— 0.5mL沉积物干重, 单位为克(g);
D—— 样品稀释倍数;
CF —— 转换系数(处理过程中有离心步骤时应测算此系数, 计算方法为1/提取率)。
5 结论
利用 SYBR Green I等高亮度荧光染色剂染色,以荧光显微镜进行观察计数是沉积物病毒定量研究最通行的方法。但对于该法技术流程中一些至关重要的实验条件及处理方式, 要么未行实验验证, 要么未行统一。本研究采用不同类型海洋沉积物, 对现行的病毒荧光计数法的主要实验流程及条件进行了效能评估和优化, 通过实验检验和分析, 提出了一套优化的沉积物病毒荧光计数法流程。实验结果表明, 本文提出的技术流程可重复性较强, 适用于从近海到深海的多种类型沉积物病毒的定量分析, 获得可靠的沉积物病毒定量数据。
马 玉, 汪 岷, 夏 骏等, 2016. 秦皇岛褐潮期超微型浮游生物丰度及多样性研究. 中国海洋大学学报(自然科学版),46(6): 142—150
中国科学院海洋研究所, 2011. HY/T 140-2011 海洋微型底栖生物调查规范. 北京: 中国标准出版社, 1—30
王海丽, 杨季芳, 屠霄霞等, 2011. 象山港海洋病毒时空分布特征及其环境影响因素. 中国环境科学, 31(5): 834—844
卢龙飞, 汪 岷, 梁彦韬等, 2013. 东海、黄海浮游病毒及异养细菌的分布研究. 海洋与湖沼, 44(5): 1339—1346
白晓歌, 汪 岷, 梁彦韬等, 2008. 运用荧光显微技术分析北黄海夏季浮游病毒的分布. 中国海洋大学学报(自然科学版), 38(4): 609—613
刘晶晶, 曾江宁, 杜 萍等, 2011. 长江口及邻近海域夏、冬季浮游病毒丰度分布. 应用生态学报, 22(3): 793—799
孙 辉, 汪 岷, 汪 俭等, 2014. 养殖活动对超微型浮游生物分布影响的研究. 海洋与湖沼, 45(6): 1272—1279
孙小磊, 赵以军, 刘 妮等, 2009. 淡水湿地浮游病毒的空间分布. 生态学报, 29(2): 1048—1054
张 喆, 王晓红, 巩秀玉等. 2017. 南海北部海域春季浮游细菌和病毒空间分布及其影响因素. 生态学报, 37(5): 1639—1649, doi: 10.5846/stxb201509231958
张 喆, 孟祥红, 肖 慧等, 2008. 青岛近岸水体夏冬季浮游病毒、细菌分布特征及其与环境因子的关系. 武汉大学学报(理学版), 54(2): 209—214
张永雨, 黄春晓, 杨 军等, 2011. 海洋微生物与噬菌体间的相互关系. 科学通报, 56(14): 1071—1079
李 清, 闫启仑, 李洪波等, 2016. 大连湾和大窑湾表层沉积物病毒分布特点. 海洋环境科学, 35(2): 184—189
李洪波, 肖 天, 林凤翱, 2010. 海洋浮游病毒的研究方法.海洋科学, 34(9): 97—101
李洪波, 崔向阳, 林凤翱等, 2010. 河北近岸海域浮游细菌与病毒的关系. 海洋环境科学, 29(2): 187—190
李胜男, 王秀娟, 周 建等, 2015. 利用流式细胞仪计数微型浮游生物的方法. 湖泊科学, 27(5): 757—766
国家海洋局, 2007. GB/T 12763.6-2007海洋调查规范 第6部分: 海洋生物调查. 北京: 中国标准出版社, 159
赵 苑, 武洪庆, 李洪波等, 2010. 胶州湾浮游病毒的分布研究. 海洋科学, 34(7): 86—92
李 娟, 2005. 病毒: 海洋生态动力学和疾病学研究的创新点.海洋湖沼通报, 2: 79—87
潘洛安, 张利华, 张 经, 2006. 应用流式细胞术检测水体病毒. 海洋环境科学, 25(3): 78—85
Brussaard C P D, 2004. Optimization of procedures for counting viruses by flow cytometry. Applied and Environmental Microbiology, 70(3): 1506—1513
Danovaro R, Dell’Anno A, Trucco Aet al, 2001. Determination of virus abundance in marine sediments. Applied and Environmental Microbiology, 67(3): 1384—1387
Danovaro R, Corinaldesi C, Filippini Met al, 2008a.Viriobenthos in freshwater and marine sediments: A review.Freshwater Biology, 53(6): 1186—1213
Danovaro R, Dell’Anno A, Corinaldesi Cet al, 2008b. Major viral impact on the functioning of benthic deep-sea ecosystems. Nature, 454(7208): 1084-1087
Danovaro R, Middelboe M, 2010. Separation of free virus particles from sediments in aquatic systems. Manual of Aquatic Viral Ecology, 8: 74—81
Dell’Anno A, Corinaldesi C, Magagnini Met al, 2009.Determination of viral production in aquatic sediments using the dilution-based approach. Nature Protocols, 4(7):1013—1022
Duhamel S, Jacquet S, 2006. Flow cytometric analysis of bacteria-and virus-like particles in lake sediments. Journal of Microbiological Methods, 64(3): 316—332
Ellery W, Schleyer M, 1984. Comparison of homogenization and ultrasonication as techniques in extracting attached sedimentary bacteria. Marine Ecology Progress Series, 15(3):247—250
Fischer U R, Kirschner A K T, Velimirov B, 2005. Optimization of extraction and estimation of viruses in silty freshwater sediments. Aquatic Microbial Ecology, 40(3): 207—216
Helton R R, Liu L, Wommack K E, 2006. Assessment of factors influencing direct enumeration of viruses within estuarine sediments. Applied and Environmental Microbiology, 72(7):4767—4774
Hennes K P, Suttle C A, 1995. Direct counts of viruses in natural waters and laboratory cultures by epifluorescence microscopy. Limnology and Oceanography, 40(6):1050—1055
Hewson I, Fuhrman J A, 2003. Viriobenthos production and virioplankton sorptive scavenging by suspended sediment particles in coastal and pelagic waters. Microbial Ecology,46(3): 337—347
Noble R T, Fuhrman J A, 1998. Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria. Aquat Microb Ecol, 14: 113—118
Patel A, Noble R T, Steele J Aet al, 2007. Virus and prokaryote enumeration from planktonic aquatic environments by epifluorescence microscopy with SYBR Green I. Nature Protocols, 2(2): 269—276
Siem-Jørgensen M, Glud R N, Middelboe M, 2008. Viral dynamics in a coastal sediment: Seasonal pattern,controlling factors and relations to the pelagic-benthic coupling. Marine Biology Research, 4(3): 165—179
Suttle C A, 2005. Review Viruses in the sea. Nature, 437(7057):356—361
Suttle C A, Fuhrman J A, 2010. Enumeration of virus particles in aquatic or sediment samples by epifluorescence microscopy.Manual of Aquatic Viral Ecology, 15: 145—153
Wen K, Ortmann A C, Suttle C A, 2004. Accurate estimation of viral abundance by epifluorescence microscopy. Applied and Environmental Microbiology, 70(7): 3862—3867
Wilhelm S W, Suttle C A, 1999. Viruses and nutrient cycles in the sea-viruses play critical roles in the structure and function of aquatic food webs. Bioscience, 49: 781—788

