G试验和GM试验联合痰真菌培养对ICU患者侵袭性真菌感染的早期诊断
孟文晴, 陆 璇, 潘正慧, 徐 猛, 李程浩, 赵文静
(1徐州医科大学,江苏 徐州 221002;2 徐州医科大学附属医院,江苏 徐州 221002)
·论著·
G试验和GM试验联合痰真菌培养对ICU患者侵袭性真菌感染的早期诊断
孟文晴1, 陆 璇1, 潘正慧1, 徐 猛1, 李程浩1, 赵文静2
(1徐州医科大学,江苏 徐州 221002;2 徐州医科大学附属医院,江苏 徐州 221002)
目的探讨血清1,3-β-D 葡聚糖检测(G试验)及半乳甘露聚糖抗原检测(GM试验)联合痰真菌培养在重症监护病房(ICU)患者侵袭性真菌感染(IFI)早期诊断中的价值。方法选取徐州医科大学附属医院2015年1月—2016年12月重症监护病房(ICU)有高危IFI因素的住院患者,根据IFI的诊断标准将患者分成3组:IFI组(包括确诊及临床诊断)、拟诊IFI组、非IFI组。分析三组患者血清G试验、GM试验和痰真菌培养的结果,评价三者联合检测对IFI的早期诊断价值。结果共调查ICU住院患者264例,其中IFI组56例,拟诊IFI组43例,非IFI组165例。56例诊断IFI患者中,血清G试验阳性46例,GM试验阳性39例,真菌培养阳性34例;三者联合检测的敏感性98.2%、特异性82.4%、阳性预测值65.5%、阴性预测值99.3%、阳性似然比5.58、阴性似然比0.02、Youden指数0.98。三者联合检测的敏感性、阴性预测值均高于G试验、GM试验和痰真菌培养的单独检测,差异均有统计学意义(均P<0.05);但是,三者联合检测的特异性、阳性预测值与单独检测G试验、GM试验和痰真菌培养比较,差异均无统计学意义(均P>0.05)。结论G试验、GM试验和痰真菌培养三者联合检测能提高ICU患者IFI早期诊断的敏感性,从而指导临床医生早期治疗IFI。
(1,3)-B-D葡聚糖; 半乳甘露聚糖; 痰培养; 危重症患者; 侵袭性真菌感染; 联合检测
侵袭性真菌感染(invasive fungal infection,IFI)是指真菌侵入人体组织、血液,并在其中生长繁殖导致组织损害、器官功能障碍和炎症反应的病理改变及病理生理过程[1]。重症监护病房(intensive care unit, ICU)患者是IFI的高发人群,IFI起病隐匿、缺乏特异的临床表现,且症状容易被患者基础疾病所掩盖,因此,容易导致漏诊、误诊。ICU患者多为危重症患者,存在多种基础疾病,容易受到真菌的侵袭性感染,且预后较差。经培养、检测早期发现并诊断真菌感染,可为临床医生早期给予准确治疗提供依据,从而降低患者病死率和真菌的耐药率,改善患者的预后[2-3]。
侵袭性真菌感染的诊断金标准是通过组织学或真菌培养检出真菌,但是组织学标本的获取需要具备一定的技术条件,有创伤性,且敏感性较低,容易引起严重的并发症,不适用于危重症患者。近年来,真菌抗原检测方法如血清1,3-β-D葡聚糖检测(G试验)及半乳甘露聚糖抗原检测(GM试验),具备操作简便、敏感性和特异性均较高等优势,广泛应用于临床,成为真菌感染早期诊断的检测方法。同时,传统的真菌培养可根据菌落的外观、生化反应等对菌株进行鉴定和药敏试验,然后根据药敏结果指导抗真菌治疗。本研究通过分析某院2015年1月—2016年11月疑似IFI的ICU住院患者的G试验、GM试验和痰真菌培养的结果,探讨G试验和GM试验联合痰真菌培养在ICU患者IFI早期诊断中的应用价值。
1 对象与方法
1.1 研究对象 徐州医科大学附属医院2015年1月—2016年11月有高危IFI因素的ICU住院患者,根据IFI的诊断标准将患者分成3组:IFI组(包括确诊及临床诊断)、拟诊IFI组、非IFI组。
1.2 诊断标准 参考欧洲癌症研究治疗组织及真菌研究组(EORTC/MSG)的诊断标准[4]和中国侵袭性真菌感染工作组制定的临床诊断侵袭性真菌病的诊断标准[5]:(1)确诊:组织病理学证实为真菌,无菌组织及血液培养为真菌;(2)临床诊断:具有IFI宿主因素及临床表现,同时伴有一项病原学依据;(3)临床拟诊:具有IFI宿主因素及临床表现,无病原学依据,抗真菌治疗有效;(4)排除诊断:不符合以上标准,单用抗菌药物治疗有效。
1.3 仪器与试剂 痰培养:法国梅里埃 ATB 半自动电脑检测仪及其培养瓶、鉴定试剂盒、沙保罗氏TTC平板。G试验:MB-80微生物快速动态检测系统、流水线式全自动酶联免疫工作站(ADCEIISA 180)、T02智能恒温仪、高速离心机、振荡器及北京金山川科技发展有限公司生产的GKT-5M动态真菌检测试剂盒(光度法)。GM试验:Bio-Rad公司生产的酶联免疫吸附检测血清GM试剂盒。
1.4 检测方法 痰真菌培养标本的留取和真菌分离培养均按照《全国临床检验操作规程》进行操作。G试验严格按照仪器和试剂说明书进行操作。诊断标准:G值<60 pg/mL,检测结果为阴性(隐球菌、接合菌除外),G值>100 pg/mL,检测结果为阳性,G值在60~100 pg/mL为临床观察期。GM试验严格按照试剂盒说明书进行操作。试验原理采用酶联免疫一步夹心法,根据换算公式Index=标本OD值/临界值对照OD值均值,将标本OD值换算为系数I值,半乳甘露聚糖的具体测定标准如下:I值(GM值)<0.5则表示检测结果为阴性,连续两次样本检测的I值>0.5,或一次检测结果的I值≥0.7,则表示检测结果为阳性。计算单项试验和联合试验的灵敏度、特异性、阳性预测者和阴性预测值、阳性似然比、阴性似然比、Youden指数等指标。联合试验是指并联试验,联合试验中有一项结果为阳性则认定为联合试验结果为阳性。

2 结果
2.1 一般资料 2015年1月—2016年11月徐州医科大学附属医院有高危IFI因素的ICU住院患者共264例,其中IFI组56例(包括确诊及临床诊断),拟诊IFI组43例,非IFI组165例。男性183例,女性81例;年龄23~90岁,平均年龄(67.0±15.7)岁。各组间性别、年龄、APACHEⅡ评分、ICU住院时间、总住院时间等差异均无统计学意义(均P>0.05),见表1。264例ICU住院患者中输注蛋白制品180例(68.2%),气管插管机械通气患者144例(54.5%),气管切开患者69例(26.1%),中心静脉置管患者193例(73.1%),使用广谱抗菌药物患者163例(61.7%),血液透析患者10例(3.8%)。

表1 IFI组、拟诊IFI组、非IFI组三组患者基本特征
注:M为中位数,QR为四分位数间距
2.2 G试验、GM试验及痰真菌培养结果 56例IFI患者中,G试验阳性46例,血清GM试验阳性39例,痰真菌培养阳性34例;165例非IFI组患者中,G试验阳性24例,血清GM试验阳性18例,痰真菌培养阳性28例,见表2。本研究中,264例患者中痰真菌培养阳性共125例次,其中以白假丝酵母菌为主(53例,占42.4%),其次为光滑假丝酵母菌(16例,占12.8%)、近平滑假丝酵母菌(15例,12.0%)和曲霉菌(14例,占11.2%)等,见表3。
表2G试验、GM试验与痰培养三组患者单项检测及联合检测结果
Table2Results of single and combined detection of G-test, GM-test, and sputum culture in three groups of patients
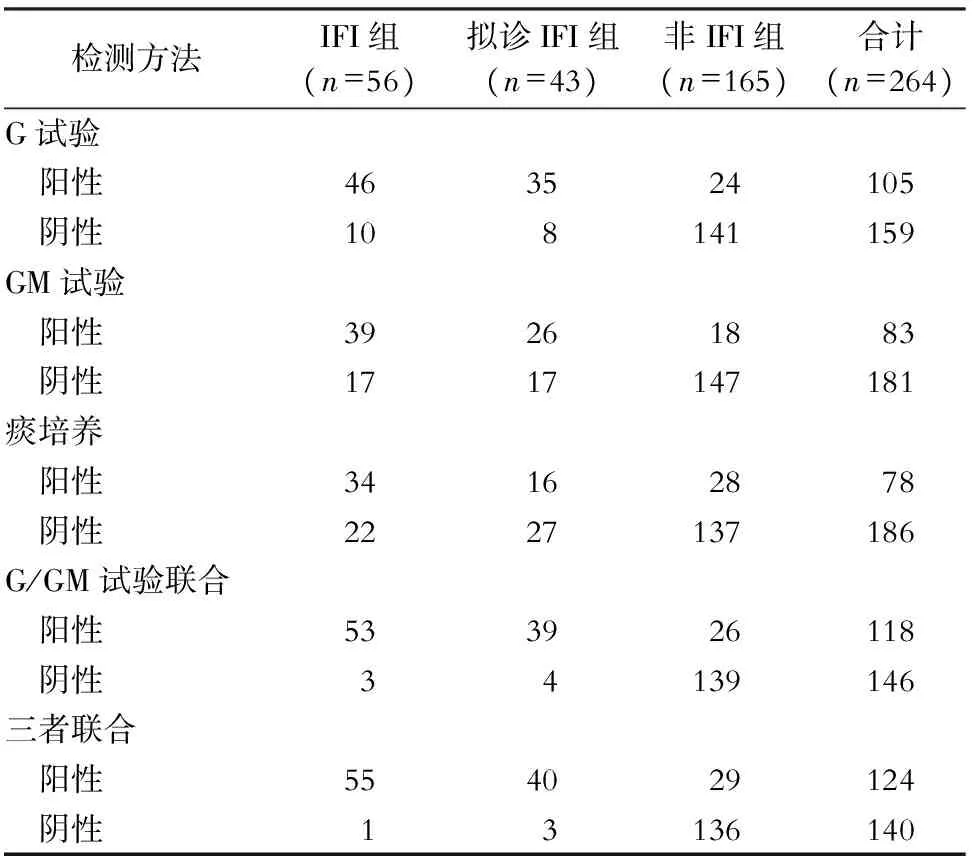
检测方法IFI组(n=56)拟诊IFI组(n=43)非IFI组(n=165)合计(n=264)G试验 阳性463524105 阴性108141159GM试验 阳性39261883 阴性1717147181痰培养 阳性34162878 阴性2227137186G/GM试验联合 阳性533926118 阴性34139146三者联合 阳性554029124 阴性13136140
表3ICU患者痰真菌培养阳性及其G试验、GM试验检测结果
Table3Positive for sputum fungal culture, as well as G-test and GM-test results of ICU patients

真菌名称例数百分比(%)G试验阳性例数GM试验阳性例数白假丝酵母菌5342.42011光滑假丝酵母菌1612.8116近平滑假丝酵母菌1512.093热带假丝酵母菌129.663克柔假丝酵母菌86.432都柏林假丝酵母菌43.212葡萄牙假丝酵母菌21.610皱褶假丝酵母菌10.810曲霉菌1411.269合计125100.05836
2.3 G试验、GM试验、痰真菌培养及联合检测结果 以IFI组为真阳性(n=56),以非IFI组为真阴性(n=165),分析G试验、GM试验、痰培养、G试验联合GM试验及三者联合检测的敏感性、特异性、阳性预测值、阴性预测值、阳性似然比、阴性似然比、Youden指数等指标。
G试验与GM试验的敏感性、特异性、阳性预测值、阴性预测值比较,差异均无统计学意义(均P>0.05)。G试验联合GM试验检测的敏感性高于单独检测G试验和GM试验,差异均有统计学意义(χ2值分别为4.264、11.930,均P<0.05)。G试验联合GM试验检测的阴性预测值高于GM试验,差异有统计学意义(χ2=8.486,P=0.004);但是与G试验比较,差异无统计学意义(P>0.05)。G试验联合GM试验检测的特异性和阳性预测值与单独检测G试验、GM试验相比,差异均无统计学意义(均P>0.05)。
三者联合检测的敏感性为98.2%、特异性为82.4%、阳性预测值为65.5%、阴性预测值为99.3%、阳性似然比为5.58、阴性似然比为0.02、Youden指数为0.98。三者联合检测的敏感性均高于G试验、GM试验和痰真菌培养的单独检测,差异有统计学意义(χ2值分别为8.166、16.946、24.129,均P<0.05)。三者联合检测的阴性预测值均高于G试验、GM试验和痰真菌培养的单独检测,差异有统计学意义(χ2值分别为6.789、12.327、17.640,均P<0.05)。但是,三者联合检测的特异性、阳性预测值与单独检测G试验、GM试验和痰真菌培养相比差异均无统计学意义(均P>0.05)。三种检测方法联合不仅提高了IFI检出的敏感性、阴性预测值,而且三种方法联合检测阳性似然比较大,阴性似然比很小,Youden指数比较高。见表4。

表4 G实验、GM试验与痰培养单项检测及联合检测结果
a:与G试验比较,P<0.05;b:与GM试验比较,P<0.05;c:与痰培养比较,P<0.05
3 讨论
ICU的住院患者由于病情危重,基础疾病较多,接受中心静脉置管、气管插管及机械通气、气管切开、血液透析等各种有创操作的机会较多,因此是IFI的高危人群。有研究[6-7]表明,ICU危重患者IFI发病率高达50%左右,明显高于普通病房患者。由于IFI早期诊断困难,不能够及时给予治疗,真菌感染患者病死率较高(56%~95%)[8],严重威胁危重患者的生命。实验室早期发现并诊断IFI,可以为临床早期抗真菌治疗提供参考依据,改善患者的预后[9]。由于传统诊断方法如组织病理、影像学、真菌培养等耗时长、敏感性差、培养阳性率低及培养条件受限,很难满足其早期诊断及早期治疗的需求。
目前,血清特异性抗原检测因操作便捷、敏感性高、特异性高等优势受到广泛关注。(1,3)-β-D葡聚糖几乎存在于所有真菌的细胞壁上,是一种真菌特异性物质,在真菌感染过程中,(1,3)-β-D葡聚糖可从胞壁中释入血液或其他液体中,因此,检测(1,3)-β-D葡聚糖可成为侵袭性真菌感染的早期诊断指标。半乳甘露聚糖(GM)是曲霉属真菌细胞壁上的一种特异性多糖成分,是曲霉菌菌丝最早释放的抗原,一般在感染的早期或发病5~8 d后GM水平即可升高。因此,在患者临床症状、肺部CT尚无特异性表现,以及真菌培养尚未出结果之前,GM抗原定性测定可以早期诊断真菌感染。但是,血清GM检测可应用曲霉菌感染的诊断,对广谱真菌感染无诊断价值。G试验和GM试验结果受多种因素影响,存在一定的假阳性。传统的真菌培养方法虽然存在耗时长、敏感性低和外源性污染等缺点,但是根据培养结果可以观察到真菌菌落的外观,并根据生化反应对菌株进行鉴定和药敏分析,从而根据药敏结果指导临床用药。
本研究结果显示,G试验的敏感性、特异性、阳性预测值、阴性预测值分别为82.1%、85.5%、65.7%和93.4%;GM试验的敏感性、特异性、阳性预测值、阴性预测值分别为69.6%、69.1%、68.4%和89.6%;提示G试验和GM试验对于ICU患者诊断IFI均具有较好的临床价值,与国内其他研究结果[10]一致;而G试验联合GM试验检测可明显提高IFI检出的敏感性(94.6%),二者联合检测阴性似然比很小、Youden指数较高,表明联合检测较单独检测效果好,与许多研究结果[11-14]一致。但是,G试验阳性只能提示存在IFI,不能确定为何种真菌感染,而且对隐球菌和接合菌的检出率很低。GM试验仅在诊断侵袭性曲霉菌感染时特异性高,而对其他真菌感染不敏感。
痰真菌培养、G试验和GM试验三种检测方法各有优缺点,本研究将三种检测方法联合,结果表明其敏感性98.2%、特异性82.4%、阳性预测值65.5%、阴性预测值99.3%、阳性似然比5.58、阴性似然比0.02、Youden指数0.98。三者联合检测使敏感性得到大大提高,可以尽量避免漏诊情况的发生,同时特异性有所降低、阴性预测值提高、阴性似然比较小,提示三者检测排除阴性结果的能力增强。三者联合检测后依然存在假阳性病例,可能与危重症患者本身病情复杂及药物使用有关。本研究显示ICU患者常合并多种基础疾病,进行有创操作和抗感染治疗的比例较普通病房高,例如行气管插管机械通气、气管切开、中心静脉置管、血液透析、输注蛋白制品、使用广谱抗菌药物等,这些因素不仅是IFI发生的高危因素,而且可能影响IFI患者G试验和GM试验检测的结果,因此,诊断IFI时需结合患者的病情综合判断。
本研究结果表明,联合检测的预测价值优于单项检测,可能与各种方法检测的物质不同,而各种物质代谢存在差异,因此,单项均可能出现假阳性结果。相关文献[15-18]报道, G试验出现假阳性的原因包括:(1)标本暴露在含有葡聚糖的材料上,如纱布;(2)败血症,其中又以链球菌导致的败血症为多见;(3)使用多糖类抗癌药物;(4)静脉输注蛋白制品、血液制品等;(5)使用可能诱发G试验假阳性如碳青霉烯类、头孢菌素类、β-内酰胺酶类、磺胺类等抗菌药物;(6)合并其他部位真菌感染。本研究纳入的264例ICU住院患者中输注蛋白制品的患者高达68.2%。本研究提示G试验阳性率高,但特异性低,阳性预测值较低,可能与ICU重症患者输注蛋白制品比例较高有关;而假阴性时可能是浅部真菌感染或定植时,(1,3)-β-D葡聚糖未被释放出来使体液中的量不增高,故其检测呈阴性[19]。
GM试验出现假阳性结果常常与以下因素有关[20-24]:(1)使用半合成青霉素尤其是哌拉西林/他唑巴坦;(2)新生儿和儿童;(3)血液透析;(4)自身免疫性肝炎;(5)输注含有葡聚糖的蛋白制剂,食用菌类食物等。GM检测结果的特异性在幼儿及新生儿中较低,可能由于GM存在于多种食物中,然后从食物中移位到胃肠黏膜引起,因此降低了GM检测的特异性[25]。本研究中非IFI组患者有6例患者出现阳性,这些GM试验假阳性的患者中有4例临床并没有出现真菌感染的症状和体征,且真菌培养及病原学检查均为阴性,GM假阳性考虑与患者检测时正在进行床旁血液透析操作,导致结果出现假阳性;其余2例GM试验假阳性患者检测时使用哌拉西林/他唑巴坦进行抗感染治疗,且这2例患者病原学检查未检测出真菌。GM试验出现假阴性则与检测时间、病情严重程度、体内分解代谢、试验最低值限制等有关。释放入血循环中的GM清除较快,当患者病情轻、使用肠内营养,或使用过抗真菌药物,可显著降低GM检测的敏感性[24]。
本研究结果显示,264例患者痰真菌培养阳性共125例次,培养菌株以白假丝酵母菌为主,其次为光滑假丝酵母菌、近平滑假丝酵母菌、曲霉菌等。这些结果显示目前临床上引起IFI常见的病原菌主要是假丝酵母菌和曲霉菌,但是由于抗真菌药物的长期大量使用,其他少见的真菌逐渐增多。本研究结果显示,真菌培养未发现其他少见真菌,可能与微生物实验室培养条件和实验环境有关。不同抗真菌药物对不同真菌的效果不同,其中氟康唑对假丝酵母菌属效果较好,伏立康唑对曲霉菌属效果好,根据真菌培养和药敏结果,可以更好地指导抗真菌药物应用。
总之,G试验、GM试验及痰真菌培养用于重症患者IFI的早期诊断具有重要价值。临床上可根据患者实际病情将G试验和GM试验联合检测,作为IFI筛查的第一步,以便指导临床尽早给予经验性抗真菌治疗,然后根据培养结果和药敏分析调整抗真菌药物。G试验和GM试验联合痰真菌培养可对ICU患者IFI进行早期诊断,提高诊断的准确性,指导早期抗真菌药物的应用,从而改善患者预后。
[1] Hammond SP, Marty FM, Bryar JM, et al. Invasive fungal disease in patients treated for newly diagnosed acute leukemia[J]. Am J Hematol, 2010, 85(9): 695-699.
[2] 章强强.深部真菌感染的实验室诊断[J].世界临床药物, 2010, 31(12):725-729.
[3] Smith JA. Pulmonary fungal infections[J]. Respirology (Carlton, Vic. ), 2012, 17(6): 913-926.
[4] De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group[J]. Clin Infect Dis, 2008, 46: 1813-1821.
[5] 中国侵袭性真菌感染工作组.血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则[J].中华内科杂志, 2013, 52(8):704-709.
[6] Ostrosky-Zeichner L, Pappas PG. Invasive candidiasis in the intensive care unit[J]. Crit Care Med, 2006, 34(3): 857-863.
[7] Schelenz S. Management of candidiasis in the intensive care unit[J]. J Antimicrob Chemother, 2008, 61(Suppl 1): i31-i34.
[8] Erjavec Z, Kluin-Nelemans H, Verweij PE. Trends in invasive fungal infections, with emphasis on invasive aspergillosis[J]. Clin Microbiol Infect, 2009, 15(7): 625-633.
[9] D’Haese J, Theunissen K, Vermeulen E, et al. Detection of galactomannan in bronchoalveolar lavage fluid samples of patients at risk for invasive pulmonary aspergillosis: analytical and clinical validity[J]. J Clin Microbiol, 2012, 50(4): 1258-1263.
[10] 李丽, 卓越, 邱小松, 等.G试验和GM试验在重症患者侵袭性真菌感染中的诊断价值的回顾性分析[J].中国急救复苏与灾害医学杂志, 2016, 11(8):795-797.
[11] 于书娴, 崔学范, 马婷, 等.G试验和GM试验对侵袭性真菌病诊断价值的Meta分析[J].中华肺部疾病杂志:电子版, 2016, 9(2):164-170.
[12] Theel ES, Doern CD. β-D-glucan testing is important for diagnosis of invasive fungal infections[J]. J Clin Microbiol, 2013, 51(11): 3478-3483.
[13] Viswesh VV, Radosevich JJ, Green MR. Inclusion and recommendation of (1→3)-β-D-glucan testing in the international guidelines for management of severe sepsis and septic shock[J]. Crit Care Med, 2013, 41(12): e487-e488.
[14] Barton RC. Laboratory diagnosis of invasive aspergillosis: from diagnosis to prediction of outcome[J]. Scientifica, 2013, 2013: 459405.
[15] Ogawa M, Hori H, Niiguchi S, et al. False-positive plasma (1-->3)-beta-D-glucan test following immunoglobulin product replacement in an adult bone marrow recipient[J]. Int J Hematol, 2004, 80(1): 97-98.
[16] Usami M, Ohata A, Horiuchi T, et al. Positive (1-->3)-beta-D-glucan in blood components and release of (1-->3)-beta-D-glucan from depth-type membrane filters for blood processing[J]. Transfusion, 2002, 42(9): 1189-1195.
[17] Kato A, Takita T, Furuhashi M, et al. Elevation of blood (1-->3)-beta-D-glucan concentrations in hemodialysis patients[J]. Nephron, 2001, 89(1): 15-19.
[18] Digby J, Kalbfleisch J, Glenn A, et al. Serum glucan levels are not specific for presence of fungal infections in intensive care unit patients[J]. Clin Diagn Lab Immunol, 2003, 10(5): 882-885.
[19] Fontana C, Gaziano R, Favaro M, et al. (1-3)-β-D-Glucan vs galactomannan antigen in diagnosing invasive fungal infections (IFIs)[J]. Open Microbiol J, 2012, 6: 70-73.
[20] Niimi K, Shepherd MG, Cannon RD . Distinguishing Candida species by beta-N-acetylhexosaminidase activity[J]. J Clin Microbiol, 2001, 39(6): 2089-2097.
[21] Aubry A, Porcher R, Bottero J, et al. Occurrence and kinetics of false-positive Aspergillus galactomannan test results following treatment with beta-lactam antibiotics in patients with hematological disorders[J]. J Clin Microbiol, 2006, 44(2): 389-394.
[22] Chambon-Pautas C, Costa JM, Chaumette MT, et al. Galactomannan and polymerase chain reaction for the diagnosis of primary digestive aspergillosis in a patient with acute myeloid leukaemia[J]. J Infect, 2001, 43(3): 213-214.
[23] Surmont I. Gluconate-containing intravenous solutions: another cause of false-positive galactomannan assay reactivity[J]. J Clin Microbiol, 2007, 45(4): 1373.
[24] Sable CA, Strohmaier KM, Chodakewitz JA. Advances in antifungal therapy[J]. Annu Rev Med, 2008, 59: 361-379.
[25] Paramythiotou E, Frantzeskaki F, Flevari A, et al. Invasive fungal infections in the ICU: how to approach, how to treat[J]. Molecules, 2014, 19(1): 1085-1119.
G-testandGM-testcombinedwithsputumfungalculturefortheearlydiagnosisofinvasivefungalinfectioninintensivecareunitpatients
MENGWen-qing1,LUXuan1,PANZheng-hui1,XUMeng1,LICheng-hao1,ZHAOWen-jing2
(1XuzhouMedicalUniversity,Xuzhou221002,China; 2TheAffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221002,China)
ObjectiveTo evaluate the detection value of serum (1,3)-β-D glucan (G-test) and galactomannan(GM-test) combined with sputum fungal culture in the early diagnosis of invasive fungal infection(IFI) in intensive care unit(ICU) patients.MethodsInpatients with high risk factors for IFI in the ICU of the Affiliated Hospital of Xuzhou Medical University between January 2015 and December 2016 were chosen, they were divided into 3 groups according to the diagnostic criteria of IFI: IFI group(including confirmed and clinically diagnosed cases), suspected IFI group, and non-IFI group. The results of serum G-test, GM-test, and sputum fungal culture in three groups of patients were analyzed, early diagnostic value in IFI with combined three tests was evaluated.ResultsA total of 264 ICU patients were investigated, IFI group, suspected IFI group, and non-IFI group were 56, 43, and 165 cases respectively. Among 56 cases of confirmed IFI, 46, 39, and 34 were positive for G-test, GM-test, and fungal culture respectively. The sensitivity, specificity, positive predictive value, and negative predictive value of combined three detection were 98.2%, 82.4%, 65.5%, and 99.3% respectively, positive likelihood ratio, negative likelihood ratio, and Youden index were 5.58, 0.02, and 0.98 respectively. The sensitivity and negative predictive values of combined three detection were both higher than those of single G-test, GM-test, and sputum fungal culture(allP<0.05); but specificity and positive predictive value of combined three detection were not significantly different from single G-test, GM-test, and sputum fungal culture(allP>0.05).ConclusionThe combination of G-test, GM-tests, and sputum fungal culture can improve the sensitivity of early diagnosis of IFI in ICU patients, and guide the clinicians in the early treatment of IFI.
(1,3)-β-D-glucan test; galactomannan test; sputum culture; critically ill patient; invasive fungal infection; combined detection
[Chin J Infect Control,2018,17(1):41-46]
2017-04-12
2009年度“六大人才高峰”D类资助项目(2009059)
孟文晴(1990-),女(汉族),江苏省徐州市人,硕士研究生,主要从事重要脏器功能保护方面研究。
赵文静 E-mail:zhaowj886@sina.com
10.3969/j.issn.1671-9638.2018.01.009
R446.6
A
1671-9638(2018)01-0041-06
孟秀娟、陈玉华)

