大戟属二萜类化学成分和生物活性研究进展
,
(中国药科大学 天然药物活性组分与功效国家重点实验室,生药学研究室,江苏 南京 211198)
大戟属二萜类化学成分和生物活性研究进展
李娟,濮社班*
(中国药科大学 天然药物活性组分与功效国家重点实验室,生药学研究室,江苏 南京 211198)
大戟属(Euphorbia)植物化学成分主要包括萜类、黄酮类、酚酸类等成分。该属植物具有抗肿瘤、抗炎、抗HIV等活性。本文主要综述了近十年来大戟属植物中发现的新的二萜类化合物及生物活性研究进展。
大戟属; 二萜; 化学成分; 生物活性
大戟属(Euphorbia)全世界分布有2 000多种,是被子植物特大属之一,我国分布有80多种[1]。大戟属植物资源丰富,适应性强,分布于不同的生态环境中,从热带到亚热带,从陆地到沙漠均见分布[2]。近年,国内出现了许多入侵植物,大戟属中包括通奶草、飞扬草、斑地锦、泽漆、大地锦等物种,危害生态系统。大戟属植物所含化学成分类型较多,包括倍半萜、二萜、三萜、甾体、黄酮、酚酸及鞣质类。基于化学成分的丰富性和结构的多样性,大戟属植物具有较多的生物活性,如抗菌、抗炎、抗癌抗肿瘤、抗病毒、驱虫、杀虫、抗病毒等,具有重要的药用价值。该属植物同时表现出对皮肤、口腔及胃肠道黏膜强烈的刺激性和致炎、致癌等毒性作用。二萜类化合物在大戟属中分布广泛,是大戟属的特征性成分之一,具有抗肿瘤、抗炎、抗病毒等活性。本文主要就近十年来大戟属植物中二萜类新化合物和生物活性研究做一综述,以期为大戟属植物资源的合理利用提供帮助。
1 大戟属植物中的新二萜类成分
大戟属植物所含的二萜成分较多,结构主要包括西松烷型(casbane type)、假白揽烷型(jatrophane type)、续随子烷型(lathyrane type)、巴豆烷型(tigliane type)、曼西醇烷型(myrsinol type)、巨大戟烷型(ingenane type)、松香烷型(abietane type)等。
1.1 西松烷型(casbane type)
西松烷型二萜(化合物1~10,图1)的结构特点为一个14元环与一个环丙烷环骈合在一起而形成。
1.2 假白榄烷型(jatrophane type)
假白榄烷型二萜(化合物11~62,图2)是大戟属中数量最多的二萜类化合物,该类化合物多为一个5元环与一个12元环骈合在一起而形成,同时某些位置的羟基通过跨环形成醚桥和酯桥而使结构更为复杂。
1.3 续随子烷型(lathyrane type)
续随子烷型二萜(化合物63~83,图3)的骨架是由一个5元环和一个11元环骈合在一起而形成,同时C-9和C-11顺势骈合一个环丙烷。
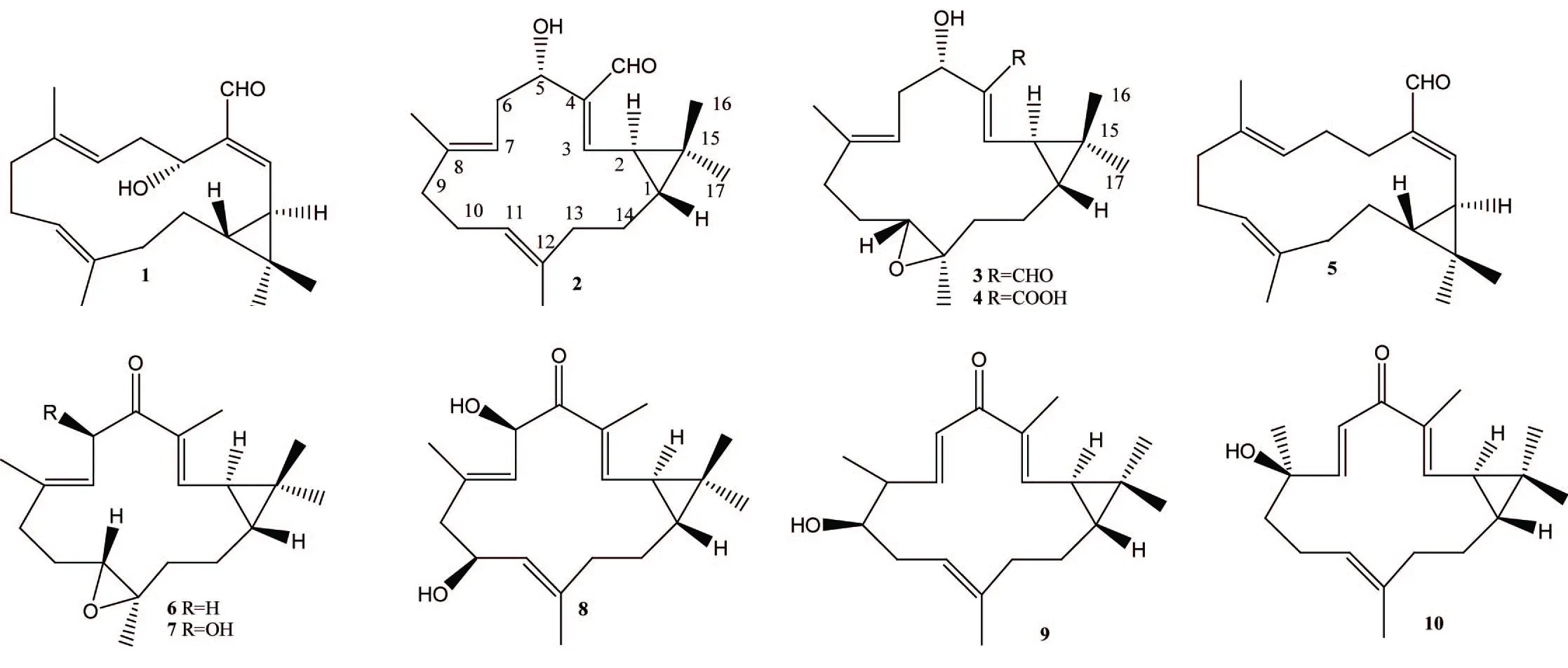
图1 大戟属西松烷型二萜化合物结构


图2 大戟属假白榄烷型二萜化合物结构
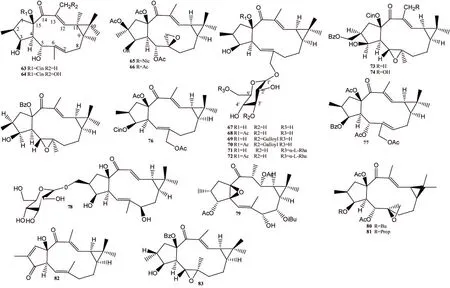
图3 大戟属续随子烷型二萜化合物结构
1.4 曼西醇烷型(myrsinol type)
曼西醇型二萜(化合物84~97,图4)骨架是由一个5元环,一个7元环以及一个6元环骈合在一起形成的,一般其 C-9和C-11位顺式骈合一个环丙烷,C-13和C-17位间有一氧桥。但新发现的化合物中也有C-13和C-17位间氧桥断裂或者C-9和C-11位顺式骈合一个环丁烷的。
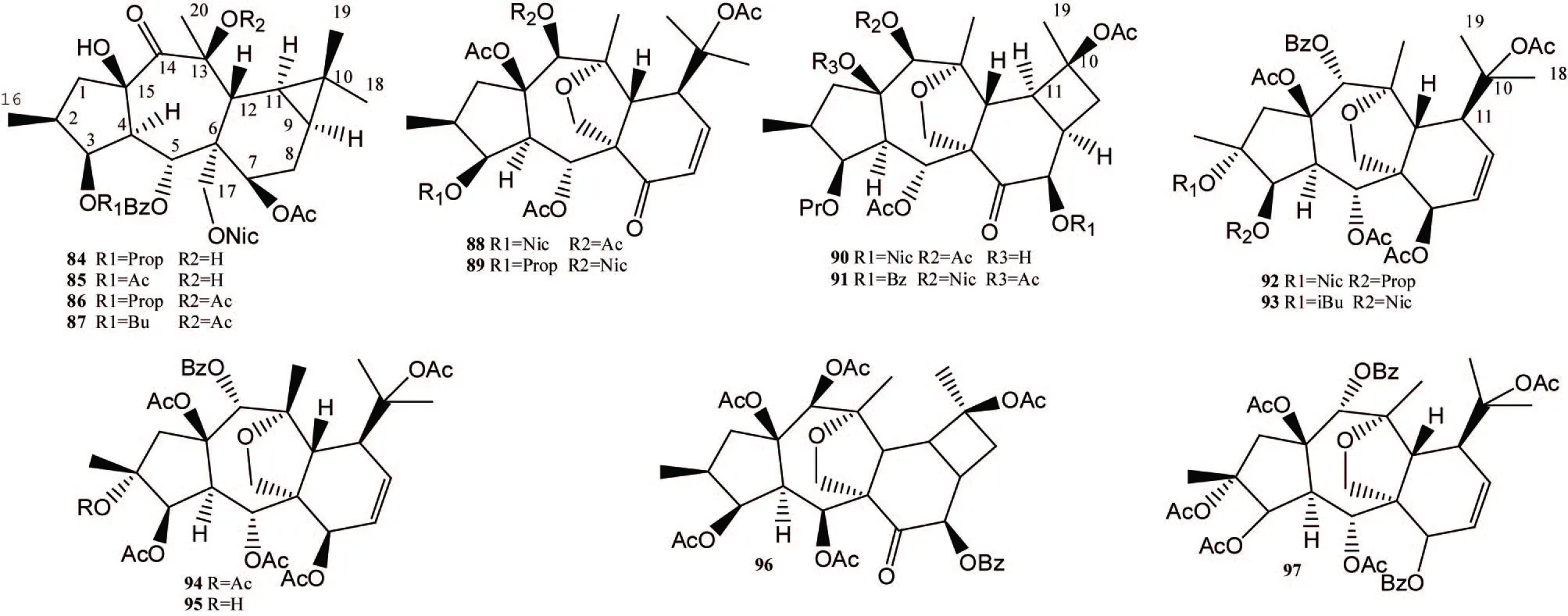
图4 大戟属曼西醇型二萜化合物结构
1.5 巨大戟烷型(ingenane type)
巨大戟烷型二萜(化合物98~121,图5)是由一个5元环(A环),两个7元环(B环和C环)系统所组成的,B环中的C-8和C-10通过羰基桥连接而形成C环,一般情况下C环上的C-13和C-14位骈合成一个环丙烷。
1.6 松香烷型(abietane type)
松香烷型二萜(化合物122~133,图6)是大戟属中数目较多的二萜类成分,为三环二萜,其中C-13位均连有一个异丙基。

图5 大戟属巨大戟烷型二萜化合物结构

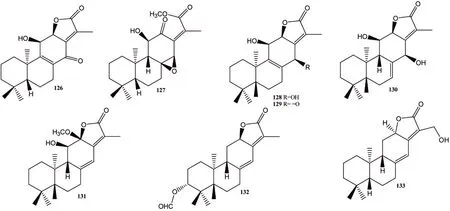
图6 大戟属松香烷型二萜化合物结构
1.7 巴豆烷型(tigliane type)
巴豆烷型属于四环三萜,是由一个5元环(A环),一个7元环(B环),一个6元环(C环)和一个环丙烷环(D环)系统所组成的。化合物134~136属于该类型。
1.8 玫瑰烷型(rosane type)
玫瑰烷型二萜(化合物137~140)为三环二萜,在其C-13位分别接有一个甲基和一个乙基,20位甲基接至C-9位上。
1.9 四氢巨大戟烷型(tetrahydroingenol type)
四氢巨大戟烷型(化合物141~144)与巨大戟烷型二萜结构类似,不同之处在于四氢巨大戟烷型是巨大戟烷型C-1,2双键和C-6,7双键氢化后得到的二萜酯型。
1.10 其他类型
近年来不断有新的大戟属二萜骨架(化合物145~149)被发现,其结构新颖,有的还被证实具有特殊活性。

图7 大戟属巴豆烷型、玫瑰烷型、四氢巨大戟烷型及其他类型二萜化合物结构
表1为大戟属植物中的二萜类成分。
2 生物活性研究进展
2.1 细胞毒性
2009年Liang等[3]从京大戟中分离得到到一个新的西松烷型二萜,命名为pekinenal,该物质对于四种人癌细胞株NCI-H460、 KB、 SGC7901、 HO-8910表现出显著的细胞毒性。MTT 法所测得的IC50分别为10.05, 8.52, 13.82, 和 14.16 μmol/L。Hegazy等[8]从E.guyoniana地上部位的提取物中分离得到2个新的假白揽烷型二萜guyonianins E 和 F,其对于人胚胎肾细胞 HEK 239表现出细胞毒性,IC50值35~100 μmol/L。Liu等[25]从E.lunulata中得到两个新二萜,其中一个为ent-abietane型,结构为ent-3a-formylabieta8(14),13(15)-dien-16, 12β-olide, dibenzoyloxy-9-oxo-2βH,13aHjatropha-5E, 11E-diene,有明显的细胞毒性。Yuan等[44]从E.ebracteolata中得到的Ebracteolatas A对于5种癌细胞株有细胞毒性。Wang等[24]从狼毒中得到的ingenol 6,7-epoxy-3-tetradecanoate对A549有显著的细胞毒性,IC50为3.35μg/mL。
2.2 逆转P-糖蛋白介导的多药耐药性
多药耐药( multi-drug resistance,MDR) 指肿瘤对某种抗肿瘤药物产生的耐药性不仅能抵抗该药物,而且对多种未接触过的结构、作用机制均有明显差异的抗肿瘤药物也具有耐药性[27]。P 糖蛋白是存在于多种正常上皮组织细胞中转运蛋白,被认为具有泵出毒性物质保护细胞的生理功能[22]。P糖蛋白(P-gp)是介导MDR的主要因素之一,它能将不同结构和功能的化疗药物排出细胞外,明显降低化疗的成功率。目前已有多种大戟属二萜被证实能逆转P-gp介导的MDR。
Lu 等[5]从对叶大戟中得到的新化合物5α,14α-dibenzoyloxy-15β-hydroxy-7β-isobutanoyloxy2α,3β, 8α, 9α-tetraacetoxyjatropha-6(17), 11E-diene在是P-pg外排泵的有效抑制剂,10μmol/L时效果强于维拉帕米。Virginia等[7]从E.cyparissias全草中分离得到两个新的假白揽烷型二萜命名为Cyparissins A 和 B。这两个化合物对P糖蛋白表现出中度的抑制作用。 Jadranin等[9]于2012年从E.dendroides的乳汁中得到的两个化合物表现出对P糖蛋白的抑制作用,其作用优于维拉帕米。Duarte等[18]从E.lagascae中得到7个化合物,其中latilagascenes D~F为新的续随子烷型化合物,7个化合物逆转MDR的活性均强于维拉帕米。Wang等[37]从中药狼毒中分离得到一个新的曼西醇型二萜J196-10-1具有逆转癌细胞多药耐药性的活性。
2.3 抗HIV活性
Xu等[42]从甘青大戟Euphorbiamicractina中得到一个新骨架型的二萜Secoeuphoractin,这个化合物表现出抗HIV病毒复制的作用。IC50值为(1.76±0.61)μmol/L。 Bedoya等[49]的研究发现,一个假白揽烷型二萜SJ23B可以减少HIV-1受体CD4, CXCR4和CCR5的内化,同时能在纳摩尔级的范围内阻碍R5和X4病毒对于人初级T细胞的感染。并且,该物质能拮抗HIV-1病毒的潜伏。Tian等[50]从E.micractina中得到的化合物euphoractin L具有体外抗HIV-1病毒复制的活性,IC50为(8.8±0.6)μmol/L。
2.4 抗炎活性
Chen等[6]从泽漆中分离得到3个假白揽烷型二萜和一个假白揽新天然产物以及9个类似物,这些二萜有抑制LPS诱导的NO产生的活性。Lee等[3]从甘遂中得到18个化合物,其中包括新化合物在内的16个化合物均有抗炎活性。Xu等[16]从土瓜狼毒中得到四个续随子烷型二萜,其他三个物质都有抑制LPS诱导的NO产生的活性。Xu等[29]在土瓜狼毒中发现了10个新的曼西醇烷型二萜,命名为euphorbialoids A~J以及两个类似物,所有物质均有抗炎活性。
2.5 其他活性
Di等[46]从Euphorbiahelioscopia中得到一个新的假白揽烷二萜14α,15β-diacetoxy-3β-benzoyloxy-7β-nicotinoyloxy-9-oxo-jatropha-5E,11E-diene,命名为euphoheliosnoid E,该化合物对口腔病原体有显著的抗微生物活性。
Hua等[34]从南欧大戟中得到12个二萜,对棉铃虫有拒始活性,EC50范围从0.36到4.60 μg/cm2。
Dang等[51]发现甘遂的甲醇提取物有杀灭褐飞虱和二斑叶螨的活性,并通过活性追踪分离从其中得到两个巨大戟烷型二萜:3-O-(2,3-dimethylbutanoyl)-13-Ododecanoylingenol和3-O-(2'E,4'Z-decadienoyl)-ingenol。二者均具有杀灭褐飞虱的活性,且活性强于茴香油和丁香油酚。其中3-O-(2,3-dimethylbutanoyl)-13-Ododecanoylingenol具有杀灭二斑叶螨的活性。
3 小结与展望
大戟属植物种类多,分布广,资源丰富,目前仅对其中一部分进行了研究。从化学成分上来看,该属植物中的二萜多为环状,且结构变异较大,部分化合物在原有基础上打开了一部分环状结构形成新化合物,值得进一步研究。大戟属作为一个有生物活性但是又同时具有强烈毒性和刺激性的植物群体,其化学成分和生物活性有待于进一步的研究,一方面可以指导大戟属资源的合理利用,另外一方面也有助于指导更安全的用药。
致谢:感谢明仁开放基金的支持。感谢江苏高校优势学科建设工程资助项目(PAPD)和江苏省高校优秀中青年教师和校长境外研修计划的支持。
[1] 中国科学院中国植物志编辑委员会. 中国植物志:第44卷第3分册[M]. 北京: 科学出版社,1997: 26-28.
[2] 耿婷, 丁安伟, 张丽. 大戟属植物的研究进展[J]. 中华中医药学刊, 2008(11): 2433-2436.
[3] LIANG Q L, DAI C C, JIANG J H, et al. A new cytotoxic casbane diterpene fromEuphorbiapekinensis[J]. Fitoterapia, 2009, 80 (8): 514.
[4] TAO W W, DUAN J A, TANG Y P, et al. Casbane diterpenoids from the roots ofEuphorbiapekinensis[J]. Phytochemistry, 2013, 94 (10): 249-253.
[5] LU D, LIU Y, AISA H A. Jatrophane diterpenoid esters fromEuphorbiasororiaserving as multidrug resistance reversal agents[J]. Fitoterapia, 2014, 92 (1): 244-251.
[6] CHEN H, WANG H, YANG B, et al. Diterpenes inhibiting NO production fromEuphorbiahelioscopia[J]. Fitoterapia, 2014, 95 (2): 133.
[7] LANZOTTI V, BARILE E, SCAMBIA G, et al. Cyparissins A and B jatrophane diterpenes fromEuphorbiacyparissiasas P-gp inhibitors and cytotoxic agents against ovarian cancer cell lines [J]. Fitoterapia, 2015, 104: 75-79.
[8] HEGAZY M E, AELH M, AOKI N, et al. Bioactive jatrophane diterpenes fromEuphorbiaguyoniana[J]. Phytochemistry, 2010, 71 (2-3): 249-253.
[9] JADRANIN M, PESIC M, ALIANCIC I S, et al. Jatrophane diterpenoids from the latex ofEuphorbiadendroidesand their anti-P-glycoprotein activity in human multi-drug resistant cancer cell lines [J]. Phytochemistry, 2013, 86 (2): 208-217.
[10] RéDEI D, FORGOP, MOLNáR J, et al. Jatrophane diterpenoids with multidrug resistance-modulating activity fromEuphorbiamongolicaProkh. [J]. Tetrahedron, 2012, 68 (40): 8403-8407.
[11] OKúSZ N, ORVOSP, CSORBA A, et al. Jatrophane diterpenes fromEuphorbiaguyonianaare new potent inhibitors of atrial GIRK channels [J]. Tetrahedron, 2016, 72 (37): 5724-5728.
[12] SONG Z Q, MU S Z, DI Y T, et al. A new jatrophane diterpenoid fromEuphorbiapeplus[J]. Chinese Journal of Natural Medicines, 2010, 8 (2): 81-83.
[13] HUANG Y, AISA H A. Jatrophane diterpenoids from Fructus Euphorbia sororia [J]. Phytochemistry Letters, 2010, 3 (4): 176-180.
[14] WANG H, ZHANG X, ZHOU Y, et al. Two new diterpenes fromEuphorbiakansuensis[J]. Fitoterapia, 2008, 79 (4): 262-6.
[15] AYATOLLAHI A M, GHANADIAN M, AFSHARYPUOR S, et al. Two new lathyrane type diterpenoids fromEuphorbiaaellenii[J]. Fitoterapia, 2010, 81 (7): 891-893.
[16] XU J, JIN D Q, GUO Y, et al. New myrsinol diterpenes fromEuphorbiaprolifera, and their inhibitory activities on LPS-induced NO production [J]. Bioorganic & Medicinal Chemistry Letters, 2012, 22 (11): 3612-3618.
[17] WANG L, MA Y T, SUN Q Y, et al. Structurally diversified diterpenoids fromEuphorbiadracunculoides[J]. Tetrahedron, 2015, 71 (34): 5484-5493.
[18] DUARTE N, Varga A, Cherepnev G, et al. Apoptosis induction and modulation of P-glycoprotein mediated multidrug resistance by new macrocyclic lathyrane-type diterpenoids [J]. Bioorganic & Medicinal Chemistry, 2007, 15 (1): 546-54.
[19] JIAO W, DONGW, LI Z, et al. Lathyrane diterpenes fromEuphorbialathyris, as modulators of multidrug resistance and their crystal structures [J]. Bioorganic & Medicinal Chemistry, 2009, 17 (13): 4786.
[20] FENG W S, GAO L, ZHENG X K, et al. A new lathyrane diterpene glycoside fromEuphorbiahelioscopiaL. [J]. Chinese Chemical Letters, 2010, 21 (2): 191-193.
[21] SHOKOOHINIA Y, CHIANESE G, ZOLFAGHARI B, et al. Macrocyclic diterpenoids from the Iranian plantEuphorbiabungeiBoiss. [J]. Fitoterapia, 2011, 82 (3): 317-322.
[22] SCHINKEL A H, Mol C, WAGENAAR E, et al. Multidrug resistance and the role of P-glycoprotein knockout mice [J]. European Journal of Cancer, 1995, 31A (7/8): 1295-1298.
[23] ZAREIS M, AYATOLLAHI A M, GHANADIAN M, et al. Unusual ingenoids fromEuphorbiaerythradeniaBioss. with pro-apoptotic effects[J]. Fitoterapia, 2013, 91(10):87-94.
[24] WANG H B, CHEN W, ZHANG Y Y, et al. Four new diterpenoids from the roots ofEuphorbiafischeriana[J]. Fitoterapia, 2013, 91 (10): 211.
[25] LIU C, LIAO Z X, LIU S J, et al. Two new diterpene derivatives fromEuphorbialunulataBge. and their anti-proliferative activities [J]. Fitoterapia, 2014, 96: 33-38.
[26] YANG D S, PENGW B, LI Z L, et al. Chemical constituents fromEuphorbiastracheyiand their biological activities [J]. Fitoterapia, 2014, 97: 211-218.
[27] 王晗. TRAIL逆转P糖蛋白介导的多药耐药研究进展 [J]. 医学综述, 2014, 20 (4): 619-621.
[28] BARILE E, FATTORUSSO E, IALENTI A, et al. Paraliane and pepluane diterpenes as anti-inflammatory agents: first insights in structure-activity relationships [J]. Bioorganic & medicinal chemistry letter, 2007, 17 (15): 4196-4200.
[29] XU J, JIN D Q, GUO Y, et al. New myrsinol diterpenes fromEuphorbiaprolifera, and their inhibitory activities on LPS-induced NO production [J]. Bioorganic & Medicinal Chemistry Letters, 2012, 22 (11): 3612-3618.
[30] LIU Z G, LI Z L, LI D H, et al. ent-Abietane-type diterpenoids from the roots ofEuphorbiaebracteolatawith their inhibitory activities on LPS-induced NO production in RAW 264.7 macrophages [J]. Bioorganic & Medicinal Chemistry Letters, 2016, 26 (1): 1-5.
[31] JIN W L, JIN Q, JANG H, et al. ChemInform Abstract: Jatrophane and Ingenane‐Type Diterpenoids fromEuphorbiakansuiInhibit the LPS‐Induced NO Production in RAW 264.7 Cells [J]. Bioorganic & Medicinal Chemistry Letters, 2016, 26 (14): 3351-3354.
[32] LU Z Q, YANGM, ZHANG J Q, et al. Ingenane diterpenoids fromEuphorbiaesula[J]. Phytochemistry, 2008, 69 (3): 812-819.
[33] GAO J, CHEN Q B, LIU Y Q, et al. Diterpenoid constituents ofEuphorbiamacrorrhiza[J]. Phytochemistry, 2016, 122 (2): 246-253
[34] HUA J, LIU Y, XIAO C J, et al. Chemical profile and defensive function of the latex of Euphorbia peplus [J]. Phytochemistry, 2017, 136: 56-64.
[35] EDVáRD S, ANDREA V, DóRA R, et al. Isolation and structure determination of new 4, 12-dideoxyphorbol esters fromEuphorbiapannonicaHost. [J]. Tetrahedron, 2009, 65 (20): 4013-4016.
[36] CHEN R, YOU C X, WANG Y, et al. Chemical constituents from the roots ofEuphorbianematocyphaHand.-Mazz. [J]. Biochemical Systematics & Ecology, 2014, 57 (57): 1-5.
[37] WANG H, CHEN X, LI T, et al. A myrsinol diterpene isolated from a traditional herbal medicine, LANGDU reverses multidrug resistance in breast cancer cells [J]. Journal of Ethnopharmacology, 2016, 194: 1-5.
[38] GENG D, SHI Y, MIN Z D, et al. A new diterpenoid fromEuphorbiahelioscopia[J]. Chinese Chemical Letters, 2010, 21 (1): 73-75.
[39] GUO J, FANG X, DI Y T, et al. Kansuinine J, a new macrocyclic diterpenoid from the roots ofEuphorbiakansui[J]. Chinese Chemical Letters, 2010, 21 (8): 943-946.
[40] IMAM B B, MUSA K B. Isolation and characterization of ingenol esters fromEuphorbiacornigera[J]. Chinese Chemical Letters, 2011, 22 (4): 451-454.
[41] WANG L, ZANG Z, WANG Y F, et al. Two new myrinsol diterpenoids fromEuphorbiadracunculoidesLam. [J]. Chinese Chemical Letters, 2015, 26 (1): 121-123.
[42] XU W D, TIAN Y, GUO Q L, et al. Secoeuphoractin, a minor diterpenoid with a new skeleton fromEuphorbiamicractina[J]. Chinese Chemical Letters, 2014, 25 (12): 1531-1534.
[43] GHANADIAN M, SAEIDI H, AGHAEI M, et al. New jatrophane diterpenes fromEuphorbiaosyridea, with pro-apoptotic effects on ovarian cancer cells [J]. Phytochemistry Letters, 2015, 12: 302-307.
[44] YUAN W J, YANG G P, ZHANG J H, et al. Three new diterpenes with cytotoxic activity from the roots ofEuphorbiaebracteolataHayata. [J]. Phytochemistry Letters, 2016, 18 (12): 176-179.
[45] WANG Y B, PING J, WANG H B, et al. Diterpenoids fromEuphorbiaesula[J]. Chinese Journal of Natural Medicines, 2010, 8 (2): 94-96.
[46] DI G, LI TAO Y I, YAO S, et al. Structure and antibacterial property of a new diterpenoid fromEuphorbiahelioscopia[J]. Chinese Journal of Natural Medicines, 2015, 13 (9): 704-706.
[47] KUANGX, LI W, KANNO Y, et al. Euphorins A-H: bioactive diterpenoids fromEuphorbiafischeriana[J]. Journal of Natural Medicines, 2016, 70 (3): 1-11.
[48] LIU X X, SHANG L, HUANG C, et al. Four new diterpenoids isolated from theEuphorbiarapulum[J]. Journal of Asian Natural Products Research, 2016, 18 (9): 823-830.
[49] BEDOYA L M, Márquez N, Martínez N, et al. SJ23B, a jatrophane diterpene activates classical PKCs and displays strong activity against HIV in vitro [J]. Biochemical Pharmacology, 2009, 77 (6): 965-978.
[50] TIANY, XU W, ZHU C, et al. Diterpenoids with diverse skeletons from the roots ofEuphorbiamicractina[J]. Journal of Natural Products, 2013, 76 (6): 1039-1046.
[51] DANG Q L, YONGHO C, GYUNGJA C, et al. Pesticidal activity of ingenane diterpenes isolated fromEuphorbiakansuiagainst Nilaparvata lugens and Tetranychus urticae [J]. Journal of Asia-Pacific Entomology, 2010, 13 (1): 51-54.
ResearchProgressonChemicalConstituentsandBiologicalActivityofDiterpenoidsfromGenusEuphorbia
Li Juan, Pu Sheban
(State Key Laboratory of Natural Medicine, Research Department of Pharmacognosy,China Pharmaceutical University, Nanjing 211198, China)
The chemical constituents of genusEuphorbiaare terpenes, flavonoids, tannins and phenolic compounds. Some diterpenoids isolated fromEuphorbiaspecies show strong antitumor, anti-inflammatory and anti-HIV activity. This article summarizes the novel diterpenoids and its bioactivity in the last 10 years.
Euphorbia; diterpenoids; chemical constituents; bioactivity
10.3969/j.issn.1006-9690.2017.06.009
2017-03-18
李娟(1992—),女,从事中药资源及生药学研究。E-mail:laobai040318@163.com
*通讯作者:濮社班。E-mail:pusheban@126.com
R963
A
1006-9690(2017)06-0036-09
植物来源参考文献1Euphorbiapekinensis[3]79E.bungei[21]2~5E.pekinensis[4]80~81E.prolifera[29]6~8E.macrorrhiza[33]82~83E.macrorrhiza[33]9~10E.rapulum[48]84~93E.prolifera[29]11~16E.sororia[5]94~95E.dracunculoides[41]17~20E.helioscopia[6]96E.nematocypha[36]21~22E.cyparissias[7]97E.prolifera[37]23~24E.guyoniana[8]98E.scheriana[24]25~37E.dendroides[9]99E.stracheyi[26]38~41E.mongolica[10]100~115E.esula[32]42~43E.guyoniana[11]116~118E.cornigera[40]44E.peplus[12]119~121E.esula[45]45—50E.sororia[13]122E.scheriana[24]51~52E.bungei[21]123E.stracheyi[26]53E.lunulata[25]124~127E.fischeriana[47]54~55E.kansui[31]128~131E.ebracteolata[30]56E.peplus[34]132E.lunulata[25]57E.helioscopia[38]133E.stracheyi[26]58E.kansui[39]134~135E.pannonica[35]59~61E.osyridea[43]136E.stracheyi[26]62E.helioscopia[46]137~138E.ebracteolata[44]62~64E.kansuensis[14]139~140E.scheriana[24]65~66E.aellenii[15]141~144E.erythradenia[23]67~72E.dracunculoides[17]145~146E.paralias[28]73~75E.lagascae[18]147E.peplus[34]76~77E.lathyris[19]148E.micractina[42]78E.helioscopia[20]149E.rapulum[48]

