母源抗体对猪瘟E2基因工程苗免疫效力的影响
何振华,颜 爱,熊小军,杨铁柱,李师师,李海辉*
(1.湖南永州双牌县动物卫生监督所,湖南 永州 4252002;湖南猪卫士科技服务有限公司,湖南 长沙 410128)
母源抗体对猪瘟E2基因工程苗免疫效力的影响
何振华1,颜 爱2,熊小军2,杨铁柱2,李师师2,李海辉2*
(1.湖南永州双牌县动物卫生监督所,湖南 永州 4252002;湖南猪卫士科技服务有限公司,湖南 长沙 410128)
通过临床免疫效果的监测,对比研究母源抗体对猪瘟兔化弱毒苗及E2基因工程苗免疫效力的干扰。结果表明,当母源抗体平均阻断率>70%时,其对猪瘟兔化弱毒苗存在显著干扰(免疫前、一免后、二免后平均阻断率分别为86.6%、58.4%、67.3%),而对E2重组苗几乎不干扰(免疫前、一免后、二免后平均阻断率分别为86.1%、73.3%、81.4%);在低水平母源抗体时(平均阻断率<40%),2种疫苗均能迅速刺激机体产生相应的免疫应答。本次研究结果表明E2基因工程苗既能产生较好的免疫应答反应同时又可对抗母源抗体的干扰。
猪瘟;E2基因工程苗;母源抗体
猪瘟(Classical Swine Fever,CSF)是由猪瘟病毒(CSFV)引起猪的一种世界性的高度接触性传染病,被世界动物卫生组织(OIE)列入OIE疾病名录[1]。免疫接种是控制猪瘟流行的主要策略,弱毒疫苗如我国的C株对该病的防控发挥了积极作用,但单纯依赖弱毒疫苗来消除CSF还有一定的困难,因为其缺乏区分疫苗免疫及野毒感染的特征,且易受母源抗体干扰,因此,一种能区分疫苗株、野毒株,同时可抵抗母源抗体干扰的新型猪瘟苗有利于我国猪瘟的防控及净化。近年来,新型疫苗研究显示,DNA疫苗、重组基因苗、亚单位苗等具有抗母源抗体干扰的特征[2]。为了解天康生物制备的E2重组杆状病毒试验灭活苗是否具有抗母源抗体干扰性能,本研究将该苗与兔化弱毒苗同时接种断奶仔猪,对比监测母源抗体对免疫的影响。
1 材料与方法
1.1 疫苗及主要试剂
猪瘟兔化弱毒疫苗(ST细胞源,购自广东某公司);E2重组基因工程苗(由天康生物提供);CSFV阻断ELISA抗体检测试剂盒(购自IDEXX公司)。
1.2 试验方法
1.2.1 试验设计
试验于2017年5月1日—7月10日在郴州某种猪场(A、B两区)进行,为期70 d。两区各选断奶仔猪300头,均在35日龄进行猪瘟第一次免疫,63日龄进行二免,A区仔猪使用弱毒苗(简称弱毒组),B区仔猪使用E2重组基因工程苗(简称E2组)。试验猪的饲养管理及其他疫苗免疫均按本场程序进行,保证正常的通风和温度、湿度。试验期间如有明显疾病发生,如严重腹泻、肢体伤残、气喘等,予以淘汰。
1.2.2 采血与检测
每组在免疫前随机抽取15头进行采血,并记录耳号,随后在二免前、二免后一个月对这些猪进行采血,利用猪瘟阻断ELISA抗体检测试剂盒(包被抗原为E2蛋白)检测猪瘟特异性抗体。
1.2.3 判定标准
猪瘟抗体ELISA检测试验成立条件:阴性对照平均OD450>0.50,阳性对照阻断率>50%。判定标准:阻断率<30%为阴性,30%≤阻断率≤40%为可疑,阻断率>40%为阳性。
2 结果
试验仔猪均在35 d进行猪瘟首次免疫,63 d进行二免,在每次免疫前及二免后一个月收集血清进行猪瘟抗体检测,母源抗体对猪瘟兔化弱毒苗及E2基因工程苗的影响见表1及图1。E2组有3头跟踪仔猪因疾病原因而淘汰。在免疫前,E2组母源抗体水平还维持较高水平(平均阻断率69.3%,阳性率83.3%),弱毒组半数转阴(平均阻断率为47.8%,阳性率为53.3%);一免后,E2组平均阻断率稍有下降为65.6%,但全部转阳,而弱毒组平均阻断率为48.6%,阳性率为73.3%;二免后,两组抗体水平均上升,平均阻断率均在75%以上。
以阻断率70%作为分界线,低于70%为中低水平,两种苗在中低水平情况下均能很好的诱导抗体的产生(图2)。在高抗体水平下(阻断率>70,图3),母源抗体对弱毒苗的干扰很明显,免疫前平均阻断率为86.6%,一免后降为58.4%,二免后稍有回升但仍较低为67.3%,而对E2基因工程苗的干扰相对要小,免疫前平均阻断率为86.1%,一免后稍有下降为73.3%,二免后回升至81.4%。数据表明,E2基因工程苗受母源抗体的干扰较小,可减少猪只的免疫空窗期。
3 分析与讨论
母源抗体可以被动保护仔猪免受微生物的感染,但同时也会干扰免疫接种后抗体的产生,因此,确定断奶仔猪疫苗免疫的适当日龄及制定合理科学的免疫程序非常关键。据报道,母源抗体的半衰期为14 d,猪场常凭经验将首免时间定在20日龄左右[3],但这种免疫方法并不能有效消除母源抗体的干扰,从该研究的数据也可反映这一点,不同区不同批次的仔猪母源抗体水平参差不齐,虽然A区整体水平已到达免疫的临界点(平均阻断率47.8%,阳性率53.3%),但抗体水平分布属于两端,在35日龄时,部分猪(阻断率<40%)已属于免疫空窗期,一免后,保护率并没有很快上升,直到二免后,抗体水平才上升(平均阻断率86.6%)(图2),而另一部分高水平的母源抗体直接抑制了疫苗的效果,甚至干扰到二免的效应(免疫前、一免后、二免后的阻断率分别为86.6%、58.4%、67.3%)(图3),因此这也解释了目前保育、育肥猪群猪瘟抗体水平低下的一个原因。
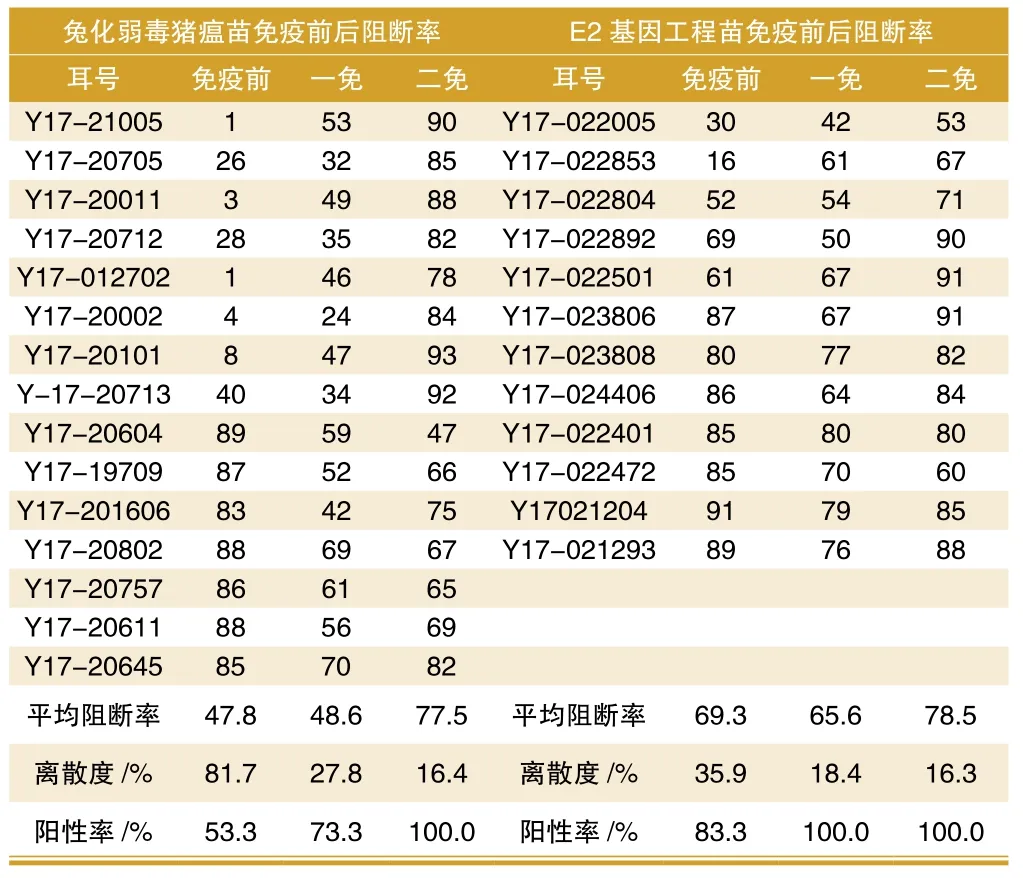
表1 母源抗体对猪瘟兔化弱毒苗及E2基因工程苗的影响
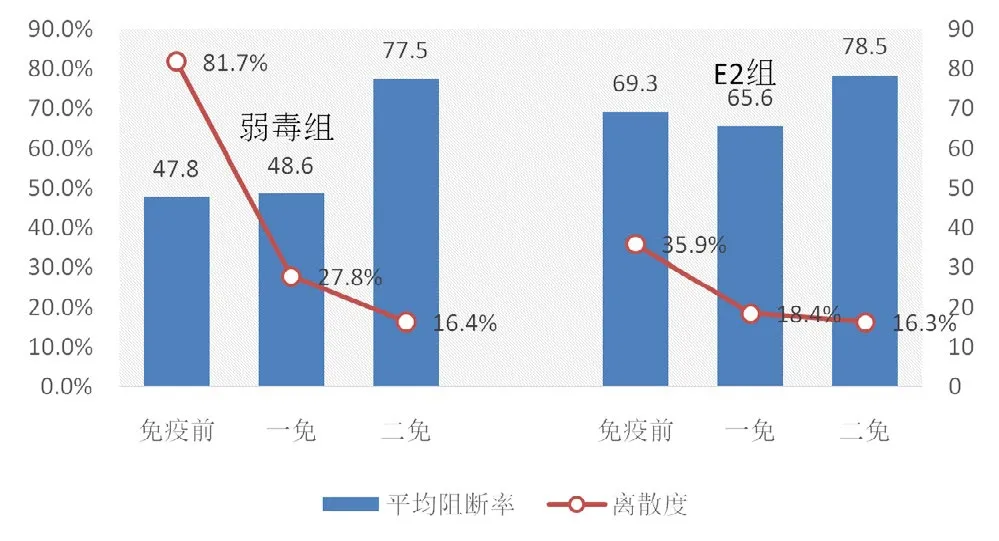
图1 母源抗体对猪瘟兔化弱毒苗及E2基因工程苗的影响
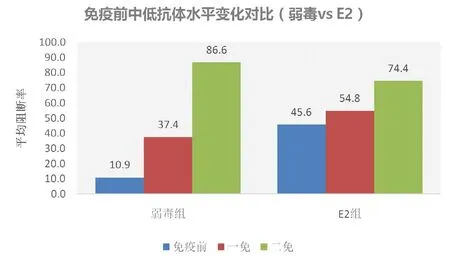
图2 两种疫苗对免疫前中低抗体的影响
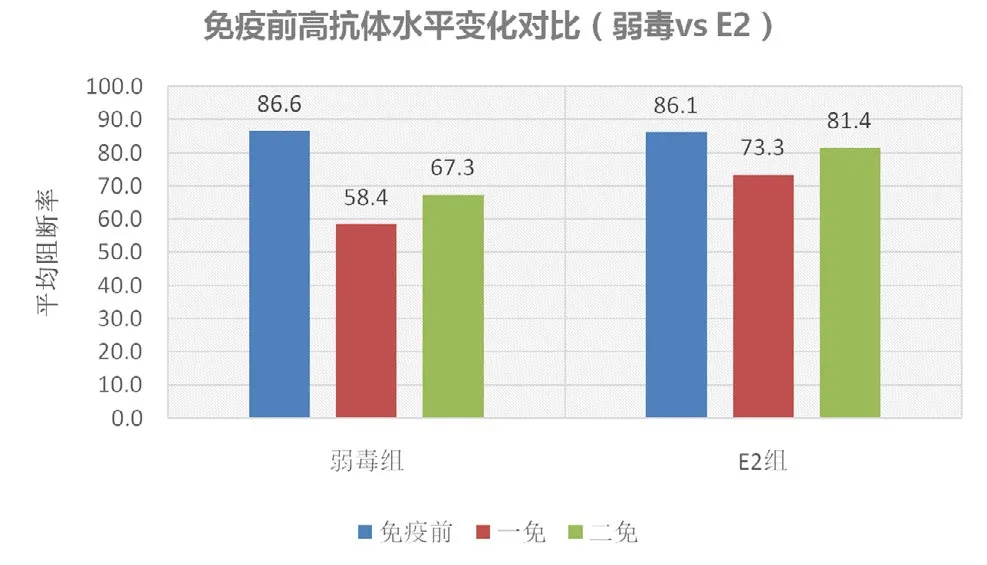
图3 两种疫苗对免疫前高抗体的影响
E2包膜糖蛋白是猪瘟病毒的主要保护性抗原,在CSFV感染时诱导中和抗体的产生,E2蛋白已被证明是一个有效的免疫原,有研究显示该蛋白重组疫苗可抵抗母源抗体的干扰[4]。该研究结果也表明了这点,免疫前阴性猪在第一次接种E2重组苗后,全部转阳(图2),而在高水平的母源抗体条件下,E2重组疫苗并未受到较大干扰(免疫前、一免、二免后的阻断率分别为86.1%、73.3%、81.4%)(图3)。
2017年农业部出台了《国家猪瘟防治指导意见(2017-2020)》,对猪瘟防控提出了新的要求,2020年底全国所有猪场和部分区域达到猪瘟净化标准,并进一步扩大猪瘟净化区域范围。而现在使用的兔化弱毒苗并不具备区分自然感染与疫苗接种的特征,所以安全、高效具有标记的新型猪瘟疫苗是未来实现猪瘟净化的关键。E2重组疫苗是最具潜力的,目前在欧洲,重组E2蛋白亚单位疫苗已经商业化,如默沙东动物保健公司生产的Porcilis®Pesti,用该疫苗接种,结合瑞士Prionics公司的猪瘟Eens抗体检测试剂盒,用于猪瘟的净化[5]。在国内,E2疫苗还处在试验阶段。该研究的数据表明E2基因工程苗既能产生较好的免疫应答反应同时又可对抗母源抗体的干扰,为E2新型苗的研究提供参考依据。
[1] MOENNING V. introduction to classical swine fever: virus,disease and control policy [J]. Vet Microbiol, 2000, 73(2-3):93-102.
[2] 孔庆波. 抗母源抗体干扰的病毒疫苗[J]. 动物医学进展. 2003,24(4):12-15.
[3] 张新成,李官兵,史子学. 猪瘟母源抗体在仔猪体内持续时间的研究[J]. 养猪,2008(1):46-48.
[4] 雷建林,杜明亮,孙元,等. 母源抗体对腺病毒/甲病毒复制子嵌合载体猪瘟疫苗rAdV-SFV-E2免疫效力的影响[J]. 中国预防兽医学报,2016,38(6):484-488.
[5] BIOME S, STAUBACH C, HENKE J, et al. Classical swine fever-an update review[J]. Virus, 2017,9(4):169-178.
2017-09-20)

