基于便携式荧光定量PCR仪的猪瘟病毒现场检测方法的建立及应用
李天芝 ,于新友 ,沈志强 ,,王金良
(1.山东绿都生物科技有限公司,山东 滨州 256600;2.山东省滨州畜牧兽医研究院,山东 滨州 256600)
基于便携式荧光定量PCR仪的猪瘟病毒现场检测方法的建立及应用
李天芝1,于新友1,沈志强1,2,王金良2
(1.山东绿都生物科技有限公司,山东 滨州 256600;2.山东省滨州畜牧兽医研究院,山东 滨州 256600)
为建立猪瘟病毒疫苗株和强毒株一步法双重荧光RT-PCR鉴别检测方法。研究参照GenBank中猪瘟病毒疫苗株以及强毒株特异性基因序列,设计特异引物和TaqMan-MGB探针,通过优化反应条件,建立了同时检测猪瘟病毒疫苗株和强毒株的双重荧光RT-PCR方法,并验证该方法的特异性、敏感性、重复性。本试验建立的TaqMan-MGB一步法双重荧光定量RT-PCR检测方法可对猪瘟病毒疫苗株和野毒株进行快速鉴别诊断,为猪瘟的净化奠定了基础。
猪瘟病毒;疫苗株;强毒株;TaqMan-MGB;一步法;双重荧光RT-PCR
猪瘟(CSF)又称烂肠瘟,是由猪瘟病毒(CSFV)引起的猪的一种重要的急性、热性、高度接触、致死性传染病。临床上主要以高热稽留、皮肤和黏膜出现大量出血点和高死亡率为主要特征。猪瘟在世界上许多养猪国家都有不同程度的流行,即能水平传播又能垂直传播,给养猪业造成了严重的经济损失[1]。世界动物卫生组织将其列为A类法定传染病之一[2],我国也将其列为一类动物疾病。
近年来,猪瘟在我国的流行特点发生改变,以隐性感染和亚病毒感染为主,临床表现形式多样,即有散发,又有区域性暴发,既有高死亡率的急性症状,又有持续感染的症状温和的慢性病例,出现了所谓的“非典型猪瘟”、“温和型猪瘟”和“带毒母猪综合征”[3],临床与病理解剖上不典型[4],同时存在着与其他病混合感染的状况,给兽医对猪瘟的临床诊断工作带来了很大的困难。我国研制的猪瘟兔化弱毒株(hog cholera lapinized virus,HCLV) 是世界公认最好的猪瘟疫苗[5],也是我国唯一一株经批准用于生产的弱毒疫苗,能同时诱导体液免疫和细胞免疫,安全性好,免疫猪可抵抗所有品系的猪瘟强毒株的攻击,HCLV在我国的大规模应用,对控制猪瘟起到了非常重要的作用,但HCLV能在已接种的猪体内持续存在一段时间,这会干扰实验室对猪瘟强毒株的检测,造成未感染免疫猪被误杀的可能。这些都不利于猪瘟的净化。需要建立可以准确区分猪瘟强毒和疫苗毒的敏感、特异的鉴别诊断方法。
CSFV是单股正链RNA病毒,基因组大小约为12.3 kb,包括5`非编码区(5`UTR)、3`非编码区3`UTR、中间是一个大的ORF,编码多聚前蛋白,多聚前蛋白可裂解为12种蛋白,包括8种非结构蛋白和4种结构蛋白,其中,5`UTR、3`UTR基因序列比较保守[6]。猪瘟病毒基因组5`UTR长374 bp, 3`-UTR长242 bp,HCLV与猪瘟强毒株3`UTR的区别是HCLV基因组3`UTR有12个碱基(CTTTTTTCTTTT)的插入,HCLV与猪瘟强毒株5`UTR的区别是猪瘟强毒株5`UTR 122位点存在一个碱基A缺失,137位点一个碱基A突变为碱基G。本研究根据猪瘟病毒5`UTR基因组特点,设计了一对检测猪瘟强毒株的引物及探针,根据猪瘟病毒3`UTR基因组特点,设计了一对检测HCLV的引物及探针,通过优化荧光RT-PCR检测条件,建立了能区分猪瘟病毒疫苗株与强毒株的TaqMan-MGB一步法双重荧光RT-PCR检测方法,为猪瘟的早期快速诊断、流行病学调查、防控和净化工作奠定了基础。
1 材料和方法
1.1 病毒株与病料
猪瘟兔化弱毒疫苗(HCLV)、猪瘟病毒石门强毒株(Shimen)、牛病毒性腹泻病毒(BVDV)、猪繁殖和呼吸综合征病毒(PRRSV)、猪乙型脑炎病毒(JEV)、猪细小病毒(PPV)、猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点开放实验室保存,临床检测病料为2016年10月—2017年9月采自山东省各地猪场临床诊断为CSFV感染猪的扁桃体、淋巴结和脾脏等。
1.2 试剂和试剂盒
Taq DNA聚 合 酶、M-MLV反 转 录 酶、RNasin、dNTPs、pMD18-T载 体、DL2000 Marker、PrimeScript™ One Step RTPCR Kit Ver.2等购自宝生物工程(大连)有限公司,AxyPrep体液病毒DNA/RNA小量试剂盒购自爱思进生物技术(杭州)有限公司。
1.3 引物和探针
应用DNAStar软件对GenBank中收录的CSFV基因组序列进行比对分析,应用生物学软件分别设计2对引物及相应TaqMan-MGB探针,其中1对引物及相应的探针扩增猪瘟兔化弱毒疫苗毒株,引物序列为CSFV-F1:5′-GGTAACCCGGGATCTGAAC-3′和CSFV-R1:5′-ACCAGTTCTTACTCATTCAA-3′,特异性探针为P1:5′- FAM-ACACTACTTTTCTTTTTTCTTTTTTATTMGB-3′,另1对引物及相应的探针扩增猪瘟强毒株,引物序列为CSFV-F1:5′-CGACGGCCGAACTGGGCTA-3′和 CSFV-R1:5′ -TCGAACTACTGACGACTGTCCTG-3′,特异性探针为P2:5′- HEX-CAAACGGAGGGACTAGCCG-MGB-3′。
1.4 病毒核酸的提取
按AxyPrep体液病毒DNA/RNA小量试剂盒使用说明书提取HCLV和CSFV石门强毒株的RNA,作为模板。
1.5 荧光RT-PCR检测方法的建立和优化
按 照 PrimeScript™ OneStep RTPCR Kit Ver.2说明配置反应体系,体系 总 体 积 为 25μL:2×1 Step Buffer 12.5μL,CSFV-F1、CSFV-R1和 P1、CSFV-F2、CSFV-R2和 P2各 若 干,PrimeScript™ 1 step Enzyme Mix 1.0μL,模板RNA 2μL,其余用RNase free dH2O补齐。离心数秒后,放入MyGo mini荧光定量PCR仪实时荧光定量PCR仪进行实时PCR扩增,对荧光RT-PCR的程序进行优化,同时对反应体系中的引物和探针浓度进行筛选,以获得最低的CT值和较高的荧光强度增加值。
1.6 荧光RT-PCR的灵敏度
参照文献[7]测定HCLV和CSFV石门强毒株TCID50。将病毒培养液进行10倍系列稀释,各取100μL病毒稀释液,经AxyPrep体液病毒DNA/RNA小量试剂盒抽提核酸后,进行荧光RT-PCR检测,重复3次,确定最低的检测灵敏度。
1.7 荧光RT-PCR的特异性、重复性试验
利用建立起的荧光RT-PCR法分别对HCLV、CSFV石门强毒株、BVDV、PRRSV、JEV、PPV、PRV、PCV2进行检测,验证其特异性。对HCLV和CSFV石门强毒株的细胞培养液分别10倍系列稀释,每个梯度同时重复检测3次后,记录CT值,然后分别计算对HCLV和CSFV石门强毒株组内检测的变异系数。
1.8 临床样品检测
用建立的双重荧光定量RT-PCR法对从山东省各地收集的临床疑似病料165份进行CSFV检测,同时用常规RT-PCR法及单重荧光定量RT-PCR法进行检测,并比较三者检测结果。
2 结果
2.1 荧光RT–PCR反应条件的优化
优化结果表明,在25μL反应体系中,扩增效果最佳的引物和探针浓度分别为:1μL CSFV-F1(15μmol/L),1.2μLCSFV-R1(15μmol/L),0.8μLP1(5μmol/L), 1 μ L C S F V-F 2(1 5 μ m o l/L),1.5μLCSFV-R2(15μmol/L),1μLP2(5μmol/L)优化后的反应程序如下:50 ℃反转录10 min,95 ℃预变性2 min,95 ℃变性 10 s,55 ℃退火 10 s,72 ℃延伸10 s(此处收集荧光)。
2.2 荧光RT-PCR的灵敏度
HCLV和CSFV石 门 强毒株细胞培养液病毒滴度分别 为 1 05.8T C I D50/1 0 0 μ L 及104.25TCID50/100μL。 当 经 典 毒 株等比稀释到10-7,即病毒滴度稀释到0.12TCID50/100μL时, 荧 光 RTPCR扩增结果仍为阳性,当高致病毒株等比稀释到10-4,即病毒滴度稀释到1.78TCID50/100μL时,荧光RTPCR扩增结果仍为阳性。
2.3 特异性检验
按建立方法对HCLV、CSFV石门强毒株、HCLV和CSFV石门强毒混合 毒、BVDV、PRRSV、JEV、PPV、PRV、PCV2的阳性样品进行荧光定量RT-PCR检测,HCLV样品孔FAM荧光检测出现了单一的s型扩增曲线,检测结果说明猪瘟疫苗毒株阳性,CSFV石门强毒株样品孔HEX荧光检测出现了单一的s型扩增曲线,检测结果说明猪瘟疫苗毒株阳性,HCLV和CSFV石门强毒株混合毒样品孔FAM和HEX荧光检测均出现了单一的s型扩增曲线,检测结果说明猪瘟疫苗毒株和强毒株均为阳性。其余样品孔FAM和HEX荧光检测均没有s型扩增曲线,表明建立的荧光RT-PCR检测方法特异性良好。
2.4 荧光RT-PCR重复性试验
利用建立起的荧光RT-PCR法分别对HCLV和CSFV石门强毒株的细胞培养液分别10倍系列稀释,每个梯度同时重复检测3次后,记录CT值,然后分别计算对HCLV和CSFV石门强毒株组内、组间检测的变异系数,结果样品的Ct值批内重复性试验CV值均小于2.0%,批间重复性试验CV值均小于1.0%,表明本方法的重复性好(表1)。
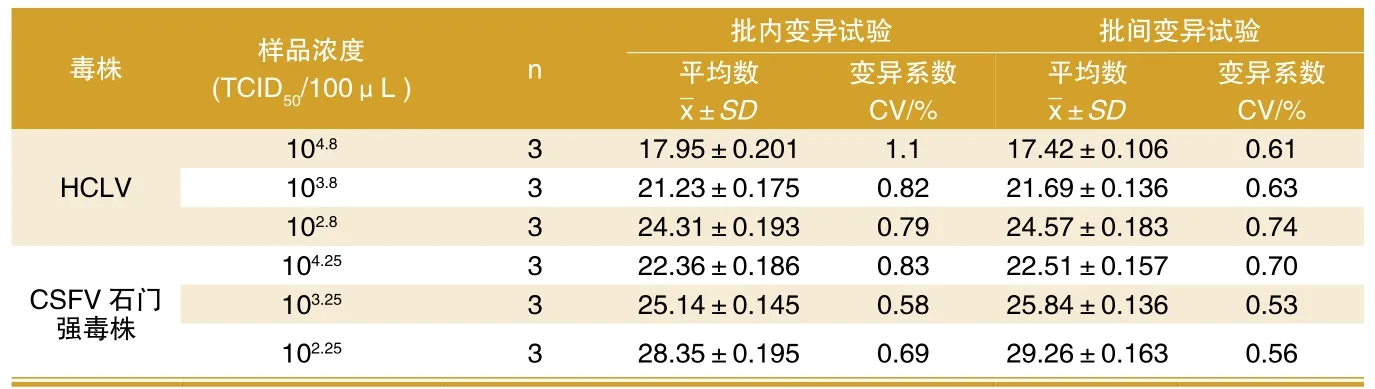
表1 实时荧光RT-PCR的组内和组间重复性实验结果
2.5 临床样品检测
分别用建立双重荧光定量RTPCR和普通RT-PCR方法,对临床收集的165份疑似CSFV样品进行检测,并与常规RT-PCR检测方法进行比较。双重荧光定量RT-PCR结果显示165份病料中有5份为CSFV疫苗毒阳性,检出率为3%;23份CSFV强毒阳性,检出率为13.9%;其中1份CSFV疫苗毒和强毒均为阳性。常规RT-PCR结果显示165份病料中有4份为CSFV疫苗毒阳性,检出率为2.4%;18份CSFV强毒阳性,检出率为10.9%;其中1份CSFV疫苗毒和强毒均为阳性;双重荧光定量RT-PCR与常规RTPCR符合率为96.4%。双重荧光定量RT-PCR与单重荧光定量RT-PCR的结果相同,二者的符合率为100%。从临床检测结果看出,双重荧光定量RT-PCR检出率高于普通RT-PCR。
3 讨论
根据《国家中长期动物疫病防治规划(2012-2020)》,猪瘟已被列入其中[8],要做到优先防治,到2020年全国所有种猪场达到净化标准。近年来,我国已出台一系列政策来支持开展猪瘟净化,同时将猪瘟列入优先防治病种之一。王伟等[9]建立了鉴别检测CSFV强毒株与疫苗株的双重SYBR Green I实时荧光定量RTPCR方法,应用该方法对CSFV强毒和疫苗株的最低检出量为10拷贝/μL,检测BVDV、PRRSV、PRV、PCV-2均呈阴性,批内、批间重复试验的变异系数均低于3%。刘俊等[10]等建立了猪瘟强毒株一步TaqMan-MGB RT-PCR诊断方法,该法能检测5.3×102pgCSFV病毒核酸;能检测除HCLV以外的猪瘟流行强毒株,对牛病毒性腹泻病毒及其他多种猪常见病毒等检测结果均为阴性。赵建军等[11]建立能区分猪瘟强毒、疫苗弱毒的实时荧光定量RT-PCR方法,并且与BVDV、TGEV、PEDV、PRV、PCV2、PRRSV、PPV不发生反应,该方法对CSFV强毒和猪瘟弱毒疫苗RNA的最低检出限分别为41.8拷贝/μL和81.5拷贝/μL。
传统CSFV诊断方法主要包括病毒的分离鉴定、酶联免疫吸附试验(ELISA)、胶体金试纸条、荧光抗体试验、常规RT-PCR、环介导等温扩增技术、横向流动试纸条技术、胶体检测法等。这些方法在敏感性、特异性、时效性等方面都存在各自的不足,尤其不适于CSFV强毒感染的早期快速诊断。比如当病毒分离鉴定耗时一长、血清学方法可能会出现一定的交叉反应,且敏感性低不能早期检测,常规RT-PCR技术不能对病毒定量,环介导等温扩增技术易出现假阳性结果等缺点,横向流动试纸条技术目前还不太成熟,没有大规模推广应用,胶体金检测虽然方便,但敏感性太低,有时特异性不好,容易出现假阳性结果。荧光定量PCR技术经过20多年发展已经成熟,笔者以为荧光PCR检测是当前最适合临床应用检测的技术,现已到了大规模推广应用荧光PCR检测病料样品的最佳时期。
荧光定量PCR技术分为染料法和探针法两种,与染料法相比探针法检测特异性好,敏感性高,本实验采取的是一种新型探针即TaqMan MGB探针,其优点是①探针背景的本底信号更低,使检测结果更准确。②能显著提高探针Tm值,因此,可以减少探针设计长度,尤其对AT富含区基因序列,设计探针更有利。③探针与模板结合的特异性更高,即使一个碱基不匹配都能正确区分。由于猪瘟疫苗毒与猪瘟强毒基因组序列差别不大,同源性96%左右,因此,TaqMan MGB探针较适用于二者的鉴别检测。
核酸提取是PCR检测的重要步骤,核酸提取的时间和质量对PCR检测的总时间和检测的效果均有重要的影响,本研究采用商品化核酸试剂提取核酸,其主要采用吸附柱式,操作简单、快速,提取时配合小型高速离心机,半小时即能完成提取过程。笔者将经典的Triol法与该法进行比对,结果检测结果一致,说明提取的RNA质量完全能满足检测要求,最重要的该法核酸提取的时间远少于传统的Triol法。与磁株相比的优势是所需要的试剂少,操作简单,试剂常温保存即可,贮存和运输不需要低温,适合现场检测。
本研究采用猪瘟病毒疫苗株和野毒株一步法双重荧光RT-PCR鉴别检测方法。只需在PCR反应中加入反转录试剂即可,无需单独反转录时间,可大幅缩减反应所需的时间,可在55 min完成扩增反应,得出检测结果。不需特定实验室,无需电泳,至少可节省1/2的时间和费用,该法操作简单,避免了由于多次操作及电泳而造成的污染问题,可检测微量病毒,将人为因素对结果的印象降到最低。试验所用的荧光定量PCR仪尺寸小,重量轻,便于携带,适合用于现场快速检测,从而节省送样的时间和样品运送途中的损耗,进一步提高检测的准确性,提早采取相应的防控措施,减少养殖场的经济损失。为了更进一步满足现场检测的需求,笔者下一步工作中将对检测试剂的保存方式进行优化,将所用检测试剂配制完成后,加入冻干保护剂,并分装到8联管中冻干保存,常温保存和运输即可,使用时,只需要加入灭菌纯化水和模板,即能进行扩增反应。简化加样步骤,避免了操作过程的污染。
本实验建立了猪瘟病毒疫苗株和野毒株一步法双重荧光RT-PCR鉴别检测方法,可用于现场检测猪瘟病毒,特异性好、灵敏度高、稳定性好,配合AxyPrep体液病毒DNA/RNA小量试剂盒,从核酸提取到报告检测结果仅需1.5 h,检测速度快,操作简便,适合现地检测,下一步可开发组装成试剂盒,市场前景很好,适合基层临床猪瘟的快速诊断,从而制定相应的防治措施,使损失降到最低,也可用于精准评估和诊断母猪猪瘟病毒带毒排毒、仔猪潜在感染情况,脐带血中猪瘟病毒含量情况,从而为猪瘟的预警、疫苗免疫效果评估及猪瘟防控净化工作提供有力的条件。
[1] 殷震,刘景华.动物病毒学[M]. 2版.北京:科学出版社,1997:652-664.
[2] 仇华吉,童光志,沈荣显.猪瘟兔化弱毒疫苗——半个世纪的回顾[J].中国农业科学,2005,38 (8):1675-1685.
[3] 于新友,李天芝,苗立中,等.分子生物学技术在猪瘟野毒与兔化弱毒鉴别诊断方法中的研究进展[J].猪业科学,2015,32(1):76-78.
[4] 涂长春.猪瘟国际流行态势、我国现状及防制对策[J].中国农业科学,2003,36(8):955-960.
[5] 陈锴,姚华伟,王长江,等.荧光定量PCR作为猪瘟兔化弱毒疫苗效价检验替代方法的研究与应用[J].中国农业科学,2013,46(1):162-169.
[6] 张改平,何文博,王德国,等.猪瘟强毒株与兔化弱毒疫苗株的LAMP鉴别检测[J].郑州大学学报(理学版),2014,46(3):85-90.
[7] 戴志红,蒋卉,李翠,等.用间接免疫荧光检测方法评价猪瘟兔化弱毒活疫苗效力的研究[J].中国兽药杂志,2014,48(1):34-37.
[8] 王长江,王琴,沙依兰古丽,等.动物疫病净化的基本要求和方法探讨[J].中国动物检疫,2013,30(8):40-43.
[9] 王伟,符芳,陈欣,等.猪瘟病毒野毒株与疫苗株双重SYBR Green I 实时荧光定量检测方法的建立[J].中国预防兽医学报,2010,32(11) :854-857.
[10] 刘俊,王琴,范学政,等.猪瘟病毒野毒株TaqMan-MGB荧光定量PCR鉴别方法的建立与应用[J].中国农业科学,2009,42(12):4366-4371.
[11] 赵建军,成丹,李娜,等.猪瘟病毒野毒株和兔化弱毒疫苗株复合实时荧光定量 RT-PCR 鉴别方法的建立[J].中国兽医科学,2007,37(5):406-412.?
猪瘟耐热冻干保护剂活疫苗免疫及检测技术的研究与示范项目;山东省现代农业产业技术体系生猪产业创新团队项目(SDAIT-08-17 )
李天芝(1985-),女,山东菏泽人,助理研究员,硕士,主要从事动物传染病诊断及防控研究.
2017-11-09)

