猪瘟诊断技术
张乾义,徐 璐,孙骏翔,王 琴
(中国兽医药品监察所,OIE/国家猪瘟参考实验室,北京 100081)
检测诊断
猪瘟诊断技术
张乾义,徐 璐,孙骏翔,王 琴
(中国兽医药品监察所,OIE/国家猪瘟参考实验室,北京 100081)
中国是世界生猪养殖大国,生猪年出栏量占到世界总量的48%。猪瘟在中国被列为一类动物疫病,影响着养猪业生产安全,在其他很多国家也是动物疫病防控的重点。有效防控猪瘟疫病,既是保护国内养猪业健康发展的需要,也是中国对世界养猪业发展责无旁贷的贡献。当前,中国正处在大力发展现代畜牧业的关键时期,随着集约化、规模化、标准化养殖的加快推进,受生态环境、饲养模式、市场流通等多方面因素的影响,重大动物疫病防控新情况、新特点不断出现,防控难度也在不断增加。2012年5月,作为一项重要的民生工程,中国政府发布了《国家中长期动物疫病防治规划(2012—2020年)》,这标志动物疫病防控从过去的有效控制迈入到了逐步净化消灭的崭新阶段。诊断检测是动物疾病防控的重要手段,准确而快速的诊断是疾病控制的前提保障。早期确诊并快速清除感染猪是控制猪瘟的关键所在。在典型性猪瘟流行的早期,人们通过典型临床症状及剖检病理变化即可进行猪瘟的诊断。然而近30年来随着非典型猪瘟越来越常见,仅靠临床症状和病理剖检变化已经难以对猪瘟进行确诊,必须依赖实验室分子生物学等诊断技术进行快速确诊。中国兽医药品监察所猪瘟实验室是OIE/国家猪瘟参考实验室,承担农业部下达的大量流行病学调查任务,每年获得病原学样本约2 000余份、血清学样本约5 000余份,在猪瘟诊断技术方面积累了一些经验和检测方法。因此本文就猪瘟临床表现、病理剖检、实验室诊断3个方面展开对猪瘟诊断技术的概述。
1 临床表现
猪瘟的临诊症状和死后病变,因毒株、宿主因素不同和病程长短有很大差异。在临床上根据病情、病毒的毒力、病程长短、临床症状和感染时期(出生前或出生后)表现不同,可将猪瘟分为最急性型、急性型、亚急性型、慢性型、持续感染型5种类型。最急性型猪瘟病程一般为1~6 d,突然发病,全身痉挛,四肢抽搐,皮肤和黏膜发绀,倒卧,很快死亡;急性型病程一般为6~20 d、亚急性型为21~30 d,二者在临床上并没有太大的症状区分,主要表现是高稽留热常超过40 ℃,腹部皮下、鼻镜、耳尖、四肢内侧均可出现紫色或大小不等的出血斑点,指压不褪色,眼结膜和口腔黏膜可见出血点,早期有结膜炎,眼睛内有多量淡黄色的浓性分泌物,食欲下降,精神沉郁,濒死期呈犬坐姿势(见图1和2)。
慢性猪瘟多发生于老疫区或接种猪瘟疫苗但免疫水平不高的猪群,病程通常在一个月以上,继发感染严重,病猪食欲减退或食欲时好时坏;体温有时正常或出现周期性发热;便秘与腹泻交替发生,病猪腹泻时间较长则出现毛色粗乱,生长停滞,贫血,日益消瘦。皮肤呈现紫色出血斑、丘疹或坏死,以耳尖坏死最为明显。病猪难以完全康复,常成为僵猪。
持续感染型是目前引起猪瘟流行的最主要原因之一。感染猪本身无任何临床症状,死亡率低,但长期带毒和排毒,母猪可正常返情,但久配不孕,并发展成繁殖障碍“带毒母猪综合征”,产木乃伊胎、死胎、畸形胎,出现新生仔猪颤抖病。国家猪瘟参考实验室的研究人员进行了人工猪瘟病毒持续感染动物模型的建立和研究,发现怀孕母猪可连续带毒750 d,母猪可正常返情,但久配不孕(《猪瘟》王琴、涂长春主编,中国农业出版社)。持续感染性猪瘟给我国养猪业带来的危害极大,“健康”的先天性病毒感染的带毒仔猪均不能消除体内的病毒,产生免疫耐受,疫苗免疫之后不产生抗体导致免疫失败。带毒仔猪如果逃避病原监测而进入后备猪群体,经水平传播不断排向外界,引起易感猪感染、发病和死亡并污染环境,导致在一个猪群内病毒持续存在,难以清除带毒仔猪进入后备猪群体成为种猪,形成恶性循环,成为主要的传染来源,这是目前对我国规模猪场养猪业危害最大的感染形式。
2 病理剖检
急性亚急性的病理剖检结果相似,脾的边缘或脾体表面可见从粟粒至黄豆大、数目不等的紫红色或紫黑色出血性梗死灶。梗死灶组织坚实、表面稍凸出于周围正常组织,切面呈楔形,其检出率约占总病例的30%~40%,见图3。肾脏病变明显,表现为颜色淡,有时呈土黄色,有针尖大至米粒大出血点,量少时出血点稀疏散甚至只有少数几个,量多时密布整个肾脏表面,如麻雀蛋外观,见图4。
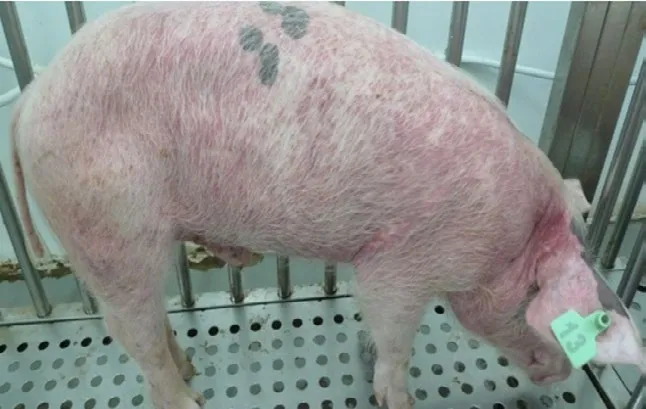
图1 全身出现紫色或大小不等的出血斑点
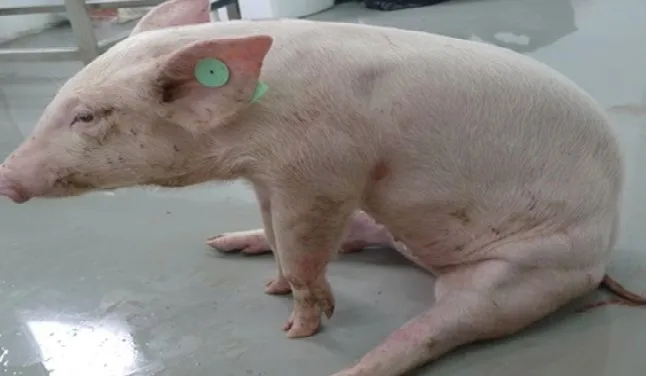
图2 濒死期病猪呈犬坐姿势
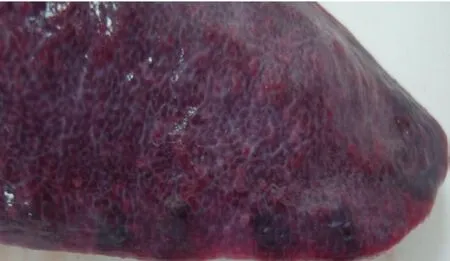
图3 脾边缘出血性梗死
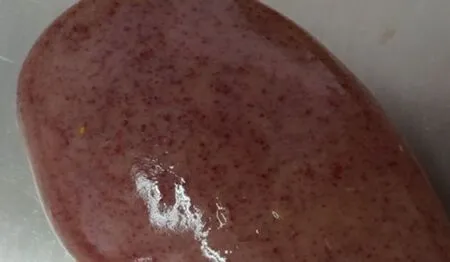
图4 肾脏点状出血
全身淋巴结病变具有一定的特征性,几乎全身淋巴结都有出血性病变。主要表现淋巴结出血、肿胀,表面呈深红色至紫黑色,见图5。切面呈红白相间的大理石状外观,这是因为淋巴窦内积聚血液,而其余淋巴组织呈灰白色,两者相互镶嵌形成大理石样花纹,见图6。在颌下、咽背、耳下、支气管、胃门、肾门、腹股沟及肠系膜等淋巴结病变最明显,见图7。
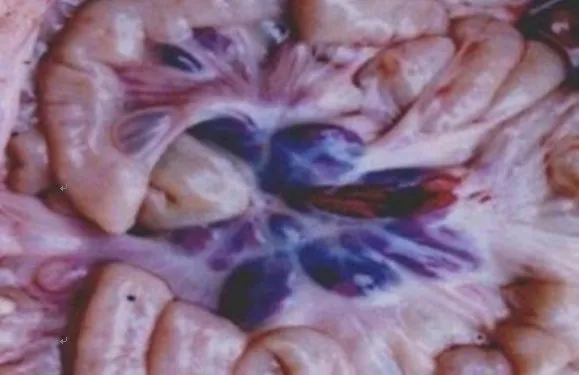
图5 肠系膜淋巴结出血
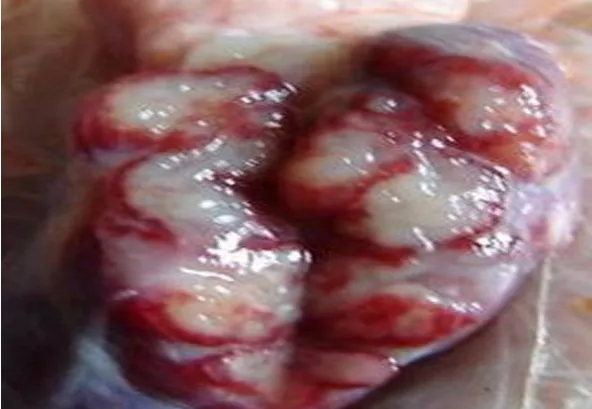
图6 颌下淋巴结大理石样变
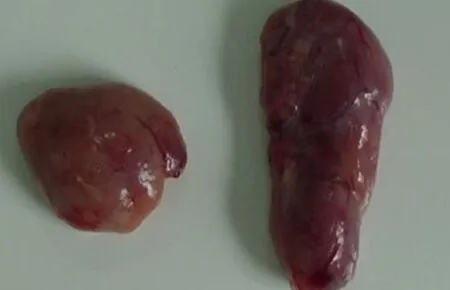
图7 颌下淋巴结出血
全身多组织器官表现出血、喉头和会厌软骨上多数有小出血点,见图8;肠道淋巴滤泡常肿大,直接从浆膜面即可明显观察;膀胱黏膜呈片状或散在点状出血;胃大弯内黏膜常见明显的充血和出血斑和出血点,表面糜烂、溃疡,见图9。扁桃体明显肿大,表面因继发细菌感染而出现的溃疡坏死灶,见图10。
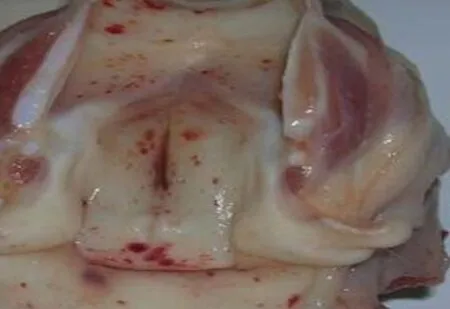
图8 喉头和会厌软骨出血
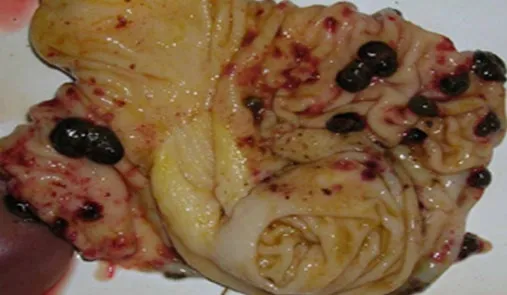
图9 胃大弯黏膜出血、溃疡

图10 扁桃体溃疡、坏死
慢性猪瘟剖检见肠黏膜充血、出血,回盲瓣呈“纽扣状”溃疡,见图11、12和13。
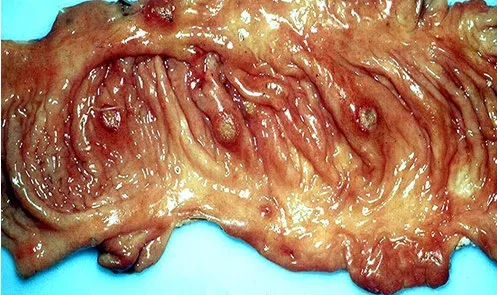
图11 肠黏膜充血、出血
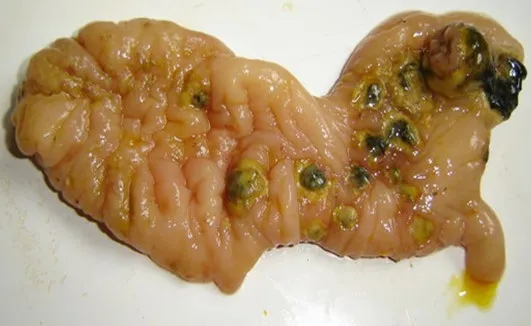
图12 回盲瓣出血、溃疡
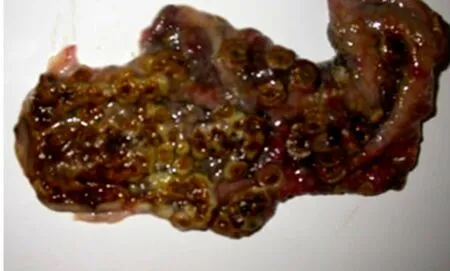
图13 回盲瓣呈“纽扣状”
持续性感染无症状或症状不明显,仔猪先天性感染猪瘟病毒,导致发生死胎、木乃伊胎、胎儿皮下水肿,腹腔积水以及畸形胎儿,出生后很快死亡的胎儿通常在皮肤和内脏器官呈现点状出血。
3 实验室诊断
猪瘟实验室诊断一般分为动物接种、病毒抗原检测、病毒分离、病毒核酸检测这4种方法,其中以病毒核酸检测最为常用。
3.1 动物接种
动物接种法诊断猪瘟主要包括兔体交互实验和本体动物回归实验。受诊断成本及时间限制,动物接种实验现在极少使用。兔体交互实验的主要原理是猪瘟强毒不会引起兔的体温反应,但能使其产生免疫力,猪瘟兔化弱毒苗能使家兔产生定型热反应,但对已产生免疫力的家兔则不产生体温反应,因此根据试验组兔不发生定型热反应,来检测样本中是否含有猪瘟病毒。通过本动物接种分离鉴定猪瘟病毒是检测猪瘟病毒最敏感的方法,但试验成本高,耗时长,动物个体差异大,存在生物安全隐患且须在动物生物安全三级实验室进行,散毒风险高。
3.2 猪瘟病毒抗原检测
如果样本是血液或者组织研磨液,可以选用酶联免疫吸附试验(ELISA),该方法具有操作简便,检测时间短的优点,但存在灵敏度低,田间感染很难检测。若是组织切片/抹片可选用免疫荧光/过氧化物酶实验,该种方法的优点是特异性高、检测时间短,但对检验人员要求高,敏感性低。
3.3 猪瘟病毒分离
目前用于猪瘟病毒分离的组织主要有:血液、扁桃体、淋巴结、脾脏、肾脏和回肠等组织。血液(抗凝血、脱纤血)、扁桃体和淋巴结等组织也是国家猪瘟参考实验室开展猪瘟流行病学监测在养猪场和屠宰场常用的采样组织,也是猪瘟病毒的嗜性组织。脾脏:健康脾脏为饱满的红棕色,猪瘟病毒感染后苍白、柔软、边缘梗死,适宜在梗死灶之间进行采样。肾脏:健康肾脏为苍白红棕色猪瘟病毒感染后表面有针状出血点,采样时采集皮质和髓质交界处。回肠:回肠底部溃烂是急性猪瘟的典型症状,但只见于回肠内壁,溃烂周围组织是病毒富集区适宜进行采样。
猪瘟病毒分离实验室操作主要分为4个步骤:组织处理(修剪、研磨)、接种(敏感细胞系:PK15或ST)、结果判定(细胞、核酸染色法)、鉴定(RTPCR、测序)。上述检测步骤也存在一定的优缺点。优点:特异性好,可用于病毒的进一步鉴定和毒种保存;缺点:灵敏度低,检测周期长,易出现假阴性。
3.4 病毒核酸检测
目前猪瘟病毒核酸检测法主要是荧光RT-PCR和RT-nPCR,且这两种方法都已申请国标为我所猪瘟组自主开发产品,见图14和图15。
荧光RT-PCR用于猪瘟病毒野毒、疫苗毒等所有毒株的诊断和监测,适用于猪活体及其脏器、血液、排泄物和细胞培养物中CSFV核酸的检测。原理是在PCR扩增体系中加入一条特异荧光探针,该探针为一寡核苷酸链,两端分别标记一个报告荧光基团(R)和一个淬灭荧光基团(Q)。探针完整时,两者发生荧光共振能量转移,R基团发射的荧光信号被Q基团淬灭,PCR扩增进行时,Taq酶发挥5`~3`外切酶活性,将探针降解,实现R基团与Q基团分离,Q基团淬灭作用随即消失,R基团释放荧光信号,被荧光监测系统接收,即每完成一次扩增,就有一个荧光信号累积,实现了荧光信号的累积与PCR产物形成完全同步。在操作过程中应设置阴性对照,包括样本阴性对照与体系阴性对照;由于该方法的灵敏性很强,需要注意实验污染,因此最好将实验分区,将试剂配置、样本处理、核酸扩增等步骤区分开来,避免污染。在大规模检测时,建议使用UNG防污染体系。

图14 猪瘟病毒荧光RT-PCR检测试剂盒
RT-nPCR即套式聚合酶链式反应,用于猪瘟的诊断和监测,适用于猪活体及其脏器、血液、排泄物和细胞培养物中猪瘟病毒核酸的检测。RT-nPCR使用两对PCR引物扩增完整目的片段,第二对引物特异性的扩增位于首轮PCR产物内的一段DNA片段,弥补RT-PCR的不足,可检测病毒含量低的样品。在RT-nPCR扩增的特定基因(E2基因)片段的基础上,扩增产物可以进行基因序列测定,因此该方法可进一步鉴定流行毒株的基因型,从而追踪流行毒株的传播来源。
3.5 猪瘟抗体检测
进行猪瘟抗体监测是国家猪瘟参考实验室开展流行病学调查的主要内容之一。抗体检测既可以用于免疫猪的抗体水平监测,从而筛选出免疫耐受猪或者对疫苗免疫效果进行监测和评价,也可用于非免疫猪的感染筛查。目前猪瘟抗体检测方法主要有细胞中和试验、兔体中和试验、正向间接血凝试验、ELISA、免疫层析技术以及其他的新型检测技术。
1)细胞中和试验常用于猪血清中具有中和作用的猪瘟抗体效价的测定,主要采用固定病毒含量(通常病毒含量为100TCID50/50μL),稀释待测血清的方法进行抗体效价测定。该方法是猪瘟抗体检测中的金标准但操作复杂,检测时间久,影响因素较多。
2)兔体中和试验也是猪瘟抗体检测中的金标准,其原理是利用工作浓度的猪瘟兔化弱毒抗原,与不同稀释度的被检血清等量混合作用后,耳静脉注射家兔,据家兔体温反应结果定性定量判定被检血清。该方法同样操作复杂,检测时间久。
图15 猪瘟病毒RT-nPCR检测试剂盒
3)猪瘟正向间接血凝试验是利用猪瘟病毒致敏红细胞,将待检血清梯度稀释后进行抗原抗体反应,根据红细胞的凝集判断结果。这种方法能够测出猪瘟抗体效价,简便易操作,常用于免疫抗体的监测。
4)酶联免疫吸附试验即ELISA技术,是国际贸易指定标准诊断方法之一,该方法又分为间接ELISA、阻断ELISA、竞争ELISA。中国兽医药品监察所国家猪瘟参考实验室制成了具有自主知识产权的猪瘟病毒间接ELISA抗体检测试剂盒,适合我国全面免疫的防控策略,具有敏感性高特点。
5)免疫层析技术其原理是利用微孔滤膜的渗滤浓缩和毛细层析作用,使抗原抗体在固相膜上反应,由胶体金标记的抗体显色,阳性反应在膜上呈现红色,阴性反应则不显色。操作简便、快速,全程只需5 min左右,肉眼直接观察和判断检测结果;可采用仪器进行相对定量,但是该方法敏感性低,不适合大量的样品检测。随着科技发展,化学发光技术、荧光微球检测技术、镧系高敏荧光定量免疫层析技术等新兴技术逐渐用于猪瘟抗体的检测。
相信随着分子生物学技术的发展和高新技术的一次次突破,越来越多的新技术、新方法被研发并应用于生产实践当中,当然也包括我们兽医界在猪瘟诊断领域的突破和创新。猪瘟参考实验室将按照OIE参考实验室的职能和国家猪瘟防控需求,努力完善猪瘟流行病学的研究,进一步提升诊断水平和标准化建设,开展相关基础研究以及新型诊断试剂及疫苗的研发,加强实验室建设,进一步增强在国际社会中的交流与合作,建立长期联系机制,深入探讨猪瘟防控中的技术问题,共同为在全球控制和消灭猪瘟做出更大的贡献。
国家自然科学基金面上项目“猪瘟病毒RNA在体内外细胞中的复制动态研究”(编号:31372434);《“十二五”农村领域国家科技计划课题》项目“猪瘟和猪伪狂犬病防控净化技术集成研究与示范”,项目编号:2015BAD12B04。
2017-10-30)

