短期NaCl胁迫对西伯利亚白刺幼苗Na+、K+分配和平衡的影响
唐晓倩,李焕勇,杨秀艳,刘正祥,张华新
(国家林业局盐碱地研究中心,北京 100091)
短期NaCl胁迫对西伯利亚白刺幼苗Na+、K+分配和平衡的影响
唐晓倩,李焕勇,杨秀艳,刘正祥,张华新*
(国家林业局盐碱地研究中心,北京 100091)
目的为探究西伯利亚白刺盐适应机制。方法以1年生西伯利亚白刺水培幼苗为材料,研究不同浓度NaCl(0、200、300 mmol·L-1)胁迫24 h后根系Na+、K+离子流的动态变化(利用扫描离子选择微电极技术,SIET)及植株各器官中Na+、K+含量的静态变化(利用电感耦合等离子体光谱仪,ICP-OES)。结果表明:(1)短期NaCl胁迫显著提高了西伯利亚白刺根、茎、叶中Na+含量,其中,叶中Na+含量是根中的3倍以上;西伯利亚白刺根、茎、叶中K+含量保持稳定或上升;(2)盐胁迫下,西伯利亚白刺根、茎、叶中K+/Na+呈下降趋势,其中,在200、300 mmol·L-1NaCl胁迫下,根中K+/Na+差异不显著;(3)离子流结果显示,NaCl胁迫显著提高了西伯利亚白刺根系Na+的外流;对照和200 mmol·L-1NaCl胁迫下,K+净流量分别为156、159 pmol·cm-2·s-1,差异不显著;300 mmol·L-1NaCl胁迫显著提高了K+的内流,净流量为-370 pmol·cm-2·s-1。结论综合分析认为,西伯利亚白刺通过叶片对Na+区隔,加强根系对Na+的外排和K+内流,进而维持植株根系K+/Na+的相对平衡,以此适应盐渍环境。
西伯利亚白刺;NaCl胁迫;离子流;K+/Na+平衡
盐胁迫是影响植物生长和作物产量最严重的环境限制之一[1]。一般盐分对植物造成直接或间接的伤害:首先,土壤中高浓度可溶性盐导致可用水减少,引起渗透胁迫;其次,植物过量积累有毒离子(特别是Na+)引起离子毒害和营养元素亏缺;最后,引起的氧化胁迫[2-4]。这些伤害都与植物对盐离子的吸收、在植物体内的积累及分配密切相关。因此,植物的耐盐能力与植物体对盐离子的吸收、运输、积累和分配调控能力有关。盐胁迫下,植物维持体内相对较高的K+/Na+是植物耐盐性强的一种表现。Shabala等[5]指出,维持细胞质中较高的K+/Na+比值比单纯的维持低Na+含量和高K+吸收更重要,因此,植物能否在盐渍条件下生存很大程度上取决于盐胁迫条件下植物体内保持K+/Na+平衡的能力[6]。植物可以通过限制Na+的吸收、增加Na+外排、Na+区隔化到液泡及限制K+的流失来维持细胞质中K+/Na+的有效平衡。对大麦[7]、小麦[8]、胡杨[9]等植物的研究发现,耐盐性品种在盐胁迫下比盐敏感性品种具有更强的Na+外排能力或限制K+流失的能力;同时,围绕盐胁迫对植物体内盐离子的吸收、运输、积累和分配的研究一直是研究者关注的热点。

1 试验材料与试验设计
西伯利亚白刺种子于2015年10月下旬采自青海柴达木盆地可鲁克湖湖边盐碱滩地。试验于2016年4—9月在中国林业科学研究院科研温室进行。种子用温水浸种24 h后,与湿沙混合催芽,于4月中旬将萌动露白的种子播种到装有蛭石的营养钵中。生长2个月后,选取长势一致的幼苗定植到含有改良的1/2 Hoagland营养液的塑料盆(长×宽×高:40 cm×30 cm×15 cm)中水培,24 h通气,每4 d更换1次营养液。培养5 d后进行NaCl胁迫处理,NaCl处理浓度为0、200、300 mmol·L-1,每盆20株,每处理3个重复。为避免盐浓度短时间内的快速升高对幼苗造成渗透休克,采取每天增加50 mmol·L-1NaCl的方式进行施盐,各处理在同一天达到预定浓度。盐胁迫24 h后检测K+、Na+离子流,并取样测定K+和Na+含量。
2 试验方法
2.1 Na+和K+含量的测定
取出盆中待测植株,用去离子水冲洗3遍,并用吸水纸吸干表面水分。将幼苗根、茎、叶分开,于105℃杀青30 min后,80℃下烘至恒质量,将烘干后的植株粉碎过筛,用于测定Na+和K+含量。Na+和K+含量参照刘正祥等[16]的方法略有改进,用HNO3消解后采用电感耦合等离子体发射光谱仪(iCAP 6300 ICP-OES Spectrpmeter, Thermo Scientific, USA)进行测定。
2.2 离子流的测定
Na+、K+离子流利用非损伤微测技术中的扫描离子选择微电极技术(SIET, BIO-IM-008, Younger USA Sci. & Tech. Corp., USA)进行测定。Na+、K+测试液的成分为:0.1 mmol·L-1KCl, 0.1 mmol·L-1MgCl2, 0.5 mmol·L-1NaCl, 0.1 mmol·L-1CaCl2, 0.3 mmol·L-1MES, pH值5.7。

2.3 数据处理与分析
离子流测定数据根据旭月科技有限公司开发的Mageflux 软件(Younger USA Sci & Tech Corp, USA)进行计算,利用SPSS 16.0软件对数据进行标准化,去除异常值,用Microsoft Excel 2007和SPSS 16.0软件进行数据整理、方差分析和作图。
3 结果与分析
3.1 NaCl胁迫对西伯利亚白刺幼苗各组织Na+和K+含量的影响
3.1.1 NaCl胁迫对西伯利亚白刺幼苗各组织Na+积累的影响 图1A 表明:NaCl胁迫显著增加了西伯利亚白刺幼苗根、茎、叶中的Na+含量。200 mmol·L-1NaCl胁迫下,幼苗根中的Na+含量显著高于对照,茎和叶中的Na+含量与对照差异不显著;300 mmol·L-1NaCl胁迫下,幼苗根、茎、叶中的Na+含量均显著高于对照。不同处理叶片中的Na+含量均显著比根和茎中的高,其中,200、300 mmol·L-1NaCl胁迫下,幼苗叶片中的Na+含量分别是根的3.14、3.07倍。上述结果表明,盐胁迫下,西伯利亚白刺幼苗吸收了大量的Na+,并将绝大部分Na+贮藏在叶片中。
3.1.2 NaCl胁迫对西伯利亚白刺幼苗各组织K+积累的影响 由图1B可知:随着NaCl浓度的升高,西伯利亚白刺茎、叶中的K+含量变化相对平稳,茎中的K+含量在200 mmol·L-1NaCl 胁迫时下降,在300 mmol·L-1NaCl 胁迫时上升至对照水平;叶片中的K+含量在NaCl 胁迫下均比对照的低,但差异不显著。随着NaCl胁迫的增强,根系对K+的吸收逐渐增强,300 mmol·L-1NaCl胁迫下,根中的K+含量比对照增加了31.1%。以上结果表明,盐胁迫下,西伯利亚白刺幼苗根系对K+的吸收增加,向地上部分的运输也未受到明显的抑制。
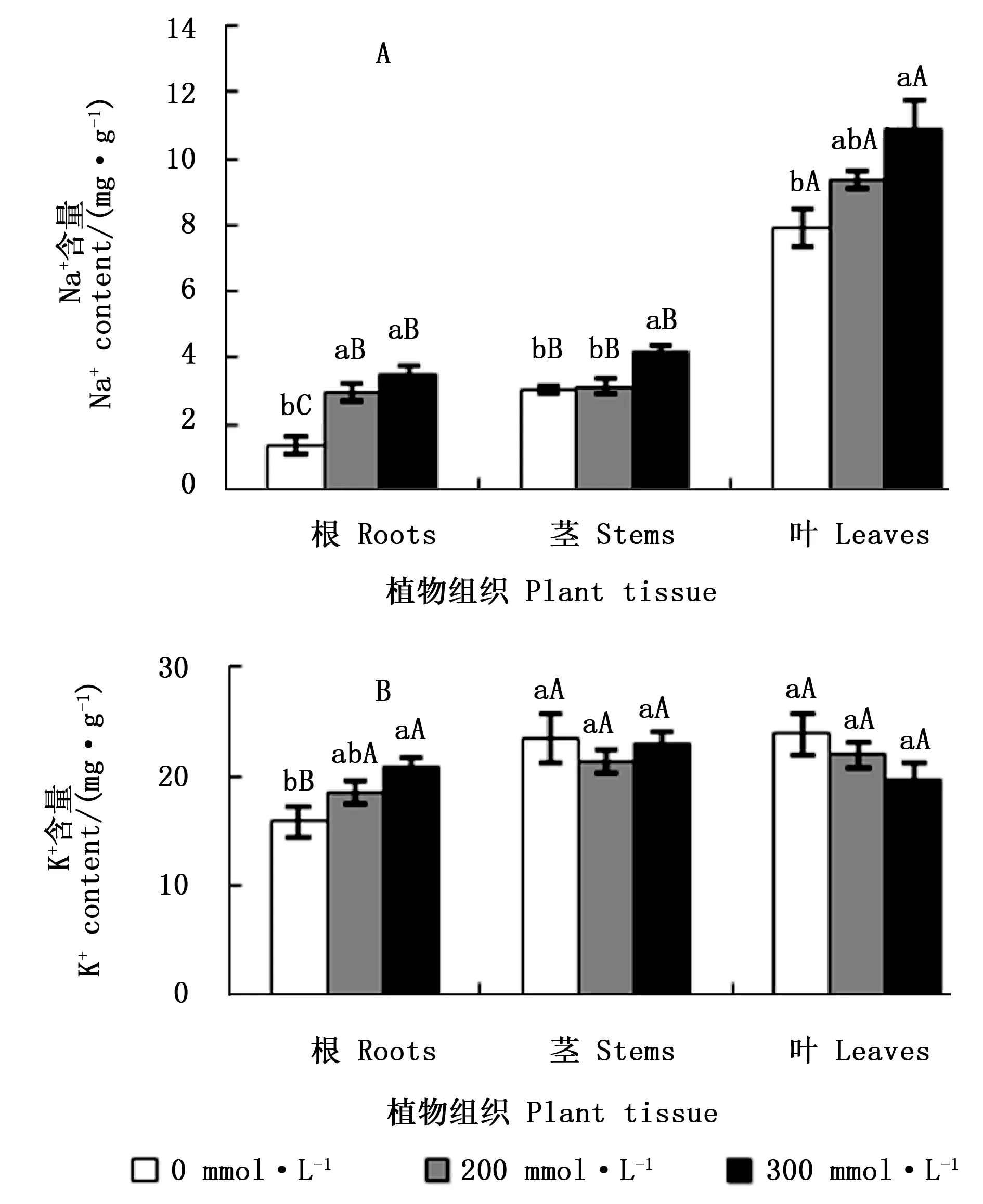
图中不同小写字母表示不同NaCl处理间差异显著(P<0.05),不同大写字母表示不同器官间差异显著(P<0.05);下同。Different small letters respresent significant differernce between diffeent NaCl concentrations(P<0.05); different capital letters indicate significant differernce bewteen diffeent plant organs(P<0.05); the same as following图1 NaCl胁迫下西伯利亚白刺幼苗各组织Na+和K+积累情况Fig.1 The accumnlation of Na+ and K+ in different tissues of Nitraria sibirica Pall. seedlings under NaCl stress
3.1.3 NaCl胁迫对西伯利亚白刺各组织K+/Na+的影响 图2表明:随着NaCl浓度的升高,西伯利亚白刺幼苗根、茎、叶中K+/Na+均呈下降趋势;与对照相比,200、300 mmol·L-1NaCl胁迫下,根中K+/Na+显著下降,而2个胁迫浓度的差异不显著;随着NaCl胁迫浓度的升高,叶中的K+/Na+显著下降;在300 mmol·L-1NaCl胁迫下,茎中的K+/Na+显著低于对照和200 mmol·L-1NaCl胁迫处理。在同一处理不同组织间,叶中的K+/Na+最低,且与根、茎中的K+/Na+差异显著。上述结果表明,盐胁迫下,西伯利亚白刺根系吸收Na+的同时加强了对K+的吸收,从而保持根中的K+/Na+平衡。由于叶片中积累的Na+含量最高,导致叶片中的K+/Na+最低。

图2 不同浓度NaCl胁迫对西伯利亚白刺各组织K+/Na+比值的影响Fig. 2 Effects of different NaCl concentrations on K+/Na+ ration in different tissues of Nitraria sibirica Pall. seedlings
3.2 NaCl胁迫下西伯利亚白刺根系离子流的变化

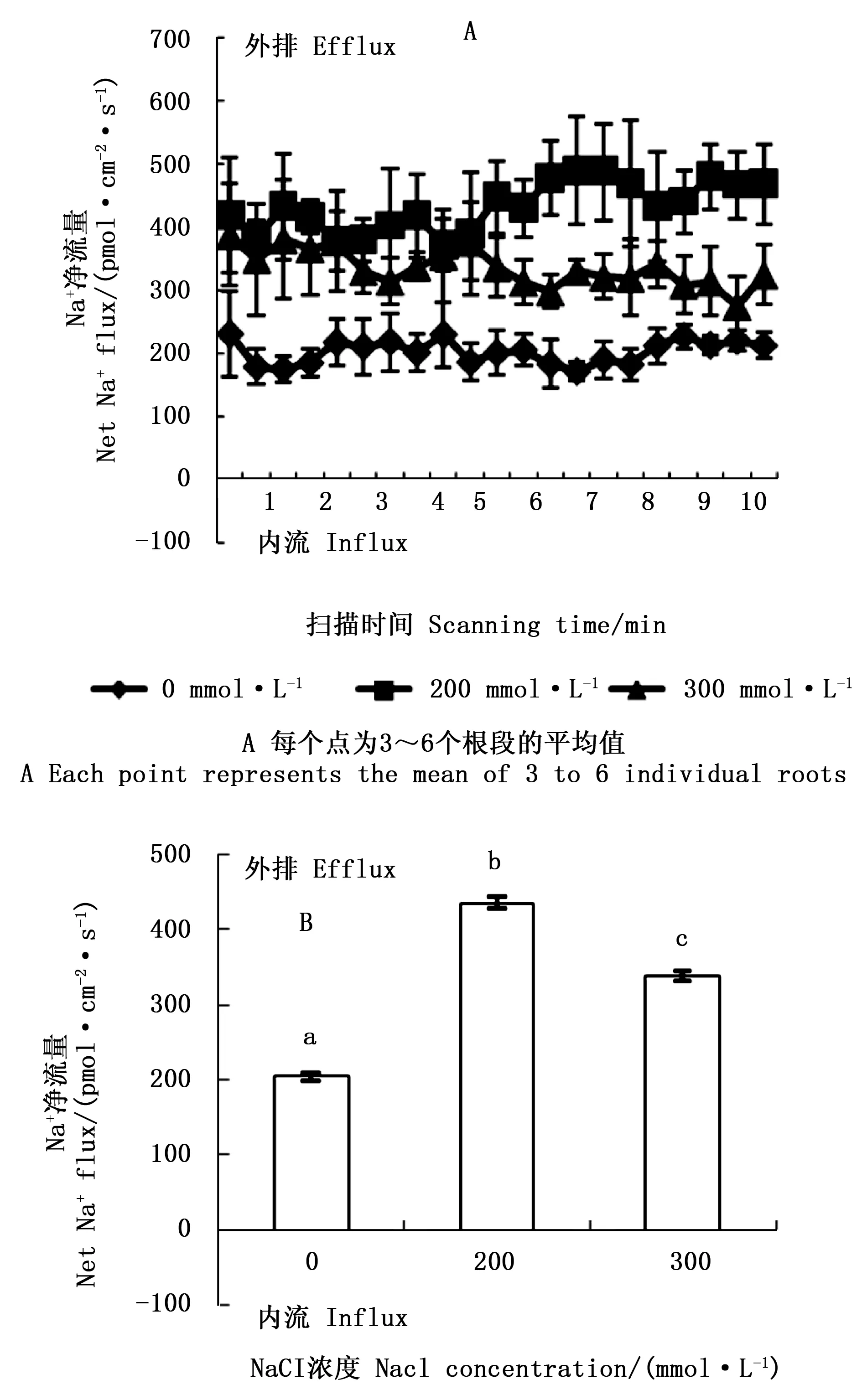
图3 NaCl胁迫对西伯利亚白刺幼苗根系稳态Na+流的影响Fig.3 Effect of NaCl stress on steady Na+ fluxes at roots of Nitraria sibirica Pall. Seedlings

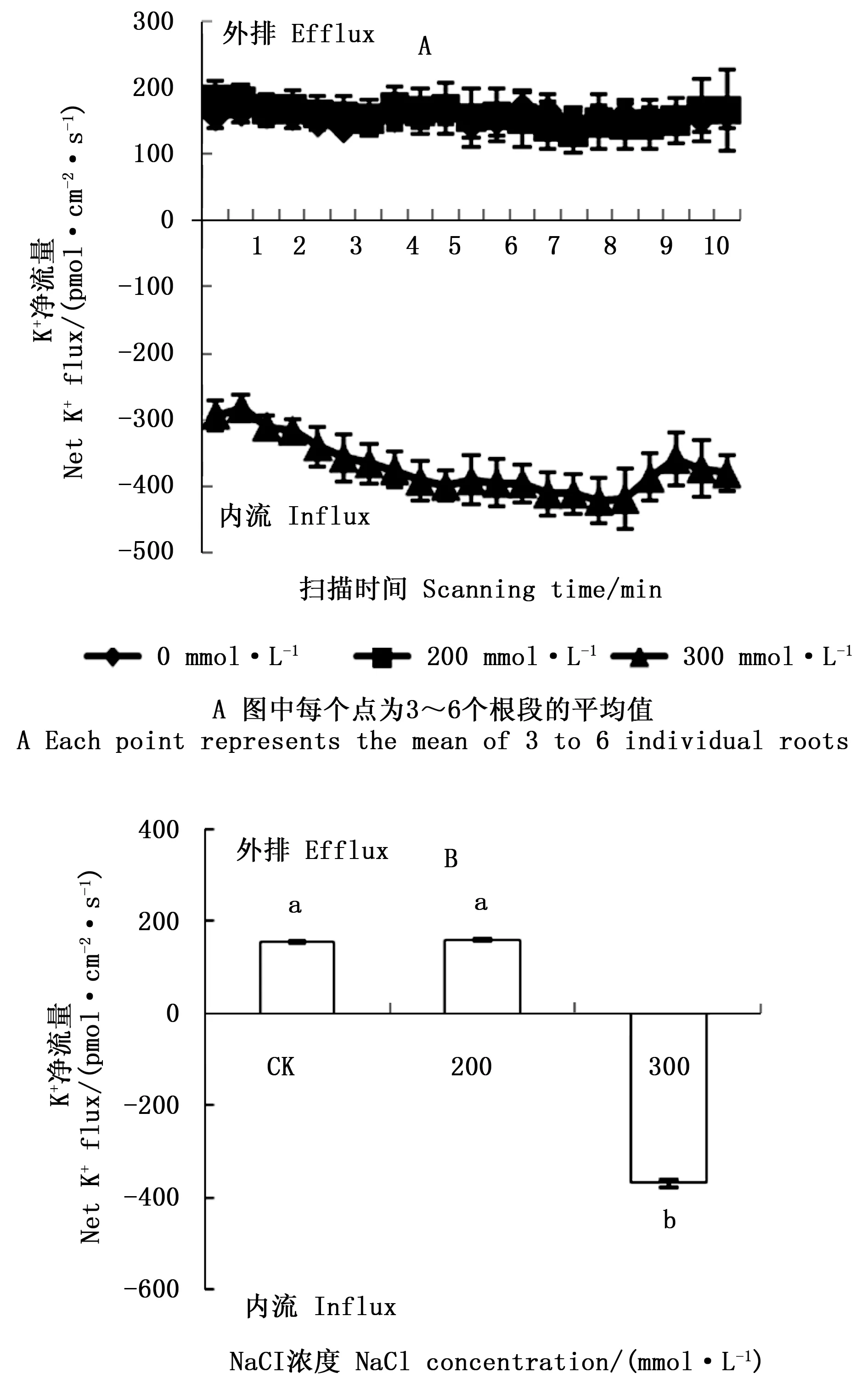
图4 NaCl胁迫对西伯利亚白刺幼苗根系稳态K+流的影响Fig.4 Effect of NaCl stress on steady K+ fluxes at roots of Nitraria sibirica Pall. seedlings
4 讨论
盐离子区隔到不同组织或细胞中的能力是植物耐盐的关键机制,同时也是维持细胞质中低浓度有毒离子和体内离子动态平衡的主要途径之一[19-20]。本研究中,盐胁迫显著提高了西伯利亚白刺根、茎、叶中的Na+含量,根系中的Na+含量增加比例最大,叶片中的Na+增加量最大,且叶片中的Na+含量显著高于根中的,说明根系作为最早感受NaCl胁迫的位点,将大量吸收的Na+运输到叶片中,这与盐生植物盐地碱蓬(Suaedasalsa(L.) Pall.)[21]和唐古特白刺(NitrariatangutorumBobr.)[22]等的研究结果一致。这一方面降低了Na+对根系的伤害作用,保证了植物对其他营养元素的吸收作用;另一方面,Na+作为渗透调节物质,在叶片中积累,增大了地上部和地下部的渗透势差,促进植物对水分吸收,从而稀释体内的盐离子,降低盐分过量积累对植物造成的伤害;然而,Na+在叶片中的大量积累,叶片并未出现盐害的症状,因此,推测可能与Na+区隔化到液泡中有关,这可能是稀盐盐生植物西伯利亚白刺适应盐胁迫的一个重要途径。
根系对K+的保有能力也是植物耐盐的重要方面。K+作为植物体内质量分数最多的阳离子,不仅是植物生长发育过程中所必需的大量元素,同时在盐胁迫下调控离子平衡、渗透调节、维持细胞膨压及蛋白质合成等方面具有重要作用[23]。盐胁迫下,盐生植物对Na+吸收增加,而在适度的盐浓度下会增加对K+的吸收[24]。Carden等[25]发现,耐盐性大麦品种比盐敏感型品种能更好的维持根细胞质中的K+含量。本研究中,随着NaCl浓度的升高,西伯利亚白刺根、茎、叶中的K+含量保持平稳或升高,特别是根中的K+含量显著增加。K+通过高亲和性K+吸收系统和K+通道进入植物体内,根中的K+含量增加,说明盐胁迫下根系细胞膜上的K+转运蛋白未受到影响或盐胁迫诱导其表达上调来加强对K+的选择性吸收,从而在一定范围内维持根部离子的相对平衡,降低Na+的伤害作用,提高植物的耐盐性。
盐胁迫条件下,植物维持体内高的K+/Na+是植物耐盐性的决定性因素[26-27]。植物可以通过增加Na+的外排或区隔化,减少K+的外流来有效维持细胞质中K+/Na+的平衡[5, 28]。本研究中,NaCl胁迫下,根中的K+/Na+显著下降,200、300 mmol·L-1NaCl 胁迫下,根中的K+/Na+无显著变化。扫描离子选择微电极技术结果显示,Na+净流量在200、300 mmol·L-1NaCl 胁迫下显著高于对照,且这2个胁迫浓度的差异显著。K+流速研究发现,200 mmol·L-1NaCl胁迫下,西伯利亚白刺根系K+净流量未受影响,300 mmol·L-1NaCl胁迫下K+流变为显著的内流,这与生化检测根系中K+含量增加基本一致,说明短期NaCl胁迫下,西伯利亚白刺根系加强了对Na+外排和K+内流能力。在小麦[8, 29]的研究中也发现相似的结果,耐盐性强的品种均为K+外流减少或变为内流,造成这一现象的原因可能是离子转运蛋白表达的上调,或是离子通道被激活,或是Na+大量积累破坏了细胞膜结构造成的。Na+外排的增加可能是由于盐胁迫诱导质膜Na+/H+逆向转运蛋白的合成,从而将Na+从细胞质中排出。植物中Na+的外排、Na+的长距离运输、细胞中K+的平衡由质膜Na+/H+逆向转运蛋白(SOS1)调控[18],质膜H+-ATPase水解ATP建立的H+跨膜电化学势为Na+的外排提供能量。在胡杨根系K+/Na+平衡调控机制的研究中发现,胡杨质膜H+-ATPase驱动的Na+/H+逆向转运蛋白PeNhaD1和PeSOS1负责盐胁迫下胡杨细胞的Na+外排[6]。Ma等[30]对霸王(Zygophyllumxanthoxylon(Bunge) Maxim.)研究表明,质膜逆向转运蛋白(ZxSOS1)在调控霸王体内Na+、K+转运和空间分配上起重要作用。另外,盐胁迫能显著提高植物细胞膜和液泡膜质子泵的活性,质子泵不仅能为Na+的跨膜外排提供能量,还能重新使细胞膜电位极化,从而阻止高盐胁迫下Na+通过非选择性阳离子通道(NSCCs)进入细胞[31]。因此,质子泵活性与植物耐盐性具有非常密切的关系,笔者下一步将对长期NaCl胁迫下西伯利亚白刺体内离子的分配及其离子转运的驱动力(质子泵活性)做进一步研究,以期深入了解西比利亚白刺离子平衡的机制。
5 结论
西伯利亚白刺为稀盐盐生植物,具有较强的盐适应性,综合本研究结果认为,NaCl胁迫下,西伯利亚白刺幼苗各器官中的Na+、K+含量保持平稳或上升,并将大量的Na+区隔化到叶片中;同时,西伯利亚白刺通过加强根对Na+的外排和K+的内流,从而维持根中K+/Na+的相对稳定,保证盐胁迫下西伯利亚白刺植株体内正常的生理生化活动,这是西伯利亚白刺对盐胁迫具有适应性的原因。
[1] Greenway H, Munns R. Mechanisms of salt tolerance in nonhalophytes[J]. Annual Review of Plant Physiology, 1980, 31(1): 149-190.
[2] Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annu Rev Plant Biol , 2008, 59: 651-681.
[3] Zhu J K. Plant salt tolerance[J]. Trends in Plant Science, 2001, 6(2): 66-71.
[4] Wang R G, Chen S L, Zhou X Y,etal. Ionic homeostasis and reactive oxygen species control in leaves and xylem sap of two poplars subjected to NaCl stress[J]. Tree Physiology, 2008, 28(6): 947-957.
[5] Shabala S, Cuin T A. Potassium transport and plant salt tolerance[J]. Physiologia Plantarum, 2008, 133(4): 651-669.
[6] Sun J, Chen S L, Dai S X,etal. Ion flux profiles and plant ion homeostasis control under salt stress[J]. Plant Signaling & Behavior, 2009, 4(4): 261-264.
[7] Chen Z H, Pottosin I I, Cuin T A,etal. Root plasma membrane transporters controlling K+/Na+homeostasis in salt-stressed barley[J]. Plant Physiology, 2007, 145(4): 1714-1725.
[8] Cuin T A, Betts S A, Chalmandrier R,etal. A root's ability to retain K+correlates with salt tolerance in wheat[J]. Journal of Experimental Botany, 2008, 59(10): 2697-2706.
[9] Sun J, Chen S L, Dai S X,etal. NaCl-induced alternations of cellular and tissue ion fluxes in roots of salt-resistant and salt-sensitive poplar species[J]. Plant Physiology, 2009, 149(2): 1141-1153.
[10] 中科院“中国植物志”编辑委员会. 中国植物志[M]. 北京: 科学出版社, 2013, 43: 120-121.
[11] 成铁龙, 李焕勇, 武海雯, 等. 盐胁迫下4种耐盐植物渗透调节物质积累的比较[J]. 林业科学研究, 2015, 28(6): 826-832.
[12] 陈志强, 李庆贱, 时瑞亭, 等. 苏打盐碱胁迫对西伯利亚白刺光合和生长的影响[J]. 北京林业大学学报, 2011, 33(3): 31-37.
[13] 萨日娜, 陈贵林. 外源亚精胺对盐胁迫下白刺幼苗叶片抗氧化酶系统的影响[J].西北植物学报,2013,33(2):352-356.
[14] 张 丽. 3种白刺对盐胁迫的响应及耐盐机理研究[D]. 北京: 中国林业科学研究院, 2010.
[15] 杨 升, 张华新, 刘 涛. 盐胁迫对16种幼苗渗透调节物质的影响[J]. 林业科学研究, 2012, 25(3): 269-277.
[16] 刘正祥, 张华新, 杨秀艳, 等. NaCl 胁迫下沙枣幼苗生长和阳离子吸收、运输与分配特性[J]. 生态学报, 2014, 34(2): 326-336.
[17] 刘正祥. 沙枣对氯化钠和硫酸钠胁迫差异性响应的生理机制[D]. 北京: 中国林业科学研究所院, 2013.
[18] 孙 健. 胡杨响应盐胁迫与离子平衡调控信号网络研究[D]. 北京: 北京林业大学, 2011.
[19] Yang S H, Ji J, Wang G. Effects of salt stress on plants and the mechanism of salt tolerance[J]. World Science-Technology Rearch & Development, 2006, 28(4): 70-76.
[20] Peng Z, He S F, Sun J L,etal. Na+compartmentalization related to salinity stress tolerance in upland cotton (Gossypiumhirsutum) seedlings[J]. Scientific Reports, 2016, 6: 34548-34562.
[21] 张海燕. 盐胁迫下盐地碱蓬体内无机离子含量分布特点的研究[J]. 西北植物学报, 2002, 22(1): 129-135.
[22] 杨秀艳, 张华新, 张 丽, 等. NaCl 胁迫对唐古特白刺幼苗生长及离子吸收、运输与分配的影响[J]. 林业科学, 2013, 49(9): 165-171.
[23] 韩志平, 郭世荣, 郑瑞娜, 等. 盐胁迫对小型西瓜幼苗体内离子分布的影响[J]. 植物营养与肥料学报, 2013, 19(4): 908-917.
[24] 杨成龙, 段瑞军, 李瑞梅, 等. 盐生植物海马齿耐盐的生理特性[J]. 生态学报, 2010, 30(17): 4617-4627.
[25] Carden D E, Walker D J, Flowers T J,etal. Single-cell measurements of the contributions of cytosolic Na+and K+to salt tolerance[J]. Plant Physiology, 2003, 131(2): 676-683.
[26] Zhang J L, Shi H. Physiological and molecular mechanisms of plant salt tolerance[J]. Photosynthesis Research, 2013, 115(1): 1-22.
[27] 杨 升, 张华新, 刘 涛, 等. NaCl胁迫下沙枣幼苗的离子代谢特性[J]. 林业科学研究, 2016, 29(1): 140-146.
[28] Feki K, Quintero F J, Khoudi H,etal. A constitutively active form of a durum wheat Na+/H+antiporter SOS1 confers high salt tolerance to transgenic Arabidopsis[J]. Plant Cell Reports, 2014, 33(2): 277-288.
[29] 王晓冬, 王 成, 马智宏, 等. 短期 NaCl 胁迫对不同小麦品种幼苗K+吸收和 Na+、K+积累的影响[J]. 生态学报, 2011, 31(10): 2822-2830.
[30] Ma Q, Li Y X, Yuan H J,etal. ZxSOS1 is essential for long-distance transport and spatial distribution of Na+and K+in the xerophyteZygophyllumxanthoxylum[J]. Plant and Soil, 2014, 374(1-2): 661-676.
[31] Maathuis F J. The role of monovalent cation transporters in plant responses to salinity[J]. Journal of Experimental Botany, 2006, 57(5): 1137-1147.
EffectsofShort-timeSaltStressonDistributionandBalanceofNa+andK+inNitrariasibiricaPall.Seedlings
TANGXiao-qian,LIHuan-yong,YANGXiu-yan,LIUZheng-xiang,ZHANGHua-xin
(Research Center of Saline and Alkali Land of State Forestry Administration,Beijing 100091,China;)
ObjectiveTo explore the salt adaptation mechanism ofNitrariasibiricaPall.MethodThe net fluxes of Na+and K+from apex root (using scanning ion-selective electrode technique) and the contents of Na+and K+in different organs (using ICP-OES Spectrpmeter) were investigated inN.sibiricaseedlings under the stress of different NaCl concentration (0, 200 and 300 mmol·L-1) for 24 hours.Result(1) Short-term NaCl stress significantly increased Na+content in roots, stems, and leaves ofN.sibiricaseedlings, and the Na+content in leaves was three times that in roots; the content of K+in roots, stems, and leaves ofN.sibiricaseedlings remained stable or increased. (2) The K+/Na+ration in roots, stems, and leaves ofN.sibiricaseedlings decreased under salt stress. The K+/Na+ration in roots showed no significant difference under 200 or 300 mmol · L-1NaCl stress. (3) The results of ion fiux showed that NaCl stress significantly increased the Na+efflux in roots. The net K+fluxes of control and 200 mmol·L-1NaCl stress were 156 pmol·cm-2·s-1and 159 pmol·cm-2·s-1respectively, and no significant difference was observed. 300 mmol · L-1NaCl stress significantly increased the influx of K+, the net K+flux was -370 pmol·cm-2·s-1.ConclusionIn conclusion,N.sibiricacan efficiently sequestrate Na+into leaves, as well as strengthen the roots Na+efflux and K+influx ability, and thus maintains the relative balance of K+/Na+in plant root, so as to adapt to the salty environment.
NitrariasibiricaPall.; NaCl stress; ion fluxes; K+/Na+homeostasis
10.13275/j.cnki.lykxyj.2017.06.020
2017-03-09
“十二·五”国家科技支撑计划课题(2015BAD07B0102)
唐晓倩(1986—),女,博士研究生.研究方向:耐盐碱植物育种.E-mial:txqcaf@163.com
* 通讯作者:研究员,博士生导师,从事耐盐碱植物遗传育种方面的研究.
S722.3
A
1001-1498(2017)06-1022-06
徐玉秀)

