作用于烟碱乙酰胆碱受体的新颖杀虫剂Flupyrimin
姜 静,李宇森,马镜博,罗梁锋,张俊峰,吕军民,曹张军 编译
(1.东华大学,上海 210620;2.澄城中学,陕西省澄城县 715200;3.陕西省澄城县农技中心,陕西省澄城县715200)
作用于烟碱乙酰胆碱受体的新颖杀虫剂Flupyrimin
姜 静1,李宇森2,马镜博2,罗梁锋3,张俊峰3,吕军民3,曹张军1编译
(1.东华大学,上海 210620;2.澄城中学,陕西省澄城县 715200;3.陕西省澄城县农技中心,陕西省澄城县715200)
烟碱乙酰胆碱受体(nAChR)是配体门控氯离子通道,快速地传递神经的兴奋性,是杀虫剂的一个重要作用靶标。烟碱型杀虫剂和相关相似配体能够与软体动物烟碱乙酰胆碱结合蛋白(AChBP)结合,此蛋白是烟碱乙酰胆碱受体胞外配体结合域的适合替代物,可用于用高分辨率的化学/结构生物学方法来弄明白药物结合域的识别特性。随后用与烟碱配体结合的位点的三维结构成功设计出具有独特药效团的新颖杀虫化合物。
在数个世纪中,烟草提取物中的烟碱(NIC)或假木贼碱(图1)是最易得到的防治刺吸式害虫的药剂,即第一代烟碱类杀虫剂。另一方面,对不寻常结构化合物的搜寻和已有化合物结构的优化成功地发现了新烟碱类杀虫剂(第二代),代表物有吡虫啉(IMI)、啶虫脒(ACE)、噻虫胺(CLO)和呋虫胺。新烟碱在全球被广泛使用,占全球杀虫剂市场的 1/4以上。目前,新颖烟碱化合物氟吡呋喃酮[flupyradifurone(FPF)]、三氟苯嘧啶[triflumezopyrim (TFM)]和dicloromezotiaz正在引入市场(图1),本文把它们归为新一代。近年,在亚洲南部、东南部和东部国家,抗新烟碱类杀虫剂害虫对水稻造成严重危害。此外,对非靶标和/或有益生物的安全性是开发农化产品的一个重要要求。在此境况下,Meiji Seika Pharma发现了新颖化学类型杀虫剂flupyrimin [FLP,N[(E)-1-chloro-3-pyriminyl-methyl]pyridine-2(1H)-ylidene]-2,2,2-trifuoroacetamide],此杀虫剂对水稻抗性害虫有杰出的杀虫活性,对授粉昆虫等有益生物有很高的安全性。

图1 和内源性激动剂烟碱竞争性作用于昆虫烟碱乙酰胆碱受体的烟碱杀虫剂的化学结构
本文由3部分组成,介绍了FLP的杀虫特性和对昆虫神经的生理影响;比较了 FLP、其他烟碱杀虫剂分别与昆虫烟碱乙酰胆碱受体结合的相互作用特性;三以FLP相似物的药效团吡啶亚基和三氟乙酰基的构效关系为基础预测了FLP分子识别昆虫烟碱乙酰胆碱受体同源物的情况。
1 生物活性
1.1 FLP和相似物
文中涉及的 FLP(1)和相似物如图2,化合物 3-10、12-17(Tomizawa,M.等,2003;Ohno,I等,2010;Kagabu,S等,2013)和化合物 11,19-21(Ishimitsu,K等,1993;Ishimitsu,K等,1992;Shiokawa,K等,1987)根据文献合成。N-[(E)-1-(6-氯-3-吡啶甲基)哌啶-2(1H)-亚基]-2,2,2-三氟乙酰胺(2)合成过程如下:在冰浴和搅拌条件下,在 1-[(6-氯-3-吡啶)甲基]哌啶-2(1H)亚胺(233 mg,1.00 mmol)的氯仿(15 mL)溶液中缓慢加入三氟乙酸酐(trifluoroacetic anhydrate) (441 mg,2.10 mmol),再加入 N,N-二异丙基乙胺(452 mg,3.50mmol)。在室温搅拌反应液过夜。在反应混合物中加入水(30 mL),用氯仿(15 mL×2)萃取,合并有机层,用 1% HCl、10%Na2CO3、水依次冲洗,干燥。真空除去溶液,用硅胶柱色谱法(己烷∶乙酸乙酯=1∶1)分离得到白色固体化合物 2:37 mg(6%);mp 65~67 ℃;NMR (CDCl3),δH1.80(2H,m),1.85(2H,m),3.06(2H,t,J=6.3 Hz),3.44(2H,t,J=6.3 Hz),4.82(2H,s),7.33(1H,d,J=8.0 Hz),7.75 (1H,dd,J=8.0 Hz,J=2.3 Hz),8.35(1H,d,J=2.3 Hz);δC19.2,22.2,29.5,48.8,51.1,115.5 (q,JC-F=288.8 Hz),124.8,130.2,139.6,149.7,151.7,164.7(d,JC-F=35.9 Hz),172.1;δF-76.1。C13H13ClF3N3O 的ESI-HRMS:计算值(+H+) 320.0777;试验值 320.0774。
N-[(E)-1-(6-氯 -3-吡 啶 甲 基)吡 啶 -2(1H)-亚基]-2-碘乙酰胺(18)合成过程如下:在搅拌条件下,在 1-[(6-氯-3-吡啶)甲基]吡啶-2(1H)亚胺(100 mg,0.45 mmol)的乙腈(10 mL)溶液中加入氯化碘乙酸(102 mg,0.50 mmol)。在室温搅拌反应2 h,加入乙酸乙酯(30 mL)。然后依次用1 N HCl(10 mL×3)和1 N NaOH(10 mL×3)溶液冲洗。干燥有机层,真空蒸发。用硅胶柱色谱法(甲醇∶乙酸乙酯=1∶1)分离得到棕色固体化合物 18:40 mg(23%);mp 116~118 ℃(decom);NMR (CDCl3),δH3.88+4.17(2H,2s),5.46 (2H,s),6.64(1H,t,J=13.5 Hz),7.31+7.33(1H,2d,J=4.3 Hz,J=4.3 Hz),7.58(2H,m),7.81(1H,m),8.25+8.33 (1H,2d,J=8.9 Hz,J=9.1 Hz),8.46(1H,t,J=4.5 Hz);δC47.2,52.7,112.5,121.7,124.6,124.7,130.1,137.6,139.2,140.5,149.4,149.5,151.7。C13H11ClIN3O的ESI-HRMS:计算值(+H+) 387.9713;试验值 387.9716。

图2 2个放射性标记的烟碱杀虫剂[3H]FLP和[3H]IMI和FLP相似物的化学结构(*表示氚的位置)
N-[(E)-1-(6-氯-3-吡啶甲基)吡啶-2(1H)-亚基]-2-苯甲酰胺(22)合成过程如下:化合物22的合成与化合物18的相似,只是氯化碘乙酸换为苯甲酰氯,得到黄色固体化合物 22:35 mg(20%);mp 115~117 ℃;NMR (CDCl3),δH5.53(2H,d,J=4.1 Hz),6.54-6.55(1H,m),7.28-7.30(1H,m),7.38-7.47(3H,重叠 m),7.53-7.63(2H,重叠 m),7.72(1H,m),8.16(2H,d,J=8.3 Hz),8.36 (1H,dd,J=8.3 Hz,J=2.7 Hz),8.45(1H,broad s);δC52.5,111.4,121.8,124.8,128.0,129.3,130.7,131.2,137.7,138.7,138.8,139.7,149.2,151.6,158.9,174.4。C18H14ClIN3O的ESI-HRMS:计算值323.0825;试验值 323.0810。
其他物质都购买或合成。
1.2 杀虫活性
按文献(Kagabu,K等,2013)测定了试验化合物对褐飞虱、白背飞虱、灰飞虱、黑尾叶蝉、棉蚜、温室白粉虱、赤须盲蝽、西花蓟马、小菜蛾、稻负泥虫和家蝇的活性,以及对蜜蜂、欧洲熊蜂和角额壁蜂的急性毒性[8]。
表1为FLP、IMI和其他商业化杀虫剂对不同标靶害虫的活性。FLP对褐飞虱、白背飞虱、小菜蛾、稻负泥虫和家蝇的活性高于 IMI,对灰飞虱、黑尾叶蝉、赤须盲蝽和西花蓟马(叶用或点滴施用)的活性与IMI相当,对棉蚜和温室白粉虱的活性低于IMI和呋虫胺。FLP对白背飞虱的活性高于氟啶虫胺腈,对褐飞虱的活性与氟虫腈相似,对家蝇的活性与氯菊酯相似。对稻负泥虫、西花蓟马和小菜蛾的活性低于呋虫胺、甲氨基阿维菌素和多杀菌素。FLP对其他种群的褐飞虱[2014和2015年从日本鹿儿岛收集(叶用)]的活性是IMI的29和41倍,氟虫腈的5~7倍(表2)。此外,即使喷淋土壤施用,FLP比IMI和氟虫腈稳定,对飞虱有效。对同一褐飞虱种群,FLP的活性是IMI的5或13倍,与氟虫腈的相似。对灰飞虱[从小田原(2001和 2006年)、大分(2013)和茨城(2016),日本]种群,FLP的活性是IMI的2~31倍;对过去几年收集的种群,FLP的活性是氟虫腈的5~22倍,氟虫腈只对2001年在小田原收集的种群有高活性。在生态毒理方面,IMI经口服和/或点滴施用对蜜蜂和欧洲熊蜂有高毒,而FLP对授粉昆虫无害(表3)。FLP对角额壁蜂低毒。
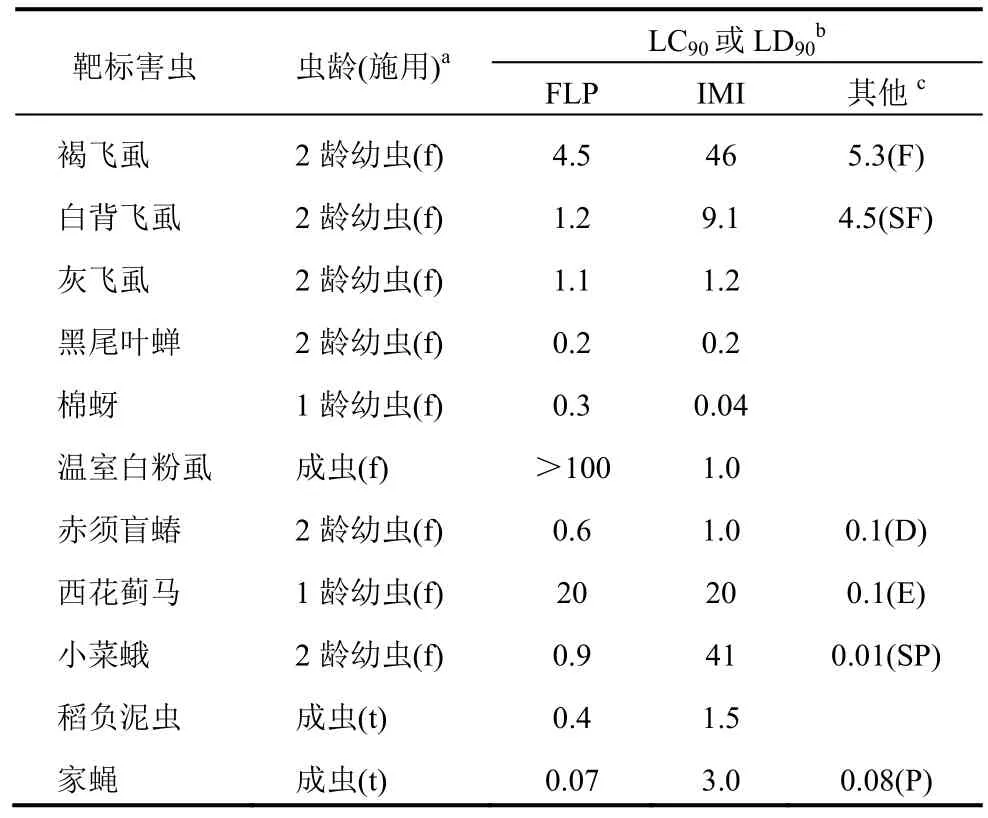
表1 FLP、IMI和其他杀虫剂对不同害虫的杀虫活性

表2 FLP、IMI和氟虫腈对从日本收集的褐飞虱和灰飞虱田间种群的杀虫活性

表3 FLP与IMI对传粉昆虫成虫的急性毒性比较
1.3 电生理作用
从美国蜚蠊雄成虫分离得到腹神经索(从末端腹神经节到第六神经节),按文献方法(Zhao,X等,2003)培养。用全细胞膜片钳技术研究了烟碱或FLP的电生理作用。
在应用10 μM烟碱后激发解离的末端腹神经节的神经元产生内向电流(图3)。相比,10 μM FLP(甚至100 μM (没有列出数据))不会激发产生内向电流,随后用盐溶液冲洗2 min,再用10 μM烟碱处理能激发产生反应。惊奇的是,在用10 μM烟碱处理前用1 nM FLP处理1 min,FLP有很强的阻断活性。此外,即使用盐溶液冲洗6 min,烟碱的激发作用也不会恢复,FLP抑制烟碱诱导产生电流的IC50为0.32 nM(图3)。

图3 ACh和FLP(处理2 s)处理使解离的美洲大蠊末端神经节神经元产生的典型电生理反应(使用全细胞膜片钳技术)
1.4 构-效关系
集中研究了杂环(化合物 1-10)二烯 π电子和卤原子(化合物1和11-20)对化合物对家蝇烟碱乙酰胆碱受体的结合力和对灰飞虱的杀虫活性影响的构-效关系(表4)。环上具有二烯π电子的FLP(1)与烟碱乙酰胆碱受体的结合力(以 IC50表示)大于相应的饱和相似物(2)。相似地,不饱和的噻唑啉(3)或咪唑啉(5)相似物的结合力大于相对应的饱和噻唑烷(4)或咪唑烷(6)。二氢吡啶环上有一个氮原子的化合物,即二氢哒嗪(7)、二氢-1,3-嘧啶(8)、二氢-1,5-嘧啶(9)和二氢吡嗪,其环上电子密度降低,没有活性。N-乙酰基相似物(CH3)(11)的亲和力只有相对应的 N-三氟乙酰基(CF3)FLP(1)的1/240。有趣的是,含有取代基 CHF2、CF2Cl、CCl3、CHCl2、CH2Cl、CH2Br 和CH2I的N-卤乙酰基相似物的亲和力与FLP(1)一样。N-硝基(19)和N-氰基(20)相似物和家蝇的烟碱乙酰胆碱受体的亲和力非常强。对昆虫烟碱乙酰胆碱受体具有高亲合力的化合物(1,12,13,17和19)对灰飞虱有杀虫(以LD90表示)作用,但其他高亲合力的化合物(3,14,15,16,18和20)的杀虫活性低。亲合力低的化合物(2,4-11)如预测一样没有杀虫活性。有趣的是化合物19有杀虫活性,但化合物20活性很低。

表4 FLP相似物替代[3H]FLP(1 nM)与家蝇nAChR结合的潜力和对灰飞虱的杀虫活性
2 与靶标的结合
按照Tomizawa等人(1996)的方法进行了[3H]FLP或[3H]IMI与野生家蝇大脑烟碱乙酰胆碱受体结合的试验。用杆状病毒系统表达了哺乳动物的α4β2烟碱乙酰胆碱受体。把从Origene Technologies购买的大鼠α4或β2亚基cDNA分别插入XhoI/EcoRI位点或BamHI/XhoI位点的pBacPAK8。根据BacPAK 杆状病毒表达系统(Clontech Laboratories,Mountain View,CA)指导手册进行了Sf21细胞的转染、噬菌斑筛选、重组病毒扩增、感染和收集细胞。单层细胞培养,接种α4和β2重组病毒,感染复数为10。在感染72 h后收集Sf21细胞。按D’Amour和Casida的方法进行受体制备和[3H]NIC结合。用SigmaPlot 13 软件(SYSTAT Software,San Jose,CA)计算IC50(取代50%结合的放射配体的试验化合物浓度)和结合参数[离解常数(KD)、最大结合能力(Bmax)、希尔系数(nH)]。
按文献方法(Tomizawa,M.等,2008;Ohno,I.等,2009;Tomizawa,M.等,2011)进行了FLP与处于与IMI结合状态的海蜗牛AChBP结构(PDB 3C79)对接和分子动态(MD)模拟研究。这涉及受体中的一个水分子(已知在IMI的吡啶氮和loop E氨基酸间形成桥连氢键)。FLP与一对亚基链[(+)-和(-) -face subunit chains]对接。然后,对AChBP-FLP进行MD模拟,来充分开发活性位点区域的构象空间。由于这对[(+)-and(-)-chains]链模型的结构局限性,对结合骨架有一定的限制。随后,根据Cerón-Carraco等人的方法,选择MD模拟的样本架构进行详细的密度泛函理论(DFT)计算。以高DFT水平[M06-2X/CCPVTZ(-F)+均衡校正]单独计算了相关氨基酸和一个水分子与FLP以在4Å距离范围内对接的相互作用能量。
2.1 结合特点
比较了[3H]FLP和[3H]IMI分别与家蝇受体结合的饱和等温线(图4)。发现[3H]FLP有多个结合点,即KD有0.27、6.5 nM,Bmax有170、210 fmol/mg蛋白,nH0.66。相比,发现[3H]IMI只有一个结合点,即KD2.2 nM,Bmax220 fmol/mg蛋白,nH0.98。

图4 [3H]FLP(左)和[3H]IMI(右)与野生家蝇大脑nAChRs特异性结合的饱和等温线和Scatchard图
比较了不同烟碱制剂与[3H]FLP受体和[3H]IMI受体的作用。表5中所有制剂的IC50表明2个生测系统具有基本相同的相互关系。nHs为结合特性指数,具有不同N-酰基基团(1、11、21和22)的FLP相似物替代[3H]FLP的nHs与替代[3H]IMI的一致,即nH约为 1.0,表示没有协同作用。然而,其他制剂(NIC、IMI、ACE、CLO 和 FPF)替代[3H]FLP的nH为 0.53~0.78,表明具有拮抗作用,而它们替代[3H]IMI的nH约1.0。值得注意的是,TFM在2个生测系统中都表现为拮抗作用(nH0.64~0.65)。

表5 不同烟碱剂代替[3H]FLP(1 nM)或[3H]IMI(5 nM)与家蝇nAChRs结合的活性
进行了同时双放射性配体结合试验(表6),试验中进行了2个放射性配体与同一家蝇大脑受体溶液同时结合或直接竞争研究。此试验能证明2个放射性配体是结合于不同位点(或受体亚型)还是同一区域(或紧密偶联位点)。在饱和试验的基础上可知(图4),1或20 nM [3H]FLP分别为或接近高亲和点(KD0.27 nM)和低亲和点(KD6.5 nM)的饱和度。20 nM[3H]IMI是KD(2.2 nM)的9.1倍。发现[3H]FLP(1 nM)和[3H]IMI(20 nM)的结合率分别为79.4%和20.6%,理论值为 100%。二者同时结合的总结合率只有44.6%。因此,一个放射性配体对另一个放射性配体的结合有明显的干扰作用。而[3H]FLP和[3H]IMI(都为20 nM)的结合率分别为理论值(100%)的88.6%和11.4%。有趣的是,在上述条件下(都为20 nM),同时使用2个放射性配体,结合率为87.5%,即2个配体大部分结合于不同的位点。因此,高亲和[3H]FLP结合点(1 nM就达到饱和状态)与[3H]IMI的重叠,2个物质在同一结合位置竞争性结合。相比,低亲和[3H]FLP结合点(20 nM时饱和)是与上述提及的不同的独立受体。此外,α-金环蛇毒素替代与家蝇受体结合的[3H]FLP的IC50为860 nM,FLP代替结合的α-金环蛇毒的 IC50为 300 nM,表明FLP对 α-金环蛇毒受体不敏感。
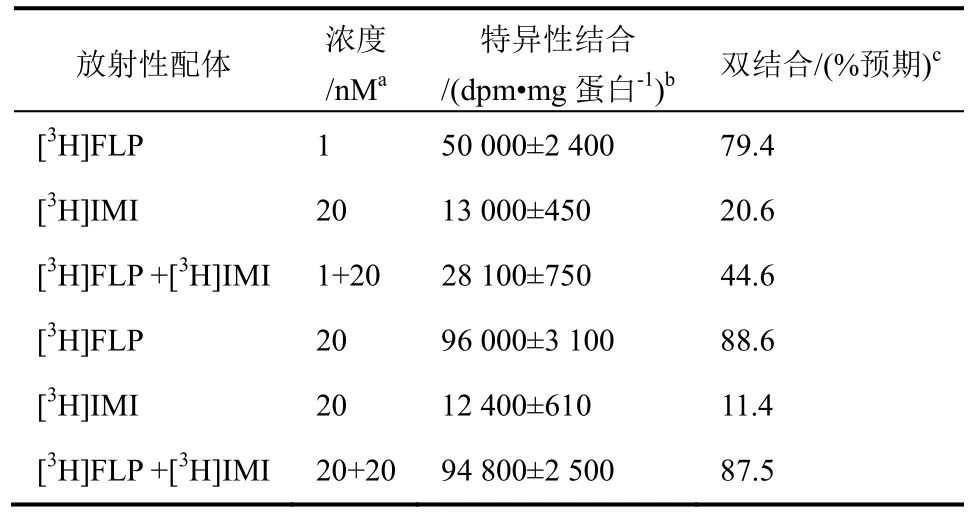
表6 同时双放射性配体与家蝇nAChRs结合
显然,[3H]FLP(100 nM)与重组的大鼠α4β2烟碱乙酰胆碱受体没有特异性结合(2.4%),而[3H]NIC(5 nM)特异性结合(97%)(表7)。此外FLP与2个代表性烟碱生物碱(-)-NIC和(±)-EPI(分别为2.8、0.09 nM)相比,与α4β2烟碱乙酰胆碱受体([3H]NIC为报道分子测定)的结合亲合力非常低(1 100 nM) (表8)。FLP经口和真皮施用对大鼠无高毒毒性(表8注脚)。

表7 放射性配体与重组大鼠α4β2 nAChR的结合
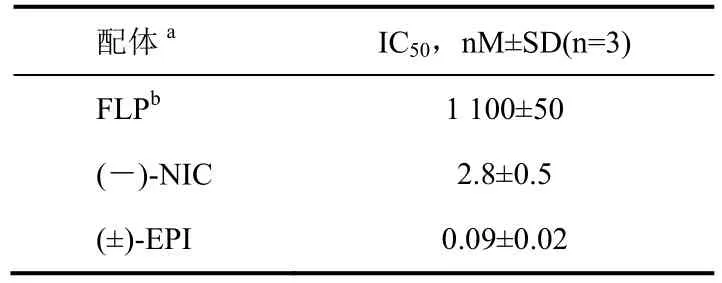
表8 烟碱配体替代[3H]NIC(5 nM)与重组大鼠α4β2 nAChR的结合活性
2.2 结合点相互作用
在以上构-效关系研究和先前的化学和结构生物学研究的基础上,通过计算机模拟建立FLP与海蜗牛AChBP(是昆虫烟碱乙酰胆碱受体胞外配体结合域的适宜结构代替物)结合位点相互作用关系(图5)。FLP的氯吡啶氯接触loop E A107和M116,在氯吡啶氮、I106和I118间形成水介导的氢键。三氟乙酰的三个氟原子通过氢键或疏水性相互作用与C226-227、S189、Y55、Q57和I118接触。=NC(O)氧接触Y55 OH、或S189/C190骨架的NH。FLP的吡啶亚基上的2个π-电子系统和W147和Y118形成π-堆积。在较高DFT水平计算了FLP和海蜗牛AChBP中形成 FLP结合口袋的每个相关氨基酸间的相互作用能量(表9)。Loop B W174和 loop C C190-191和FLP有很强的相互作用。Loop E I118、loop C Y188和水也有重要的相互作用。Loop D Q57或Y55也有一定的贡献,而loop C S189或loop E M116似有相互作用。

图5 FLP与海蜗牛AChBP(昆虫nAChR配体结合域的适宜替代结构)结合位点相互作用的结构模型

表9 FLP与形成结合腔的主要氨基酸的相互作用能量
3 讨 论
与靶标具有非典型的相互作用而不会被解毒的新颖化学类型烟碱杀虫剂的开发可能赋予此类物质独特的生物学特性,如对抗新烟碱类杀虫剂的害虫具有高活性,对传粉媒介安全。
本文介绍了Meiji Seika Pharma开发的一个新药剂 FLP,此产品具有优异的杀虫活性,特别是对水稻害虫,包括对IMI不敏感的害虫种群。重要的水稻害虫褐飞虱和和灰飞虱由于细胞色素 P450(s)的解毒能力增加而对IMI和其他新烟碱杀虫剂产生抗性。令人惊奇的是,R81T突变(桃蚜β1 loop D上)的抗IMI的桃蚜(高抗FRC品系)仍保留有一个高亲和性[3H]IMI结合点(KD4 nM和Bmax2000 fmol/mg蛋白)。要强调的是在急性毒性评估中 FLP比 IMI和其他新烟碱杀虫剂对蜜蜂的毒性低。此外,FLP对哺乳动物安全,部分原因是和脊椎动物大脑中表达的主要烟碱乙酰胆碱受体亚型即重组大鼠 α4β2受体亲和性低。
就结合特性而言,[3H]FLP与多个受体亚型结合。有趣的是其中之一被认为是[3H]IMI敏感亚型。其他的[3H]FLP位点可能是IMI不敏感亚型。因此,FLP可能作用于不同的昆虫烟碱乙酰胆碱受体亚型。NIC、3个新烟碱杀虫剂(IMI、ACE和CLO),和2个新杀虫剂FPF和TFM以不同于含有N-酰基亚胺药效团的FLP相似物的方式作用于高亲和性的[3H]FLP位点。相比,这6个烟碱药剂和FLP相似物竞争性地作用于[3H]IMI位点。这些发现表明接纳FLP相似物的N-酰基亚胺药效团的结合亚位点或合适的位置与新烟碱N-硝基/氰亚胺基团的不一样,但是,整个 N-酰基结合位置的一小部分为与 N-硝基/氰基顶端相互作用点。FLP大概与新烟碱杀虫剂共用同一腔(或紧密偶联的亚位点)。另一方面,TFM可能以不同于新烟碱或FLP的方式与家蝇烟碱乙酰胆碱受体相互作用,虽然TFM以竞争的方式与家蝇[3H]IMI位点结合。FLP对草地贪夜蛾的神经元有激动作用,而TFM为大蠊的烟碱作用拮抗剂。本文研究中,FLP也呈现强的拮抗作用。然而,CLO对大蠊的神经元有兴奋作用。毫无疑问FLP具有不同于FPF和新烟碱的生理作用。
IMI和FLP都含有6-氯吡啶-3-基甲基基团,然而它们的药效系统大不同。新烟碱在胍或脒和硝基或氰基取代基间共面,因此产生电子共轭现象,使部分负电荷朝末端氧或氮原子流动。带负电荷的氧或氮主要与loop C氨基酸形成氢键(图6)。因此,共轭电子系统为新烟碱主要的药效团。事实上,硝基/氰亚胺新烟碱与由昆虫α (家蝇的α2或果蝇α2)和哺乳动物 β(大鼠 β2)亚基组成的杂交烟碱乙酰胆碱受体(s)有高亲和性。一旦杂交受体(果蝇α2/鸡β2)的果蝇α2亚基被鸡α4亚基替代,此受体对IMI的反应就完全没有了。假想杂交受体由昆虫α与脊椎动物β2亚基组成,昆虫loop D序列被插入其中,适当地增加了IMI-激发的兴奋性反应(EC50s比野生型高几倍)。形成鲜明对比的是,FLP三氟乙酰基的氟原子与loop C、D和E氨基酸经氢键(s)和/或范德瓦尔斯接触有不同的相互作用。因此,长的延伸的FLP三氟乙酰基药效团被由loops C、D和E组成的界面腔锚定。相对地,相似物N-乙酰氨基(例如具有吡嗪环的化合物21)型药效团位于上述提到的位置。此外,杂环上的二烯π-电子和loop B和C的芳香氨基酸形成π-堆积相互作用,赋予非常稳定的能量。因此以上2个独特的FLP药效团对结合表面的分子识别具有独特的和决定性作用。此外,在电生理学和放射性配体结合的基础上对 FLP相似物构-效关系的研究能够充分地解释FLP的杀虫作用机制。

图6 FLP C(O)CF3药效团与海蜗牛AChBP loops C、D和E氨基酸(上左)独特结合相互作用的图示[与IMI NO2顶端氧与loop C氨基酸(PDB 3C79)(上右)相互作用形成鲜明对比]
总之,FLP为Meiji Seika Pharma发现的新化学类型烟碱杀虫剂,具有显著的生物学特性,对抗新烟碱类杀虫剂的水稻害虫具有优异的防效,对授粉媒介高度安全。有趣的是,FLP以不同于其他烟碱杀虫剂的识别方式作用于昆虫烟碱乙酰胆碱受体,为拮抗剂。
10.16201/j.cnki.cn31-1827/tq.2017.06.04
TQ453
A
1009-6485(2017)06-0016-07
姜静(1993—),女,甘肃定西人,在读研究生。研究方向:药物筛选新靶点确定及实践。E-mail: JannicaJiang@126.com。
2017-12-01。

