颈前路椎间盘切除和融合术对慢性椎间盘源性颈痛的疗效
吴 兵 ,彭宝淦 ,何 鑫
慢性颈痛是一种不愉快的感觉和情绪体验,对个体的行为和健康可能产生负面效果,并对其家庭和职业生活产生重大影响。慢性颈痛十分常见,约66.6%的成年人在其一生中的某时间段会受慢性颈痛的影响[1]。大多数患者主诉长期存在颈肩部疼痛,其影像学表现为除椎间盘信号改变外,未见有明显的椎间盘突出或者神经根及脊髓的压迫,这种症状称之为椎间盘源性颈痛[2]。有关临床试验已经表明,颈前路椎间盘切除和融合术(anterior cervical discectomy and fusion,ACDF)可有效减轻颈椎病患者的颈痛症状[3]。然而,迄今为止慢性椎间盘源性颈痛的发病机制仍不明确,也尚未有前瞻性的队列研究观察ACDF对慢性椎间盘源性颈痛的治疗效果。因此,本研究分析ACDF治疗慢性椎间盘源性颈痛的疗效并在此基础上进一步探索慢性椎间盘源性颈痛的发病机制,为慢性椎间盘源性颈痛的治疗提供参考依据。
1 对象与方法
1.1 对象 选取2014-03至2016-03武警总医院脊柱外科及上海长征医院脊柱外科收治的87例慢性椎间盘源性颈痛患者,对其跟踪随访1年。87例患者中,51例接受了ACDF手术治疗,其余36例拒绝手术而选择保守治疗。其中有82例(94.2%)完成了为期一年的跟踪调查,包括手术治疗49例(手术组),保守治疗33例(保守组)。
1.2 纳入与排除标准 纳入标准:(1)年龄在18~65岁;(2)病程>6个月,且经≥3个月正规保守治疗无效;(3)核磁共振(magnetic resonance imaging,MRI)检查显示明确颈椎间盘退变,不伴神经根和(或)脊髓压迫;(4)颈痛,伴或不伴其他颈椎症状如头痛、头晕、耳鸣、视力障碍;(5)计划行ACDF手术治疗或保守治疗;(6)手术前颈椎间盘造影成功复制相应部位疼痛;(7)签署本研究书面知情同意书。排除标准:(1)有颈部外伤史或手术史;(2)患有严重的心血管疾病,认知功能障碍及任何其他严重的系统性疾病;(3)有明显的先天性或发育性颈椎异常;(4)由于个人原因不能依从该研究。
1.3 方法 首先,收集两组患者的一般资料包括年龄、性别、患者视觉模拟评分(visual analogue scale,VAS),颈椎功能障碍指数(neck disability index,NDI)及退变椎间盘节段。手术组确认符合手术指征后,对其行ACDF治疗,术后采用标准护理进行康复治疗。保守治疗包括口服非甾体类抗炎药,物理治疗,间歇性颈托治疗和休息。其次,采用VAS、NDI和抑郁自评量表(self-rating depression scale,SDS)评估比较两组患者颈痛变化。
1.4 观察指标 观察两组的VAS评分、NDI评分和SDS评分。除此之外,根据患者对手术或者保守治疗的主观评价,本研究将颈痛的治疗效果分为无颈痛(症状基本消失)、明显改善(大部分症状消失)、轻微改善(症状减轻)和无改善(症状没有减轻)。最后,本研究在治疗后的1、3、6和12个月分别对这些指标进行随访评估,并在此基础上进一步探索慢性椎间盘源性颈痛的发病机制。
1.5 统计学处理 应用SPSS 23.0软件进行统计分析,计量资料以表示,组内比较采用配对t检验;计数资料采用频数和率表示,组间比较采用Person χ2检验。随时间变化的VAS和NDI评分比较采用重复测量方差分析,组间两两比较采用LSD-t 检验。两组等级资料比较采用Mann-Whitney秩和检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 一般资料 所选患者中,男31例,女51例,年龄22~64岁,平均(44.7±9.5)岁。两组在年龄、性别、术前VAS评分、术前NDI评分及退变椎间盘节段方面比较,差异无统计学意义,具有可比性,见表1。
2.2 两组治疗前后VAS评分和NDI评分比较 在基线测量时,两组颈部疼痛的平均强度均为严重(VAS>54 mm),且两组VAS评分、NDI值在治疗前差异无统计学意义。对不同时间点两组的VAS评分和NDI值进行方差齐性检验,均符合方差齐性。重复测量方差分析显示:时间与处理因素之间的交互作用具有统计学意义(F=258.008,P<0.001;F=185.762,P<0.001)。治疗后各时间点两组的VAS评分和NDI值较治疗期前均显著降低(F=648.005,P<0.001;F=731.421,P<0.001),经 LSD-t检验提示,手术组治疗后各个时间点VAS评分和NDI值较对照组降低更为明显(P<0.001,表2)。
2.3 两组治疗前后抑郁测量自评变化 治疗前两组抑郁自评结果显示,长期颈痛影响其精神状态,使得部分患者产生不同程度抑郁。手术组治疗后1个月,抑郁情况就得到改善,其余患者在随后随访中渐渐恢复,只有少数未能改善;而保守组在治疗后1个月,抑郁情况几乎无改善,且在治疗后12个月,只有少数得到改善,见图1。
2.4 两组治疗后疗效主观评价 根据患者在治疗后12个月时随访的主观评分,将治疗效果分为无颈痛、明显改善、轻微改善和无改善四个等级。结果发现手术组效果好于保守组,且差异具有统计学意义(P<0.05,表3)。
表1 手术组和保守组慢性椎间盘源性颈痛患者一般资料的比较

表1 手术组和保守组慢性椎间盘源性颈痛患者一般资料的比较
注:手术组,行颈前路椎间盘切除和融合术;保守组,未经手术保守治疗;VAS,视觉模拟量表;NDI,颈椎功能障碍指数
组别 例数 性别 年龄 VAS评分 NDI评分 病变阶段男女C3/4 C4/5 C5/6 C6/7手术组 49 18(36.7) 31(63.3) 43.4±9.4 69.9±6.0 25.9±4.3 7(10.4) 19(28.4) 36(53.7) 5 ( 7.5)保守组 33 13(39.4) 20(60.6) 46.0±9.6 68.0±4.4 25.0±4.1 3( 6.0) 9(19.1) 29(83.0) 6 (12.8)χ2/t值 0.059 1.572 1.507 0.955 0.016 P值 0.808 0.120 0.136 0.342 0.900
表2 两组慢性椎间盘源性颈痛患者治疗前后各时间点的VAS、NDI评分比较
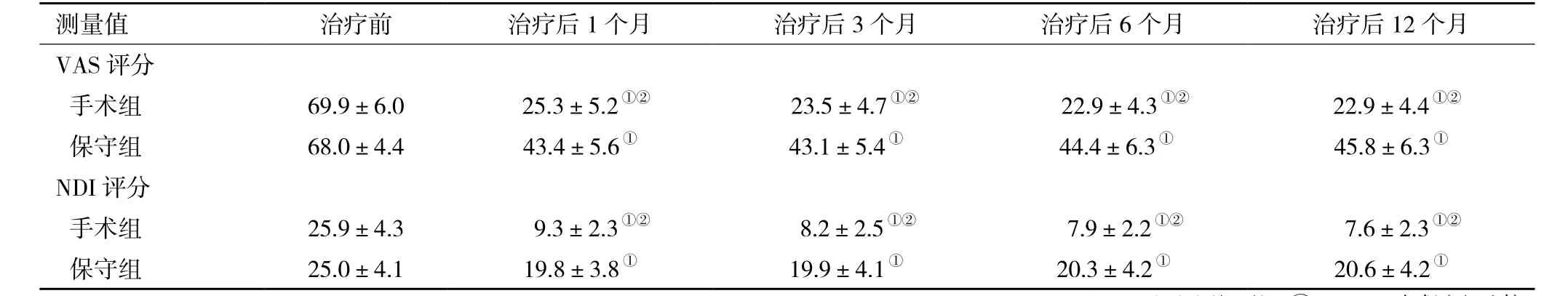
表2 两组慢性椎间盘源性颈痛患者治疗前后各时间点的VAS、NDI评分比较
注:手术组,行颈前路减压手术;保守组,未经手术保守治疗;VAS,视觉模拟量表;NDI,颈椎功能障碍指数;与同组内治疗前比较,①P<0.05;与保守组比较,② P<0.05
测量值 治疗前 治疗后1个月 治疗后3个月 治疗后6个月 治疗后12个月VAS评分手术组 69.9±6.0 25.3±5.2①② 23.5±4.7①② 22.9±4.3①② 22.9±4.4①②保守组 68.0±4.4 43.4±5.6① 43.1±5.4① 44.4±6.3① 45.8±6.3①NDI评分手术组 25.9±4.3 9.3±2.3①② 8.2±2.5①② 7.9±2.2①② 7.6±2.3①②保守组 25.0±4.1 19.8±3.8① 19.9±4.1① 20.3±4.2① 20.6±4.2①

图1 两组慢性椎间盘源性颈痛患者治疗前后SDS评分变化
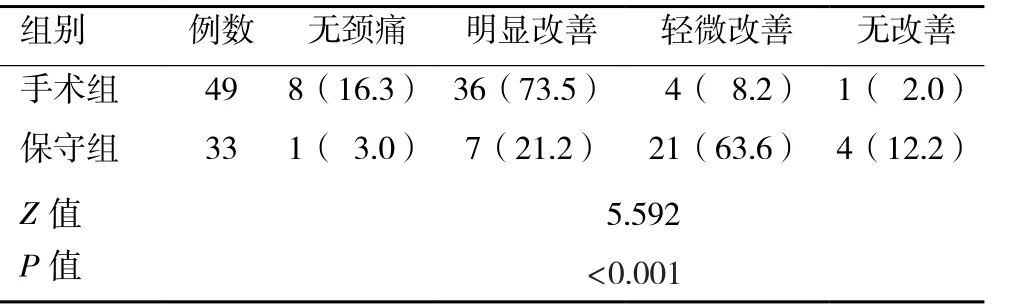
表3 两组慢性椎间盘源性颈痛患者治疗后疗效主观评分比较[n(%)]
3 讨 论
颈椎病是常见的疾病之一,由颈椎病引起的慢性颈痛在临床上也十分常见。当下,慢性椎间盘源性颈痛是颇具争议的一个话题,其具体的发病机制尚不十分明确。临床上,慢性颈痛可用椎间盘造影来评估。椎间盘造影所引发的疼痛表明椎间盘是有疼痛反应的,而这种疼痛信号是由椎间盘本身的神经末梢发出,并受椎间盘内神经调节[4]。退变的椎间盘大多数伴有炎性反应,而疼痛的椎间盘是炎性反应、神经生长及过度机械负荷的聚集点[5]。椎间盘细胞可表达神经生长因子(nerve growth factor,NGF),且在炎性环境下,NGF表达上升。NGF作为一种外周疼痛介质能在脑源性神经营养因子的作用下通过改变中枢伤害感受器信号调节疼痛。而且,椎间盘中的NGF可诱导感觉神经向内生长至椎间盘内层[6-8]。
尽管关于椎间盘源性疼痛的传导机制一直存有争议,但相关研究已经证实在椎间盘纤维环和背根神经节间存在两条传导通路,最终转入相应的脊神经[4]。窦椎神经是脊柱疼痛的神经解剖学基础,许多解剖学研究也证实了椎间盘相关性疼痛受窦椎神经调节[9,10]。交感干是位于脊柱前外侧缘成对链的神经节,交感干内在的轴突借灰交通支与脊神经相连[11]。此外,Oh与Shim[12]也证实了灰交通支是椎间盘神经分布的最大来源,并且认为进入椎间盘的椎体神经分布不仅只有自主神经,还包括躯体神经系统,因而椎间盘源性疼痛可能与伤害性刺激有关[13]。
结合本研究的结果及早期相关研究[9-12],笔者认为慢性椎间盘源性颈痛的发病机制可能是颈椎间盘退变引发的炎性反应,在NGF及其他细胞因子的作用下使得血管神经长入椎间盘,控制椎间盘内疼痛相关肽的合成,特别是在背根神经节中的合成,以及调节与脊髓背角疼痛传递有关的突触,最终诱发了颈痛。
早在20世纪,ACDF已成为治疗颈椎病的经典手术方式[14,15],尽管在一定程度上融合术降低颈椎的活动范围,加速临近节段椎间盘的退变,但该术式在本研究过程中将病变的椎间盘摘除,从根本上阻断了疼痛的来源,进而解决了由椎间盘退变所引起的颈部疼痛,达到较好的临床效果的同时也改善患者的生活质量;而保守治疗是通过口服非甾体类消炎药物抑制退变颈椎间盘内炎性的发展,配以相关物理治疗从而达到能够缓解局部颈痛症状。
本研究主要分析ACDF手术对慢性椎间盘源性颈痛的治疗效果,并与保守治疗的效果进行对比。结果表明,尽管接受保守治疗的患者与治疗前相比,其颈部疼痛不适的症状及颈椎功能也得到一定程度的改善,但是经过12个月的随访发现,在颈痛缓解与功能恢复方面,ACDF手术的疗效要显著好于保守治疗;并且两组治疗后疗效主观评价方面,手术组显著高于保守组。此外,长期的疼痛会加重患者的心理负担甚至导致严重的心理疾病。而椎间盘源性颈痛是一种退变性疾病,随着年龄的增长,颈痛症状可能会逐渐加重。本研究发现选择保守治疗的患者在治疗后1个月,抑郁情况几乎无改善,且在治疗后12个月,只有少数抑郁情况得到改善,而大部分手术组患者,在治疗后1个月,抑郁情况就能得到改善,其余患者在随后的随访中渐渐恢复,这也间接佐证了ACDF在该病治疗中的效果。
总之,本研究发现ACDF治疗慢性椎间盘源性颈痛较传统治疗方法可显著缓解颈部的疼痛,改善患者的生活质量,值得临床推广。但在本研究中,由于伦理学问题,未设计一个随机对照试验研究,因此无法排除安慰剂效应和霍桑效应对疗效的影响。此外,由于慢性椎间盘源性颈痛是以主观症状为主的疾病,且病因广泛,无确定的客观指标,在今后的进一步研究中可以考虑加入其他更加有效的分析指标,使研究成果更有说服力。
[1]Elbinoune I, Amine B, Shyen S, et al. Chronic neck pain and anxiety-depression: prevalence and associated risk factors [J]. Pan Afr Med J, 2016(24): 89. DOI:10.11604/pamj.2016.24.89.8831.
[2]Manchikanti L, Cash K A, Pampati V, et al. Twoyear follow-up results of fluoroscopic cervical epidural injections in chronic axial or discogenic neck pain: a randomized, double-blind, controlled trial [J]. Int J Med Sci, 2014, 11(4): 309-320. DOI: 10.7150/ijms.8069.
[3]Chen A , Lai D M, Wang S F, et al. Comparison of cervical kinematics, pain, and functional disability between singleand two-level anterior cervical discectomy and fusion [J].Spine(Phila Pa 1976), 2016, 41(15): E915-E922.DOI: 10.1097/BRS.0000000000001502.
[4]Onyewu O, Manchikanti L, Falco F J, et al. An update of the appraisal of the accuracy and utility of cervical discography in chronic neck pain [J]. Pain Physician, 2012(15): E777-E806.
[5]Wiet M G, Piscioneri A, Khan S N, et al. Mast Cell-Intervertebral disc cell interactions regulate inflammation,catabolism and angiogenesis in discogenic back pain [J].Sci Rep, 2017, 7(1): 12492. DOI: 10.1038/s41598-017-12666-z.
[6]García-Cosamalón J, del Valle M E, Calavia M G, et al.Intervertebral disc, sensory nerves and neurotrophins: who is who in discogenic pain? [J]. J Anat, 2010, 217(1): 1-15.DOI: 10.1111/j.1469-7580.2010.01227.x.
[7]Sainoh T, Sakuma Y, Miyagi M, et al. Efficacy of anti-nerve growth factor therapy for discogenic neck pain in rats [J].Spine(Phila Pa 1976), 2014, 39(13): E757-E762.DOI: 10.1097/BRS.0000000000000340.
[8]Risbud M V, Shapiro I M. Role of cytokines in intervertebral disc degeneration: pain and disc content [J].Nat Rev Rheumatol, 2014, 10(1): 44-56. DOI: 10.1038/nrrheum.2013.160.
[9]Fujimoto K, Miyagi M, Ishikawa T, et al. Sensory and automonic innervation of the cervical intervertebral disc in rats: The pathomechanics of chronic discogenic neck pain [J]. Spine, 2012(37): 1357-1362. DOI: 10.1097/BRS.0b013e31824ba710.
[10]Lotz J C, Ulrich J A. Innervation, inflammation,and hypermobility may characterize pathologic disc degeneration: Review of animal model data [J]. J Bone Joint Surg Am, 2006(88): 76-82. DOI: 10.2106/JBJS.E.01448.
[11]Blume H G. Cervicogenic headaches: radiofrequency neurotomy and the cervical disc and fusion [J]. Clin Exp Rheumatol, 2000, 18(2 Suppl 19): S53-S58.
[12]Oh W S, Shim J C. A randomized controlled trial of radiofrequency denervation of the ramus communicans nerve for chronic discogenic low back pain [J]. Clin J Pain,2004(20): 55-60.
[13]Groen G J, Baljet B, Drukker J. Nerves and nerve plexuses of the human vertebral column [J]. Am J Anat, 1990, 188(3): 282-96. DOI: 10.1002/aja.1001880307.
[14]Wu T K, Wang B Y, Deng M D, et al. A comparison of anterior cervical discectomy and fusion combined with cervical disc arthroplasty and cervical disc arthroplasty for the treatment of skip-level cervical degenerative disc disease: A retrospective study [J]. Medicine(Baltimore), 2017, 96(41): e8112. DOI: 10.1097/MD.0000000000008112.
[15]Kapetanakis S, Thomaidis T, Charitoudis G, et al. Single anterior cervical discectomy and fusion (ACDF) using self- locking stand-alone polyetheretherketone(PEEK)cage: evaluation of pain and health-related quality of life[J]. J Spine Surg, 2017, 3(3): 312-322. DOI: 10.21037/jss.2017.06.21.

