酶解与包合技术制备水溶性花粉的比较研究(续)
(重庆市畜牧科学院,荣昌 402460)
酶解与包合技术制备水溶性花粉的比较研究(续)
刘佳霖 殷素会 高丽娇 曹 兰 罗文华 程 尚
(重庆市畜牧科学院,荣昌 402460)
(续《中国蜂业》2017年第10期)
2.4.5 纤维素酶+β-环糊精:使用1 mol/L的HCl调节蜂花粉溶液pH=5.2,加入纤维素酶0.750 g(酶添加量为1500 U/g),65℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,冷却。反应结束后,于100℃下加热5 min灭酶,冷却。使用1 mol/L的氢氧化钠调节蜂花粉水溶液pH=8.7,加入β-环糊精6.250 g(与蜂花粉质量比为1:4),37℃下水浴磁力搅拌4 h,过滤。
2.4.6 果胶酶+碱性蛋白酶:使用1 mol/L的HCl调节蜂花粉溶液pH=4.0,加入果胶酶0.469 g(酶添加量为1500 U/g),40℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,冷却。使用1 mol/L的NaOH调节蜂花粉溶液pH=9.0,加入碱性蛋白酶1.25 g(酶添加量为1500 U/g),50℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,过滤。
2.4.7 果胶酶+β-环糊精:使用1 mol/L的HCl调节蜂花粉溶液pH=4.0,加入果胶酶0.4688 g(酶添加量为1500 U/g),40℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,冷却。使用1 mol/L的氢氧化钠调节蜂花粉水溶液pH=8.7,加入β-环糊精6.250 g(与蜂花粉质量比为1∶4),37℃下水浴磁力搅拌4 h,过滤。
2.4.8 脂酶+碱性蛋白酶:使用1 mol/L的HCl调节蜂花粉溶液pH=5.5,加入脂酶3.750 g(酶添加量为1500 U/g),40℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,冷却。使用1 mol/L的NaOH调节蜂花粉溶液pH=9.0,加入碱性蛋白酶1.250 g(酶添加量为1500 U/g),50℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,过滤。
2.4.9 脂酶+β-环糊精:使用1 mol/L的HCl调节蜂花粉溶液pH=5.5,加入脂酶3.750 g(酶添加量为1500 U/g),40℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,冷却。使用1 mol/L的氢氧化钠调节蜂花粉水溶液pH=8.7,加入β-环糊精6.250 g(与蜂花粉质量比为1:4),37℃下水浴磁力搅拌4 h,过滤。
2.4.10 β-葡萄糖苷酶+碱性蛋白酶:使用1 mol/L的氢氧化钠调节蜂花粉溶液pH=5.5,加入葡萄糖苷酶0.189 g(酶添加量为1500 U/g),50℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,冷却。使用1 mol/L的NaOH调节蜂花粉溶液pH=9.0,加入碱性蛋白酶1.250 g(酶添加量为1500 U/g),50℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,过滤。
2.4.11 β-葡萄糖苷酶+β-环糊精:使用1 mol/L的氢氧化钠调节蜂花粉溶液pH=5.5,加入葡萄糖苷酶0.189 g(酶添加量为1500 U/g),50℃条件下搅拌反应4 h。反应结束后,于100℃下加热5 min灭酶,冷却。使用1 mol/L的氢氧化钠调节蜂花粉水溶液pH=8.7,加入β-环糊精6.250 g(与蜂花粉质量比为1:4),37℃下水浴磁力搅拌4 h,过滤。
2.5 蛋白质及黄酮含量测定
2.5.1 蛋白质含量测定:标准曲线测定:采用考马斯亮蓝蛋白质定量试剂盒方法[21],将0、40、80、120、160、200、240 μl牛血清蛋白BSA标准溶液分别加入试管中,加入PBS补足600 μl(600、560、520、480、440、400、360 μl ),向各试管加入11.40 mL考马斯亮蓝染液,混匀,室温放置5~10 min,分别在595 nm处记录吸光值。
测定蜂花粉水溶液的蛋白质含量:取50 ml产物溶液定容至500 ml,将适当体积的样品加入到试管中,并用PBS补足到600 μl,在向各试管加入11.4 ml考马斯亮蓝染液,混匀,室温放置5~10 min,分别在595 nm处记录吸光值。
按下列公式计算水溶性蜂花粉的蛋白质提取率:
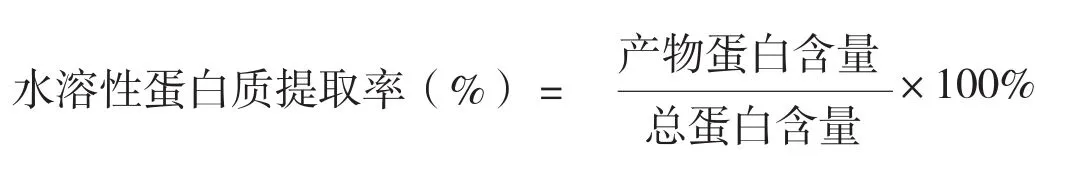
2.5.2 黄酮含量测定:标准曲线的制作:精密吸取芦丁标准溶液(1000 μg/ml):0、0.1、0.2、0.3、0.4、0.5 ml于10 ml比色管中,加5% NaNO2溶液0.3 ml,摇匀后放置6 min,加入10% Al(NO3)3溶液0.3 ml,摇匀后静置6 min,加入4%NaOH溶液4 ml在用乙醇或者水定容,摇匀,于波长510 nm处测定吸光度。对所测得的数据采用直线回归法计算产物黄酮含量
出标准曲线的回归方程,并以吸光度为横坐标,对照品浓度为纵坐标绘制标准曲线[22]。
样品的测定方法:精密吸取1 ml样品溶液置于10 ml容量瓶中,加入乙醇(加入4 ml)至5 ml,加入NaNO2-Al(NO3)3-NaOH显色体系[22],摇匀,以相应试剂做空白,于510 nm处测定吸光值,并计算样品中总黄酮的含量。
按下列公式计算水溶性蜂花粉的黄酮提取率:

2.6 统计分析
采用SPSS16.0软件进行统计学分析,试验数据以“平均值±标准差”表示,方差分析使用One-way ANOVA的LSD法,显著水平P<0.05。
3 结果与分析
3.1 蛋白质及黄酮标准曲线
以BSA(牛血清标准蛋白)为横坐标x(μl),595 nm处吸光值为纵坐标y作图,制作的标准曲线在0~240 μl BSA范围内符合方程y=0.0038x+0.0373,R2=0.996。
以芦丁标准品为横坐标x(μg),510 nm处吸光值为纵坐标y作图,制作的标准曲线在0~500 μg 芦丁标准品范围内符合方程y=0.0011x-0.0083,R2=0.999。
3.2 酶解与包合技术制备水溶性花粉的比较
酶解与包合技术制备水溶性蜂花粉的结果如表1所示。单一酶制剂或包合材料制备水溶性花粉,水溶性蛋白质及黄酮提取率最高的为碱性蛋白酶及环糊精2:1,水溶性蛋白质提取率分别为84.55%和84.33%,黄酮提取率分别为19.51%和18.50%。采用酶解与包合复合技术制备水溶性花粉,水溶性蛋白质提取率最高的为果胶酶+β-环糊精和纤维素酶+β-环糊精,水溶性蛋白质提取率分别为95.40%和88.91%;水溶性黄酮提取率最高的为纤维素+碱性蛋白酶和纤维素酶+β-环糊精,黄酮提取率分别为35.93%和37.86%。综合比较,采用纤维素酶+β-环糊精制备水溶性花粉能够获得较高的水溶性蛋白质提取率和黄酮提取率,与空白对照相比可提高水溶性蛋白质提取率120.95%,提高水溶性黄酮提取率105.98%,显著高于单一酶制剂或包合材料制备水溶性花粉的效果。
4 讨论
蜂花粉是一种天然、绿色、安全的保健品[1,5,6],水溶性、稳定性及感官特性是限制其深加工及广泛应用的关键难题。目前,蜂花粉的深加工通常采用真空冷冻干燥技术及超微粉碎技术制备高活性、低致敏的产品,但其理化性状并没有得到很大的改善,主要活性成分的提取仍处于发展阶段。酶解改性技术是目前使用最广泛的蛋白质改性技术,通过多种酶的内切或外切作用可以改变物料的理化特性和功能特性,该技术反应速度快、条件温和、无有毒有害物质产生,能够保证物料中的活性成分得到有效的保留[23,24]。本研究比较了多种蛋白酶、纤维素酶、果胶酶、脂酶及葡萄糖苷酶制备水溶性花粉的效果,结果显示,不同的酶制备水溶性蜂花粉的效果差异较大,碱性蛋白酶制备的水溶性蜂花粉蛋白质提取率和黄酮提取率最高,分别为84.55%和19.51%。与前人的结果一致[7],碱性蛋白质制备水溶性蜂花粉的效果显著高于其他酶。
包合技术是一种重要的蛋白质物理改性技术,一般采用环糊精为辅料,包合物料中的多种小分子物质,对其营养成分影响较小[25]。该技术在改善物料水溶性、稳定性及感官特性等方面具有十分重要的作用,已广泛应用于食品及医药等多个产业[26,27]。本研究比较了不同环糊精添加量对制备水溶性蜂花粉的影响,结果显示,环糊精添加量对包合技术制备水溶性蜂花粉的影响较小(P<0.05), 环糊精2:1制备的水溶性蜂花粉蛋白质提取率和黄酮提取率最高,分别为84.33%和18.50%。包合技术和酶解改性技术制备水溶性蜂花粉的效果差异不显著。
本研究在单一使用酶解与包合技术的基础上进一步开展蛋白酶+纤维素酶、果胶酶、脂酶、葡萄糖苷酶以及环糊精+纤维素酶、果胶酶、脂酶、葡萄糖苷酶的复合工艺制备水溶性蜂花粉的比较研究。综合结果显示,采用纤维素酶+β-环糊精制备水溶性花粉的效果最好,其水溶性蛋白质提取率为88.91%,水溶性黄酮提取率高达37.86%,显著高于单一酶制剂或环糊精制备水溶性花粉的效果。由此,本研究认为,多种工艺的复合使用有利于蜂花粉深加工产业的进一步发展,在改善蜂花粉理化性状,分离、纯化蜂花粉主要活性物质方面具有十分广阔的发展前景。
5 结论
采用纤维素酶+β-环糊精制备水溶性花粉能够获得较高的水溶性蛋白质提取率和黄酮提取率,与空白对照相比可提高水溶性蛋白质提取率120.95%,提高水溶性黄酮提取率105.98%,显著高于单一酶制剂或包合材料制备水溶性花粉的效果。多种技术的复合使用,有助于蜂花粉深加工的进一步发展。
[1] 刘建涛, 赵利, 苏伟, 等. 蜂花粉生物活性物质的研究进展[J]. 食品科学, 2006, 27(12): 909-912.
[2] BRODSCHNEIDER R, CRAILSHEIM K. Nutrition and health in honey bees[J]. Apidologie, 2010, 41(3): 278-294.
[3] HUANG Z. Pollen nutrition affects honey bee stress resistance[J]. Terrestrial Arthropod Reviews. 2012, 5(2): 1-15.
[4] 董文滨, 马兰婷, 王颖, 等. 意大利蜜蜂春繁、产浆、越冬和发育阶段营养需要建议标准[J]. 动物营养学报, 2014, 26(2):342-347.
[5] 张金振, 吴黎明, 赵静, 等. 13种植物源蜂花粉蛋白质的营养学评价[J]. 食品科学, 2014, 35(01): 254-257.
[6] 程尚, 罗文华, 高丽娇, 等. 酶解改性技术在蜂产品中的应用[J]. 黑龙江畜牧兽医, 2016, (10上): 229-233.
[7] 朱晓丽, 孙丽萍, 董捷. 油菜蜂花粉蛋白酶解条件的研究[J].食品科学, 2008, 29(4): 234-238.
[8] 高鲲, 张红城, 董捷. 复合蛋白酶酶解油菜蜂花粉及其表征[J]. 食品科学, 2011, 32(20): 99-103.
[9] 李艳伏, 徐怀德, 陈金海, 等. 木瓜蛋白酶酶解核桃粕蛋白产物抗氧化活性研究[J]. 中国食品学报, 2008, 8(5): 8-14.
[10] 张海生, 陈锦屏. 蜂蛹蛋白质酶解工艺及其氨基酸口服液对小鼠的强壮作用[J]. 西北农林科技大学学报(自然科学版),2007, 35(1): 100-105.
[11] 郭冬青, 纪付江, 高健, 等. 无花果蛋白酶的不同提取方法比较及酶学性质研究[J]. 湖北农业科学, 2011, 50(6): 1258-1260.
[12] 张璟晶, 袁敏, 管远红, 等. 不同温度、pH和无机离子对黑曲霉A66菌株产柚苷酶活力影响的初步研究[J]. 江西农业大学学报, 2006, 28(3): 449-452.
[13] 张伟光, 袁鹏, 尹志红, 等. 胃-胰蛋白酶水解蜂王浆主蛋白制备血管紧张素转化酶抑制肽工艺的优化[J]. 浙江大学学报(农业与生命科学版), 2012, 38(4): 511-518.
[14] 马宇翔, 杨国龙, 周瑞宝, 等. 菠萝蛋白酶水解醇法大豆浓缩蛋白的研究[J]. 河南工业大学学报(自然科学版), 2006,27(5): 43-46.
[15] 郭冬青, 纪付江, 高健, 等. 无花果蛋白酶的不同提取方法比较及酶学性质研究[J]. 湖北农业科学, 2011, 50(6): 1258-1260.
[16] 王邕, 黎海彬, 白先放, 等. 酶解-溶剂法提取罗汉果中黄酮类物质的研究[J]. 食品科技, 2006, 31(7): 125-127.
[17] 张明春, 解军波, 李婷, 等. 复合酶法提取酸枣仁黄酮研究[J]. 食品科学, 2008, 29(9): 174-177.
[18] 何新益, 符绳慧, 王磊. 水溶性蜂胶的酶解制备工艺优化[J]. 农业工程学报, 2009, 25(2): 280-284.
[19] 张红城, 董捷, 李春阳, 等. β-葡萄糖苷酶酶解蜂胶黄酮苷的研究[J]. 食品科学, 2008, 29(11): 332-336.
[20] 戴继荣, 唐力, 邓玉林, 等. 生物活性环糊精衍生化蛋白质的合成[J]. 北京理工大学学报, 2005, 25(4): 369-371.
[21] BRAFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976,72: 248-254.
[22] 孙丽萍, 田文礼, 朱晓丽, 等. 蜂花粉总黄酮检测方法的研究[J]. 食品科学, 2007, 28(1): 262-265.
[23] 郝晓霞, 罗明, 余淑娴. 酶解技术及其应用[J]. 江西科学,2007, 25(3): 355-358.
[24] 许雄, 孙灵霞, 李苗云, 等. 酶解畜禽兽肉的研究进展[J].安徽农业科学, 2008, 36(9): 3677-3678, 3714.
[25] 谷福根, 高永良, 崔福德. 环糊精包合物研究进展[J]. 中国新药杂志, 2005, 14(6): 686-693.
[26]赵海霞,陈浩,田景振.环糊精包合技术[J]. 山东中医杂志, 2000, 19(4): 241-243.
[27] JUN S W, KIM M S, KIM J S, et al. Preparation and characterization of simvastatin/hydroxypropyl-beta-cyclodextrin inclusion complex using supercritical antisolvent (SAS) process[J].European Journal of Pharmaceutics and Biopharmaceutics, 2007,66(3): 413-421.characterization of simvastatin/hydroxypropylbeta-cyclodextrin inclusion complex using supercritical antisolvent(SAS) process[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2007, 66(3): 413-421.
国家蜂产业技术体系建设专项(CARS-45-SYZ15);重庆市基础与前沿研究计划项目(cstc2015jcyjA80032);重庆市基本科研业务费(16440)
刘佳霖(1988-),男,研究实习员,硕士,研究方向蜜蜂授粉行为学及蜂产品研究。E-mail: liujialin5164@163.com。
程尚(1981-),男,硕士,研究方向为蜜蜂授粉行为学及蜂产品研究。E-mail: chengshang3@126.com。

