建立玉米幼胚高效再生体系的研究
李金红,霍 岩,付 莉,陶承光,史振声
(1.辽宁省农业科学院创新中心,辽宁 沈阳 110161; 2.沈阳农业大学特种玉米研究所,辽宁 沈阳110866; 3.锦州医科大学食品学院,辽宁 锦州 121000)
建立玉米幼胚高效再生体系的研究
李金红1,2,霍 岩1,3,付 莉3,陶承光1,史振声2
(1.辽宁省农业科学院创新中心,辽宁 沈阳 110161; 2.沈阳农业大学特种玉米研究所,辽宁 沈阳110866; 3.锦州医科大学食品学院,辽宁 锦州 121000)
为建立高效的玉米再生体系,以玉米幼胚为材料,研究了不同浓度的L-Pro、AgNO3和2,4-D对愈伤组织诱导率的影响,同时还分析了不同浓度的玉米素和IBA对分化和生根的影响,结果表明,愈伤组织诱导率最佳的组合为基本培养基中添加 L-Pro 700 mg/L、AgNO30.1 mg/L和2、4-D 1.5 mg/L;在基本培养基中添加5 mg/L的玉米素可有效促进愈伤组织分化,再生芽和再生植株分化率分别达到97.96%和97.67%,在生根培养基中添加0.1 mg/L的IBA生根效果较好。
玉米;幼胚;愈伤诱导率;再生;
玉米是世界上重要的粮饲作物,我国经济发展和市场稳定具有举足轻重的作用[1,2]。利用分子生物学手段培育耐盐碱玉米,对种植玉米面积的扩大和提高玉米产量具有重要意义[3~6],而建立高效的再生体系是遗传转化是否成功的的关键因子。因此玉米优良基因型再生体系的建立一直是人们研究的热点[7]。自1975年首次利用未成熟胚诱导愈伤组织获得再生植株以来,玉米的再生体系技术获得不断发展[8],如幼胚、成熟胚、胚芽鞘节、丛生芽等,但以玉米幼胚作为外植体,其诱导愈伤组织率和再生率都非常高[9~12],然而其组织培养的过程中,影响因素颇为复杂。
本试验设计了9种不同诱导培养基对玉米A188自交系的进行诱导愈伤组织,并添加不同浓度的2、4-D和IBA对分化和生根进行诱导,并获得再生植株,探索建立高效遗传再生体系的条件,为建立高效的玉米转基因受体系统奠定基础。
1 材料与方法
1.1 试验材料
供试材料为玉米自交系A188,2017年种植于辽宁省农业科学院试验基地,8月进行人工授粉。
1.2 试验方法
1.2.1 幼胚的获得
在开花授粉期人工套袋,授粉后9~12 d,当幼胚长到1.0~1.2 mm大小时,取雌穗剥去苞叶,每剥去一层苞叶喷洒75%的酒精,进行表面消毒,用刀片在超净工作台下挑去幼胚,盾片向上,接种到诱导培养基上。
1.2.2 愈伤组织的诱导
诱导培养基是基础培养基中添加不同浓度的2,4-D、硝酸银(AgNO3)、脯氨酸(L-Pro),试验设计见表1进行三因素三水平的正交试验,每个处理接种100个幼胚,3次重复。7 d后及时切除胚根和胚芽,14 d后统计愈伤诱导率,确定最适宜配比浓度。
愈伤组织诱导率=诱导出愈伤组织的幼胚数/接种总幼胚数×100%
1.2.3 玉米素的对幼苗分化的影响
将产生的颗粒状、乳白色或浅黄色的生长较快的胚性愈伤组织接种到不同浓度玉米素的分化培养基上,分化培养基为基本培养基分别添加3 mg/L、5 mg/L、7 mg/L的玉米素,每个培养皿放置25个胚性愈伤组织,3次重复。25℃持续光照,光强5 000 lx,21 d后统计幼苗分化率。
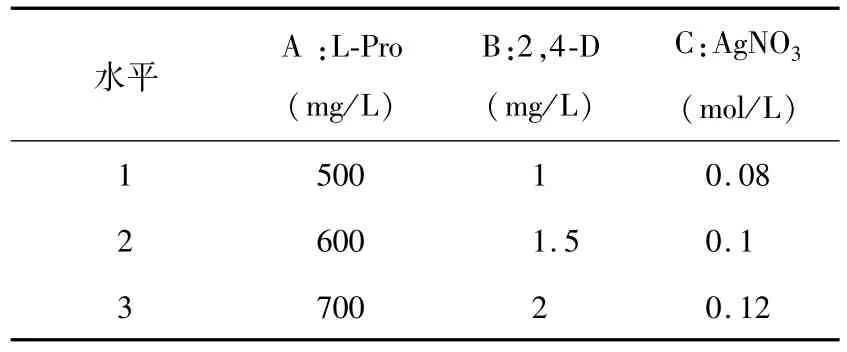
表 1 L9(33)试验设计Table 1 L9(33)Orthogonal test designs table
幼苗分化率 =分化出的组织培养苗数/愈伤组织数 ×100%
1.2.4 生根培养基中IBA浓度的确定
当待分化苗植株长到到2~3 cm后,将分化出的玉米幼苗转移到生根培养基中,生根培养基为基本培养基中分别添加 0.1 mg/L、0.2 mg/L、0.3 mg/L、0.4 mg/L的 IBA,将待生根的幼苗置于25℃、3 000 lx进行光照培养,光周期为16 h/8 h。每次处理25株植株,3次重复。待再生植株高达5 cm左右,且具有3~5个新生根时进行统计。
1.2.5 炼苗与移栽
待幼苗长出3~5个主根时,打开瓶口进行炼苗,炼苗时培养基中倒入无菌水1~2 d后,用无菌水清洗幼苗根部残留的培养基,再水培2~3 d后移栽至基质中,移栽21 d以后调查成活,培养条件同生根培养。
2 结果与分析
2.1 愈伤组织诱导培养基的优化
愈伤组织诱导率(表2)和显著性分析(表3)结果表明,L-Pro的浓度对愈伤组织诱导率呈现极显著差异,当L-Pro的浓度为700 mg/L时,其愈伤诱导率为 83.77%,显著高于 500 mg/L和600 mg/L时愈伤诱导率。2,4-D和 AgNO3的含量对愈伤组织诱导率呈现显著性差异。2、4-D的浓度为1.5 mg/L时愈伤组织诱导率为73.27%,明显高于浓度为1 mg/L和2 mg/L的愈伤诱导率;当AgNO3的为0.1 mol/L时,愈伤组织诱导率为71.4%;明显高于 0.08 mol/L和0.12 mol/L处理。诱导愈伤组织的最佳组合处理为L-Pro 700 mg/L、2、4-D 1.5 mg/L和 AgNO30.1 mol/L,诱导率达到98.60%。
2.2 玉米素的对幼苗分化的影响
将胚性愈伤组织接种到在含有 3 mg/L、5 mg/L、7 mg/L的玉米素的分化培养基上,3~5 d胚性愈伤组织开始转绿,7~10 d开始出现绿色芽点(图1A),进而分化成幼苗(图1B、图1C)。玉米素可以促进胚性愈伤组织分化,本试验研究表明培养基中添加5 mg/L玉米素时,其再生芽和再生植株分化率分别为97.96%和97.67%,明显优于培养基中添加3 mg/L和7 mg/L的玉米素时的分化率(表4)。
2.3 生根培养基中IBA浓度的确定
研究结果表明,当生根培养基中添加0.1 mg/L的 IBA时,根的长度大部分过于细长(图2A),不利于再生植株的生长;当生根培养基中添加IBA的浓度大于0.3mg/L时,根生长缓慢且须根较少(图2C、2D),不适合再生植株的生长,当生根培养基中添加0.2 mg/L的IBA时,根粗壮、须根较多并且生长迅速(图2B),适合再生植株的生长,因此生根培养基中添加0.2 mg/L的IBA为适宜浓度。
2.4 炼苗与移栽
一般生根培养10 d左右,幼苗长到3~4片叶,将三角瓶移入人工气候温室中,打开瓶口并倒入无菌水,1~2 d后将根部残留的培养基洗净,再进行水培炼苗(图2E),2~3 d后将幼苗转移,移栽于经过无菌处理的优质土壤中。移栽时,将幼苗叶片剪去少许,外面扣膜,以保持湿度。每2 d喷水1次,待有新叶长出时,逐渐通风去掉薄膜,此时小苗即可正常生长发育(图2F)。21 d后成活率达到90%,获得了较为理想的再生植株。
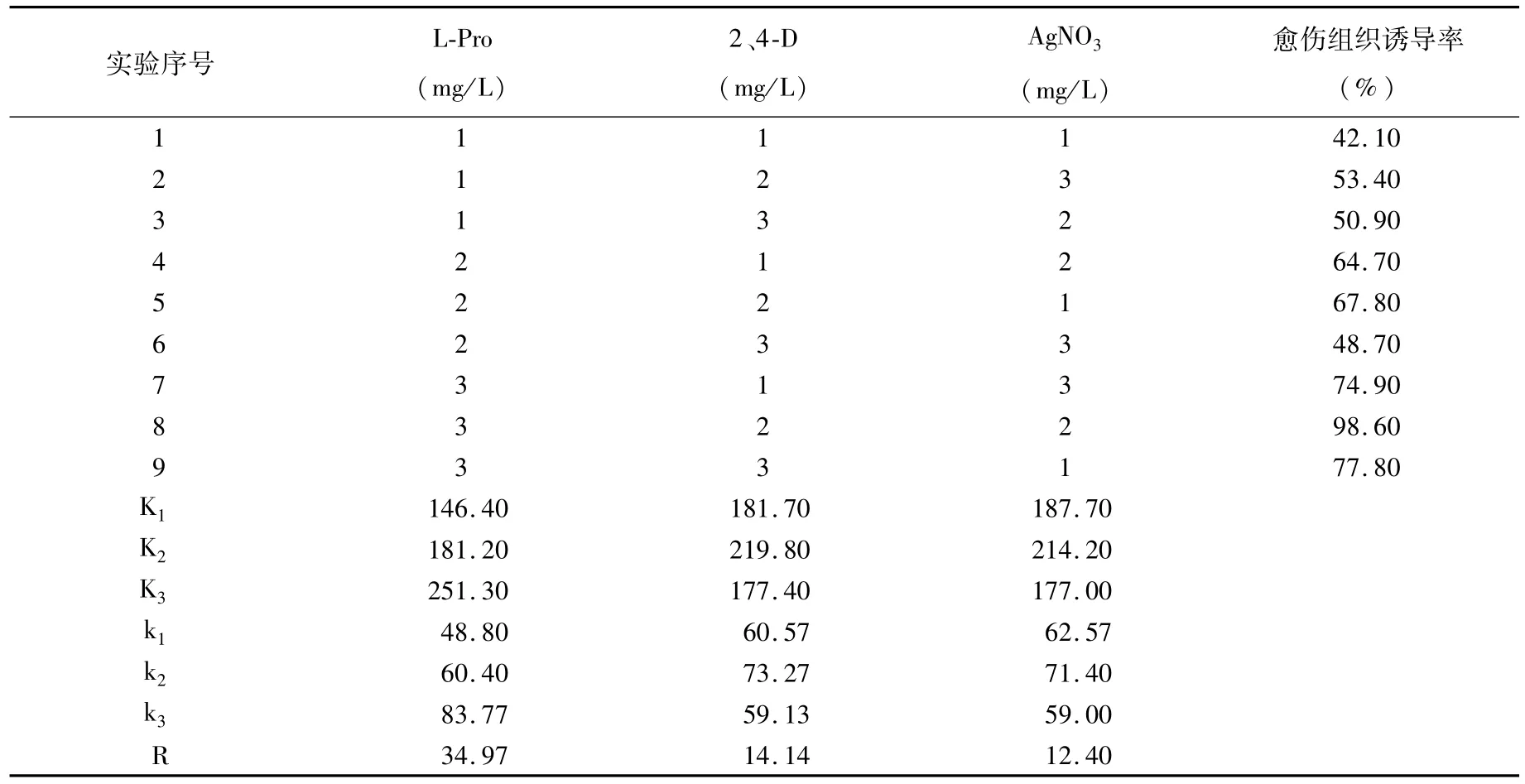
表2 三因素三水平正交试验Table 2 Three factors and three levels orthogonal table
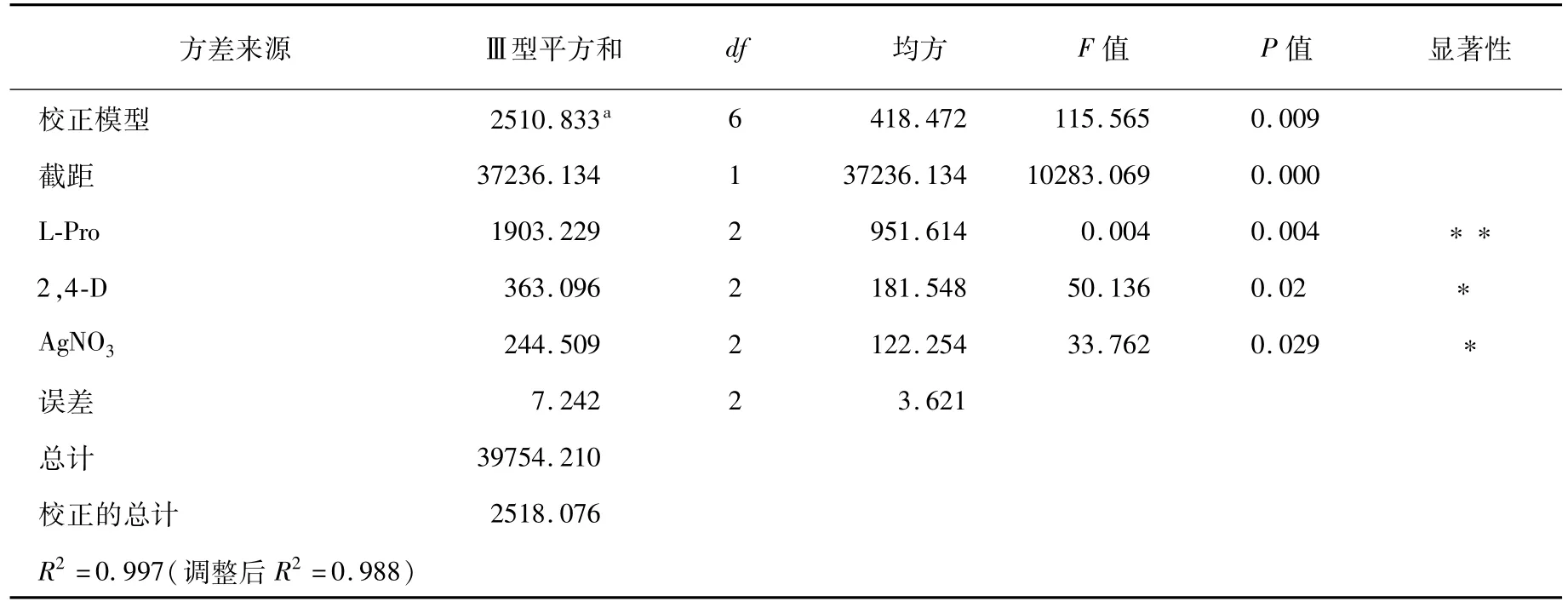
表3 显著性分析Table 3 Significance analysis

表4 不同浓度玉米素对愈伤组织分化的影响Table 4 Effect of different ZT hormones on shootfornation ofmaize callus

图1 胚性愈伤组织分化Figure 1 Embryonic callus differentiaton
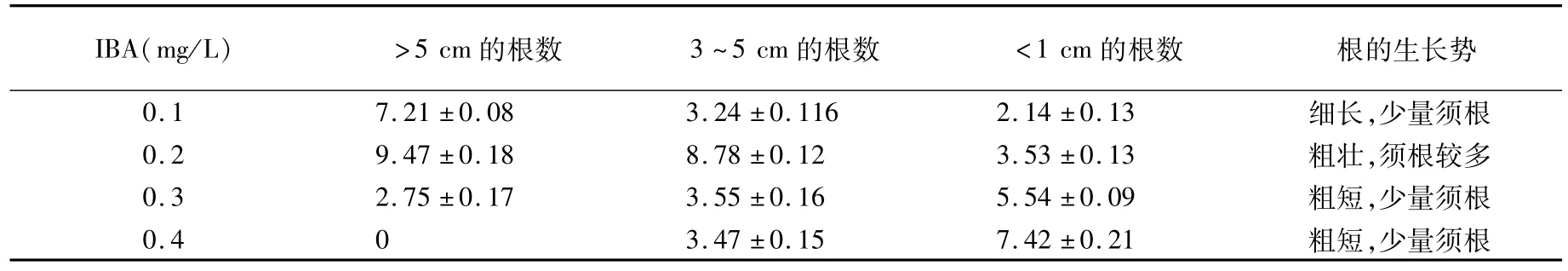
表5 不同浓度IBA对无菌苗生根的影响Table 5 Effect of different IBA hormones on plantlet rooting

图2 不同浓度的IBA生根的影响及炼苗移栽Figure 2:Effect of different IBA hormones on plantlet rooting注:A:IBA的浓度为0.1 mg/L;B:IBA的浓度为0.2 mg/L;C:IBA的浓度为0.3 mg/L;D:IBA的浓度为0.4 mg/L;E:炼苗;F:移栽Note:A:0.1 mg/L IBA concentration;B:0.2 mg/LIBA concentration;C:0.3 mg/LIBA concentration;D:0.4 mg/L IBAconcentration;E:Hardening-seedling;F:Transplanting
3 讨论与结论
本试验以授粉后7~12 d,1.0~1.2 mm大小的幼胚为受体材料,接种到9中不同的培养基,结果表明不同浓度的L-Pro、2、4-D和硝酸银均能诱导出愈伤组织,但最佳诱导愈伤组织的组合浓度为 L-Pro 700 mg/L、2、4-D 1.5 mg/L和 AgNO30.1 mol/L。说明当选用幼胚作为受体材料时,普遍可以诱导出愈伤,但其营养物质和激素浓度对诱导愈伤的效率有很大的干预作用。
在分化阶段,激素能够诱发细胞分裂活性,引起细胞脱分化和无序增殖,产生愈伤组织[13],在本试验中,基本培养基中添加5 mg/L的玉米素可有效促进愈伤组织分化,再生芽和再生植株分化率分别达到97.96%和97.67%。
玉米组织的生根是再生体系的一个关键环节,只有根系发达才能长成健壮的幼苗,培养基中IBA的添加可以促进根的生成。本试验研究表明,在基本培养基中添加0.2 mg/L IBA,5 d左右后即可看到0.5~1.0 cm的粗壮的幼根,10 d以后即可炼苗移栽,如果环境条件适宜,移栽成话率也较高,能够获得比较理想的再生植株。
[1] Kole C.Genomemapping andmolecular breeding in plants[J].Spring-Verlag Berlin Heidelberg,2007,53(2):105~119.
[2] 张曼,吴颖,苏胜忠,等.玉米茎节再生体系建立及AGPL基因遗传转化的研究[J].玉米科学,2016,24(3):51~56.
[3] 王志春,梁正伟.植物耐盐研究概况与展望[J].生态环境,2003,12(1):106~109.
[4] Zhang JF,Fang Y F,Makeschin,etal.A-groforestry and its application in elioration of saline soils in eastern China coastal region[J].Energy and Industry,2002,10(1):10~13.
[5] 王金君,崔丽华.基因工程在玉米育种上的应用[J].国外农学—杂粮作物,1999,19(6):19~22.
[6] Richard A Z,Fred O.Corn grain for cattle:influence of processing on site and extent of digestion[J].Southwest Nutrition,2005:86~112.
[7] 贾秀萍,王汉宁,张金文,等.2,4-D和NAA对成熟玉米种子不同外植体胚性愈伤组织诱导效果的影响[J].甘肃农业大学学报,2008,43(6):48~51.
[8] 王雷,张君,王丕武.胚龄和2,4-D浓度对玉米自交系幼胚愈伤组织诱导率的影响[J].玉米科学,2001,9(3):26~28.
[9] 王奕,范俊山,尚丽霞,等.玉米幼胚再生体系的建立[J].华北农学报.2015,30(5):130~134.
[10] 马海珍,朱伟伟,王启柏,等.玉米幼苗不同部位的再生能力和某些影响因子[J].作物学报.2014,40(2)313~319.
[11] Sidorov V,Gilbertson L,Addae P,Duncan D.Agrobacteriummediated transformation of seedling-derived maize callus[J].Plant Cell Rep,2006,25:320~328
[12] Zhong H,Srinivasan C,Sticklen M B.In vitromorphogenesis of corn(Zeamays L.):II.Differentiation of ear and tassel clusters from cultured shoot apices and immature inflorescences[J].Planta,1992,187:490~497.
[13] 姚丹,王丕武,刘占柱,等.玉米愈伤组织的遗传转化和对草丁膦抗性及植株再生的研究[J].玉米科学,2004(3):33~35.
Study on the Establishment of High Efficiency Regeneration System of Maize
LIJin-hong1,2,HUO Yan1,3,FU Li3,TAO Cheng-guang1,SHIZhen-sheng2(1.Innovation Center,Liaoning Academy of Agricultrual Science,Shenyang,Liaoning 110161; 2.Special Corn Institute of Shenyang Agriculture University,Shenyang,Liaoning 110866; 3 Institute of Food,Jinzhou Medical University,Jinzhou,Liaoning 121000)
To establish high-frequency regenration technique system for gene tranformation inmaize,We studyed on callus induction rate in L-Pro、AgNO3and 2,4-D when immature embryo is used as amaterial;we also analyzed the effects of different concentrations of ZT and IBA hormone on differentiation and rooting,The results showed that the best callus induction rate is added to L-Pro 700 mg/L、AgNO30.1 mg/L and 2、4-D1.5 mg/L in bascimedium;regeneration buds rate and regeneration plants rate reached 97.96%and 97.67%respectively if the basicemediuim was added to 5 mg/L zeatin;The result of rooting was the best when basice meidum was added 0.1 mg/L IBA as the exogenous hormone.
Maize;Immature embryo;Callus-induced rate;Regeneration
S513.035.3
A
1002-1728(2017)06-0001-05
10.3969/j.issn.1002-1728.2017.06.001
2017-10-12
辽宁省企业博士后项目(137301);国家现代农业产业技术体系(CARS-06-01-06);科技部其他项目(2016YFD0101803)
李金红(1979-),女,博士 助理研究员,主要从事作物分子育种研究。E-mail:lijinhong_0315@163.com通讯作者:陶承光(1955-),男,博士,研究员,主要从事作物分子育种的研究。E-mail:laast@vip.sina.com史振声(1954-),男,博士,教授,从事玉米育种与栽培生理研究。E-mail:Shi.zhensheng@163.com

