‘槜李’果实软化相关基因PsPG的克隆与表达分析
王 刚, 贾展慧, 张计育, 贾晓东, 王 涛, 翁文昕, 宣继萍, 郭忠仁
〔江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
‘槜李’果实软化相关基因PsPG的克隆与表达分析
王 刚, 贾展慧, 张计育, 贾晓东, 王 涛, 翁文昕, 宣继萍①, 郭忠仁①
〔江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
研究了室温〔(25±1) ℃〕贮藏、低温〔(4±1) ℃〕贮藏、1-甲基环丙烯(1-MCP)处理和减压浸钙处理条件下‘槜李’(Prunussalicina‘Zuili’)果实硬度的动态变化,进一步克隆获得‘槜李’的多聚半乳糖醛酸酶基因(PsPG),并对该基因进行了生物信息学和表达分析。结果表明:低温贮藏、1-MCP处理和减压浸钙处理可有效减缓‘槜李’果实硬度下降。‘槜李’PsPG基因的开放阅读框(ORF)长度为1 134 bp,编码377个氨基酸。PsPG蛋白的二级结构由11.14%的α螺旋、31.03%的β折叠和57.82%的无规则卷曲构成。生物信息学分析结果显示:PsPG蛋白含有果胶酸裂解酶3结构域和4个PbH1结构域;PsPG基因与Prunuspersica(Linn.) Batsch和PrunusarmeniacaLinn.的PG基因编码的氨基酸序列的亲缘关系较近,相似度达96%以上。qRT-PCR分析结果显示:随着采后贮藏时间的延长,低温贮藏、1-MCP处理和减压浸钙处理条件下PsPG基因的相对表达量均呈先升高后降低的趋势,且分别于贮藏5、3和5 d达到最高值。研究结果显示:‘槜李’PsPG基因与其果实软化关系密切,低温贮藏是‘槜李’果实采后保鲜的有效手段,可抑制PsPG基因的表达以延缓果实软化。
‘槜李’;PsPG基因; 克隆; 基因表达; 果实软化
软化不仅是果实成熟的显著特征,也是影响采后果实贮藏品质和货架期的重要因子。在果实软化过程中,细胞壁的降解和细胞总体结构的破坏导致细胞壁松动和分离。目前,对参与果实软化过程细胞壁降解的多聚半乳糖醛酸酶(polygalacturonase,PG)已有广泛研究,虽然研究表明PG可能不是惟一调节果实软化进程的关键酶[1],但在苹果(MalusdomesticaBorkh.)[2]、翠冠梨(Pyruspyrifolia‘Cuiguan’)[3]、Prunuspersica(Linn.) Batsch[4]和Prunusdomesticasubsp.insititia(Linn.) C. K. Schneid.[5]的果实成熟过程中PG积累并负责水解细胞壁中多聚半乳糖醛酸中的1,4-α-D-半乳糖苷键,同时伴随mRNA转录水平和PG活性的上升,说明PG在核果类果实软化过程中起着重要作用。
植物中PGs是一个大的基因家族[6],不同成员的应激反应和时空表达存在差异。目前,已分离获得Prunuspersica[4]、Prunusdomesticasubsp.insititia[5]、中华猕猴桃(ActinidiachinensisPlanch.)[7]、甜瓜(CucumismeloLinn.)[8]、葡萄(VitisviniferaLinn.)[9]、西洋梨(PyruscommunisLinn.)[10]和草莓(Fragaria×ananassaDuch.)[11]等植物果实的PG基因,这些基因在果实软化过程中发挥不同的作用。
‘槜李’(Prunussalicina‘Zuili’)是蔷薇科(Rosaceae)李属(PrunusLinn.)植物,主要分布于浙江嘉兴地区,是中国稀有的李中珍品。其果实含有丰富的氨基酸、钙、铁、维生素和有机酸等多种营养成分,且‘槜李’果实成熟时肉质果肉化浆,汁液香如醴、甘如蜜,风味独特,深受人们喜爱。‘槜李’果实属于呼吸跃变型果实,采收后迅速进入呼吸高峰期,并在3 d内快速软化,达到后熟化浆状态,极不耐贮藏,限制了其商品性。阐明‘槜李’果实软化的分子机制对调控其采收、贮藏和货架期有很大帮助,但有关‘槜李’果实细胞壁降解基因的研究极少。
本研究以‘槜李’果实为研究材料,克隆并结合不同采后处理研究了‘槜李’PG基因在采后贮藏期间的表达特性,以期揭示‘槜李’PG基因在其果实软化过程中的作用,并为采取适宜措施延长‘槜李’果实的货架期提供理论依据。
1 材料和方法
1.1 材料
‘槜李’果实采自浙江省桐乡市桃园村‘槜李’种质资源苗圃。2014年6月25日采收八成熟果实,散去田间热后装箱运回江苏省中国科学院植物研究所果树科学实验室。挑选大小均一、熟度一致、无机械损伤、无病虫害的果实并随机分成4组进行处理。共设置4个处理组:T1(室温贮藏,对照),不做任何采后处理,(25±1) ℃贮藏;T2(低温贮藏),不做任何采后处理,(4±1) ℃贮藏;T3(减压浸钙处理),在80 kPa下采用质量体积分数2% CaCl2溶液浸泡5 min后取出晾干,(25±1) ℃贮藏;T4〔1-甲基环丙烯(1-MCP)处理〕,在含0.5 μL·L-11-MCP气体的密闭箱中放置24 h后拿出,(25±1) ℃贮藏。每处理组250个果实。采后当天(记为0 d)开始测定相关指标。果实硬度每天测定1次,共11次。每处理组每2 d取20个果实的果肉组织,去除外果皮和内果皮后,将中果皮在液氮中速冻后,于-80 ℃冰箱中保存、备用。
1.2 方法
1.2.1 果实硬度测定 采用探头直径8 mm的GY-3型果实硬度计(浙江托普仪器有限公司)检测‘槜李’去皮果实硬度。各处理组随机抽取5个果实,去掉果实缝合线两侧最大横径处的外果皮,在该区域测量硬度值。单果重复检测4次。
1.2.2 基因克隆 采用CTAB法[12]提取各处理组‘槜李’果肉组织总RNA,经质量体积分数1%琼脂糖凝胶电泳和Onedrop OD-1000分光光度计(南京五义科技有限公司)检测总RNA的质量和浓度合格后,采用PrimeScriptTMReverse Transcriptase〔宝生物工程(大连)有限公司〕逆转录cDNA分别用于‘槜李’PsPG基因的克隆和qRT-PCR实验。具体操作见试剂盒使用说明书。
以GenBank数据库中已经登录的多种植物PG基因的核苷酸序列为基础,搜索并提取‘槜李’PG基因的可能序列,采用Primer Premier 5.0程序分别在序列的上游和下游设计并合成开放阅读框(ORF)验证引物。PsPG-F 的序列为 5′-TGGCGAACCGTAG AAGCCT-3′;PsPG-R 的序列为 5′-CTACAAACAA CTTGTAGGCTGAACC-3′。反应体系包括10×PCR buffer 2.5 μL、25 mmol·L-1dNTPs mixture 2.0 μL、25 mmol·L-1MgCl21.5 μL、5 U·μL-1rTaq酶0.2 μL、10 μmol·L-1上游和下游引物各1.0 μL及模板cDNA 1.5 ng·μL-1,用ddH2O补足至终体积25.0 μL。反应程序为:94 ℃预变性5 min;94 ℃变性45 s、56 ℃退火45 s、72 ℃延伸90 s,35个循环;最后于72 ℃延伸10 min。采用质量体积分数1.0%琼脂糖凝胶电泳验证PCR产物,然后利用AxyPrep DNA凝胶试剂盒〔爱思进生物技术(杭州)有限公司〕回收PCR产物,再将回收产物与pMD19-T Vector〔宝生物工程(大连)有限公司〕连接并转化到大肠杆菌DH5α感受态细胞中做TA克隆,挑取单克隆菌落经PCR(反应体系和反应程序同上)验证后送上海美吉生物医药科技有限公司测序。其中,MgCl2、dNTPs mixture和rTaq酶均购自宝生物工程(大连)有限公司,大肠杆菌DH5α由本实验室保存。
1.2.3 生物信息学分析 将克隆的‘槜李’果实细胞壁降解相关基因的cDNA或氨基酸序列使用不同的网络程序或本地软件进行相关生物信息学分析,即在NCBI数据库中提交克隆序列,并运行BLASTn查找同源序列(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi);再利用BioXM查找序列的最大开放阅读框并推导氨基酸序列;而后用pI/Mw tool(http:∥www.expasy.org/tools/pi_tool.html)、ProtParam(http:∥expasy.org/tools/protparam.html)和Kyte-Doolittle(http:∥fasta.bioch.virginia.edu/fasta_www2/fasta_www.cgi?rm=misc1)分析蛋白质的理化性质;同时,用SMART预测蛋白质的结构域,用GOR在线程序预测蛋白质的二级结构(http:∥smart.embl-heidelberg.de/);利用DNAman 7.0进行氨基酸序列的多重比对,利用MEGA 4.1[13]并运用邻接法构建进化树,均用500次重复进行bootstrap检验,采用默认的Poisson correction模型和Complete deletion选项。
1.2.4 基因表达分析 分别取各处理组‘槜李’果肉组织总RNA 1 μg,采用消除残留DNA的试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser〔宝生物工程(大连)有限公司〕合成cDNA。
根据qRT-PCR引物设计原则及克隆获得的‘槜李’PG基因,采用Beacon Designer 7.0设计并合成荧光定量特异引物;选取蛋白延伸因子(EF-2)作为看家基因。根据NCBI上已登录的EF-2设计引物。PsPG-qF 的序列为 5′-ATCTGGTGTCACAATCCTC AACTC-3′,PsPG-qR的序列为5′-GCCTCTTCTTG CTCCTTGCC-3′;EF-2-qF的序列为5′-GGTGTGA CGATGAAGAGTGATG-3′,EF-2-qR的序列为5′-TGAAGGAGAGGGAAGGTGAAAG-3′。引物合成由上海捷瑞生物工程有限公司完成。
qRT-PCR反应在Applied Biosystems 7300 Real-Time PCR System上进行,反应体系包括SYBR® Green qPCR Master Mix 10.0 μL、10 μmol·L-1上游和下游引物各0.3 μL及模板cDNA 1.0 μL,用ddH2O补足至终体积20.0 μL。反应程序为:94 ℃预变性4 min;94 ℃变性30 s、60 ℃退火20 s、72 ℃延伸43 s,40个循环;最后于72 ℃延伸5 min。溶解温度设置为63 ℃~95 ℃。基因的相对表达量采用2-ΔΔCt法[14]进行计算。为了使结果更直接化,将室温贮藏条件下各采后贮藏时间‘槜李’PG基因的相对表达量作为其他3个处理组对应采后贮藏时间的相对表达量的参照,并将每个处理组“0”点的相对表达量设为“1”,高于或低于“1”分别表示上调或下调。每个样品3次重复。
1.3 数据统计
采用EXCEL 2007、SPSS 22.0和Origin v10.2.1统计分析软件进行数据统计和图表制作。
2 结果和分析
2.1 不同采后处理和贮藏条件下‘槜李’果实硬度的动态变化
不同采后处理和贮藏条件下‘槜李’果实硬度的动态变化见图1。由图1可以看出:4个处理组‘槜李’果实的硬度均呈持续下降趋势,且与采后贮藏时间呈线性负相关。其中,室温贮藏(对照)条件下果实硬度下降最快,低温贮藏条件下果实硬度下降较慢,1-甲基环丙烯(1-MCP)处理和减压浸钙处理条件下果实硬度下降速度居中。室温贮藏条件下‘槜李’果实贮藏2 d,果实硬度急剧下降至0 kg·cm-2,即果实完全软化;减压浸钙处理条件下果实贮藏4 d完全软化;1-MCP处理和低温贮藏条件下果实贮藏5 d完全软化。
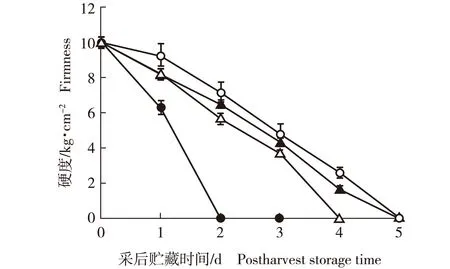
—●—: 室温贮藏Room temperature storage; —○—: 低温贮藏Low temperature storage; —▲—: 1-甲基环丙烯(1-MCP)处理1-methylcyclopropene (1-MCP) treatment; —△—: 减压浸钙处理 Immersed in Ca2+ solution with decompression treatment.图1 不同采后处理和贮藏条件下‘槜李’果实硬度的动态变化Fig. 1 Dynamic change in fruit firmness of Prunus salicina ‘Zuili’ in different postharvest treatments and storage conditions
2.2 ‘槜李’PsPG基因的克隆及生物信息学分析
2.2.1PsPG基因的克隆 以GenBank数据库中已经登录的多种植物PG基因的核苷酸序列为基础,克隆‘槜李’PG基因的cDNA序列,获得该基因开放阅读框(ORF)长度为1 134 bp,编码377个氨基酸,起始密码子为ATG,终止密码子为TAG。NCBI比对结果显示:该基因与Prunuspersica和PrunusarmeniacaLinn.的PG基因的相似度分别达到98%和97%,说明获得的cDNA序列为‘槜李’PsPG基因,GenBank登录号KX149044。
2.2.2PsPG基因的生物信息学分析 运用生物信息学在线软件分析得出,‘槜李’PsPG蛋白的氨基酸总数为377。推导该蛋白质的理论相对分子质量为39 550,理论等电点pI 5.62。
应用GOR在线程序预测PsPG蛋白的二级结构由11.14%的α螺旋、31.03%的β折叠和57.82%的无规则卷曲组成,其中,无规则卷曲是该蛋白质二级结构的主要组分。
‘槜李’PsPG基因与其他4种植物PG基因编码的氨基酸序列的多重比对结果见图2。由图2可以看出:PsPG基因编码的氨基酸序列含有果胶酸裂解酶3结构域(pectate lyase 3 domain)和4个PbH1保守结构域,其编码的氨基酸序列与Prunuspersica、Prunusarmeniaca和西洋梨等果树PG基因编码的氨基酸序列相似度较高。
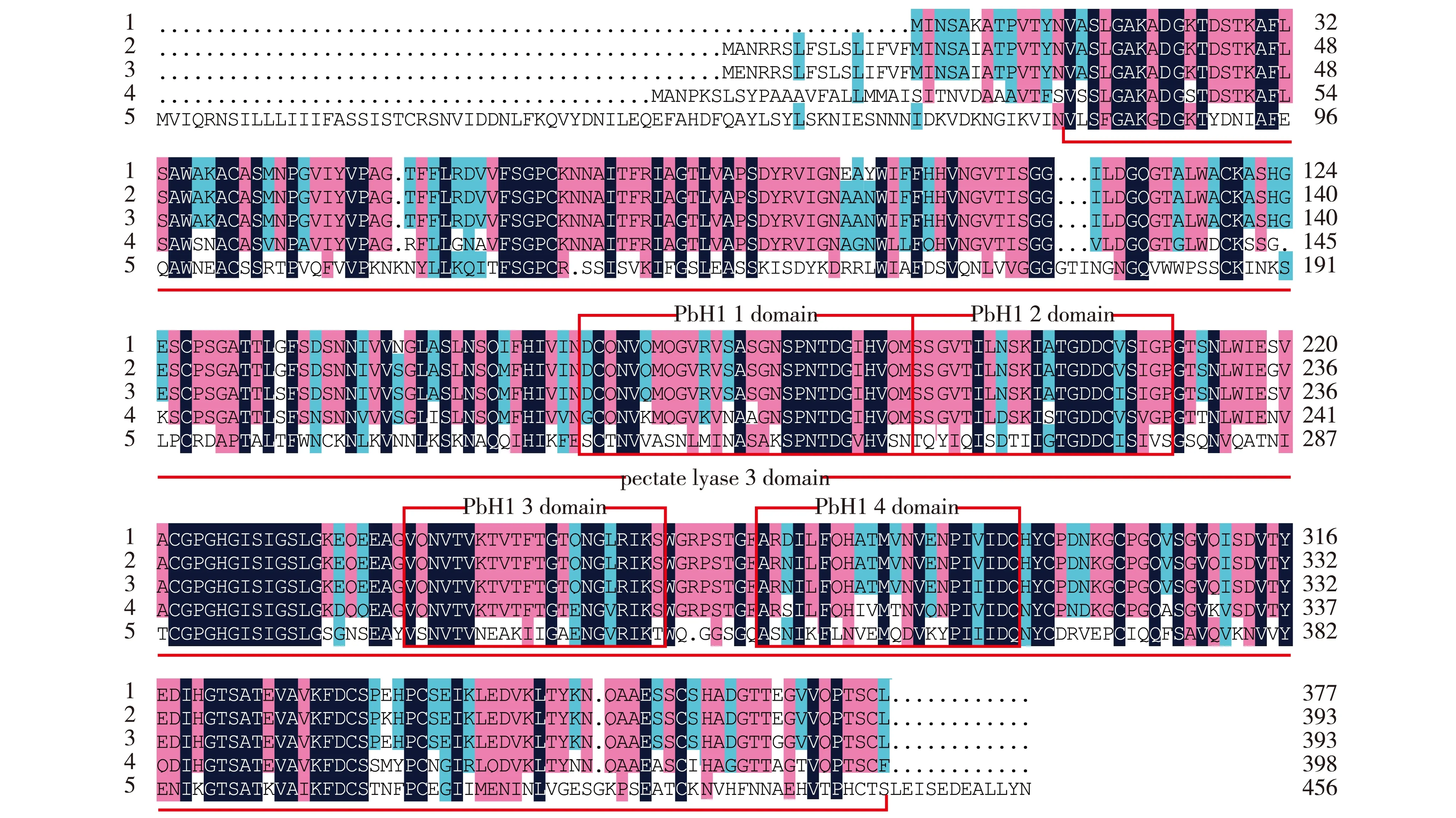
1: ‘槜李’Prunus salicina ‘Zuili’; 2: Prunus persica (Linn.) Batsch; 3: Prunus armeniaca Linn.; 4: 西洋梨Pyrus communis Linn.; 5: Solanum lycopersicum Linn.图2 ‘槜李’PsPG基因与其他4种植物PG基因编码的氨基酸序列的多重比对结果Fig. 2 Alignment result of amino acid sequences encoded by PsPG gene from Prunus salicina ‘Zuili’ and PG genes from other four species
PsPG基因编码的氨基酸序列与Prunuspersica的3个PG基因编码的氨基酸序列(AAC64184、AAP21999和ABV32553)的相似度高达98%,与Prunusarmeniaca的2个PG基因编码的氨基酸序列(ADT82706和AFD62267)的相似度在96%以上,与西洋梨的3个PG基因编码的氨基酸序列(CAH18935、BAF42034和BAC22689)以及沙梨〔Pyruspyrifolia(Burm. f.) Nakai〕(AER27668)、Pyrus×bretschneideriRehd.(AGR44470)、甜橙〔Citrussinensis(Linn.) Osbeck〕(KDO51591)和葡萄(CAN78679)的PG基因编码的氨基酸序列的相似度介于72%~79%之间。
基于‘槜李’PsPG基因与其他8种植物PG基因编码的氨基酸序列构建系统树,结果见图3。由图3可以看出:所选大部分植物的PG基因编码的氨基酸序列具有较高的同源性。‘槜李’PsPG基因编码的氨基酸序列与Prunuspersica(AAC64184)和Prunusarmeniaca(ADT82706)的PG基因编码的氨基酸序列的亲缘关系最近,与西洋梨(CAH18935)、沙梨(AER276668)和Pyrus×bretschneideri(AGR44470)的PG基因编码的氨基酸序列的亲缘关系也较近,与甜橙(KDO51591)、葡萄(CAN78679)和大桉(EucalyptusgrandisW. Hill ex Maiden)(KCW57484)的PG基因编码的氨基酸序列的亲缘关系较远。

节点处数据表示自展值 Datums on the nodes indicate the bootstrap values. 1: ‘槜李’Prunus salicina ‘Zuili’; 2: Prunus persica (Linn.) Batsch; 3: 西洋梨Pyrus communis Linn.; 4: 沙梨Pyrus pyrifolia (Burm. f.) Nakai; 5: Prunus armeniaca Linn.; 6: Pyrus×bretschneideri Rehd.; 7: 甜橙Citrus sinensis (Linn.) Osbeck; 8: 大桉Eucalyptus grandis W. Hill ex Maiden; 9: 葡萄Vitis vinifera Linn.图3 基于‘槜李’PsPG基因与其他8种植物PG基因编码的氨基酸序列的系统树Fig. 3 Phylogenetic tree based on amino acid sequences of PsPG gene from Prunus salicina ‘Zuili’ and PG genes from other eight species
2.3 不同采后处理和贮藏条件下‘槜李’PsPG基因的表达模式分析
不同采后处理和贮藏条件下‘槜李’PsPG基因的相对表达量见图4。结果显示:低温贮藏和减压浸钙处理条件下,‘槜李’PsPG基因的相对表达量缓慢升高,贮藏5 d时达到最高值,随后急剧降低(图4-A,C),且贮藏5 d时果实完全软化,PsPG基因的相对表达量分别约为同时期室温贮藏条件下的30和60倍。1-甲基环丙烯(1-MCP)处理条件下,贮藏3 d时PsPG基因的相对表达量急剧升高至最高值,随后迅速降低(图4-B)。
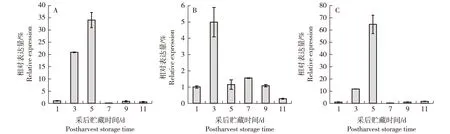
A: 低温贮藏Low temperature storage; B: 1-甲基环丙烯(1-MCP)处理1-methylcyclopropene (1-MCP) treatment; C: 减压浸钙处理Immersed in Ca2+ solution with decompression treatment.图4 不同采后处理和贮藏条件下‘槜李’PsPG基因的相对表达量Fig. 4 Relative expression of PsPG gene from Prunus salicina ‘Zuili’ in different postharvest treatments and storage conditions
3 讨论和结论
3.1 PsPG蛋白的结构域与果实软化关系密切
‘槜李’PsPG基因中的果胶酸裂解酶3结构域具有类果胶酸裂解酶的β螺旋,其与糖苷水解酶第28家族(glycoside hydrolase,family 28,GH28)密切相关,这些酶对细胞壁的代谢与降解具有重要作用。此外,在果胶酸裂解酶3结构域内还含有4个平行β螺旋重复(parallelβhelix repeats,PbH1)结构域,该区域是β片层垛叠区,可以形成较大的螺旋结构,具有催化多糖水解的活性[15]。这说明PsPG蛋白与果实软化关系密切。
3.2 低温有利于‘槜李’果实采后贮藏保鲜
目前,已有许多报道较为深入地研究了低温胁迫对果实品质和代谢的影响。首先,低温使代谢过程中许多酶的活性减弱,并抑制乙烯的生物合成;其次,低温能有效抑制微生物生长,减少腐烂病发生。不同品种果实在不同温度下的耐受能力不同。李(PrunussalicinaLinn.)、杏李(P.simoniiCarr.)和欧洲李(P.domesticaLinn.)部分品种在室温条件下可贮藏20~30 d,在温度4 ℃和空气相对湿度90%~95%条件下贮藏时间可达50 d[16];‘金太阳’杏(Armeniacavulgaris‘Golden sun’)在温度(0±1) ℃和空气相对湿度90%~95%条件下可贮藏40~50 d,失重率仅为0.2%,可加工果率高达96%[17];汪开拓等[18]研究认为,采用1 ℃贮藏杨梅〔Myricarubra(Lour.) Sieb. et Zucc.〕果实较5 ℃或10 ℃贮藏更为显著地延缓了果实软化,并降低了果实腐烂率,从而有效延长了果实贮藏期。本研究中,低温〔(4±1)℃〕贮藏条件下‘槜李’果实硬度的降幅较室温〔(25±1)℃〕贮藏条件下明显减小,说明低温贮藏有利于保持‘槜李’果实的商品品质。此外,结合本研究中1-甲基环丙烯(1-MCP)处理和减压浸钙处理在抑制‘槜李’果实软化相关基因的表达上的作用,推测在1-MCP处理或减压浸钙处理后采用低温贮藏可进一步延长货架期和保持良好的风味品质。
3.3 PsPG基因参与‘槜李’果实软化过程
多聚半乳糖醛酸酶是植物体内水解果胶物质的基础酶[19],其基因的表达与果胶变性和细胞壁结构变化密切相关[20]。研究结果表明:在不同种类果实软化过程中,PG基因的表达增加,同时伴随着果胶聚合物的变性和果实的软化[10,20]。结合不同采后处理和贮藏条件下‘槜李’果实硬度变化趋势和PsPG基因表达模式推测,在果实完全软化前,PsPG基因转录水平升高;当果实完成软化后,负反馈机制抑制该基因的进一步表达,说明PsPG基因参与了‘槜李’果实软化的某些阶段。
乙烯是一种内源性的气态植物激素,调控果实的发育进程。Kyte等[21]在PG基因启动子序列中发现乙烯应答元件,PG基因的表达和内源乙烯释放量的增加在时间上有紧密相关性。1-MCP为乙烯受体抑制剂,能够高效抑制内源乙烯的释放。本研究中,在1-MCP处理条件下,‘槜李’PsPG基因的表达模式与其果实硬度的下降趋势相对应,PsPG基因表达受抑制,果实硬度下降趋势减缓,表明PsPG基因受乙烯调控参与‘槜李’果实软化。在果实软化初期,PsPG基因响应乙烯信号,表达量升高,激活了多聚半乳糖醛酸酶活性促进果实软化;当果实完全软化后,不再需要多聚半乳糖醛酸酶发挥功能,乙烯信号减弱并协同负反馈机制阻断PsPG基因进一步表达。但具体响应机制仍需RNAi技术结合目的基因的遗传转化来进一步深入阐明。
钙是果树必不可缺的矿质营养元素,也是一种多功能的细胞信号分子,其在果实生长发育进程中发挥着极其重要的作用。而在果实软化方面,Silveira等[22]研究认为,外源补钙主要是增加组织中自由钙离子(Ca2+)和结合钙含量,促进Ca2+与果胶的相互交链,减少细胞内酶通过细胞壁与底物接触的机会,从而有效地减缓果实的软化。在本研究中,采用减压浸钙处理和低温处理一方面延缓了‘槜李’PsPG基因表达,另一方面明显提高了PsPG基因的表达水平,由此推测,PsPG基因不仅参与了‘槜李’果实软化过程,同时能响应Ca2+和低温诱导参与其他重要生化过程。其原因可能是,Ca2+通过诱导果实中PsPG基因大量表达,激活了果实内多聚半乳糖醛酸酶活性,从而增加了其与底物的接触机会,完成果实软化过程。另外,PsPG基因表达上升阶段主要发生在‘槜李’果实快速软化阶段,说明多聚半乳糖醛酸酶是参与果实软化的诱导酶,而非启动酶。
3.4 结论
综合研究结果显示:‘槜李’果实在贮藏过程中,果实硬度呈下降趋势,1-MCP处理、减压浸钙处理和低温贮藏可以明显延缓果实硬度下降。PsPG基因的相对表达量呈现先升高后降低的趋势,PsPG基因可受到1-MCP的抑制,并能够明显响应Ca2+诱导。低温贮藏是‘槜李’果实采后品质保鲜的有效手段,可以抑制PsPG基因的表达以延缓果实软化过程。本研究结果为进一步揭示‘槜李’果实贮藏和软化机制提供了科学依据。
[1] GIOVANNONI J J, DELLAPENNA D, BENNETT A B, et al. Expression of a chimeric polygalacturonase gene in transgenic rin (ripening inhibitor) tomato fruit results in polyuronide degradation but not fruit softening[J]. The Plant Cell, 1989, 1: 53-63.
[2] JOHNSTON J W, HEWETT E W, HERTOG M L A T M, et al. Postharvest softening of apple (Malusdomestica) fruit: a review[J]. New Zealand Journal of Crop and Horticultural Science, 2002, 30: 145-160.
[3] 李 慧, 丛 郁, 常有宏, 等. 翠冠梨PG基因家族两成员的克隆及其表达与货架期果实软化的关系[J]. 果树学报, 2012, 29(1): 17-23.
[4] GHIAI A, ONELLI E, AINA R, et al. A comparative study of melting and non-melting flesh peach cultivars reveals that during fruit ripening endo-polygalacturonase (endo-PG) is mainly involved in pericarp textural changes, not in firmness reduction[J]. Journal of Experimental Botany, 2011, 62: 4043-4054.
[5] IGLESIAS-FERNANDEZ R, MATILLA A J, RODRIGUEZ-GACIO M C, et al. The polygalacturonase genePdPG1 is developmentally regulated in reproductive organs ofPrunusdomesticaL. subsp.insititia[J]. Plant Science, 2007, 172: 763-772.
[6] HADFIELD K A, BENNETT A B. Polygalacturonases: many genes in search of a function[J]. Plant Physiology, 1998, 117: 337-343.
[7] 陈义挺, 赖瑞联, 程春振, 等. 猕猴桃果实软化过程中AcPG基因的克隆与表达[J]. 农业生物技术学报, 2017, 25(2): 205-213.
[8] HADFIELD K A, ROSE J K C, YAVER D S, et al. Polygalacturonase gene expression in ripe melon fruit supports a role for polygalacturonase in ripening-associated pectin disassembly[J]. Plant Physiology, 1998, 117: 363-373.
[9] NUNAN K J, DAVIES C, ROBINSON S P, et al. Expression patterns of cell wall-modifying enzymes during grape berry development[J]. Planta, 2001, 214: 257-264.
[10] HIWASA K, KINUGASA Y, AMANO S, et al. Ethylene is required for both the initiation and progression of softening in pear (PyruscommunisL.) fruit[J]. Journal of Experimental Botany, 2003, 54: 771-779.
[11] SALENTIJN E M J, AHARONI A, SCHAART J G, et al. Differential gene expression analysis of strawberry cultivars that differ in fruit-firmness[J]. Physiologia Plantarum, 2003, 118: 571-578.
[12] 宣继萍, 贾展慧, 钱美华, 等. 李果实果肉组织RNA提取方法的比较分析[J]. 北方园艺, 2015(22): 106-110.
[13] TAMURA K, DUDLEY J, NEI M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24: 1596-1599.
[14] WANG G, LOVATO A, LIANG Y H, et al. Validation by isolation and expression analyses of the mitogen-activated protein kinase gene family in the grapevine (VitisviniferaL.)[J]. Australian Journal of Grape and Wine Research, 2014, 20: 255-262.
[15] HEFFRON S, MOE G R, SIEBER V, et al. Sequence profile of the parallel parallelβhelix in the pectate lyase superfamily[J]. Journal of Structural Biology, 1998, 122: 223-235.
[16] 张加延. 中国果树科学与实践: 李[M]. 西安: 陕西科学技术出版社, 2015: 33-53.
[17] 王淑贞, 鲁墨深, 张 静. 金太阳杏的贮藏保鲜试验初报[J]. 落叶果树, 2001, 33(4): 35-36.
[18] 汪开拓, 廖云霞, 阚建全, 等. 杨梅采后低温贮藏期间蔗糖代谢酶活性与果实花色苷合成关系的研究[J]. 西南大学学报(自然科学版), 2014, 36(12): 1-7.
[19] POOVAIAH B W, NUKAYA A. Polygalacturonase and cellulase enzymes in the normal Rutgers and mutant rin tomato fruits and their relationship to the respiratory climacteric[J]. Plant Physiology, 1979, 64: 534-537.
[20] ROSE J K C, HADFIELD K A, LABAVITCH J M, et al. Temporal sequence of cell wall disassembly in rapidly ripening melon fruit[J]. Plant Physiology, 1998, 117: 345-361.
[21] KYTE J, DOOLITTLE R F. A simple method for displaying the hydropathic character of a protein[J]. Journal of Molecular Biology, 1982, 157: 105-132.
[22] SILVEIRA A C, AGUAYO E, CHISARI M, et al. Calcium salts and heat treatment for quality retention of fresh-cut ‘Galia’melon[J]. Postharvest Biology and Technology, 2011, 62: 77-84.
CloningandexpressionanalysisonfruitsofteningrelatedgenePsPGfromPrunussalicina‘Zuili’
WANG Gang, JIA Zhanhui, ZHANG Jiyu, JIA Xiaodong, WANG Tao, WENG Wenxin, XUAN Jiping①, GUO Zhongren①
(Institute of Botany, Jiangsu Province and Chinese Academy of Sciences, Nanjing 210014, China),J.PlantResour. &Environ., 2017,26(4): 60-66
Dynamic changes in fruit firmness ofPrunussalicina‘Zuili’ in the conditions of room temperature 〔(25±1) ℃〕 storage, low temperature 〔(4±1) ℃〕 storage, 1-methylcyclopropene (1-MCP) treatment, and immersed in Ca2+solution with decompression treatment were studied, polygalacturonase gene (PsPG) fromP.salicina‘Zuili’ was cloned, and its bioinformatics and expression were analyzed. The results show that low temperature storage, 1-MCP treatment, and immersed in Ca2+solution with decompression treatment can effectively retard the decrease of fruit firmness ofP.salicina‘Zuili’. The length of open reading frame (ORF) ofPsPGgene fromP.salicina‘Zuili’ is 1 134 bp, which encodes 377 amino acids. The secondary structure of PsPG protein includes 11.14% ofαhelix, 31.03% ofβsheet, and 57.82% of random coil. The result of bioinformatics analysis shows that PsPG protein has pectate lyase 3 domain and four PbH1 domains; the relationships among amino acid sequences encoded byPsPGgene andPGgenes fromPrunuspersica(Linn.) Batsch andPrunusarmeniacaLinn. are close, with similarity more than 96%. The result of qRT-PCR analysis shows that with prolonging of postharvest storage time, all relative expressions ofPsPGgene increase firstly and then decrease in the conditions of low temperature storage, 1-MCP treatment, and immersed in Ca2+solution with decompression treatment, and reach the peak value when stored for 5, 3, and 5 d, respectively. It is suggested thatPsPGgene fromP.salicina‘Zuili’ has a close relationship with its fruit softening, low temperature storage is effective measure to retain freshness of fruit ofP.salicina‘Zuili’ after harvest, which can inhibit expression ofPsPGgene to postpone fruit softening.
Prunussalicina‘Zuili’;PsPGgene; cloning; gene expression; fruit softening
Q943.2; S662.3
A
1674-7895(2017)04-0060-07
10.3969/j.issn.1674-7895.2017.04.08
2017-03-23
国家科学技术部“十二五”农村领域国家科技计划项目(2014BAD16B04)
王 刚(1984—),男,山西兴县人,博士,助理研究员,主要从事果树遗传育种方面的研究。
①通信作者E-mail: xuanjiping@cnbg.net; zhongrenguo@cnbg.net
张明霞)

