基于三重表征的『弱电解质的电离』教学设计
文华中师范大学龙岗附属中学 周鹏
基于三重表征的『弱电解质的电离』教学设计
文华中师范大学龙岗附属中学 周鹏
1982年苏格兰格拉斯哥大学科学教育中心的约翰斯顿(A.H.Johnstone)教授提出学习化学的三重表征以来,三重表征的研究就受到了国外化学教育专家的重视。化学三重表征指的是宏观知识、微观知识及符号知识的外在呈现形式和在头脑中的加工与呈现形式。建立“宏观—微观—符号”三者之间的内在联系是化学学科特点所采用的有效学习方法。在人教版化学选修4第三章第一节“弱电解质的电离”教学中,笔者采用了“识、明、破、练、解”策略组织教学,帮助学生完成从三重表征上认识和深化弱电解质的电离。
一、识:认识弱电解质
问题1:请同学们仔细观察实验,能获取哪些客观事实?
演示实验:测定浓度均为0.1mol/LHCl、CH3COOH溶液的pH。
【生】客观事实:HCl溶液pH为1.0;CH3COOH溶液pH为2.9。
【师】宏观现象pH有差别,说明两种溶液中的H+的浓度是不同的。相同浓度的盐酸和醋酸中H+的浓度却不相同,说明HCl和CH3COOH的电离程度不同。
问题2:请你分析电离的微观本质。
【生】微观本质:HCl在水溶液中全部电离生成H+和Cl-;CH3COOH在水溶液中只有部分电离生成CH3COO-和H+。
【师】电解质在水中电离程度是有强、弱之分。能够全部电离的电解质为强电解质,如强酸、强碱和盐;反之只有部分电离的电解质称为弱电解质,如弱酸和弱碱。像醋酸等弱电解质的电离过程有什么特殊之处?
【生】产生的离子在溶液中相互碰撞又会结合成分子,即为可逆过程。
问题3:请你用适当的方法表示电离过程
【生】CH3COOH⇆CH3COO_+H+
二、明:明确弱电解质的电离平衡
问题4:请同学们仔细观察实验,能获取哪些客观事实?
演示实验:6mL 8mol/L甲酸和6mL 0.04mol/L盐酸导电性测定
【生】接通电路后,两边灯泡亮度相同。往甲酸中注入蒸馏水后,灯泡逐渐变亮而后又变暗;盐酸中注蒸馏水灯泡很快就变暗。
【师】结合可逆反应特点,分析甲酸一侧灯泡亮度变化原因。
【生】注入蒸馏水后,破坏甲酸原有电离平衡,使平衡向电离方向移动,电离程度增大,c(H+)、c(HCOO-)浓度增大,灯泡变亮;再继续稀释,电离程度继续增大,但浓度逐渐减小,灯泡变暗。
三、破:突破电离平衡常数
问题5:请同学们仔细观察实验,能获取哪些客观事实?
演示实验:向两支分别盛有0.1mol/L醋酸和苯酚的试管中滴加等浓度Na2CO3溶液,观察现象。
【生】醋酸能与碳酸钠溶液反应,生成气体,而苯酚则不能。
【师】通过以上实验现象,可以定性分析说明三者酸性强弱为:醋酸>碳酸>苯酚。能否用定量分析三者酸性强弱?
【生】电离常数相对大小
问题6:什么是电离平衡常数?有什么特点?对于弱电解质AmBn,怎样书写电离平衡常数表达式?
【生】与化学平衡类似,电离平衡的平衡常数,就是电离平衡常数,用k表示,只受物质的结构和温度影响。
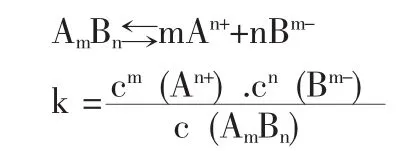
弱酸用ka,弱碱用kb。分子中含有两个或两个以上可电离H+的多元弱酸的电离是分步进行的。
【师】一般K1》K2》K3,即第二电离通常比第一步电离难得多,第三步电离又比第二步电离难得多。因此计算多元弱酸的c(H+)及比较弱酸酸性相对强弱时,通常只考虑第一步电离。
四、练:练习电离平衡常数的应用
练习:常温下,将0.1 mol/L的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是()
A.CH3COOH的电离平衡常数增大为原来的10倍
B.CH3COO-与CH3COOH的浓度之比增大为原来的10倍
C.CH3COO-与H+的浓度之积减小为原来的
D.CH3COOH与CH3COO-的浓度之和减小为原来的
五、解:理解电离平衡常数的意义
问题7:请从定性和定量的视角,描述弱电解质电离的特征
【生】从定性的角度讲:弱酸、弱碱的电离出H+和OH-是引起水溶液成酸性、成碱性的客观事实,根据酸、碱性强弱同时也可以从微观上解释弱电解质电离的本质和规律;从定量的角度讲:电离平衡常数表示了弱电解质电离的程度及强弱。
责任编辑 韦英哲

