福建武夷山的野生干巴菌Thelephoraganbajun Zang新分布
蔡程山, 张 英, 张雨森, 赵国柱
(北京林业大学生物科学与技术学院,北京 100083)
福建武夷山的野生干巴菌ThelephoraganbajunZang新分布
蔡程山, 张 英, 张雨森, 赵国柱
(北京林业大学生物科学与技术学院,北京 100083)
对福建武夷山疑似野生干巴菌的子实体,标本编号GB-WYS,进行形态和分子鉴定.ITS-5.8S rDNA扩增测序,获得656 bp核酸片段,与GenBank中产自云南的干巴菌同源比对分析,同源性达91%~94%.系统发育分析显示:GB-WYS与云南干巴菌以及干巴菌模式标本同属于一大的分支,又产生一定分化.结合形态特征、分子鉴定及生境特点将GB-WYS鉴定为干巴菌,并推断由于地理隔离,GB-WYS与云南的干巴菌存在一定的遗传分化.这是我国云南省之外罕见报道的野生干巴菌的新分布,扩大了干巴菌的生境范围,为其生态研究、保护开发等提供参考.
菌根真菌; 分类; 生态; 革菌
干巴菌ThelephoraganbajunZang为担子菌门革菌目革菌科革菌属[1],又称松毛菌、绣球菌、对花菌、马牙菌.子实体莲花片状,纤维革质,高5~14 cm, 阔4~14 cm,灰色或灰棕色,幼时柔软,老后干韧.干巴菌是野生食用菌中的上品,菌香浓郁、生尝微甘,似有海藻气味,肉质坚韧,有腌牛肉干的浓郁香味,民间俗称“干巴”,因而得名干巴菌.干巴菌营养丰富,含有钙、铁、蛋白质、硫胺素等多种微量元素,具有抗氧化物质,能清除人体内的自由基,延缓衰老,强身健体等功效[2].它含有核苷酸、多糖等物质,有助于降低胆固醇,调节血脂,提高免疫力等[3-5],而且对HIV逆转录酶有抑制作用[6],抑制肿瘤细胞增殖等[7].
现有文献中干巴菌大多记载为我国云南省特有的野生食用菌[8],以滇中高原为主,主产地为昆明、玉溪、曲靖、楚雄等[9],多分布于600~2 500 m海拔的松林地带.每年七月到九月生长在马尾松、思茅松、云南松等林地上,并形成外生菌根[10].由于独特的地理生境、较高的经济食用价值和难以人工栽培等特点,自然资源极其有限.已有的研究多集中在云南省的干巴菌,包括分类、 菌种分离、营养成分测定等,云南之外,鲜有报道.
武夷山位于福建省西北部,东经117°37′22″—118°19′44″,北纬27°27′31″—28°04′49″,属中亚热带地区,四季气温较均匀、温和湿润,年平均气温12~13 ℃,降水量在2 000 mm以上,平均相对湿度高达85%,是福建省降水量最多的地区.武夷山国家自然保护区保存了世界同纬度带最完整、最典型、面积最大的中亚热带原生性森林生态系统,该保护区动植物菌类繁多,生物多样性丰富.笔者于2015年7月,在武夷山的大型菌物考察中,采集到一份疑似野生干巴菌标本,因该菌大多报道分布于我国云南,生境比较特殊,遂对其展开进一步的形态与分子研究,以明确我国云南之外(武夷山)是否分布野生干巴菌,为干巴菌的生境生态研究、保护应用开发等提供参考.
1 材料与方法
1.1 研究标本
2015年7月在福建武夷山黄岗山大峡谷松树阔叶树混交林地采集标本,编号GB-WYS;2016年8月在云南南华县食用菌交易市场购得云南新鲜干巴菌,编号GB-YNNH.
1.2 样品鉴定
1.2.1 形态学鉴定 对采集的标本进行形态学鉴定,包括子实体宏观特征,如大小、颜色、质地、菌片厚度等.在KOH,棉蓝,Melzer试剂中进行显色反应.微观特征包括:体视镜观察、显微镜观察、扫描电镜观察.体视镜下观察时,清除样本表面根部泥土,昆虫粪便等杂质,观察解剖特征等.显微镜观察,用无菌的镊子和剪刀剪取洁净的支片,制切片,于显微镜下观察菌丝组织结构,孢子形态特征.扫描电镜观察,用无菌的剪刀和镊子剪取0.5 cm×0.5 cm大小的干燥洁净组织块,用导电的双面胶粘贴在金属板上,放在小型离子溅射仪中镀金后,于扫描电镜下观察,拍照.
1.2.2 分子鉴定 DNA提取:取子实体干标本样品0.1 g,于灭菌好的研钵中研磨至粉末,采用上海浩然生物技术有限公司生产的真菌DNA小量提取试剂盒,按说明书步骤进行.ITS-5.8S rDNA区域的特异性PCR扩增:上游引物为ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′,下游引物为 ITS4:5′-TCCTCCGCTTATTGATATGC-3′[11].PCR反应体系(50 μL):Mix 25 μL,引物 ITS4、ITS5(20 μmol·L-1)各1 μL,DNA模板2 μL,加双蒸水(ddH2O)至50 μL.PCR反应条件:94 ℃预变性10 min,94 ℃变性15 s,55 ℃退火30 s,72 ℃延伸40 s,共35个循环,最后72 ℃延伸7 min.PCR产物检测:取5 μL产物加1 μL 6×上样缓冲液于含Goldview的1.5%琼脂糖凝胶中电泳检测,PCR产物由北京睿博兴科测序生物公司纯化并测序.
基于rDNA ITS 序列构建系统发育树:使用多重序列比对分析软件BioEDIT对所得 ITS序列与GenBank中已公布的同属多株代表菌株以及干巴菌模式标本序列(云南大学王鹏飞博士论文中获取的干巴菌模式标本ITS序列)[12]进行比对(Alignment).应用 MEGA 6.0软件进行分析,采用邻近连接法(Neighbor-Joining Method)进行聚类分析,选取Thelephoraregularis(U83485.1)做系统发育树的外群,以自展法(bootstrap)进行显著性分析检验,重复1000次[13].
2 结果与分析
2.1 形态学鉴定
GB-WYS:子实体子层高3~12 cm,直径5~13 cm,珊瑚状多次分支,基部肉质较厚,沿子实体菌片向上依次裂成扇形或扫梳状小分支,顶端的小枝片高5 cm,多次分支,小支片边缘锯齿状.子实体整体灰褐色,有浓郁的菌香(图1A).在普通光学显微镜下(400倍)可以看到大量的担孢子,孢子边缘不整齐,有疣突(图1C),菌丝体扭结清晰可见.孢子和菌丝体在棉兰试剂中有明显的嗜蓝反应,KOH反应呈蓝色; Melzer试剂反应呈蓝黑色.扫描电镜观察,可以清晰看到孢子,担孢子(7~12)μm×(6~8) μm,通常圆球型,淡褐色,有时失水多有变形,褶皱,多角形,有疣突(图1B、D).菌丝粗4~6 μm,具锁状联合,透明,尖端扭曲.
2.2 分子鉴定
对武夷山采集到的疑似干巴菌子实体标本GB-WYS和云南的干巴菌GB-YNNH,分别提取DNA后,PCR扩增ITS-5.8S rDNA基因区段,产物电泳可见650 bp左右的清晰电泳条带(图2).两份标本均成功扩增了ITS-5.8S rDNA区段.
干巴菌GB-WYS测序结果显示,ITS区(包含5.8S rDNA)全长656 bp(KU847425),GC含量51.37%.将GB-WYS、GB-YNNH、干巴菌模式标本(云南大学王鹏飞博士论文中获取的干巴菌模式标本ITS序列,未在GenBank中到)[12]以及GenBank中Gb001、Gb077和Gb259等基因序列[14]输入到ClustalW软件中分析,发现GB-WYS样本扩增序列含有缺失位点3个,插入位点2个,碱基突变位点33个.
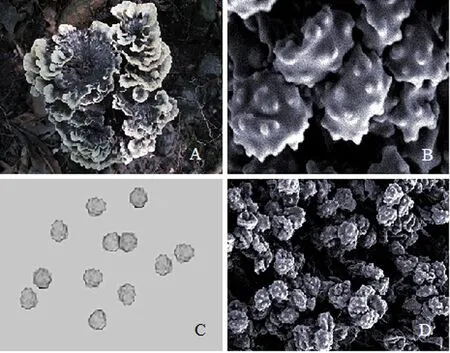
A:子实体;B,D:扫描电镜下的干巴菌担孢子,表面具有明显的疣突;C:普通光学显微镜下的担孢子.图1 福建武夷山的干巴菌(GB-WYS)形态学分析Fig.1 T.ganbajun Zang (GB-WYS) collected from Wuyi Mountain, Fujian
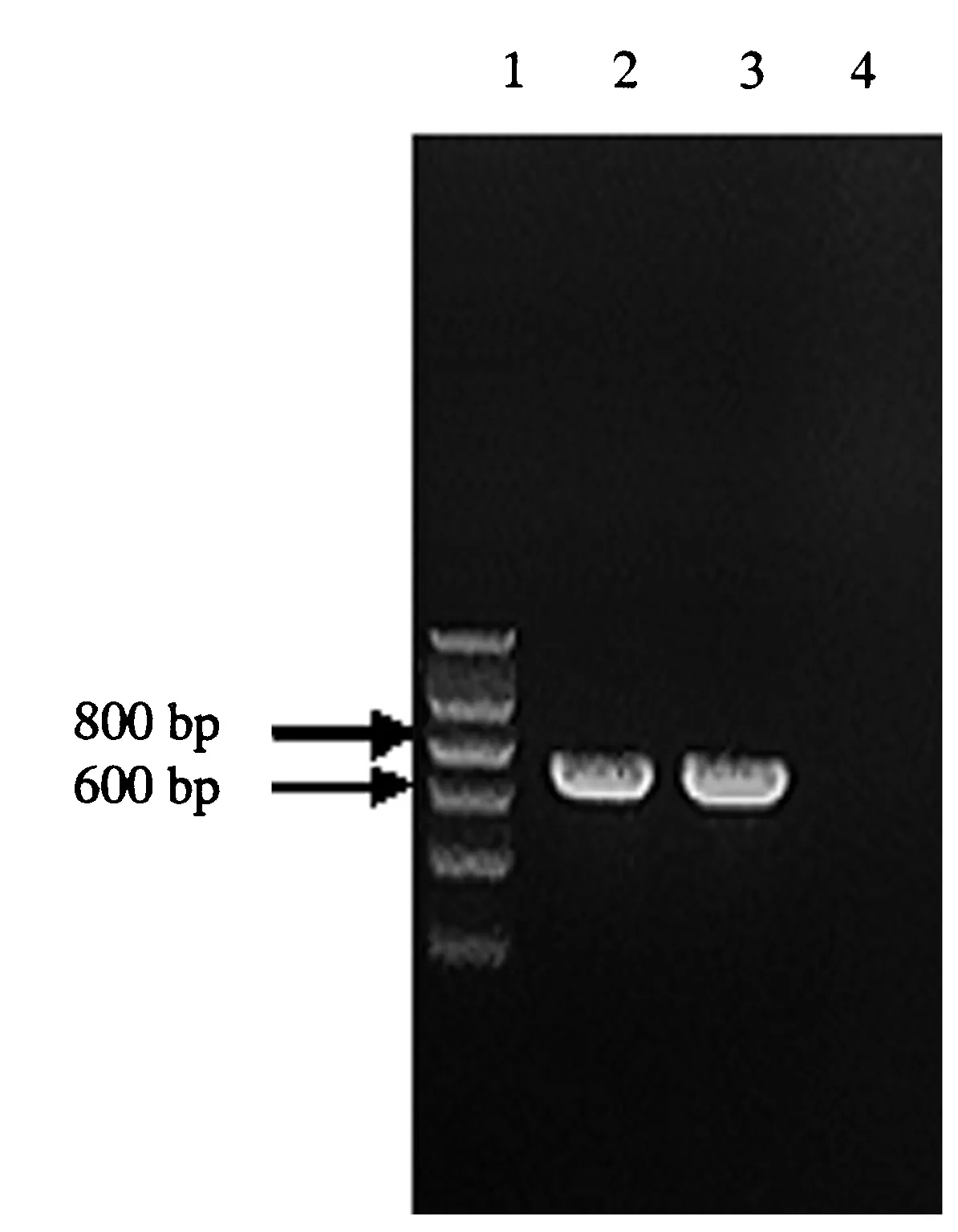
1.Marker;2.武夷山的干巴菌GB-WYS;3.云南的干巴菌 GB-YNNH;4.阴性对照.图2 干巴菌的ITS-5.8S rDNA片段PCR产物电泳结果Fig.2 PCR electrophoresis of ITS-5.8S rDNA of T.ganbajun Zang
从GenBank筛选革菌属Thelephora,毛革菌属Tomentella,两属5个干巴菌相似种(Tomentellasublilacina、Tomentellasubtestacea、Thelephoraversatilis、Thelephoracaryophyllea、Thelephoraterrestris)共10份标本的ITS-5.8S rDNA序列(每种2个标本/菌株序列),与模式标本T.ganbajunfruit type[12],GB-WYS、GB-YNNH以及GenBank中干巴菌Gb001、Gb077和Gb259标本的ITS-5.8S rDNA序列构建系统发育树(图3).可以明确看出武夷山的干巴菌GB-WYS和干巴菌模式标本[12],GB-YNNH以及Gb001、Gb077和Gb259菌株分布在同一大分支上,支持率(Bootstrap值)高于96%,而与革菌科下的其它属种距离较远.结合形态特征,确定武夷山的标本GB-WYS为干巴菌T.ganbajunZang.但是在系统发育树上,武夷山的干巴菌GB-WYS与云南的干巴菌存在一定的分化,分析可能是地理隔离造成的.
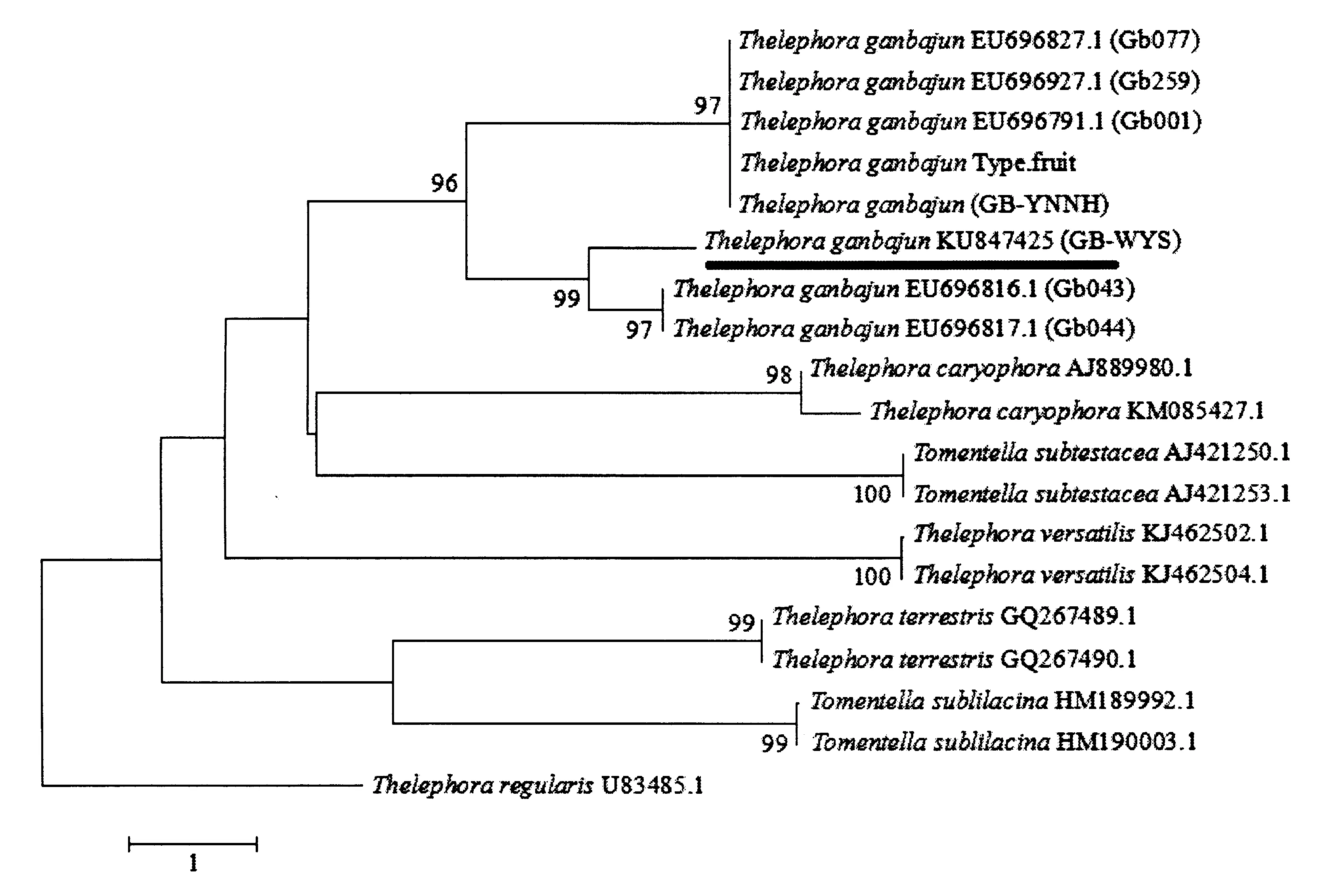
T.regularis为外群.图3 基于rDNA-ITS序列构建的干巴菌GB-WYS的N-J系统发育树Fig.3 N-J phylogenetic tree of rDNA-ITS of T.ganbajun Zang GB-WYS
3 讨论
干巴菌在我国云南采食历史悠久,但分类学地位一直存在争议,长期被认为是绣球菌Sparassiscrispa(Wulf.) Fr.,直到臧穆系统研究和比较之后,认为干巴菌并非绣球菌,并建立一新种T.ganbajunZang,才得以澄清[15].民间人们平常所习称的干巴菌除了干巴菌(T.ganbajunZang),也常包含莲座革菌(T.vialisSchwein)和橙黄革菌(T.aurantiotinctaCorner)[4].在诸多文献报道中,干巴菌常作为我国云南特有的种类,然而近年对福建莆田老鹰尖自然保护区、安徽鹞落坪自然保护区、江西省、四川省等地的大型真菌考察,偶有报道野生干巴菌的存在,但未见详细的形态描述和分子鉴定[16-19].林汝楷等曾对武夷山进行系统的大型真菌资源考察,采集大型真菌标本827份,共鉴定232种,食用菌102种,均未见干巴菌的报道[20].笔者在福建武夷山的考察发现疑似野生干巴菌,子实体宏观与显微形态特征与云南报道的较为吻合,然而分子鉴定结果存在一定差异.
通过对标本ITS-rDNA序列对比分析,发现武夷山的干巴菌GB-WYS比云南的干巴菌类群多个基因突变位点.在系统发育树上,虽然聚在一个大的分支上,但也表现出一定的遗传分化,这与王鹏飞对云南干巴菌群体的遗传学研究相吻合.他发现各基因的等位基因在云南滇中地区分布较多,少数具有明显独立遗传特性的群体分布于滇中之外的边缘地区中,说明基因流交汇区域为滇中,边缘地区因基因流较少而保留了少量的遗传分化特性[12].Sha et al[14]表示干巴菌的基因流动是有限的,云南同一地区内的遗传分化通常在7%以内,地区之间的遗传分化低于小于10%,说明云南省内不同地域的干巴菌也存在较大的遗传分化.福建武夷山与云南相距约2 000 km,因此判断云南干巴菌与福建武夷山干巴菌为两个独立的种群.对于存在地理隔离的不同群体来说,GB-WYS与云南的干巴菌类群同源性在91%~94%之间,群体之间可能因为缺乏基因交流而出现的遗传分化,属于种内变异,但也不能否认远距离的异域分化形成不同物种的可能.标本GB-WYS的外貌形态、气味(浓郁菌香)、孢子形态、生境等特点,均与云南干巴菌较为吻合[10,15],结合分子序列将其鉴定为干巴菌.由于获得的武夷山干巴菌标本数量有限,不排除将来获得大量标本材料进一步深入研究定为新种的可能.这是我国云南之外较为系统深入的干巴菌的研究报道,不但丰富了福建武夷山大型野生食用菌的种类,扩大了干巴菌的生境范围和地理分布,而且为干巴菌及其相关类群真菌的研究提供了重要信息.
干巴菌是一种外生菌根真菌,与伴生植物关系密切,另受气候、海拔、降雨量等环境因素影响.它的自然资源稀缺,虽然可以通过宜林地的管理、合理采集和人工促繁等方法来维持和增加自然产量[21],但尚未实现完全人工栽培.干巴菌市场的供应主要来自云南,完全依赖采集野生资源,简单索取、无序利用,野生干巴菌的自然资源和生态环境已受到严重破坏,价格逐年攀升[22],产量和质量逐年下降[23].如何合理的保护开发和利用,探索云南之外干巴菌适宜的栖息繁殖保护地,应引起人们的重视.本次云南之外的野生干巴菌报道,对其生态习性、基因的多样性、遗传发育进化,保护开发等具有重要参考.
[1] 李玉,李泰辉,杨祝良,等.中国大型菌物资源图鉴[M].郑州:中原农民出版社,2015:1 349.
[2] LIU J K, HU L, DONG Z J, et al. DPPH radical scavenging activity of ten natural p-terphenyl derivatives obtained from three edible mushrooms indigenous to China[J]. Chemistry & Biodiversity, 2004,1:601-605.
[3] 陈亚萍,邱幵雄,陈亚娟,等.干巴菌抗氧化活性研究[J].昆明医学院学报,2012,33(1):40-42.
[4] 傅四清,魏蓉城.干巴菌研究进展[J].林业科技通讯,1997(8):21-23.
[5] ZHAO Y Y, HOU B, TANG Z J, et al. Application of ultrasonics to enhance the efficiency of cleaningThelephoraganbajun[J]. Ultrasonics Sonochemistry, 2009,16:209-211.
[6] WANG H X, NG T B. Purification of a novel ribonuclease from dried fruiting bodies of the edible wild mushroomThelephoraganbajun[J]. Biochemical and Biophysical Research Communications, 2004,324:855-859.
[7] XU D P, ZHENG J, ZHOU Y, et al. Extraction of natural antioxidants from theThelephoraganbajunmushroom by anultrasound-assisted extraction technique and evaluation of antiproliferative activity of the extract against human cancer cells[J]. Molecular Sciences, 2016,17:1 664-1 679.
[8] ZHANG P, LUO X Y, WU Y, et al. Optimization of submerged fermentation ofThelephoraganbajunZang[J]. Journal of Basic Microbiology, 2014,54:866-872.
[9] 郭安,胡慧蓉,赵凤喜,等.云南优特野生食用菌——干巴菌的开发利用[J].西南林学院学报,1998,18(2):105-108.
[10] 臧穆.东喜马拉雅引人注目的高等真菌和新种[J].云南植物研究,1987,9(1):81-88.
[11] WHITE T J, BRUNS T, LEE S. Amplification and direct sequencing of fungal ribosomal RNA gene for phylogenetics[M]∥INNIS M A, GELFAND D H, SNINSKY J J, et al. PCR protocols: a guide to methods and application. San Diego: Academic Press, 1990:315-322.
[12] 王鹏飞.Thelephora-Tomentella分子系统发育及干巴菌群体遗传学和线粒体异质性研究[D].昆明:云南大学,2015.
[13] TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013,30(12):2 725-2 729.
[14] SHA T, XU J P, PALANICHAMY M G, et al. Genetic diversity of the endemic gourmet mushroomThelephoraganbajunfrom south-western China[J]. Microbiology, 2008,154:3 460-3 468.
[15] 臧穆.“干巴菌”考[J].食用菌,1986(4):1-2.
[16] 李碧琼,陈政明,卢翠香,等.莆田老鹰尖自然保护区野生食用菌资源调查[J].中国食用菌,2012,31(1):8-10.
[17] HE Y X, WU W B, LI N S. A checklist of macrofungi in yaoluoping nature reserve, Anhui[J]. Journal of Resources and Ecology, 2016,7(2):144-150.
[18] 张俊波,宋海燕,胡殿明.江西大型真菌名录调查初报[J].生物灾害科学,2016,39(1):113.
[19] 谭方河,王云璋.四川松树、桉树外生菌根菌种类调查[J].四川林业科技,2000,21(3):65-69.
[20] 林汝楷,郑群力,江宝兴,等.福建省武夷山风景名胜区大型真菌资源考察初报[J].食用菌学报,2010,17(1):86-94.
[21] 桂明英,刘落,朱萍,等.干巴菌生态学初步研究[J].西南农业学报,2005,18(3):325-327.
[22] HE J, ZHOU Z M, YANG H X, et al. Integrative management of commercialized wild mushroom: A case study ofThelephoraganbajunin Yunnan, Southwest China[J]. Environmental Management, 2011,48:98-108.
[23] 周志美,杨会贤,尚素.野生干巴菌人工促繁与保育技术措施研究[J].中国食用菌,2010,29(2):17-18.
AnewdistributionofThelephoraganbajunZanginWuyiMountain,Fujian,China
CAI Chengshan, ZHANG Ying, ZHANG Yusen, ZHAO Guozhu
(College of Biological Sciences and Biotechnology, Beijing Forestry University, Beijing 100083, China)
A suspected wildThelephoraganbajunspecimen (No.GB-WYS) was found in Wuyi Mountain, Fujian Province. A 656 bp ITS-5.8S rDNA sequence fragment was obtained from the fruiting body of GB-WYS, which shared 91%-94% similarity withT.ganbajunsequence from Yunnan. In the phylogenetic tree, GB-WYS clustered with those from Yunnan and type specimen, but with a short distance. Combined morphological characteristics, molecular identification and habitat characteristic of GB-WYS, it was identified asT.ganbajun. Meanwhile, we inferred that the geographical segregation resulted in a certain genetic differentiation between GB-WYS andT.ganbajunin Yunnan. This is a new distribution of wildT.ganbajunoutside Yunnan Province, which expanded the habitat range ofT.ganbajunand provided important reference for its ecological research, protection and development.
mycorrhizal fungi; taxonomy; ecology;Thelephora
2017-05-31
2017-08-13
国家自然科学基金资助项目(31570019, J1310005).
蔡程山(1990-),男,硕士研究生.研究方向:食药用真菌资源开发.Email:2862536108@qq.com.通讯作者赵国柱(1976-),男,博士,硕士生导师.研究方向:真菌分类和食药用菌资源开发.Email:zhaogz@im.ac.cn.
Q939.5
A
1671-5470(2017)06-0692-05
10.13323/j.cnki.j.fafu(nat.sci.).2017.06.015
(责任编辑:苏靖涵)

