小麦品种郑麦7698耐强光高温的生理机制
齐学礼,方宇辉,赵明忠,韩留鹏,郭 瑞,王会伟,胡 琳,许为钢
(河南省农业科学院小麦研究所/小麦国家工程实验室/农业部黄淮中部小麦生物学与遗传育种重点实验室/河南省小麦生物学重点实验室,河南郑州 450002)
小麦品种郑麦7698耐强光高温的生理机制
齐学礼,方宇辉,赵明忠,韩留鹏,郭 瑞,王会伟,胡 琳,许为钢
(河南省农业科学院小麦研究所/小麦国家工程实验室/农业部黄淮中部小麦生物学与遗传育种重点实验室/河南省小麦生物学重点实验室,河南郑州 450002)
为了阐明小麦品种郑麦7698耐强光高温的生理机制,以黄淮南片麦区区域试验对照品种周麦18和大面积推广品种矮抗58为对照,研究了该试验材料在强光、高温、强光高温交叉胁迫下的生理特性。结果表明,3种逆境对小麦叶片光合功能的影响程度依次为强光<高温<强光高温,且3个品种的耐强光高温特性存在显著差异。3种逆境胁迫处理下,郑麦7698的光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、PSⅡ最大光化学效率(Fv/Fm)、光化学猝灭(qP)的下降幅度均显著低于周麦18和矮抗58,相对电导率、丙二醛(MDA)含量、超氧阴离子生成速率、过氧化氢含量的上升幅度显著小于周麦18和矮抗58,超氧化物歧化酶、过氧化物酶和过氧化氢酶活性在逆境下的上升幅度显著高于周麦18和矮抗58,表现出较好的耐强光高温特性。综合分析表明,郑麦7698之所以较周麦18和矮抗58具有更好的耐强光高温特性,是因为其在逆境下具有较高水平的抗氧化酶活性,可有效清除活性氧类物质,降低其光合机构受损程度,从而维持较高水平的光合效率。
小麦;强光;高温;光合作用
灌浆期是小麦产量形成的关键时期,旗叶保持较高水平光合效率对其获得高产具有重要意义,然而在小麦灌浆期经常遇到强光、高温、干旱等不利环境因子,使小麦旗叶光合速率下降,影响小麦的灌浆特性,造成减产[1-3]。高温破坏植株叶片叶绿体结构,影响光合产物积累与运输[4],强光使小麦旗叶产生光抑制[5],与其他环境胁迫同时存在时,植物光合作用更易受到抑制和破坏[6-7]。在实际大田生态环境中小麦生育后期最常遇到强光和高温的交叉逆境胁迫,据报道河南省小麦灌浆期间,天气晴朗时全天可有2~4 h气温超过38 ℃,光强超过1 800 μmol·m-2·s-1[7]。前人研究多侧重在高温或者强光单一环境因子胁迫对小麦光合特性的影响,而对强光、高温、强光高温交叉胁迫,3种逆境胁迫同时进行研究的报道较少。之前我们研究了不同小麦品种在强光高温同时作用下的光合特性,结果表明小麦品种间的耐强光高温特性存在差异[8],而未阐明强光高温同时存在的情况下影响小麦旗叶光合特性的主要因素是高温还是强光,也未进一步研究品种间耐强光、高温、强光高温交叉胁迫的生理机制。本研究以河南省农业科学院小麦研究所分子育种研究室选育的高产优质多抗广适小麦品种郑麦7698、黄淮麦区区试对照品种周麦18和生产上大面积推广的广适品种矮抗58为试验材料,在灌浆期分别用强光、高温和强光高温交叉胁迫处理,探讨郑麦7698耐强光高温的生理机制,以期为小麦抗逆育种提供理论依据。
1 材料与方法
1.1 试验材料
小麦品种周麦18、矮抗58和郑麦7698,均由河南省农业科学院小麦研究所分子育种室提供。
1.2 材料的种植
材料种植方式为盆栽。花盆内径为30 cm,高为32 cm,每盆装入15 kg风干土样,土壤取自0~30 cm耕层土壤,基本肥力状况为碱解氮88.6 mg·kg-1,有效磷23.8 mg·kg-1,速效钾108.6 mg·kg-1,每盆定苗5株,每品种种植20盆,常规栽培管理。
1.3 材料的处理
正常处理(non-stress treatment,NT):旗叶处光强为1 300 μmol·m-2·s-1,温度25 ℃,处理4 h。
强光处理(high light treatment,HL):旗叶处光强为1 900 μmol·m-2·s-1,温度25 ℃,处理4 h。
高温处理(high temperature treatment,HT):旗叶处光强为1 300 μmol·m-2·s-1,温度38 ℃,处理4 h。
强光高温处理(high light and high temperature treatment,HLHT):旗叶处光强约为1 900 μmol·m-2·s-1,温度38 ℃,处理4 h。
处理时期为灌浆期(开花后10 d),处理前浇水,然后将盆栽置于人工气候室,调控光强和温度,空气相对湿度保持65%。
1.4 测定指标及方法
1.4.1 旗叶气体交换参数的测定
采用CIRAS-3型便携式光合作用测定系统(PP SYSTEMS Co.,USA)测定净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)、细胞间隙CO2浓度(intercellular CO2concentration,Ci)、叶温(temperature of leaf,TL)。供气方式为大气供气,气体流速为300 mL·min-1,LED光源控制光强。
1.4.2 旗叶叶绿素荧光参数的测定
将旗叶进行20 min的暗适应后,利用FMS-2便携式脉冲调制式荧光仪(Hansatech Co.,UK),参照Genty等[9]的方法对旗叶PSⅡ的最大光化学效率(Fv/Fm)和光化学猝灭(qP)进行测定。
1.4.3 旗叶超氧阴离子生成速率、过氧化氢含量、丙二醛含量和抗氧化酶活性的测定
样品提取:称取剪碎的小麦旗叶叶片0.5 g,加5 mL预冷的提取液(pH=7.8的磷酸缓冲液),冰浴研磨,于4 ℃下12 000 r·min-1离心20 min,取上清液即为样品提取液。
超氧阴离子生成速率测定参照Elstner和Heupel[10]的方法。
过氧化氢(hydrogen peroxide,H2O2)含量测定参照Brennan和Frenkel[11]的方法。
丙二醛(malondialdehyde,MDA)含量的测定参照Heath和Packer[12]的方法。
超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)活性的测定参照Tan等[14]的方法。
1.4.4 旗叶相对电导率的测定
相对电导率(relative electrical conductivity,REC)的测定参照Clarke等[13]的方法。
1.5 统计分析
用DPS 7.05进行统计分析,用Microsoft Excel 2003绘图。
2 结果与分析
2.1 强光、高温及强光高温交叉胁迫对不同小麦品种光合作用参数的影响
如表1所示,强光高温交叉胁迫处理较正常处理下的光合速率下降幅度最大,其次是高温处理,强光处理下降低的幅度最小,且各处理间差异显著,说明单一高温胁迫处理对小麦旗叶光合速率的影响显著大于单一强光胁迫处理,而强光高温交叉胁迫处理对小麦旗叶光合速率的影响显著大于单一高温和单一强光胁迫处理。强光、高温及强光高温交叉胁迫处理后,3个小麦品种的净光合速率均较正常处理显著下降,其中,周麦18分别下降23.76%、40.52%和67.72%,矮抗58分别下降23.14%、42.57%和65.86%,郑麦7698分别下降19.70%、35.45%和57.81%,即郑麦7698的下降幅度最小,说明郑麦7698具有较好的耐强光高温特性。

表1 强光、高温及强光高温交叉胁迫下不同小麦品种的光合作用参数Table 1 Photosynthesis parameters of different wheat varieties under non-stress,high light,high temperature,high light and high temperature treatments
同列数值后不同字母表示同一处理下不同品种间的差异在0.05水平上显著;同行数值后不同字母表示同一品种在不同处理间的差异在0.05水平上显著。表2~7同。
Different letters following values in a column represented the difference among different varieties under the same treatment was significant at 0.05 level;Different letters following values in a row represented the difference among different treaments for a variety was significant at 0.05 level.The same in table 2-7.
不同处理下小麦旗叶蒸腾速率与光合速率的变化趋势一致,郑麦7698在不同处理下的蒸腾速率均显著高于周麦18和矮抗58。逆境胁迫下较高的蒸腾速率能够降低叶片温度[15],郑麦7698在强光、高温及强光高温交叉胁迫处理下的叶温均显著低于周麦18和矮抗58,这可能是其维持较高光合速率的原因之一。
不同处理下的气孔导度也与光合速率的变化趋势一致。强光、高温及强光高温交叉胁迫处理下,小麦旗叶的胞间二氧化碳浓度较正常处理显著升高,但郑麦7698与周麦18和矮抗58的胞间二氧化碳浓度差异不显著,说明郑麦7698在逆境下可维持较高光合速率的原因是非气孔因素。
2.2 强光、高温及强光高温交叉胁迫对不同小麦品种叶绿素荧光参数的影响
如表2所示,强光高温处理较正常处理下的Fv/Fm下降幅度最大,其次是高温胁迫处理,强光胁迫处理下降幅度最小,且各处理间差异显著,说明单一高温胁迫对小麦旗叶Fv/Fm的影响显著大于单一强光胁迫处理,而强光高温交叉胁迫处理对小麦旗叶Fv/Fm的影响显著大于单一高温和单一强光胁迫处理。强光、高温及强光高温交叉胁迫处理后,3个小麦品种的Fv/Fm均较正常处理显著下降,其中,周麦18分别下降13.69%、19.82%、26.71%,矮抗58分别下降12.33%、19.63%、26.33%,郑麦7698分别下降6.84%、13.67%、19.40%,即郑麦7698的下降幅度最小,且在3种逆境胁迫处理后的Fv/Fm均显著高于周麦18和矮抗58,表明在强光、高温及强光高温交叉胁迫处理下郑麦7698的光合机构受到伤害程度较轻,仍可维持较高的PS Ⅱ最大光化学效率。
不同处理下小麦旗叶的qP表现出与Fv/Fm一致的变化趋势,说明在强光、高温及强光高温交叉胁迫处理下郑麦7698的光化学效率显著高于周麦18和矮抗58。
2.3 强光、高温及强光高温交叉胁迫对不同小麦品种相对电导率和MDA含量的影响
由表3可见,强光高温处理较正常处理下的相对电导率上升幅度最大,其次是高温处理,强光处理上升幅度最小,且各处理间差异显著,说明3种逆境胁迫对小麦叶片内部结构伤害程度为强光<高温<强光高温。正常处理下3个品种的相对电导率无显著差异,强光、高温及强光高温交叉胁迫处理后3个小麦品种的相对电导率均较正常处理显著上升,其中,周麦18分别上升24.44%、57.78%、77.78%,矮抗58分别上升31.82%、63.64%、84.09%,郑麦7698分别上升11.06%、32.98%、56.38%,即郑麦7698的上升幅度最小,且在3种逆境胁迫处理后的相对电导率均显著低于周麦18和矮抗58,说明郑麦7698叶片内部结构损伤程度最低。
由表4可见,不同处理下小麦旗叶的MDA含量与相对电导率的变化趋势一致,说明在强光、高温及其强光高温交叉胁迫处理下郑麦7698旗叶的细胞膜稳定性也显著优于周麦18和矮抗58。
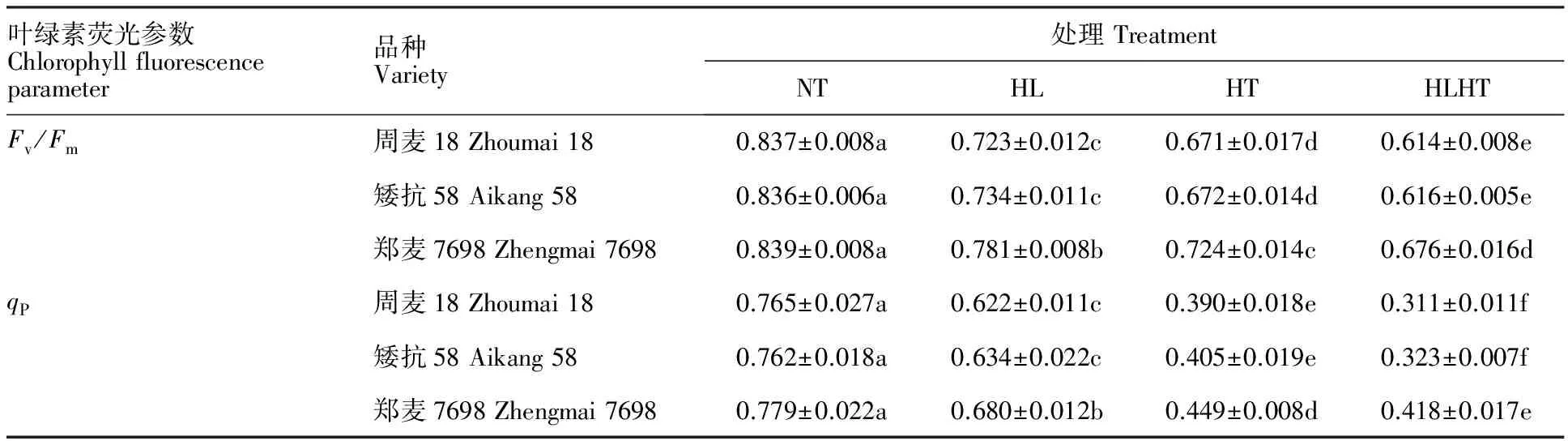
表2 强光、高温及强光高温交叉胁迫下不同小麦品种的叶绿素荧光参数Table 2 Chlorophyll fluorescence parameters of different wheat varieties under non-stress,high light,high temperature,high light and high temperature treatments
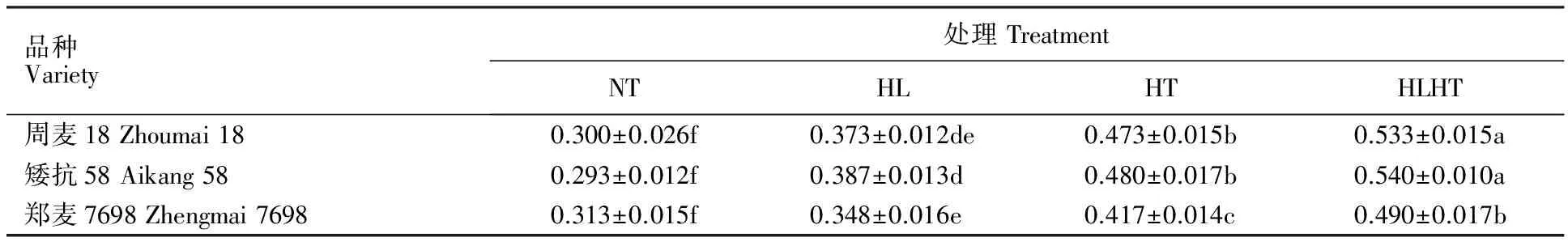
表3 强光、高温及强光高温交叉胁迫下不同小麦品种的相对电导率Table 3 Relative electric conductivity of different wheat varieties under non-stress, high light,high temperature,high light and high temperature treatments %
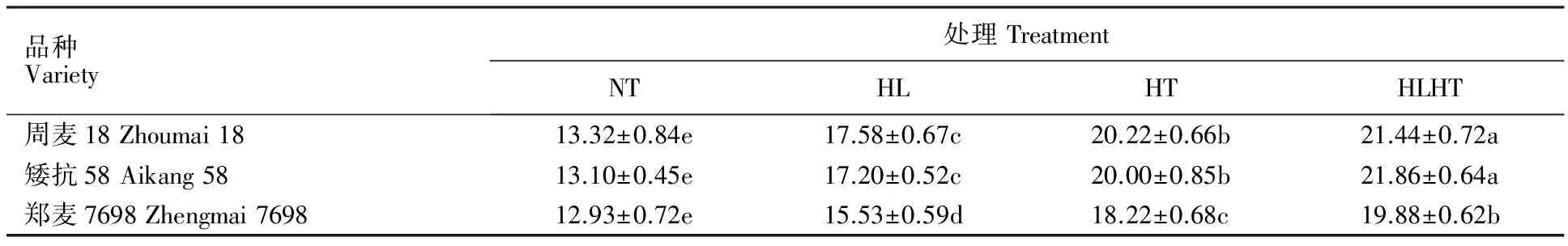
表4 强光、高温及强光高温交叉胁迫下不同小麦品种的丙二醛含量Table 4 Content of MDA in different wheat varieties under non-stress,high light,high temperature,high light and high temperature treatments μmol·g-1 FW
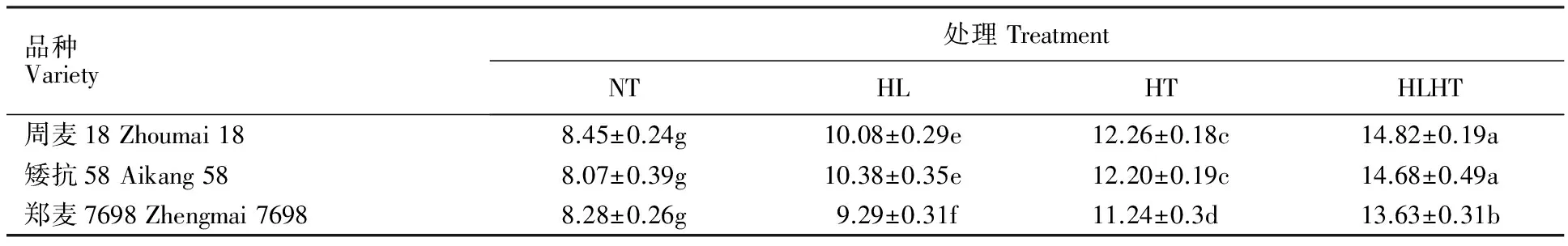
表5 强光、高温及强光高温交叉胁迫下不同小麦品种的超氧阴离子生成速率Table 5 Production rate of superoxide anion in different wheat varieties under non-stress, high light,high temperature,high light and high temperature treatments nmol·min-1·g-1 FW
2.4 强光、高温及强光高温交叉胁迫对不同小麦品种超氧阴离子生成速率和H2O2含量的影响
由表5可见,强光高温处理较正常处理下的超氧阴离子生成速率上升幅度最大,其次是高温处理,强光处理上升幅度最小,且各处理间差异显著,说明高温对小麦旗叶超氧阴离子生成速率的影响要显著大于强光,而强光高温胁迫处理对小麦旗叶超氧阴离子生成速率的影响显著大于单一高温和单一强光处理。正常处理下,3个品种的超氧阴离子生成速率无显著差异,而强光、高温及强光高温交叉胁迫处理后,3个小麦品种的超氧阴离子生成速率均较正常处理显著上升,其中,周麦18分别上升15.42%、44.42%、72.13%,矮抗58分别上升33.27%、51.73%、79.31%,郑麦7698分别上升14.41%、31.55%、63.77%,即郑麦7698的上升幅度最小,且在3种逆境胁迫处理后的超氧阴离子生成速率均显著低于周麦18和矮抗58。此外,由表6可见,不同处理下小麦旗叶的H2O2含量与超氧阴离子生成速率的变化趋势一致。说明在强光、高温及其强光高温交叉胁迫处理下郑麦7698旗叶累积的活性氧类有害物质含量上升幅度较小,这是其在逆境胁迫处理下叶片内部结构受损较轻的原因。
2.5 强光、高温及强光高温交叉胁迫对不同小麦品种SOD、POD、CAT酶活性的影响
由表7可见,强光高温处理较正常处理下的SOD活性下降幅度最大,其次是高温处理,强光处理下降低幅度最小,且各处理间差异基本上显著,说明高温对小麦旗叶SOD活性的影响要显著大于强光,而强光高温交叉胁迫处理对小麦旗叶SOD活性的影响又显著大于单一强光和单一高温处理。强光、高温及强光高温交叉胁迫处理后3个小麦品种的SOD酶活性均较正常处理显著下降,其中,周麦18分别下降14.54%、24.15%、32.15%,矮抗58分别下降9.05%、21.23%、28.85%,郑麦7698分别下降2.73%、13.57%、23.40%,即郑麦7698的下降幅度最小,且在3种逆境胁迫处理后的SOD酶活性均显著高于周麦18和矮抗58。POD和CAT活性的变化趋势与SOD一致。说明在强光、高温及其强光高温交叉胁迫处理下郑麦7698中较高的抗氧化酶活性可有效清除逆境胁迫下小麦叶片内部活性氧类物质,从而降低叶片内部结构受损程度,维持叶片细胞膜稳定,最终起到保护光合机构的作用,这可能是其在逆境下具有较高光合速率的原因之一。
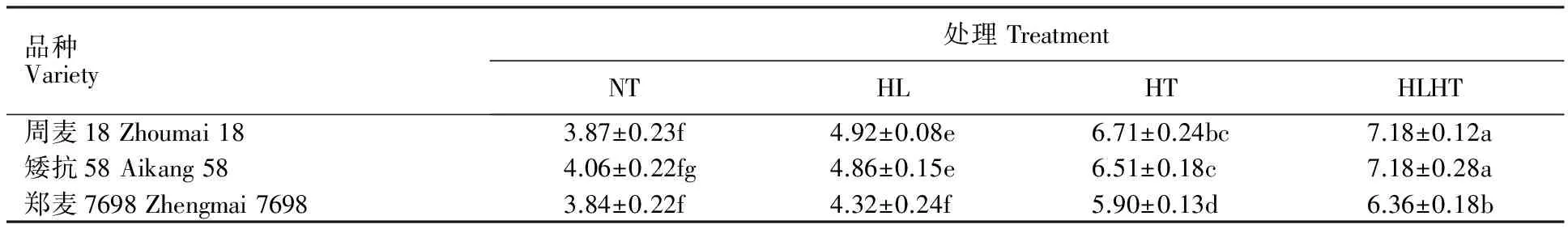
表6 强光、高温及强光高温交叉胁迫下不同小麦品种的过氧化氢含量Table 6 Content of H2O2 in different wheat varieties under non-stress,high light,high temperature,high light and high temperature treatments μmol·g-1 FW
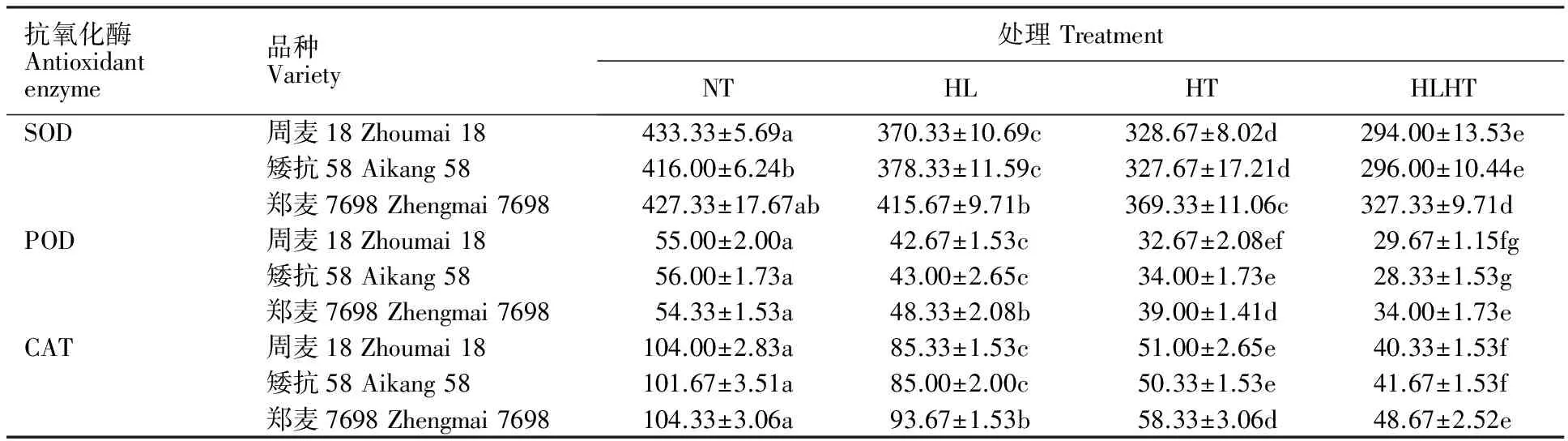
表7 强光、高温及强光高温交叉胁迫下不同小麦品种的SOD、CAT、SOD酶活性Table 7 SOD,POD and CAT activity of different wheat varieties under non-stress,high light, high temperature,high light and high temperature treatments unit·g-1 FW
3 讨 论
郑麦7698是河南省农业科学院小麦研究所分子育种研究室培育的高产优质多抗广适小麦品种,于2012年通过国家农作物品种审定委员会审定。本课题组科研人员多年研究发现,该品种生育后期根系活力强,灌浆速度快,转色落黄好,抗干热风能力强,在田间遭遇到强光高温天气胁迫后,叶片仍具有较好的持绿性。前期研究也表明,田间中午强光高温胁迫最严重的时间其净光合速率显著高于周麦18和矮抗58[16],并能最终获得较高的千粒重和产量[17],因此,初步判定该品种对高温强光具有较好的抗性。
植物交叉逆境研究一直是植物逆境生物学的研究热点,多项关于强光高温共同胁迫的研究被报道[1,7,18-20],但前人多数仅关注强光高温下植物的生理特性,很少有学者同时研究强光、高温、强光高温交叉胁迫分别对植物生理特性的影响。本研究以国家黄淮麦区小麦区域试验对照品种周麦18和黄淮麦区大面积推广品种矮抗58为对照,研究了强光、高温、强光高温交叉胁迫对不同小麦品种的生理特性影响,结果发现,3种逆境对小麦叶片光合功能受影响程度依次为强光<高温<强光强光高温。气体交换和荧光参数研究结果表明,3种逆境下郑麦7698的光合速率和光化学效率均显著高于周麦18和矮抗58,说明郑麦7698较2个对照品种具有更好的耐强光高温能力。前人的研究结果也表明,不同小麦品种耐强光高温特性存在差异[1,8,21-22],与本文的研究结果相似。由此可见,通过遗传改良可以选育出具有较好耐强光高温特性的小麦新品种。
强光高温主要伤害植物PSⅡ的放氧复合体和光化学反应中心[9],逆境胁迫后郑麦7698的Fv/Fm和qP下降幅度显著低于周麦18和矮抗58,说明其PSⅡ反应中心受到伤害程度较小,逆境下能具有较高水平的光能利用率。相对电导率和丙二醛含量是反映逆境下植物受伤害程度的重要指标[4],从这两项生化指标的研究结果可知逆境下郑麦7698的细胞膜稳定性显著优于周麦18和矮抗58,这是其在逆境下保持较高光化学效率的重要原因。进一步分析抗氧化酶活性和活性氧类物质含量,结果发现,逆境下郑麦7698较对照品种表现出更高水平的SOD、POD和CAT酶活性,较高的抗氧化酶系统可有效清除了逆境下植物体内产生的活性氧类物质,有效地保护其细胞膜稳定性,最终使郑麦7698在逆境下保持较高的光合效率。
综上所述,本研究3种逆境对小麦叶片光合功能影响程度依次为强光<高温<强光强光高温,且3个品种的耐强光高温特性存在显著差异。郑麦7698在逆境下具有较高水平的抗氧化酶活性,可有效清除活性氧类物质,降低其叶片内部机构受损程度,从而维持较高水平光合效率,这是郑麦7698具有较好耐强光高温特性的原因。
[1]MONNEVEUX P,PASTENES C,REYNOLDS M P.Limitations to photosynthesis under light and heat stress in three high-yielding wheat genotypes [J].JournalofPlantPhysiology,2003,160(6):657.
[2] ASSENG S,EWERT F,MARTRE P,etal.Rising temperatures reduce global wheat production [J].NatureClimateChange,2015,5(2):143.
[3] ZHAGN X,WANG X,ZHONG J,etal.Drought priming induces thermo-tolerance to post-anthesis high-temperature in offspring of winter wheat [J].EnvironmentalandExperimentalBotany,2016,127:26.
[4] BERRY J,BJORKMAN O.Photosynthetic response and adaptation to temperature in higher plants [J].AnnualReviewofPlantPhysiology,1980,31(1):491.
[5] ARO E M,MCCAFFERY S,ANDERSON J M.Photoinhibition and D1 protein degradation in peas acclimated to different growth irradiances [J].PlantPhysiology,1993,103(3):835.
[6] BJORKMAN O,POWLE S B.Inhibition of photosynthetic reactions under water stress interactions with light level [J].Planta,1984,161:490.
[7] CHEN Y E,ZHANG C M,SU Y Q,etal.Responses of photosystem Ⅱ and antioxidative systems to high light and high temperature co-stress in wheat [J].EnvironmentalandExperimentalBotany,2017,135:45.
[8] 齐学礼,胡 琳,董海滨,等.强光高温同时作用下不同小麦品种的光合特性[J].作物学报,2008,34(12):2196.
QI X L,HU L,DONG H B,etal.Characteristics of photosynthesis in different wheat cultivars under high light intensity and high temperature stresses [J].ActaAgronomicSinica,2008,34(12):2196.
[9] GENTY B,BRIANTAIS J M,BAKER N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J].BiochimicaetBiophysicaActa-GeneralSubjects,1989,990(1):87.
[10] ELSTNER E F,HEUPEL A.Inhibition of nitrite formation from hydroxylammoniumchloride:a simple assay for superoxide dismutase [J].AnalyticalBiochemistry,1976,70(2):616.
[11] BRENNAN T,FRENKEL C.Involvement of hydrogen peroxide in the regulation of senescence in pear [J].PlantPhysiology,1977,59(3):411.
[12] HRATH R L,PACKER L.Photoperoxidation in isolated chloroplasts:I.Kinetics and stoichiometry of fatty acid peroxidation [J].ArchivesofBiochemistryandBiophysics,1968,125(1):189.
[13] CLARKE S M,MUR L A J,WOOD J E,etal.Salicylic acid dependent signaling promotes basal thermotolerance but is not essential for acquired thermotolerance inArabidopsisthaliana[J].ThePlantJournal,2004,38(3):432.
[14] TAN W,LIU J,DAI T,etal.Alterations in photosynthesis and antioxidant enzyme activity in winter wheat subjected to post-anthesis water-logging [J].Photosynthetica,2008,46(1):21.
[15] 邹 琦.小麦的高温伤害与高温适应[J].植物学报,1988,30(4):388.
ZOU Q.Heat injury and heat acclimation in wheat plants [J].ActaBotanicaSinica,1988,30(4):388.
[16] 张庆琛,许为钢,胡 琳,等.小麦品种郑麦7698生育后期的光合性能及同化物运转特性[J].麦类作物学报,2016,36(3):362.
ZHANG Q C,XU W G,HU L,etal.Characteristics of photosynthetic capacity and photosynthate translocation in wheat cultivars of Zhengmai 7698 [J].JournalofTriticeaeCrops,2016,36(3):362.
[17] ZHANG Y,XU W,Wang H,etal.Progress in genetic improvement of grain yield and related physiological traits of Chinese wheat in Henan province [J].FieldCropsResearch,2016,199:117.
[18] HEWEZI T,LEGER M,GENTZBITTE L.A comprehensive analysis of the combined effects of high light and high temperature stresses on gene expression in sunflower [J].AnnalsofBotany,2008,102(1):127.
[19] 秦舒浩,王 娜,张文莉.高温强光胁迫对西葫芦幼苗光合生理特性及荧光参数的影响[J].扬州大学学报(农业与生命科学版),2011,32(1):26.
QIN S H,WANG N,ZHANG W L.Effects of high temperature and strong light stress on photosynthetic,physiological characteristics and fluorescence parameters of squash seedlings [J].JournalofYangzhouUniversity(AgriculturalandLifeScienceEdition),2011,32(1):26.
[20] 秦立琴,张悦丽,郭 峰,等.强光下高温与干旱胁迫对花生光系统的伤害机制[J].生态学报,2011,31(7):1835.
QIN L Q,ZHANG Y L,GUO F,etal.Damaging mechanisms of peanut(ArachishypogaeaL.) photosystems caused by high-temperature and drought under high irradiance [J].ActaEcologicaSinica,2011,31(7):1835.
[21] 徐如强,孙其信,张树榛.不同冬小麦品种对高温胁迫反应的研究[J].中国农业大学学报,1998,3(1):98.
XU R Q,SUN Q X,ZHAGN S Z.Study on the responses of winter wheat genotypes to high temperature stress [J].JournalofChinaAgricultureUniversity,1998,3(1):98.
[22] SOMMER R,GLAZIRINA M,YULDSHEV T,etal.Impact of climate change on wheat productivity in central Asia [J].Agriculture,Ecosystems&Environment,2013,178:78.
PhysiologicalMechanismofHighLightIntensityandHighTemperatureCo-stressToleranceofaWheatVarietyZhengmai7698
QIXueli,FANGYuhui,ZHAOMingzhong,HANLiupeng,GUORui,WANGHuiwei,HULin,XUWeigang
(Wheat Research Institute,Henan Academy of Agricultural Sciences/National Engineering Laboratory of Wheat/Key Laboratory of Wheat Biology and Genetic Breeding Central Huang-Huai Region,Ministry of Agriculture/Henan Provincial Key Laboratory of Wheat Biology,Zhengzhou,Henan 450002,China )
Grain filling stage is the key period for wheat kernel weight. However,wheat often encounters high light intensity combined with high temperature at this stage. The combined stresses result in the decline of photosynthetic rate,which ultimately causes yield loss. In our previous study,we found that a wheat variety Zhengmai 7698 showed strong tolerance to high light intensity and high temperature. In order to illuminate the physiological mechanism of high light intensity and high temperature co-stress tolerance of Zhengmai 7698,we took two wheat varieties (Zhoumai 18 and Aikang 58) as control,to study their physiological characters under three treatments (high light,HL; high temperature,HT; and high light and high temperature,HLHT). The results showed that the degree of negative effects on wheat photosynthesis was HL Wheat; High light intensity and high temperature; Photosynthesis 时间:2017-12-11 网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20171211.1106.020.html 2017-05-28 2017-08-21 国家重点基础研究发展计划(973计划)项目(2015CB150106);国家小麦产业技术体系项目(CARS-3-1-9) E-mail:xueliqi888@163.com 王会伟 (E-mail:whuiweiw@163.com) S512.1;S311 A 1009-1041(2017)12-1589-08

