结肠癌中DLC-1与Moesin的表达及临床病理学意义
,,,贺修
(1.湖南环境生物职业技术学院医学院,湖南 衡阳 421001;2.南华大学肿瘤研究所)
·临床医学·
结肠癌中DLC-1与Moesin的表达及临床病理学意义
全胜1,陈雄新1,华中昌1,贺修胜2*
(1.湖南环境生物职业技术学院医学院,湖南 衡阳 421001;2.南华大学肿瘤研究所)
目的探讨结肠癌组织中DLC-1及Moesin表达的相关性与临床病理学意义。方法收集结肠癌标本72例及相应癌旁结肠黏膜组织,分别应用Western blotting和免疫组化方法检测DLC-1及Moesin蛋白质的表达。结果结肠癌组织中DLC-1蛋白表达水平及其阳性表达率明显低于癌旁结肠黏膜组织,而Moesin蛋白表达水平及其阳性表达率明显高于癌旁结肠黏膜组织,两者表达呈负相关。低分化结肠癌组织中DLC-1阳性表达率低于高、中分化结肠癌组织,而Moesin阳性表达率高于高、中分化结肠癌组织;Ⅲ、Ⅳ期结肠癌组织中DLC-1阳性表达率低于Ⅰ、Ⅱ期结肠癌组织,而Moesin阳性表达率高于Ⅰ、Ⅱ期结肠癌组织;淋巴结转移及5年内病情复发或者死亡病例结肠癌组织中DLC-1阳性表达率分别低于无淋巴结转移及5年内无复发病例,而Moesin阳性表达率分别高于无淋巴结转移及5年内无复发病例,差异均具有统计学意义。结论结肠癌组织中DLC-1低表达,Moesin高表达,两者表达呈负相关。DLC-1低表达及Moesin高表达与结肠癌分化程度、TNM分期、淋巴结转移及预后密切相关。
结肠癌; Moesin; DLC-1; 分化; TNM分期; 转移
目前我国及世界范围内结肠癌发病率呈逐年升高的趋势,严重危害人们的健康[1]。侵袭和转移也是导致结肠癌患者死亡的主要原因,探讨侵袭和转移相关的分子机制对于防治结肠癌具有重要的意义。研究发现,肝癌缺失基因(deleted in liver cancer-1,DLC-1)低表达可导致Rho蛋白活化,而活化的Rho蛋白可导致膜突蛋白(Moesin)表达增高,参与肝癌、多形性胶质瘤的侵袭、转移[2-3];体外实验也证实转染DLC-1基因能抑制结肠癌细胞生长增殖[4-5],但关于结肠癌组织中DLC-1与Moesin表达的相关性及其作用机制未见报道。本研究通过检测DLC-1及Moesin蛋白质在结肠癌组织中的表达,分析其相关性及临床病理学意义,为进一步研究DLC-1及Moesin在结肠癌发生、发展中的作用及分子机制奠定基础。
1 资料与方法
1.1临床资料收集南华大学附属第一医院2009年10月~2011年10月行结肠癌根治术并建立电话随访的72例病例标本及相应的癌旁(距癌组织至少5 cm或以上)结肠黏膜组织,所有病例均经过病理学诊断证实,且术前均未接受放化疗,其中男性50例,女性22例,年龄<50岁32例,≥50岁40例,高、中分化结肠癌28例、低分化结肠癌44例;TNM分期Ⅰ和Ⅱ期40例、Ⅲ和Ⅳ期32例;伴淋巴结转移者30例,无淋巴结转移者42例;38例在5年内复发或死亡,34例5年内无复发。所有病例标本手术取材后保存于液氮罐,分别用于提取组织蛋白质或经4%多聚甲醛固定制成石蜡切片。
1.2实验试剂蛋白裂解液、BCA蛋白质定量试剂盒、PVDF膜购自北京中杉金桥生物技术公司;免疫组化试剂盒、DAB显色试剂盒、兔抗人β-actin单抗购自武汉博士德公司,Moesin及DLC-1兔抗人多克隆抗体购自Santa Cruz公司。
1.3实验方法
1.3.1 Western blotting法 提取各组结肠组织标本总蛋白并采用BCA 法测定样品蛋白浓度,将样品与上样缓冲液混合后SDS-PAGE电泳分离蛋白质,经半干转膜仪转到 PVDF 膜上,脱脂奶粉封闭1.5 h,分别加入Moesin( 1∶800)及DLC-1( 1∶1000)兔抗人多克隆抗体和β-actin 抗体( 1∶500) ,37 ℃孵育2 h,HRP 标记II抗孵育1 h,ECL化学发光显影,采用Quantity One软件测定各条带的吸光度值,分别以各条带与β-actin吸光度的比值计算各组标本中DLC-1及Moesin蛋白的相对含量。
1.3.2 免疫组织化学方法 采用改良型SP法检测标本中DLC-1及Moesin蛋白的表达。石蜡切片常规脱蜡至水,3%H2O2孵育10 min 以阻断内源性过氧化物酶,10%枸橼酸盐缓冲液热修复抗原,PBS 洗后滴加适度稀释的Moesin( 1∶300)及DLC-1( 1∶200)兔抗人多克隆抗体,4 ℃孵育过夜,滴加二抗,DAB显色,苏木精复染,中性树胶封片,镜下观察。阴性对照以PBS代替I抗。免疫组化染色结果判断根据文献[6]进行:每张切片至少随机观察10个高倍视野,按照阳性细胞所占比例记分:无阳性细胞为0分;≤ 10% 为1分;11%~50%为2分;51%~75%为3分;>75% 为 4分。同时根据染色强度记分为: 无黄色为0分;淡黄色为1分;黄色或深黄色为2 分;褐色或深褐色为3 分。两项指标的积分相乘结果: ≤3分为阴性,>3分为阳性。
1.4统计学处理采用SPSS18.0统计学软件处理各组数据,计数资料用百分率(%) 表示,样本率的比较行2检验;计量数据用均数±标准差表示,组间均数比较行t检验,DLC-1及Moesin在结肠癌组织中的表达进行Spearman相关性分析,P<0.05表示差异具有统计学意义。
2 结 果
2.1结肠癌组织中DLC-1及Moesin蛋白的表达
Western blotting检测结果显示,结肠癌组织中DLC-1的相对含量(0.08±0.01)明显低于癌旁结肠黏膜组织(0.98±0.06),而结肠癌组织中Moesin蛋白(1.16±0.09)明显高于癌旁结肠黏膜组织(0.10±0.02)(P<0.05,图1)。免疫组化显示,DLC-1阳性表达于胞浆,Moesin阳性表达定位于胞浆、胞膜(图2,图3)。在结肠癌及癌旁结肠黏膜组织中DLC-1的阳性表达率分别为29.2%(21/72)及87.5%(63/72),Moesin的阳性表达率分别为83.3%(60/72)及11.1%(8/72),差异均有显著性(P<0.05)。
2.2结肠癌组织DLC-1及Moesin蛋白表达的相关性51例DLC-1蛋白表达阴性结肠癌组织标本中有46例Moesin表达阳性,而21例DLC-1表达阳性的结肠癌组织标本有7例Moesin表达阴性,两者均阳性的标本有14例,相关性分析表明,结肠癌组织标本中DLC-1及Moesin蛋白表达呈负相关(2=27.245,r= - 0.524,P<0.05)。
2.3结肠癌组织中DLC-1及Moesin蛋白表达与临床病理特征的关系如表1所示,不同年龄、性别结肠癌组织中DLC-1及Moesin蛋白阳性表达率无明显差异。低分化结肠癌组织中DLC-1、Moesin阳性表达率分别为13.6%(6/44)及93.2%(41/44),而高、中分化结肠癌组织的阳性表达率分别为53.6%(15/28)及67.9%(19/28);Ⅲ、Ⅳ期结肠癌组织中DLC-1、Moesin阳性表达率分别为11.1%(4/36)及97.2%(35/36),而Ⅰ、Ⅱ期分别为47.2%(17/36)及69.4%(25/36);淋巴结转移结肠癌组织中DLC-1、Moesin阳性表达率分别为6.7%(2/30)及100%(30/30),而无淋巴结转移的分别为45.2%(19/42)及71.4%(30/42);5年内病情复发或者死亡病例结肠癌组织中DLC-1、Moesin阳性表达率分别为13.2%(5/38)及97.4%(37/38),而5年内无复发病例分别为47.1%(16/34)及67.6%(23/34),差异均有显著性(P<0.05)。

图1 Western blotting检测DLC-1及Moesin蛋白表达A:免疫印迹检测两种蛋白质表达的代表性图;B:两种蛋白质相对表达量统计分析(n=72).与癌旁结肠组织比较,*P<0.05. T:结肠癌组织;N: 癌旁结肠组织

图2 免疫组化检测DLC-1的表达A:癌旁结肠组织;B:结肠癌组织

图3 免疫组化检测Moesin的表达A:癌旁结肠组织;B:结肠癌组织
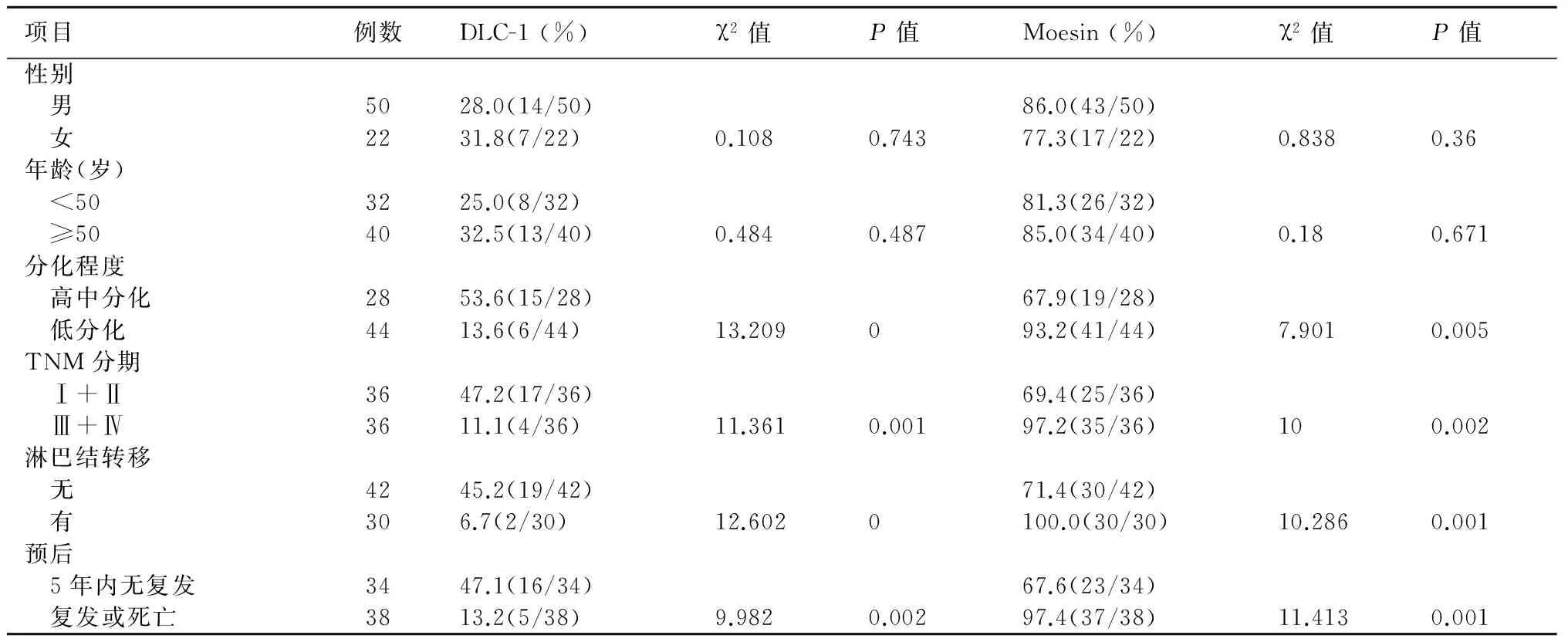
表1 结肠癌组织中DLC-1及Moesin蛋白表达与临床病理特征#关系
#结肠癌组织学分型及TNM分期标准根据2013年4月国家卫计委颁发“结肠癌规范化诊疗指南(试行)”执行
3 讨 论
DLC-1基因位于人染色体8p21.3-22区,其cDNA全长3 850 bp,含14个外显子,编码由1 091个氨基酸组成、相对分子质量为123 kDa的蛋白质。DLC-1蛋白主要位于细胞质中,它含有RhoGTP酶激活蛋白(Rho GTPase activating protein,Rho GAP)、类固醇急性调节相关脂质转移域( steroidogenic acute regulatory related lipid transfer domains,START)和山姆(sterile alpha motif,SAM) 3个重要的功能结构域,此外,在Rho GAP和SAM结构域之间富含丝氨酸的区域存在一个黏着斑定位序列(focal adhesion targeting sequence)[7]。其中Rho GAP结构域能特异性增强Rho家族蛋白自身内源性GTP酶水解活性,催化GTP水解使Rho蛋白失活,因此DLC-1蛋白通过Rho GAP结构域扮演了Rho蛋白负性调控因子的作用,Rho GAP结构域也是DLC-1蛋白抗肿瘤作用的主要位点[8]。黏着斑定位序列使DLC-1蛋白可以结合张力蛋白和肌动蛋白上的SH2结构域,在黏着斑定位及肿瘤抑制中也发挥重要作用[9]。DLC-1基因在肝癌、非小细胞肺癌等多种恶性肿瘤中经常发生表达的缺失或下调,其下调机制往往与启动子区域甲基化有关[6,10]。既往研究发现,应用RNAi技术沉默DLC-1阳性表达的LoVo结肠癌细胞株中DLC-1的表达,可导致细胞增殖加快,侵袭能力明显增强[11];而将DLC-1基因转染至DLC-1低表达的SW480及HT-29结肠癌细胞后,能使其细胞周期阻滞,抑制其增殖和迁移能力,其机制可能与调控Wnt/β-catenin 信号通路及CyclinD1、p21的表达有关[4-5],表明DLC-1基因对结肠癌细胞有抑制作用,可能也是结肠癌的一种抑制基因。本文结果显示,结肠癌组织中DLC-1蛋白表达水平及其阳性表达率明显低于癌旁结肠黏膜组织,且分化程度越低的结肠癌组织中DLC-1阳性表达率越低,Ⅲ、Ⅳ期结肠癌组织中DLC-1阳性表达率低于Ⅰ、Ⅱ期结肠癌组织,淋巴结转移及5年内病情复发或者死亡病例结肠癌组织中DLC-1阳性表达率分别低于无淋巴结转移及5年内无复发病例,证实DLC-1基因在结肠癌中具有抑制基因功能,其低表达与结肠癌分化程度、临床分期、淋巴结转移及预后密切相关。
膜突蛋白(Moesin)属埃兹蛋白-根蛋白-膜突蛋白(Ezrin-Radixin -Moesin,ERM)家族成员,该蛋白家族的成员在维持细胞骨架结构和细胞运动过程起着重要作用[12]。膜突蛋白基因定位于Xq11.2-Xq12区,其cDNA全长3835 bp,编码577个氨基酸组成的蛋白质分子。激活的Moesin蛋白能介导肌动蛋白与质膜的交联从而引发肌动蛋白骨架的重构,促进细胞生长、迁移,因此Moesin蛋白高表达参与了多种肿瘤的浸润及转移过程[13-14]。已有研究表明Moesin高表达不仅与乳腺癌分化程度、临床分期、淋巴结转移有关,可能是乳腺癌的潜在标志物[15],而且与宫颈鳞癌[16]、甲状腺乳头状癌[17]等肿瘤的侵袭和转移有关。本研究发现结肠癌组织中Moesin蛋白表达水平及其阳性表达率明显高于癌旁结肠黏膜组织;Moesin表达与性别、年龄无关,但低分化结肠癌组织中Moesin阳性表达率明显高于高、中分化结肠癌组织,且Moesin蛋白高表达与结肠癌TNM分期、淋巴结转移呈正相关,Ⅲ+Ⅳ期结肠癌组织Moesin阳性表达率高于Ⅰ+Ⅱ期,淋巴结转移及5年内病情复发或者死亡病例结肠癌组织中Moesin阳性表达率分别高于无淋巴结转移及5年内无复发病例,提示Moesin在结肠癌侵袭与转移过程可能具有重要作用,这也与先前的研究报道认为Moesin高表达与结直肠癌组织分化程度、淋巴结转移、Dukes'分期有关的观点相符[18]。由于Moesin高表达能导致细胞骨架重构,促进肿瘤细胞浸润及转移,而淋巴结转移或远处转移与结肠癌患者临床分期及预后息息相关,这也就不难解释本研究中DLC-1低表达及Moesin高表达与结肠癌临床分期及预后直接相关。
既往有研究报道,DLC-1低表达可通过Rho蛋白级联导致Moesin表达增高,参与多形性胶质瘤、肝癌等的侵袭、转移[2-3]。本文结肠癌组织中DLC-1与Moesin的表达呈负相关,提示结肠癌组织中DLC-1的低表达也能促进Moesin高表达,进而参与结肠癌细胞的侵袭、转移,但结肠癌中DLC-1低表达是否也可通过Rho蛋白导致Moesin表达改变,有待进一步研究。
[1] 韩雪.上海市杨浦区2002—2012年户籍人口结直肠癌发病和生存分析[J].中华流行病学杂志,2014,35 (3):289-294.
[2] Wong CC,Wong CM,Ko FC,et al.Deleted in liver cancer 1 (DLC1) negatively regulates Rho/ROCK/MLC pathway in hepatocellular carcinoma [J].PLoS One,2008,3(7):e2779.
[3] DeSouza LV,Matta A,Karim Z,et al.Role of moesin in hyaluronan induced cell migration in glioblastomamultiforme[J].Mol Cancer,2013,12:74.
[4] Wang C,Wang J,Liu H,et al.Tumor suppressor DLC-1 induces apoptosis and inhibits the growth and invasion of colon cancer cells through the Wnt/β-catenin signaling pathway[J].Oncol Rep,2014,31(5):2270-2278.
[5] Ullmannova V,PopescuNC.Inhibition of cell proliferation,induction of apoptosis,reactivation of DLC1,and modulation of other gene expression by dietary flavone in breast cancer cell lines[J].Cancer Detect Prev,2007,31(2):110-118.
[6] Song LJ,Liu Q,Meng XR,et al.DLC-1 is an independent prognostic marker and potential therapeutic target in hepatocellular cancer[J].Diagn Pathol,2016,11(1):19.
[7] Kim TY,Vigil D,Der CJ,et al.Role of DLC-1,a tumor suppressor protein with RhoGAP activity,in regulation of the cytoskeleton and cell motility[J].Cancer Metastasis Rev,2009,28(1-2):77-83
[8] Grise F,Bidaud A,Moreau V.Rho GTPases in hepatocellular carcinoma[J].BiochimBiophysActa,2009,1795(2):137-151.
[9] Shih YP,Sun P,Wang A,et al.Tensin1 positively regulates RhoA activity through its interaction with DLC1[J].BiochimBiophys Acta,2015,1853(12): 3258-3265.
[10] Feng H,Zhang Z,Wang X,et al.Identification of DLC-1 expression and methylation status in patients with non-small-cell lung cancer[J].MolClinOncol,2016,4(2):249-254.
[11] Jin Y,Tian X,Shang Y,et al.Inhibition of DLC-1 gene expression by RNA interference in the colon cancer LoVo cell line[J].Oncol Rep,2008,19(3): 669-674.
[12] Ponuwei GA.A glimpse of the ERM proteins[J].J Biomed Sci,2016,23(1):35.
[13] Li YY,Zhou CX,Gao Y.Moesin regulates the motility of oral cancer cells via MT1-MMP and E-cadherin/p120-catenin adhesion complex[J].Oral Oncol,2015,51(10): 935-943.
[14] Wang X,Liu M,Zhao CY.Expression ofezrin and moesin related to invasion,metastasis and prognosis of laryngeal squamous cell carcinoma[J].Genet Mol Res,2014,13(3):8002-8013.
[15] Halon A,Donizy P,Surowiak P,et al.ERM/Rho protein expression in ductal breast cancer: a 15 year follow-up[J].Cell Oncol (Dordr),2013,36(3): 181-190.
[16] He M,Cheng Y,Li W,et al.Vascular endothelial growth factor C promotes cervical cancer metastasis via up-regulation and activation of RhoA/ROCK-2/moesin cascade[J].BMC Cancer,2010,10:170.
[17] 刘畅,高政南,刘忠,等.Ezrin和Moesin在甲状腺乳头状癌中的相关性研究[J].中国耳鼻咽喉头颈外科杂志,2011,46(9):761-763.
[18] 谢先木,王虹,王华毅.膜突蛋白和基质金属蛋白酶-11在结直肠癌中的表达及其临床意义[J].广东医学,2011,32(19):2569-2571.
TheexpressionandclinicalpathologicalsignificancesofDLC-1andMoesininhumancoloncancertissues
QUAN Sheng,CHEN Xiongxin,HUA Zhongchang,et al
(MedicalCollege,HunanPolytechnicofEnvironmentandBiology,Hengyang421001,Hunan,China)
ObjectiveTo explore the correlation and clinical pathological significances of DLC-1and Moesin in colon cancer tissues.Methods72 cases of human colon carcinoma tissues with different clinical stage and differentiation degree and matching colon mucosa tissues in paratumor were collected,in which the expression of DLC-1and Moesin were detected by Western blotting and immunohistochemistry,respectively.ResultsCompared with colon mucosa tissues in paratumor,the expression and positive rates of DLC-1 protein in carcinoma tissues decreased,but Moesin increased significantly.DLC-1 expression was found to inversely correlate with Moesin in colon carcinoma tissues.The positive rate of DLC-1 in poorly-differentiated colon carcinoma tissues was lower than that in well or moderately-differentiated colon cancer tissues.In colon carcinoma tissues at Ⅲ or Ⅳof TNM stage,with lymphatic metastasis and with recurrence or death in less than 5 years,the positive rate of DLC-1 was lower than that at Ⅰ or Ⅱ stage,without lymphatic metastasis and with relapse-free in five years,respectively.The positive rates of Moesin was inverse to DLC-1 in colon carcinoma tissues with different differentiation degree,TNM stage,lymph node metastasis and prognosis.ConclusionThe expression of DLC-1 protein decreased and was inversely correlated with Moesin which was increased significantly in colon carcinoma tissues,and Moesin and DLC-1 were highly correlated with tumor differentiation,TNM stage,lymph node metastasis and prognosis of colon cancer.
colon cancer; Moesin; DLC-1; differentiation; TNM stage; metastasis
10.15972/j.cnki.43-1509/r.2017.03.013
2016-07-16;
2017-03-30
2014年湖南省教育厅科研项目(编号:14C0387 ).
*通讯作者,E-mail: Hexiusheng@hotmail.com.
R735.35
A
蒋湘莲)

