紫花苜蓿MsLEA4-4基因的克隆、表达分析及遗传转化
贾会丽,王学敏,郭继承,高洪文,吴欣明,刘建宁,石永红,董宽虎,王运琦*
(1.山西省农业科学院畜牧兽医研究所,山西 太原 030032;2.中国农业科学院北京畜牧兽医研究所,北京 100193;3.北京绿京华园林工程有限公司,北京 102209;4.山西农业大学动物科技学院,山西 太谷 030801)
紫花苜蓿MsLEA4-4基因的克隆、表达分析及遗传转化
贾会丽1,王学敏2,郭继承3,高洪文2,吴欣明1,刘建宁1,石永红1,董宽虎4,王运琦1*
(1.山西省农业科学院畜牧兽医研究所,山西 太原 030032;2.中国农业科学院北京畜牧兽医研究所,北京 100193;3.北京绿京华园林工程有限公司,北京 102209;4.山西农业大学动物科技学院,山西 太谷 030801)
胚胎晚期富集蛋白(LEA)广泛参与植物对多种逆境胁迫的反应。本研究利用同源克隆的方法,从紫花苜蓿中克隆了一个LEA4类基因的开放阅读框(ORF),命名为MsLEA4-4。该基因编码512个氨基酸,结构分析显示MsLEA4-4包含5个重复的由11个氨基酸TAQAAKEKTQQ组成的序列特征。利用实时荧光定量PCR检测了MsLEA4-4在不同逆境下的表达量,结果显示,该基因受干旱、NaCl、Cu2+、Zn2+和外源ABA诱导表达上调,其中NaCl胁迫2 h、Cu2+和Zn2+胁迫8 h,MsLEA4-4基因表达量最高;冷胁迫和干旱胁迫下,该基因的表达量随处理时间的延长呈逐渐上升趋势,表明该基因可能参与了紫花苜蓿的抗逆性调控。构建植物超表达载体pCAMBIA3301-MsLEA4-4,采用农杆菌介导法侵染拟南芥花序,通过草铵膦(PPT)筛选和分子检测,7株抗性苗呈阳性,表明目的基因已成功导入拟南芥基因组中。本研究为进一步探索MsLEA4-4基因在紫花苜蓿抗逆性调控中的作用奠定了基础。
紫花苜蓿;胚胎晚期富集蛋白(LEA);逆境胁迫;遗传转化
由于植物的不可移动性,在生长发育过程中往往会遭受干旱、高温、低温、高盐等各种非生物胁迫,这些胁迫都会引起植物内部的水分缺失。缺水会引起植物体内的呼吸作用和光合作用等一系列生理活动失调[1]。在长期的进化过程中,植物演化出一系列从细胞到生理水平的应答反应,如基因的表达、代谢的调节、酶活性的改变等,来提高自己对不良环境的耐受性[2]。胚胎晚期富集蛋白(late embryogenesis abundant,LEA)是参与细胞抗逆保护的一类重要蛋白,可阻止干旱导致的蛋白质聚集,从而提高植物耐旱性;在低温胁迫下,LEA蛋白的合成可保护生物膜,提高植物的抗寒性;LEA蛋白还可通过稳定细胞膜,隔离或结合离子的方式降低渗透压,减少植物在高渗、高盐条件下导致的细胞脱水和结构破坏等[3]。LEA蛋白不仅在植物发育晚期的种子中大量积累,在受到水分胁迫(干旱、盐、低温等)的营养组织中,LEA蛋白也可被诱导表达[4]。因此,LEA蛋白的表达与植物细胞抗逆保护作用有着密切联系。近年来,有诸多研究证明LEA基因的过量表达可以增强转基因植物的胁迫抗性[5]。邹永东等[6]将大豆(Glycinemax)LEA1蛋白转入拟南芥(Arabidopsisthaliana)中,发现转基因拟南芥的耐盐性有所提高。赵咏梅等[7]将小麦(Triticumaestivum)LEA2基因转入拟南芥中,发现转基因拟南芥的耐盐性和耐旱性明显提高。Dalal等[8]发现在干旱、渗透胁迫、高盐以及外源ABA胁迫下SbLEA3的表达量升高,SbLEA3参与高粱(Sorghumbicolor)体内的逆境调控。白永琴[9]将紫花苜蓿(Medicagosativa)LEA3-1基因转入烟草(Nicotianatabacum)中,240 mmol/L NaCl胁迫下转基因植株体内丙二醛含量、电导率与对照相比明显降低,说明转LEA3-1蛋白提高了转基因烟草的耐盐性。Amara等[10]将第5组LEA蛋白Rab28转入玉米(Zeamays)中,增强了转基因植株的耐旱性,渗透胁迫下转基因植株的叶面积和根面积增加,叶绿素含量降低缓慢,丙二醛含量降低。LEA4蛋白在植物界中也普遍存在,目前已经从玉米[11]、大豆[1]等多种植物中克隆到了LEA4基因,转化拟南芥后发现转基因植株的抗盐性和耐旱性明显提高。总之,目前对LEA1~3类蛋白保护功能的研究已积累了较多资料,如LEA基因的表达模式、细胞学定位、转基因植物研究、蛋白质特性分析等[12],但对LEA4蛋白的研究相对较少,其功能和作用机制仍然不清楚。
紫花苜蓿营养价值高,适口性好,且具有抗寒、耐盐碱等优良特性,在家畜日粮和土壤改良中发挥着重要角色[13]。近年来,畜牧业结构的调整和转型升级加快了草食畜牧业的发展,对优质安全草食畜产品的需求推动着紫花苜蓿在品种改良和抗性育种方面的研究越来越深入[14]。本研究从紫花苜蓿中成功克隆出LEA4类基因MsLEA4-4,对其进行生物信息学分析,并研究在不同逆境胁迫下MsLEA4-4的表达模式,同时构建超表达植物载体,将MsLEA4-4基因转入拟南芥中,为深入研究MsLEA4-4基因在紫花苜蓿中的抗逆机制提供理论依据。
1 材料与方法
1.1 实验材料
紫花苜蓿“中苜1号”为中国农业科学院北京畜牧兽医研究所育成品种。DNA聚合酶Ex Taq、DNA Makers、pMD18-T Vector、限制性内切酶、T4DNA连接酶均购自Takara公司(日本);RevertAidTMFirst Strand cDNA Synthesis Kit购自Fermentas(美国),Trizol试剂购自Invitrogen(美国),SMARTTM RACE cDNA Amplification Kit和In-Fusion® HD Cloning Kit均购自Clontech(美国),ABA购自Sigma(美国),大肠杆菌感受态细胞EscherichiacoliDH5α购自北京天根生化科技有限公司。ZnSO4·7H2O、CuSO4·5H2O、氯仿、异丙醇、乙醇、NaCl、PEG6000等均为国产分析纯试剂。
1.2 实验方法
1.2.1材料的种植与处理 2014年4月将100粒紫花苜蓿中苜1号种子用氯气消毒24 h后播种于铺有滤纸的培养皿上,置于25 ℃光照培养箱内发芽,待长出2片子叶后移至营养钵中(蛭石∶珍珠岩=3∶1),培养4 周后选取长势一致的苜蓿幼苗进行干旱、高盐、低温和脱落酸胁迫人工模拟环境处理,每个处理5株,重复3次。干旱处理:将紫花苜蓿幼苗置于20% PEG6000的1/2 MS营养液中,室温25 ℃条件下将植株分别处理0,2,4,8,12和24 h;高盐处理:将紫花苜蓿幼苗置于含有250 mmol/L NaCl的1/2 MS营养液中,室温25 ℃条件下分别处理0,2,4,8,12和24 h;冷处理:将紫花苜蓿幼苗置于1/2 MS营养液中,4 ℃条件下分别处理0,2,4,8,12和24 h;Zn2+处理和Cu2+处理:将紫花苜蓿幼苗分别置于含有500 μmol/L ZnSO4·7H2O和500 μmol/L CuSO4·5H2O的1/2 MS营养液中,室温25 ℃条件下分别处理0,2,4,8,12和24 h。ABA处理:将紫花苜蓿幼苗置于含有0.1 mmol/L ABA的1/2 MS营养液中,室温25 ℃条件下分别处理0,2,4,8,12和24 h。以上处理分别取其叶,-80 ℃下保存备用。
1.2.2紫花苜蓿MsLEA4-4基因的克隆与生物信息学分析 用Trizol法分别提取250 mmol/L NaCl溶液处理2,4,8,12和24 h后的幼叶总RNA后,按照质量比为1∶1∶1∶1∶1混合均匀。参照RevertAidTMFirst Strand cDNA Asynthesis Kit说明书,将不同处理下提取的RNA进行混合后反转录成cDNA,采用RACE-PCR方法进行扩增。根据转录组测序得到的类LEA蛋白Unigene序列(未发表),分别设计5′RACE和3′RACE的特异性引物GSP1和GSP2,PCR扩增出两端序列,经PMD18-T载体连接,阳性克隆送英骏公司(上海)测序,最后将测序所得3′端和5′端序列拼接,获得全长cDNA序列。
用DNAStar 7.0分析MsLEA4-4基因的核酸及氨基酸序列,用ScanProsite 对MsLEA4-4基因进行功能预测。从NCBI上下载其他植物的LEA蛋白序列,用DNAMAN 6.0进行多序列比对;下载蒺藜苜蓿(Medicagotruncatula)LEA蛋白序列,利用MEGA 5.0软件Neighbor-Joning法构建系统进化树。
1.2.3不同逆境胁迫下紫花苜蓿MsLEA4-4基因的表达特异性 用Trizol试剂分别提取1.2.1中获得的各处理RNA,根据RevertAidTMFirst Strand cDNA Synthesis试剂盒说明书分别反转录为cDNA。参考 TaKaRa公司的SYBR System(ABI,美国),采用两步法进行Real-time PCR扩增,第1步:95 ℃预变性30 s;第2步:95 ℃ 5 s,60 ℃ 34 s,40个循环。每次实验3个样品,每个样品3次重复。基因特异引物为F1/R1,以紫花苜蓿ACT2基因为内参基因,引物为F2/R2。根据得到的Ct值,将每种处理的0 h设为对照,2,4,8,12和24 h分别设为5个不同处理,利用2-△△ct法[15],分别计算MsLEA4-4基因在不同处理下的表达量。
1.2.4构建植物表达载体 分别设计含有BglⅡ和BsteⅡ 酶切位点的引物F4和R4(表1),用该引物扩增MsLEA4-4的ORF序列,得到带有酶切位点的目的基因片段;用BglⅡ和BsteⅡ双酶切该目的基因片段和pCAMBIA3301 质粒载体,经 T4 DNA 连接酶连接,得到插入目的基因的pCAMBIA3301-MsLEA4-4植物超表达载体(图1),转化E.coliDH5α 感受态细胞,挑选测序正确序列用于后续试验。
1.2.5农杆菌转化及筛选 提取测序正确的pCAMBIA3301-MsLEA4-4质粒,使用冻融法转入农杆菌菌株GV3101。采用花序侵染法转化拟南芥,在含草铵膦(PPT, 50 mg/L)的1/2 MS固体培养基上筛选转基因抗性植株,使用PCR和RT-PCR法分别在基因组水平和转录水平对转基因植株进行检测。重复此筛选步骤至获得T3代转基因植株并用于后期胁迫处理试验。将获得的转基因植株在含有NaCl(浓度分别为0、50、100、150、200、250、300 mmol/L)的1/2 MS培养基中生长1周后比较T3转基因植株和野生型拟南芥植株的生长情况。
实验中用到的所有引物用Primer Premier 5.0软件设计,引物序列见表1。

表1 实验中的引物序列Table 1 Primer used in the study
注:表中下划线表示限制性酶切位点。
Note: Underlined nucleotides indicate the restriction site.

图1 pCAMBIA3301-MsLEA4-4植物超表达载体构建Fig.1 Sketch map of over-expression vector of MsLEA4-4
2 结果与分析

图2 紫花苜蓿MsLEA4-4 ORF及载体酶切鉴定结果Fig.2 PCR results of MsLEA4-4 ORF and constructed vector enzyme digestion a:紫花苜蓿MsLEA4-4 ORF电泳Electrophoresis result of the MsLEA4-4 ORF; M: DNA Marker 2000; 1: MsLEA4-4 ORF 片段 The fragment of MsLEA4-4 ORF.b:植物超表达载体pCAMBIA3301-MsLEA4-4酶切鉴定Enzyme digestion of over-expression vector pCAMBIA3301-MsLEA4-4;M: DNA Marker 2000;2: BglⅡ/BstEⅡ双酶切3301-MsLEA4-4 double enzyme digestion of over-expression vector pCAMBIA3301-MsLEA4-4.
2.1 紫花苜蓿MsLEA4-4基因的克隆
根据高通量测序得到的225 bp类LEA Unigene片段,利用RACE-PCR技术,得到3′端长度为665 bp,5′端长度为498 bp的序列。利用DNAMAN 6.0软件对所得到的序列进行拼接后,得到长为613 bp的ORF序列,见图2a。 利用NCBI中的BLAST功能进行序列比对,结果显示该序列与鹰嘴豆(Cicerarietinum)等物种的LEA基因高度同源,初步认为获得的序列是一个LEA类蛋白序列。
2.2 紫花苜蓿MsLEA4-4基因的生物信息学分析
该序列含有一个498 bp的开放阅读框,编码166个氨基酸。序列编码的蛋白质分子量为17.81 kDa,理论等电点为8.74,其中包含25个强碱性氨基酸(K、R),23个强酸性氨基酸(D、E),33个疏水性氨基酸(A、I、L、F、W、V),61个极性氨基酸(N、C、Q、S、T、Y)。该蛋白缺少半胱氨酸(W)和色氨酸(C),富含甘氨酸、丙氨酸、谷氨酰胺、赖氨酸、精氨酸以及苏氨酸等,有5个重复的由11个氨基酸序列TAQAAKEKTQQ组成的序列特征(图3)。
利用GenBank上的BlastP搜索到来源于不同物种的9个LEA蛋白序列,并进行了比对分析。图3中可见,该基因编码蛋白与其他物种中LEA蛋白的同源性相对较高,与蒺藜苜蓿同源性达96%,与拟南芥、野生大豆(Glycinesoja)、鹰嘴豆、地三叶(Trifoliumsubterraneum)等同源性达52%~82%。
将该基因与蒺藜苜蓿中LEA基因家族进行聚类分析,发现与蒺藜苜蓿LEA4-4聚为一类,属于第4组LEA蛋白(图4)。说明该基因可能具有LEA4-4蛋白的功能,将其命名为MsLEA4-4。

图3 MsLEA4-4氨基酸序列与其他植物LEA蛋白的多序列联配Fig.3 Multiple alignment analysis of MsLEA4-4 with homologous from other plants 方括号为5个重复的TAQAAKEKTQQ序列。Square brackets are five repetitive sequences of TAQAAKEKTQQ.Ms:紫花苜蓿 Medicago sativa;Mt:蒺藜苜蓿 Medicago truncatula;Ts:地三叶 Trifolium subterraneum;Ca:鹰嘴豆 Cicer arietinum;Cc:木豆 Cajanus cajan;Ah:花生 Arachis hypogaea;Va:赤豆 Vigna angularis;Gs:野生大豆 Glycine soja;Cj:锦鸡儿 Caragana jubata;At:拟南芥 Arabidopsis thaliana.
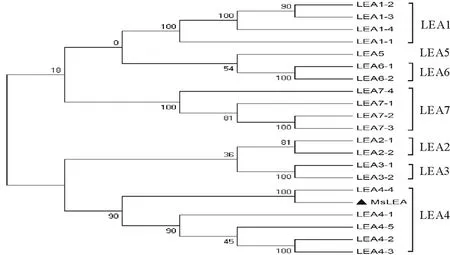
图4 蒺藜苜蓿LEA家族DNA序列系统进化树Fig.4 Phylogenetic tree of LEA DNA in M. truncatula
2.3 逆境胁迫下紫花苜蓿MsLEA4-4基因的表达分析
利用qRT-PCR对紫花苜蓿MsLEA4-4基因在非生物逆境胁迫下的表达量进行了检测。结果显示,多种逆境胁迫均能诱导紫花苜蓿MsLEA4-4基因的增强表达。在干旱(PEG模拟)、盐(NaCl)、重金属(Cu2+处理、Zn2+处理)胁迫诱导下,MsLEA4-4的表达量上调。其中干旱胁迫下该基因的表达量上调最显著,处理8 h表达量为对照的189倍,处理24 h的表达量达到对照的1065倍(图5A);NaCl胁迫下,MsLEA4-4基因的表达量在8 h之前无明显变化,8 h表达量为对照的16倍,接着又降低到与对照的表达量基本一致,24 h的表达量又逐渐上升为对照的35倍(图5B);Cu2+胁迫下,MsLEA4-4基因的表达量随处理时间变化呈单峰趋势,在8 h表达量达到最大,为对照的35倍(图5C);Zn2+胁迫下,MsLEA4-4基因的表达量在12 h之前基本无变化,在处理时间达24 h时表达量突然上升,但是变化也不大,为对照的15倍左右(图5D);冷(4 ℃)胁迫下MsLEA4-4基因的表达量呈现出先升高后降低的趋势,在2 h表达量达到最大,接着就迅速下降,2 h后表达量均低于对照(图5E);外源ABA也能明显诱导MsLEA4-4基因的表达,随诱导时间的变化表达量逐渐上升,处理24 h时表达量达到最大,为对照的85倍(图5F)。
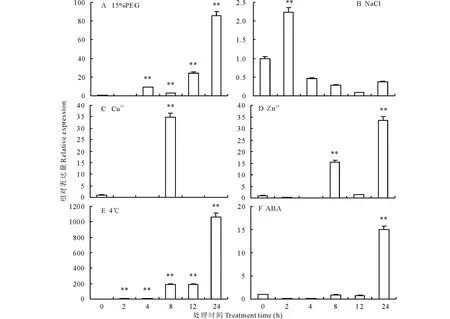
图5 不同胁迫下MsLEA4-4基因的表达量分析Fig.5 Gene expression analysis of MsLEA4-4 in response to different stress 图中所有数据均重复3次,进行方差分析,**为极显著差异。All data are repeated three times in the Figure, analysis of variance, ** is extremely significant difference.
2.4 紫花苜蓿MsLEA4-4基因转化拟南芥
本研究将来自紫花苜蓿的MsLEA4-4 cDNA全长片段通过农杆菌介导的遗传转化方式导入模式植物拟南芥中进行超量表达。首先将MsLEA4-4 cDNA全长片段克隆到植物双元表达载体pCAMBIA3301中(图1)。通过限制性内切酶BglⅡ/BstEⅡ双酶切检测,获得与预期大小相符613 bp左右的条带(图2b)。再将酶切阳性的克隆测序检测,插入序列完整、无缺失、无突变,表明MsLEA4-4基因已经成功克隆到植物表达载体中。通过草铵膦筛选后, 提取T2代转基因植株DNA, 分别用nptⅡ和MsLEA4-4引物进行PCR检测,最终筛选出7株含有MsLEA4-4基因的阳性苗(图6),可用于后续MsLEA4-4基因功能验证实验。
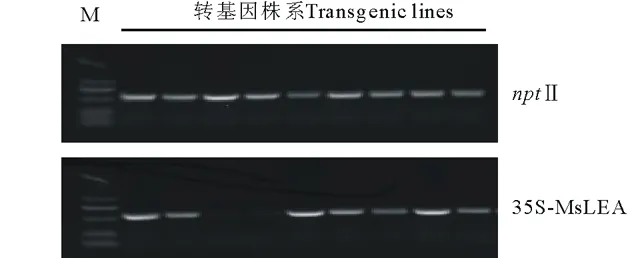
图6 转基因植株PCR检测Fig.6 Detection of transgenic plants by PCR
3 讨论
LEA蛋白最早发现于棉花(Gossypiumhirsutum)子叶中,因其在植物胚胎发育后期大量表达而得名[16]。根据蛋白质序列同源性及其特殊的基元序列,Battaglia等[17]将LEA蛋白分为7个不同的类群。研究发现,不同LEA蛋白都具有高亲水性和热稳定性,缺少半胱氨酸和色氨酸,并富含甘氨酸或其他氨基酸类(如丙氨酸、丝氨酸和苏氨酸)[18]。LEA蛋白在植物中是个数量庞大的家族,LEA基因家族系统进化分析最先在拟南芥中被报道,其共有51个成员,被划分为7类[19],随后在水稻(Oryzasativa)[20]、大豆[21]、黄瓜(Cucumissativus)[22]、玉米[23]中发现分别含有34、35、78和32个LEA蛋白,近年来又在蒺藜苜蓿[24]中发现含有23个LEA蛋白。紫花苜蓿和蒺藜苜蓿为近缘物种,因此本研究以模式植物蒺藜苜蓿中LEA蛋白为参考基因,对MsLEA4-4基因进行聚类分析,发现MsLEA4-4与蒺藜苜蓿LEA4-4聚在一起,归属于LEA4类。因此MsLEA4-4可能具有与LEA4类蛋白相似的功能。
ABA在植物逆境胁迫响应过程中发挥着信号分子的作用。LEA蛋白作为重要的逆境蛋白之一,可能会通过ABA信号途径来调控植物的耐逆性[25]。这是因为LEA基因的启动子区域一般含有ABREs元件,这种顺式作用元件可以通过核心基序(ACGT)与转录因子相结合,来起始ABA响应基因的转录[26]。除了ABREs元件外,LEA基因的启动子区域中还有富含AT序列的ATHB基序(CAATTATTA),它能与ABA信号途径中的调控因子相互作用来调控相关基因的表达。此外,在LEA基因启动子区域还含有能被ABA诱导的胚特异性表达的DPBF基序(ACACNNG)等[3]。本研究发现在外源ABA诱导下,MsLEA4-4基因的表达量在24 h明显上升,达到对照的85倍,说明MsLEA4-4对外源ABA的作用比较敏感,有可能会通过体内的ABA信号途径来参与紫花苜蓿的抗逆性调控。
LEA蛋白在植物应对外界压力的过程中扮演着重要的角色[27]。过去的许多研究已经报道了一些LEA蛋白与植物抗逆性相关的功能。例如,LEA基因的过量表达可以增强转基因植物的胁迫抗性[28]。LEA蛋白最常见的功能是参与植物对干旱的响应过程[29],这是因为LEA基因的启动子区域上都具有一些与干旱相关的顺式作用元件,所以可能被干旱胁迫所诱导[30]。LEA蛋白还有可能通过保护植物体内的酶活性来提高植物对干旱以及各种胁迫的耐逆性[31]。Wu等[32]发现在干旱和高盐条件下转LEA基因丹参体内丙二醛含量较低,并具有很高的超氧化物歧化酶活性和谷胱甘肽浓度。本研究中对MsLEA4-4基因进行了模拟干旱、高盐、重金属等逆境胁迫,发现干旱、高盐、重金属胁迫以及低温胁迫均能诱导mRNA的积累,尤其是干旱胁迫下表现最为明显,说明MsLEA4-4基因可能参与了这些逆境调控。因此下一步将对转基因植株进行干旱、盐等逆境胁迫,并研究转基因植株体内抗氧化酶活性的变化情况,期望揭示紫花苜蓿MsLEA4-4基因在非生物逆境胁迫中的调控作用。
References:
[1] Liu G B. The Matal-Binding Properties and the Protective Effect on Biological Macromolecules of Two Soybean LEA4 Protein. Changchun: Northeast Normal University, 2006.
刘国宝. 两种大豆LEA4蛋白的金属离子结合特性及对生物大分子的保护作用. 长春: 东北师范大学, 2006.
[2] Wang Y R, Zhang Z G, Wu J X. LEA protein and its application in improvement of stress tolerance in plants. Biotechnology Bulletin, 2015, 31(3): 1-9.
王艳蓉, 张治国, 吴金霞. LEA蛋白及其在植物抗逆改良中的应用. 生物技术通报, 2015, 31(3): 1-9.
[3] Liu F, Wang X D, Zhao Y P,etal. Isolation and functional characterization of the seed-specific promoter ofLEAgene from cotton (GossypiumhirsutumL.). Cotton Science, 2014, 26(4): 290-294.
刘峰, 汪小东, 赵彦鹏, 等. 棉花种子特异表达的LEA启动子克隆及功能验证. 棉花学报, 2014, 26(4): 290-294.
[4] Li X. Molecular Evolutionary Research of the PlantLEAGene Family and Preliminary Functional Analysis of an AtypicalLEAGene inArabidopsis. Zhenjiang: Jiangsu University, 2016.
李翔. 植物LEA基因家族的分子进化研究和拟南芥非典型LEA基因功能的初步分析. 镇江: 江苏大学, 2016.
[5] Banerjee A, Roychoudhury A. Group II late embryogenesis abundant (LEA) proteins: structural and functional aspects in plant abiotic stress. Plant Growth Regulation, 2015, 79(1): 1-17.
[6] Zou Y D, Shi L S, Liu G B,etal. Structure and function of group 1 late embryo genesis abundant proteins. Chinese Bulletin of Life Sciences, 2008, 20(3): 490-494.
邹永东, 施丽沙, 刘国宝, 等. 植物胚胎发育晚期丰富蛋白1组的结构与功能. 生命科学, 2008, 20(3): 490-494.
[7] Zhao Y M, Yang J X, Yu J N,etal. Transformation of a stress tolerant gene in wheat,TaLEA2, intoArabidopsisthaliana. Acta Botanica Boreali Occidentalia Sinica, 2006, 26(1): 1-6.
赵咏梅, 杨建雄, 俞嘉宁, 等. 小麦耐逆基因-TaLEA2转化拟南芥的研究. 西北植物学报, 2006, 26(1): 1-6.
[8] Dalal M, Kumar G S, Mayandi K. Identification and expression analysis of group 3 LEA family genes in sorghum [Sorghumbicolor(L.) Moench]. Acta Physiologiae Plantarum, 2013, 35: 979-984.
[9] Bai Y Q. Cloning and Functional Characterization ofLEA3-1 Gene from Alfalfa (MedicagosativaL.). Beijing: Chinese Academy of Agricultures Sciences, 2010.
白永琴. 紫花苜蓿LEA3-1基因克隆及其功能验证. 北京: 中国农业科学院, 2010.
[10] Amara I, Capellades M, Ludevid M D,etal. Enhanced water stress tolerance of transgenic maize plants over-expressingLEARab28 gene. Journal of Plant Physiology, 2013, 170(9): 864-873.
[11] Zamora-Briseno J A, Jimenez E S. A LEA 4 protein up-regulated by ABA is involved in drought response in maize roots. Molecular Biology Reports, 2016, 43(4): 221-228.
[12] Dang N X, Popova A V, Hundertmark M,etal. Functional characterization of selected LEA proteins fromArabidopsisthalianain yeast andinvitro. Planta, 2014, 240(2): 325-336.
[13] Jia H L, Wang X M, Gao H W,etal. Cloning the gene γ-tocopherol methyltransferase (γ-TMT) from alfalfa and expression analysis in adverse situations. Acta Prataculturae Sinica, 2012, 21(6): 198-206.
贾会丽, 王学敏, 高洪文, 等. 紫花苜蓿γ-生育酚甲基转移酶(γ-TMT)基因的克隆与逆境下的表达分析. 草业学报, 2012, 21(6): 198-206.
[14] Xu A K. The Basic Study on Genetic Improvement ofPuccinelliachinampoensisandMedicagosativaUnder Saline-alkali Conditions. Changchun: Northeast Normal University, 2014.
徐安凯. 盐碱条件下朝鲜碱茅及紫花苜蓿遗传改良的基础研究. 长春: 东北师范大学, 2014.
[15] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real time quantitative PCR and the 2-△△CTmethod. Methods, 2001, 25(4): 402-408.
[16] Baker J, Van D C, Dure L. Sequence and characterization of 6 Lea proteins and their genes from cotton. Plant Molecular Biology, 1988, 11(3): 277-291.
[17] Battaglia M, Olvera C Y, Garciarrubio A,etal. The enigmatic LEA proteins and other hydrophilins. Plant Physiology, 2008, 148(1): 6-24.
[18] Liu Y, Xing X, Li D Q. Studies on the classification and function of LEA proteins. Biotechnology Bulletin, 2011, 8: 36-43.
刘洋, 邢鑫, 李德全. LEA蛋白的分类与功能研究进展. 生物技术通报, 2011, 8: 36-43.
[19] Hundertmark M, Hincha D K. LEA (Late Embryogenesis Abundant) proteins and their encoding genes inArabidopsisthaliana. BMC Genomics, 2008, 9: 118.
[20] Wang X S, Zhu H B, Jin G L,etal. Genome-scale identification and analysis ofLEAgenes in rice (OryzasativaL.). Plant Science, 2007, 172(2): 414-420.
[21] Li L, Xu H L, Yang X L,etal. Genome-wide identification, classification and expression analysis ofLEAgene family in soybean. Scientia Agricultura Sinica, 2011, 44(19): 3945-3954.
李乐, 许红亮, 杨兴露, 等. 大豆LEA 基因家族全基因组鉴定、分类和表达. 中国农业科学, 2011, 44(19): 3945-3954.
[22] Altunoglu Y C, Baloglu P, Yer E N,etal. Identification and expression analysis ofLEAgene family members in cucumber genome. Plant Growth Regulation, 2016, 80(2): 225-241.
[23] Li X, Cao J. Late embryogenesis abundant (LEA) gene family in maize: identification, evolution, and expression profiles. Plant Molecular Biology Reporter, 2015, 34(1): 15-28.
[24] Liu Z M, Liu W X, Jia X T,etal. Genome-wide analysis ofLEAgene family inMedicagotruncatula. Pratacultural Science, 2015, 32(3): 382-391.
刘志敏, 刘文献, 贾喜涛, 等. 蒺藜苜蓿LEA基因家族全基因组分析. 草业科学, 2015, 32(3): 382-391.
[25] Bielas B, Leida C, Rubio-Cabetas M J. Physiological characterization of drought stress response and expression of two transcription factors and twoLEAgenes in threePrunusgenotypes. Scientia Horticulturae, 2016, 213(14): 260-269.
[26] Jia H Y, Suzuki M, McCarty D R. Regulation of the seed to seedling developmental phase transition by the LAFL and VAL transcription factor networks. Developmental Biology, 2014, 3(1): 135-145.
[27] Su M Y, Huang G, Zhang Q,etal. The LEA protein, ABR, is regulated by ABI5 and involved in dark-induced leaf senescence inArabidopsisthaliana. Plant Science, 2016, 247: 93-103.
[28] Liu Y, Wang L, Jiang S S. Group 5 LEA protein,ZmLEA5C, enhance tolerance to osmotic and low temperature stresses in transgenic tobacco and yeast. Plant Physiology and Biochemistry, 2014, 84: 22-31.
[29] Yu J, Lai Y M, Wu X,etal. Overexpression ofOsEm1 encoding a group I LEA protein confers enhanced drought tolerance in rice. Biochemical and Biophysical Research Communications, 2016, 478(2): 703-709.
[30] Sun X J, Tang X Q, Yu L X,etal. Cloning and characterization of the LEA3 protein gene and promoter fromSorghumbicolor. Plant Diversity and Resources, 2013, 35(5): 585-593.
孙晓娇, 汤晓倩, 于丽霞, 等. 高粱LEA3 蛋白基因和启动子的克隆及序列分析. 植物分类与资源学报, 2013, 35(5): 585-593.
[31] Furuki T, Sakurai M. Group 3 LEA protein model peptides protect enzymes against desiccation stress. Biochimica et Biophysica Acta, 2016, 1864(9): 1237-1243.
[32] Wu Y C, Liu C L, Kuang J,etal. Overexpression ofSmLEAenhances salt and drought tolerance inEscherichiacoliandSalviamiltiorrhiza. Protoplasma, 2014, 215(5): 1191-1199.
CloningandexpressionanalysisofMsLEA4-4fromMedicagosativa
JIA Hui-Li1, WANG Xue-Min2, GUO Ji-Cheng3, GAO Hong-Wen2, WU Xin-Ming1, LIU Jian-Ning1, SHI Yong-Hong1, DONG Kuan-Hu4, WANG Yun-Qi1*
1.AnimalHusbandryandVeterinaryInstitute,ShanxiAcademyofAgriculturalSciences,Taiyuan030032,China; 2.InstituteofAnimalScience,ChineseAcademyofAgriculturesSciences,Beijing100193,China; 3.BeijingGreenJinghuaLandscapingCo.,Ltd,Beijing102209,China; 4.CollegeofAnimalScienceandTechnology,ShanxiAgriculturalUniversity,Taigu030801,China
Late embryogenesis abundant (LEA) proteins are widely involved in many adverse situations for plants. In this study, we isolated a LEA4 gene from alfalfa by homology cloning strategy, termedMsLEA4-4. TheMsLEA4-4 encoding revealed 512 amino acids and structure analysis showed that the gene contains eleven repeating TAQAAKEKTQQ amino acids sequences. Quantitative real-time PCR was used to detectMsLEA4-4 expression quantities in adverse situations. Results revealed that the expression ofMsLEA4-4 was up-regulated by drought (PEG), salinity (NaCl), Cu2+, Zn2+and ABA stress. Gene expression was highest at 2 h and 8 h under the stress of NaCl, Cu2+and Zn2+. Under chilling and drought stress, the gene showed a rising trend. These results indicate that theMsLEA4-4 protein may be involved in the regulation of environment stress responses in alfalfa. The plant expression vector pCAMBIA3301-MsLEA4-4 was constructed and transgenic plants were obtained through infecting inflorescences ofArabidopsisbyAgrobacteriumtumefaciens-mediated transformation. The vector sequence was tested by antibiotic (PPT) and PCR in the genome of transgenic plants and indicated that the target gene had been transferred. This study provides basic information for further study of theMsLEA4-4 function in stress-tolerance regulation in alfalfa.
Medicagosativa; late embryogenesis abundant proteins (LEA); adversity stress; genetic transformation
10.11686/cyxb2017202http//cyxb.lzu.edu.cn
贾会丽, 王学敏, 郭继承, 高洪文, 吴欣明, 刘建宁, 石永红, 董宽虎, 王运琦. 紫花苜蓿MsLEA4-4基因的克隆、表达分析及遗传转化. 草业学报, 2017, 26(12): 108-116.
JIA Hui-Li, WANG Xue-Min, GUO Ji-Cheng, GAO Hong-Wen, WU Xin-Ming, LIU Jian-Ning, SHI Yong-Hong, DONG Kuan-Hu, WANG Yun-Qi. Cloning and expression analysis ofMsLEA4-4 fromMedicagosativa. Acta Prataculturae Sinica, 2017, 26(12): 108-116.
2017-04-25;改回日期:2017-06-14
现代农业产业技术体系专项资金(CARS-35-25),物种资源保护费(2130135)和山西省农业科学院畜牧兽医研究所项目(xms201506)资助。
贾会丽(1980-),女,山西临猗人,助研,在读博士。E-mail:jiahuili333@126.com*通信作者Corresponding author. E-mail: wangyunqi2017@126.com

