低温对青海扁茎早熟禾活性氧代谢的影响和相关基因表达分析
史毅,牛奎举,余倩倩,刘文辉,马晖玲*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.华南农业大学园艺学院,广东 广州 510640;3.青藏高原优良牧草种质资源利用省级重点实验室,青海省畜牧兽医科学院,青海 西宁 810016)
低温对青海扁茎早熟禾活性氧代谢的影响和相关基因表达分析
史毅1,牛奎举1,余倩倩2,刘文辉3,马晖玲1*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.华南农业大学园艺学院,广东 广州 510640;3.青藏高原优良牧草种质资源利用省级重点实验室,青海省畜牧兽医科学院,青海 西宁 810016)
为研究青海扁茎早熟禾(BJ)在低温胁迫下活性氧积累、抗氧化酶防御与逆境相关基因表达的机制,以WY-2(草地早熟禾‘午夜2号’)为对照,对这两种材料低温适应(10/5 ℃) 3 d和冷冻胁迫(-10 ℃) 24 h,测定了O2-·产生速率、H2O2含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性及其抗氧化酶相关基因、冷胁迫相关转录因子的相对表达量。结果表明,低温胁迫可引起BJ和WY-2叶片内的O2-·产生速率、H2O2含量和MDA含量的增加,BJ活性氧的积累程度和MDA含量均低于WY-2;低温胁迫可导致BJ的SOD、APX和GR活性的降低,CAT活性呈先升后降的趋势,但只有APX活性表现为BJ高于WY-2,同时,BJ和WY-2叶片内的Cu/ZnSOD、CAT、APX和GR基因的表达量在低温胁迫后被明显的上调,且BJ抗氧化酶相关基因的相对表达量普遍高于WY-2;BJ叶片内的DREB2是下调表达的,ERF、DREB1、CSP和HSP基因在低温胁迫后均表现出明显的上调表达,且ERF、CSP和HSP的相对表达量高于WY-2。从而得出结论,扁茎早熟禾在低温胁迫时有害物质的积累低于午夜二号,抗氧化酶相关基因表达上调幅度,以及一些与冷胁迫相关转录因子的表达调控均大于午夜二号。这些物质合成和基因表达的差异可能共同导致扁茎早熟禾的高耐冷性。
青海扁茎早熟禾;草地早熟禾;活性氧;抗氧化酶;基因表达
低温胁迫是暖季型草坪草分布、生长和生产力的一个重要限制因子[1]。在我国北方地区,低温是影响冷季型草坪草绿期和越冬的一个关键因子[2]。因此,提高草坪草的抗寒性和延长绿期将是目前草坪草研究中的一个重要课题。
青海扁茎早熟禾(Poapratensisvar.ancepscv. Qinghai)是草地早熟禾(Poapratensis)的一个变种,广泛分布于青海省海拔3000 m 以上的天然草地上,具有较强的抗寒性[3],尤其强于一些草地早熟禾商用品种,例如午夜2号,本实验室已有数据证明,但尚未发表。目前对青海扁茎早熟禾的研究主要集中在其生长特性[4-5]、繁殖特性[6-7]和种群变化特征[8-9],对其响应逆境胁迫的生理和分子机制的研究很少。然而,明确优良种质资源适应逆境胁迫的机制是培育优良抗性种质和发展高效率、低成本草坪的关键措施。
草坪草抗逆性机理涉及多种代谢进程,主要包括水分和营养元素的关系、碳水化合物代谢、蛋白质代谢、激素代谢和抗氧化防御系统[1,10]。低温胁迫可影响植物体内多种代谢的能量平衡,从而引起活性氧(ROS)的积累和脂质、核酸及蛋白的氧化损伤[11]。酶类和非酶类的抗氧化剂可通过一定程度的清除ROS来缓解逆境胁迫引起的氧化损伤,抗氧化清除能力的增加与低温胁迫下植株的生存能力息息相关[12]。然而,在多年生黑麦草(Loliumperenne)[13]和狗牙根(Cynodondactylon)[14]响应低温胁迫的研究中发现,低温胁迫可导致抗氧化酶活性(SOD,CAT和APX)的下降。同时,低温胁迫也会引起这两种材料过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)下调表达,而鹰嘴豆(Cicerarietinum)响应短期低温胁迫时,超氧化物歧化酶SOD和CAT是上调表达的[15]。此外,一些逆境相关基因的表达调控与草坪草对逆境胁迫响应有着一定的联系。Zhang 等[16]对低温胁迫下草地早熟禾的转录组进行分析后发现,抗寒转录因子(CBF/DREB)、乙烯响应因子(ERF)、热激转录因子(HSF)、NAC蛋白和生长素应答因子(ARF)等是草地早熟禾响应低温胁迫的主要转录调控因子。
因此,本研究以草地早熟禾‘午夜2号’(WY-2)为对照,对青海扁茎早熟禾(BJ)响应短期低温胁迫的机理进行了初步的研究,包括活性氧(ROS)的积累、脂质过氧化(MDA)、抗氧化酶活性(SOD、CAT、APX、GR)、抗氧化酶基因表达和逆境胁迫相关基因表达(ERF、DREB、CSP、SWEET、HSP)。旨在为草坪草响应低温胁迫的机理和草坪草抗寒新品种的培育奠定一定的理论基础。
1 材料与方法
1.1 供试材料
‘青海扁茎早熟禾’(BJ)的种子由青海省畜牧兽医科学院提供,‘午夜2号’(WY-2)的种子由北京克劳沃草业技术开发中心提供。
1.2 材料培养和生长条件
试验于2016年7-9月在甘肃农业大学培养室内进行,选取健康、饱满的种子,播种于内口径20 cm、高14 cm的聚乙烯塑料盆中,基质为土壤表层土与沙的混合物(4∶1),播量为6.5 g/m2,在光照培养室内培养,光照强度为400 μmol/(m2·s);温度为白天25 ℃、14 h,夜间20 ℃、10 h;相对湿度为60%~70%。出苗前用无纺布覆盖,苗齐后进行间苗,留下长势一致和分布均匀的20株幼苗。采用正常的养护管理,每隔10 d浇一次1/2 Hoagland营养液[17],每盆100 mL。
1.3 低温处理和取样
待每株长到5~6片真叶进行低温胁迫处理。挑选每盆内材料长势一致的4盆组成一组,将其移至10/5 ℃的培养箱内(其他条件与对照保持一致)低温适应,3 d后再将材料放置于-10 ℃的冰箱内冷冻处理24 h,分别于低温适应处理前(0 h),低温适应3 d 后(C-3d),冷冻处理2 h(F-2 h)、4 h(F-4 h), 8 h(F-8 h), 24 h(F-24 h)取样,每种每个时间点4个重复(每盆为一个重复),共取48个早熟禾叶片样品,取后放入液氮中,-80 ℃保存,用于生理指标和基因表达量测定。
1.4 生理指标测定
O2-·产生速率参照Schneider等[18]的方法测定;H2O2含量用Liu 等[19]的方法测定;丙二醛(MDA)含量的测定采用Heath等[20]的方法;粗酶液的提取和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)活性的测定参照de Azevedo等[21]的方法。
1.5 基因表达分析
1.5.1总RNA的提取和第一链cDNA的合成 叶片总RNA采用TIANGEN的总RNA抽提试剂盒(RNAsimple Total RNA Kit),RNA的质量和浓度用超微量分光光度计检验,保证每个样本的A260/A280值为 1.8~2.2,且A260/A230接近于2.0。去除基因组DNA 污染和第一链cDNA的合成采用TaKaRa 的反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)(TaKaRa)。具体操作步骤均按照试剂盒的说明书进行。
1.5.2引物设计和RT-qPCR分析Cu/ZnSOD、CAT、APX、GR和Actin基因的引物序列根据NCBI的同源序列进行比对设计(表1),ERF(c117307)、DREB1(c115634)、DREB2(c122138)、CSP(c117281)、SWEET(c121279)、HSP(c112042)基因的引物序列参照Zhang等[16]的报道。引物合成由金开瑞生物工程有限公司完成,纯化方式为PAGE纯化。每对引物在所有样本均可扩增出单一的目的条带,溶解曲线均为单峰。
实时定量PCR (RT-qPCR)分析采用LightCycle 96 (Roche),荧光试剂用TaKaRa的试剂盒(SYBR® Premix DimerEraserTM)。反应体系为20 μL,包含1.5 μL cDNA, 10 μL 2×SYBR® Premix DimerEraser, 上下游引物 (10 μmol/L)各0.6和 7.3 μL ddH2O。扩增程序为: 95 ℃ 预变性300 s,95 ℃变性10 s,60 ℃退火30 s,40个循环,随后进行60~95 ℃的溶解曲线的绘制分析。基因相对表达量的计算采用2-ΔΔCt法[22]。

表1 引物序列信息Table 1 Primer sequences
1.6 数据处理
采用SPSS 19.0进行数据单因素方差分析(ANOVA),使用Duncan法以及LSD法在0.05显著性水平进行差异显著性分析,原始数据的基本处理和图表绘制采用Microsoft Excel 2013。
2 结果与分析
2.1 低温胁迫对O2-·产生速率和H2O2含量的影响
如图1所示,低温胁迫可增加早熟禾O2-·产生速率和H2O2含量,除冷冻处理4 h (F-4 h)外,BJ(青海扁茎早熟禾)的O2-·产生速率在整个低温处理期间均低于WY-2(草地早熟禾‘午夜2号’)。低温适应3 d 后(C-3 d),BJ和WY-2的O2-·产生速率与处理前(0 h)均有所降低,但并无显著性差异(P>0.05)。BJ的O2-·产生速率在冷冻处理4 h后达到最高值,为8.2 nmol/(min·g),较处理前增加了19.3%。然而,冷冻处理2和8 h WY-2的O2-·产生速率均显著高于0 h (P<0.05),且冷冻处理2 h后的O2-·产生速率较0 h增加了80.4%。
BJ和WY-2的H2O2含量在整个处理期内总体呈先增高后降低的趋势(图1)。BJ的H2O2含量在低温适应和冷冻处理初期(F-2h)有所增加,但与0 h 并无显著性差异(P>0.05),在冷冻处理8 h后,H2O2含量显著增加(P<0.05),并达到最大值。WY-2的H2O2含量在整个低温处理期间均显著高于0 h (P<0.05),在冷冻处理2 h后就达到了最大值,为389.6 nmol/g,较0 h 增加了58.2%;在冷冻处理24 h后,H2O2含量显著降低,但仍然高于0 h。
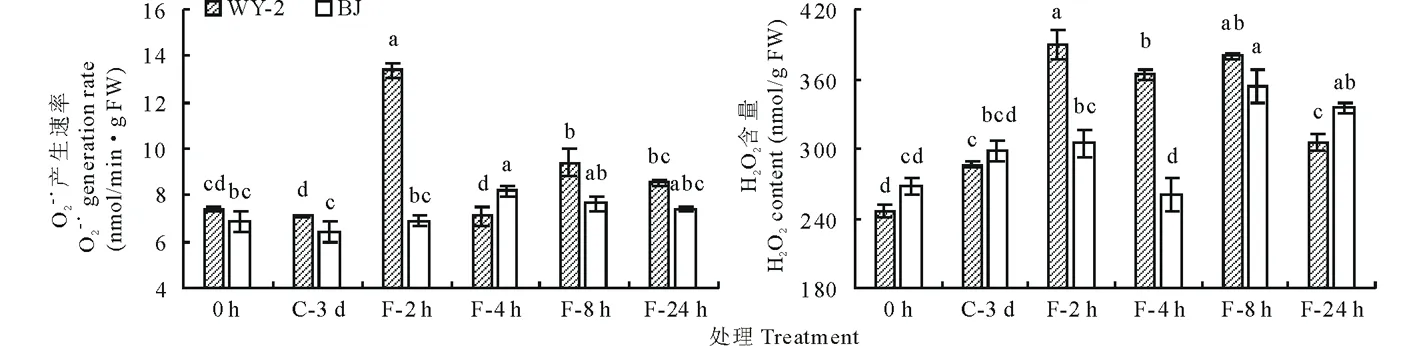
图1 低温胁迫对两种早熟禾叶片组织O2-·产生速率和H2O2含量的影响Fig.1 Effects of cold stress on O2-· generation rate and H2O2 content of the leaf tissue of two blue grass species C:低温胁迫 Cold acclimation;F:冷冻胁迫 Frozen stress.竖线表示标准误,不同的小写字母表示差异显著(P<0.05),下同。Vertical bars indicate mean±standard error (SE). Different lowercase letters represent significant difference at 0.05 level. The same below.
2.2 低温胁迫对MDA含量的影响

图2 低温胁迫对两种早熟禾叶片组织MDA含量的影响Fig.2 Effects of cold stress on MDA content of the leaf tissue of two blue grass species
如图2所示,低温胁迫可导致BJ和WY-2叶片内MDA(丙二醛)含量的持续增加,BJ的MDA含量在整个处理期间均显著低于WY-2 (P<0.05)。BJ和WY-2的MDA含量在冷冻胁迫24 h (F-24 h)后均达到了最大值,分别为78.8和161.8 nmol/g,较0 h分别增加了50.0%和115.3%,即冷冻处理24 h后WY-2的MDA增长量是BJ的2.3倍。
2.3 低温胁迫对抗氧化酶活性的影响
BJ和WY-2叶片内不同种类的抗氧化酶对低温胁迫的响应存在一定的差异(图3)。低温胁迫可导致BJ和WY-2的SOD活性降低,低温适应3 d可显著降低BJ 的SOD活性(P<0.05),WY-2的SOD活性较0 h虽有所降低,但未达到显著性差异(P<0.05)。BJ的SOD活性在冷冻胁迫4 h后降到最小,较0 h降低了80%;在冷冻处理8 h后BJ的SOD活性有小幅的上升,但仍显著低于0 h (P<0.05)。WY-2的SOD活性在冷冻处理2 h降到最低,较0 h降低了68.6%;在冷冻处理8 h后,WY-2的SOD活性较2 h显著增加(P<0.05),且与0 h无显著性差异(P>0.05)。
BJ 的CAT活性随着低温处理时间的延长呈先增加后降低的趋势,而 WY-2 的CAT活性则呈先降后升再降的趋势(图3)。同时,在整个低温处理过程中,WY-2 的CAT活性整体要高于BJ。
BJ和WY-2的APX、GR活性对低温胁迫响应的敏感性较SOD和CAT的低,在冷冻处理8 h之前的整个低温处理期内,这两种材料叶片内的APX和GR活性与0 h均无显著性差异,WY-2的GR活性甚至在整个低温处理期间均没有显著的变化(P>0.05)。WY-2的APX活性在冷冻处理24 h后显著低于0 h,较0 h降低了81.3%。BJ的GR活性在冷冻处理8 h后显著低于0 h,较0 h降低了52.4%,WY-2的GR活性虽然在整个低温处理期间并没有显著性的变化,但是一直维持在比较高的水平。
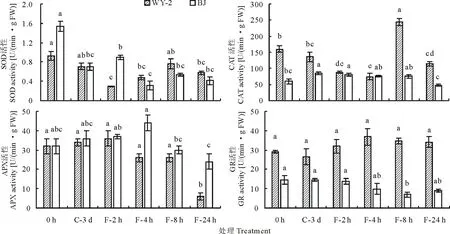
图3 低温胁迫对两种早熟禾叶片组织抗氧化酶活性的影响Fig.3 Effects of cold stress on antioxidant enzyme activity of the leaf tissue of two blue grass species
2.4 低温胁迫对抗氧化酶相关基因表达的影响
低温胁迫引起BJ和WY-2的抗氧化酶相关基因的表达上调,BJ的Cu/ZnSOD、CAT、APX和GR相对表达量普遍高于WY-2(图4)。除WY-2的Cu/ZnSOD相对表达量随着低温处理时间的延长逐渐增加外,BJ和WY-2的CAT、APX、GR相对表达量以及BJ的Cu/ZnSOD相对表达量均随着处理时间的延长呈先增加后降低的趋势。BJ和WY-2的CAT相对表达量均在冷冻胁迫2 h后达到最高,此时BJ的CAT相对表达量是WY-2的2.7倍;当冷冻胁迫8 h后,CAT相对表达量逐渐接近于0 h的相对表达量。BJ的APX相对表达量在冷冻处理4 h后最高,是0 h的46.6倍,而WY-2的APX相对表达量在低温适应3 d后最高,是0 h相对表达量的12.3倍。BJ和WY-2的GR相对表达量在低温适应3 d后最高,分别为0 h相对表达量的15.3和9.1倍;在冷冻胁迫处理期间BJ的GR相对表达量均接近于低温适应后的值,WY-2的GR相对表达量在冷冻处理24 h后有明显的降低。
2.5 低温胁迫对逆境相关基因表达的影响
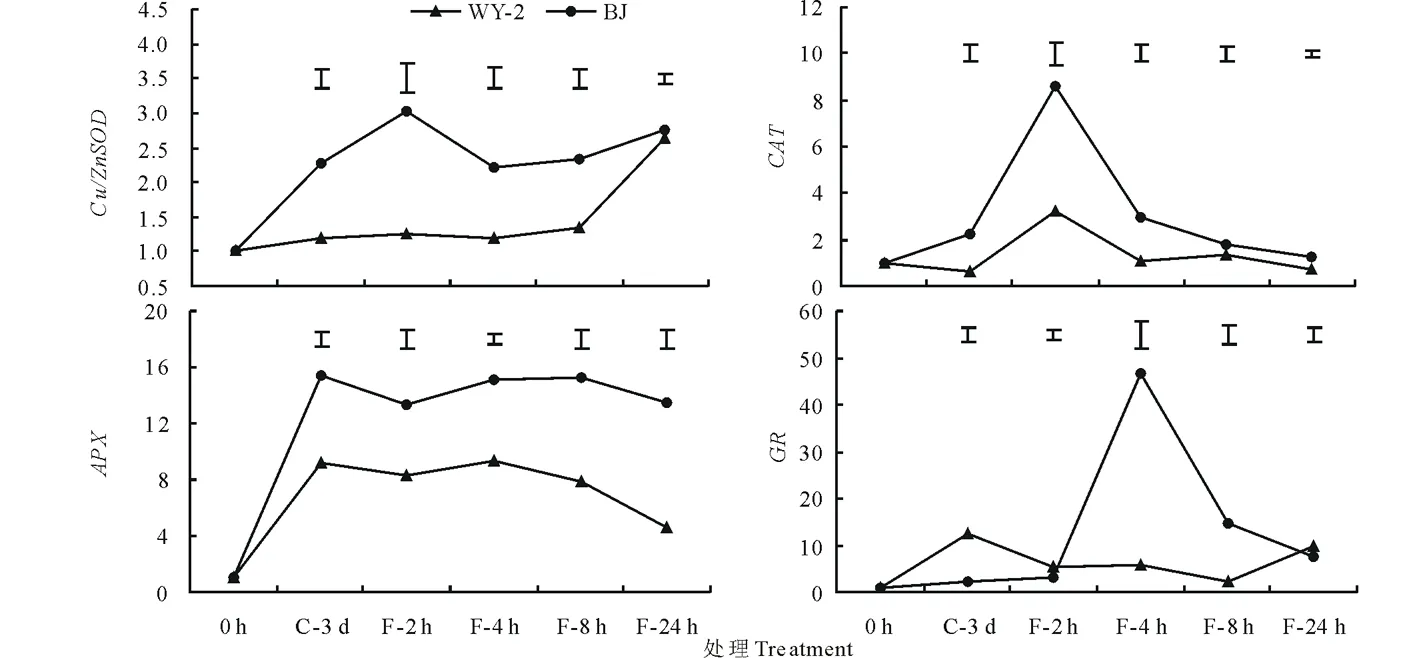
图4 低温胁迫对两种早熟禾叶片组织抗氧化酶基因表达量的影响Fig.4 Effects of cold stress on relative expression level of antioxidant enzyme genes of the leaf tissue of two blue grass species 图中短线表示同一时间点的两个平均值间的最小显著差异。下同。The bar in the Figure presents the least significant difference between the means in the same time point. The same below.

图5 低温胁迫对两种早熟禾叶片组织逆境胁迫相关基因相对表达量的影响Fig.5 Effects of cold stress on relative expression level of stress-related genes of the leaf tissue of two blue grass species
如图5所示, 低温胁迫可诱导早熟禾叶片内逆境相关基因(ERF、DREB1、DREB2、CSP、SWEET、HSP)的上调或下调表达。BJ与WY-2叶片内的ERF相对表达量对低温胁迫的响应截然相反,即BJ的ERF在低温胁迫后是上调的,而WY-2的ERF则是下调的;BJ的ERF相对表达量在低温胁迫期间呈先升后降的趋势,在冷冻处理4 h后最高,是0 h的21.8倍;WY-2的ERF相对表达量在冷冻胁迫2 h后最低,是0 h的9%。BJ与WY-2叶片内的DREB2相对表达量对低温胁迫的响应与ERF的表达情况正好相反,其在BJ叶片内是下调的,而WY-2叶片内出现十分明显的上调表达,在冷冻处理2 h后,其表达量是0 h的91.4倍。
BJ的CSP、SWEET、HSP相对表达量在低温胁迫期间均高于WY-2,具体的表达调控方式在BJ与WY-2间同样存在明显的差异(图5)。SWEET除BJ低温适应3 d后有明显的上调外,其余处理时间均与0 h相近,无明显的上调或下调表达。BJ的CSP和HSP在整个低温胁迫期间均明显出现了上调表达,而WY-2的CSP则没有出现明显的表达调控。BJ和WY-2的DREB1表达调控对低温胁迫的响应基本相似,呈先升后降再升的趋势,且WY-2的DREB1相对表达量高于BJ。
综上所述,BJ叶片内的ERF、DREB1、CSP和HSP在低温胁迫后均表现出明显的上调表达,且ERF、CSP和HSP的相对表达量高于WY-2;低温处理后DREB2在BJ叶片内是下调表达的,SWEET对低温胁迫的敏感性较低,表达调控不明显。
3 讨论
3.1 低温胁迫对早熟禾氧化损伤的影响
在正常生长情况下,植物细胞内活性氧(reactive oxygen species ROS,包括O2-·,OH·和H2O2等)的产生与清除处于动态平衡;当植物体遭受到各种逆境胁迫时,这种动态平衡就会被打破,导致ROS的不断积累[23-24],从而引起细胞结构性损伤。而植物对逆境胁迫的抗性,常常与逆境下对ROS的清除能力有关[25]。同时,ROS包括自由基的积累会启动膜脂过氧化反应,使膜内脂双分子层中含有的不饱和脂肪酸链降解,从而对细胞膜的完整性产生破坏,这一反应伴随着过氧化产物MDA 积累[11,26-27]。本研究表明,BJ(青海扁茎早熟禾)和WY-2(草地早熟禾‘午夜2号’)在遭受到低温胁迫时会引起H2O2含量和O2-·产生速率的增加,其 WY-2叶片内ROS积累的程度高于BJ;同时,低温胁迫也引起BJ和WY-2叶片内MDA含量的增加,且BJ的MDA含量在整个胁迫过程中始终低于WY-2,这两个结果同时说明BJ受短期的低温胁迫的损害程度较WY-2低,对低温具有较强的耐受性。惠竹梅等[28]的研究发现低温胁迫可导致葡萄幼苗体内H2O2、OH·的含量及O2-·的产生速率、MDA 的含量的增加,本研究结果与其相似。Prasad等[29]使用低温处理玉米4 h,出现H2O2积累峰值,处理18 h后过氧化氢酶出现峰值,此时H2O2含量已下降至初始值,此与本研究中H2O2含量和O2-·产生速率先升高后降低的趋势相符。
3.2 低温胁迫下早熟禾的抗氧化酶防御系统
植物在长期的进化过程中形成了一套复杂而精密的系统以保证自身体内ROS产生和清除的动态平衡[11]。抗氧化酶类催化的一系列酶促反应是植物体内ROS清除最直接和有效的方法,这些抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)等[30]。SOD和CAT位于植物体内ROS清除体系的最前线,这两种酶不仅可以阻止更多ROS的形成,还在细胞内H2O2信号传导过程中扮演着必不可少的角色[31]。APX和GR 则参与AsA-GSH循环中,通过维持抗坏血酸(AsA)和谷胱甘肽(GSH)在细胞内的含量来清除ROS[32]。
Kazemi-Shahandashti 等[15]研究发现,鹰嘴豆(Cicerarietinum)的抗氧化酶在抵御短期的低温胁迫时呈现出相互协同的作用。本研究表明,在WY-2和BJ遭受到低温胁迫时,SOD活性均出现了下降,说明植物体内ROS的清除系统已启动。BJ叶片内的CAT和APX活性表现为先上升后下降,而WY-2叶片CAT活性表现为先下降后上升又下降,且WY-2以上各酶变化幅度均大于BJ,说明BJ体内抗氧化酶的调节能力强于WY-2。而GR活性在BJ叶片内始终低于WY-2,低温胁迫初期并无明显变化,在冷冻处理8 h才出现了显著降低,表明谷胱甘肽调节途径启动较晚。各种氧化酶的变化时间不同说明叶片内抗氧化酶的相互协同作用来防御短期的低温胁迫,先是SOD,再是CAT和APX,最后是GR。此外,在酶活性降低的同时,植物体内应激发相应的基因表达来产生抗氧化酶。本研究对低温胁迫期间早熟禾叶片内的抗氧化酶基因表达分析后发现,当早熟禾遭受到胁迫时抗氧化酶基因的相对表达量出现了显著升高,WY-2抗氧化酶相关基因的相对表达量要普遍高于BJ,此与WY-2酶系统活性变化幅度较大相符,也同时说明了BJ的抗氧化调节能力强于WY-2。其他关于草坪草响应低温胁迫的研究同样表明低温胁迫可导致抗氧化酶活性(SOD,CAT和APX)的下降[13-14],而与抗氧化酶活性降低相对应的是抗氧化酶相关基因的上调表达[15]。
基因转录和表达水平跟品种,组织类型、胁迫强度和胁迫事件等密切相关,因此抗氧化酶基因的表达情况相对比较复杂[33]。本研究中各抗氧化酶相关基因表达升高均早于抗氧化酶活性的变化,跟酶活性不呈一致性,这一点尤其表现在GR的酶活性在胁迫初期基本与0 h没有显著性差异,而GR的相对表达量则在低温适应和冷冻胁迫期间较0 h有明显的提高。在草地早熟禾响应干旱和盐碱胁迫时同样观察到了这种抗氧化酶活性与相关基因的表达量不一致的情况[27,34-35],造成这种不一致性的可能原因是这种酶的活性是由转录后的调控作用控制的,而不是直接由转录水平所决定[35]。
3.3 低温胁迫下早熟禾逆境相关基因的表达情况
低温胁迫可引起一系列与诱导冷调节蛋白基因相关的信号转导,这些冷调节蛋白基因包括CBF(C-repeat binding factor),又称作DREB(dehydration responsive element binding protein)转录因子,其属于ERF乙烯响应转录因子家族,多个报道表明CBF基因的表达与植物低温胁迫能力有关[36-37]。Zhang等[16]用转录组测序技术对低温胁迫下草地早熟禾抗寒相关基因进行了分析,CBFs是草地早熟禾响应低温胁迫的重要转录因子,同时,SWEET(sugars will eventually be exported transporter)蛋白、HSP(热激蛋白)和CSP(冷激蛋白)基因也参与草地早熟禾响应低温胁迫的转录调节。SWEET基因被称作糖运输蛋白基因,糖运输在植物渗透调节和抗逆性能中起到重要作用,并且过表达AtSWEET16的拟南芥表现出较强的抗冻能力[38]。HSP在植物受到各种逆境胁迫时均会出现过表达,在植物遇到低温胁迫时也不例外[39]。
本研究表明,BJ叶片内的DREB1、CSP和HSP在低温胁迫后均表现出明显的上调表达,且变化程度明显大于这些基因在WY-2叶片内的表达变化。ERF在BJ叶片内呈明显的上调表达,DREB2却下调表达,与Zhang 等[16]的研究结果相似,而WY-2叶片内ERF表达下调,DREB2呈上调表达。此结果表明ERF和DREB2的转录表达情况可能与BJ具有较强的耐寒性有很大关系。
4 结论
短期的低温胁迫可引起午夜二号草地早熟禾和青海扁茎早熟禾叶片内活性氧的积累和MDA含量的增加,扁茎早熟禾活性氧的积累程度和MDA含量均低于午夜二号。同时,低温胁迫可导致两种早熟禾叶片内的抗氧化酶活性的变化和引发抗氧化酶相关基因的上调表达,并且引起一些冷相关转录因子上调表达。扁茎早熟禾抗氧化酶活性并非都强于午夜二号,但其酶相关基因变化幅度均大于午夜二号,且其一部分冷相关转录因子均较午夜二号大幅度上调表达,这些基因变化可能与BJ具有较强的耐寒性有很大的关系。然而,本研究只是对BJ和WY-2响应短期低温胁迫的抗氧化系统和一些逆境相关转录因子进行了初步的研究,有关BJ和WY-2在高海拔地区的越冬情况是否存在差异以及这两种材料响应低温胁迫的代谢和分子机理有待进一步的研究。
References:
[1] Dacosta M. Research advances in mechanisms of turfgrass tolerance to abiotic stresses: from physiology to molecular biology. Critical Reviews in Plant Sciences, 2014, 33(2/3): 141-189.
[2] Lü Y W, He J Y, Bai X M,etal. Evaluation of physiological responses and resistances of nine wildPoato low temperature. Acta Agrestia Sinica, 2014, 22(2): 326-333.
吕优伟, 贺佳圆, 白小明, 等. 9个野生早熟禾对低温胁迫的生理响应及苗期抗寒性评价. 草地学报, 2014, 22(2): 326-333.
[3] Zhou Q P, Yan H B, Han Z L,etal.Taming breeding of rhizom-type forage varietyPoapratensisL. var.Gaud.cv. Qinghai in apline area. Acta Agrestia Sinica, 2008, 16(4): 328-335.
周青平, 颜红波, 韩志林, 等. 高原根茎型优质草种“青海扁茎早熟禾”的驯化选育. 草地学报, 2008, 16(4): 328-335.
[4] Liu W H. Seasonal dynamics of underground biomass ofPoapratensisvar.ancepscv. Qinghai. Chinese Journal of Grassland, 2009, 31(5): 47-52.
刘文辉. 青海扁茎早熟禾地下生物量季节动态变化. 中国草地学报, 2009, 31(5): 47-52.
[5] Liu W H, Zhou Q P, Yan H B,etal. Study on dynamics of aboveground biomass ofPoapratensisvar.ancepsGaud. cv. Qinghai. Acta Prataculturae Sinica, 2009, 18(2): 18-24.
刘文辉, 周青平, 颜红波, 等. 青海扁茎早熟禾种群地上生物量积累动态. 草业学报, 2009, 18(2): 18-24.
[6] Yang Y L. Study on Characters of Reproduction ofPoapratensisvar.ancepsGaud. cv. Qinghai. Doctoral dissertation. Xining: Qinhai University, 2009.
杨艳莉. 青海扁茎早熟禾(Poapratensisvar.ancepsGaud cv.Qinghai)繁殖特性的研究[D]. 西宁: 青海大学, 2009.
[7] Yang Y L, Zhou Q P, Yan H B,etal. The effects of row distance on clone reproduction ofPoapratensisvar.ancepscv. Qinghai. Pratacultural Science, 2009, 26(5): 66-71.
杨艳莉, 周青平, 颜红波, 等. 行距对青海扁茎早熟禾无性繁殖影响的研究. 草业科学, 2009, 26(5): 66-71.
[8] Wu L, Zhou Q P, Liu W H,etal. Population characteristics ofPoapratensiscv. Qinghai. Pratacultural Science, 2011, 28(6): 1070-1074.
伍磊, 周青平, 刘文辉, 等. 青海扁茎早熟禾种群变化特征. 草业科学, 2011, 28(6): 1070-1074.
[9] Wu L, Zhou Q P, Liu W H,etal. Age structure features of cloning population hibernation ofPoapratensisvar.ancepscv. Qinghai. Pratacultural Science, 2011, 28(11): 1967-1971.
伍磊, 周青平, 刘文辉, 等. 青海扁茎早熟禾冬眠无性系种群年龄结构特征. 草业科学, 2011, 28(11): 1967-1971.
[10] Huang B. Recent advances in drought and heat stress physiology of turfgrass-a review. Acta Horticulturae, 2004, 661: 185-192.
[11] Mittler R, Vanderauwera S, Gollery M,etal. Reactive oxygen gene network of plants. Trends in Plant Science, 2004, 9(9): 490-498.
[12] Janda T, Szalai G, Rios-Gonzalez K,etal. Comparative study of frost tolerance and antioxidant activity in cereals. Plant Science, 2003, 164(2): 301-306.
[13] Hoffman L, Dacosta M, Ebdon J S,etal. Effects of drought preconditioning on freezing tolerance of perennial ryegrass. Environmental & Experimental Botany, 2012, 79(2): 11-20.
[14] Zhang X, Ervin E H, Labranche A J. Metabolic defense responses of seeded bermudagrass during acclimation to freezing stress. Crop Science, 2006, 46(6): 2598-2605.
[15] Kazemi-Shahandashti S, Maali-Amiri R, Zeinali H,etal. Effect of short-term cold stress on oxidative damage and transcript accumulation of defense-related genes in chickpea seedlings. Journal of Plant Physiology, 2014, 171(13): 1106-1116.
[16] Zhang L, Ren J, Li T,etal. De novo Transcriptome sequencing of cold-treated kentucky bluegrass (Poapratensis) and analysis of the genes involved in cold tolerance. Journal of Horticulture, 2016, 8: 1-9.
[17] Hoagland D R, Arnon D I. The water-culture method for growing plants without soil circular. California Agricultural Experiment Station, 1950, 347: 357-359.
[18] Schneider K, Schlegel H G. Production of superoxide radicals by soluble hydrogenase fromAlcaligeneseutrophusH16. Biochemical Journal, 1981, 193(1): 99-107.
[19] Liu Z J, Guo Y K, Bai J G. Exogenous hydrogen peroxide changes antioxidant enzyme activity and protects ultrastructure in leaves of two cucumber ecotypes under osmotic stress. Journal of Plant Growth Regulation, 2010, 29(2): 171-183.
[20] Heath R L, Packer L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation. Archives of Biochemistry & Biophysics, 1968, 125(1): 189-198.
[21] de Azevedo N A, Prisco J T, Eneas-Filho J,etal. Hydrogen peroxide pre-treatment induces salt-stress acclimation in maize plants. Journal of Plant Physiology, 2005, 162(10): 1114-1122.
[22] Chen Y, Hu B, Tan Z,etal. Selection of reference genes for quantitative real-time PCR normalization in creeping bentgrass involved in four abiotic stresses. Plant Cell Reports, 2015, 34(10): 1825-1834.
[23] Elia A C, Galarini R, Taticchi M I,etal. Antioxidant responses and bioaccumulation inIctalurusmelasunder mercury exposure. Ecotoxicology and Environmental Safety, 2003, 55(2): 162-167.
[24] Nahar K, Hasanuzzaman M, Alam M M,etal. Insights into spermine-induced combined high temperature and drought tolerance in mung bean: osmoregulation and roles of antioxidant and glyoxalase system. Protoplasma, 2016, 254(1): 1-16.
[25] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, 2004, 55: 373-399.
[26] Knörzer O C, Burner J, Boger P. Alterations in the antioxidative system of suspension-cultured soybean cells (Glycinemax) induced by oxidative stress. Physiologia Plantarum, 1996, 97(2): 388-396.
[27] Bian S, Jiang Y. Reactive oxygen species, antioxidant enzyme activities and gene expression patterns in leaves and roots of kentucky bluegrass in response to drought stress and recovery. Scientia Horticulturae, 2009, 120(2): 264-270.
[28] Hui Z M, Wang Z Z, Hu Y,etal. Effects of 24-epibrassinolide on the antioxidant system and osmotic adjustment substance in grape seedlings (V.viniferaL.) under chilling stress. Scientia Agricultural Sinica, 2013, 46(5): 1005-1013.
惠竹梅, 王智真, 胡勇, 等. 24-表油菜素内酯对低温胁迫下葡萄幼苗抗氧化系统及渗透调节物质的影响. 中国农业科学, 2013, 46(5): 1005-1013.
[29] Prasad T K, Anderson M D, Martin B A,etal. Evidence for chilling-induced oxidative stress in maize seedlings and a regulatory role for hydrogen peroxide. The Plant Cell, 1994, 6(1): 65-74.
[30] Xing X, Zhou Q, Xing H,etal. Early abscisic acid accumulation regulates ascorbate and glutathione metabolism in soybean leaves under progressive water stress. Journal of Plant Growth Regulation, 2016, 35(3): 1-12.
[31] Skyba M, Petijová L, Košuth J,etal. Oxidative stress and antioxidant response inHypericumperforatumL. plants subjected to low temperature treatment. Journal of Plant Physiology, 2012, 169(10): 955-964.
[32] Noctor G, Foyer C H. Ascorbate and glutathione: Keeping active oxygen under control. Plant Biology, 1998, 49(49): 249-279.
[33] Xu Z, Zhou G, Shimizu H. Plant responses to drought and rewatering. Plant Signaling & Behavior, 2010, 5(6): 649-654.
[34] Xu L. Antioxidant enzyme activities and gene expression patterns in leaves of kentucky bluegrass in response to drought and post-drought recovery. Journal of the American Society for Horticulturalence, 2011, 136(4): 247-255.
[35] Puyang X, An M, Han L,etal. Protective effect of spermidine on salt stress induced oxidative damage in two kentucky bluegrass (PoapratensisL.) cultivars. Ecotoxicology and Environmental Safety, 2015, 117: 96-106.
[36] Fowler S, Thomashow M F.Arabidopsistranscriptome profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway. Plant Cell, 2002, 14(8): 1675-1690.
[37] Yamaguchi-Shinozaki K, Shinozaki K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses. Annual Review of Plant Biology, 2006, 57: 781-803.
[38] Klemens P A, Patzke K, Deitmer J,etal. Overexpression of the vacuolar sugar carrier AtSWEET16 modifies germination, growth, and stress tolerance inArabidopsis. Plant Physiology, 2013, 163(3): 1338-1352.
[39] Martinez J, Perez-Serrano J, Bernadina W E,etal. Stress response to cold inTrichinellaspecies. Cryobiology, 2001, 43(4): 293-302.
EffectoffreezingstressonROSmetabolismandcold-inducedgenesinPoapratensisvar.ancepscv.Qinghai
SHI Yi1, NIU Kui-Ju1, YU Qian-Qian2, LIU Wen-Hui3, MA Hui-Ling1*
1.CollegeofPrataculturalScience,GansuAgriculturalUniversity,KeyLaboratoryofGrasslandEcosystem,MinistryofEducation;Sino-U.S.CenterforGrazinglandEcosystemSustainability,Lanzhou730070,China; 2.CollageofHorticulture,SouthChinaAgriculturalUniversity,Guangzhou510640,China; 3.KeyLaboratoryofSuperiorForageGermplasmintheQinghai-TibetanPlateau,QinghaiAcademyofAnimalScienceandVeterinaryMedicine,Xining810016,China
To explore the mechanism of cold tolerance ofPoapratensisvar.ancepscv. Qinghai (BJ) plants were exposed to cold acclimation (10/5 ℃) for 3 d followed by freezing stress (-10 ℃) for 24 h, withP.pratensisvar. ‘Midnight II’ (WY-2) as control, and ROS accumulation, antioxidant enzyme activity and stress related gene expression were monitored. Rate of the production of O2-·, levels of H2O2and MDA, activity of SOD, CAT, APX, GR and the relative expression of the antioxidant enzyme genes were measured, as well as several cold induced genes. The results demonstrated that freezing stress increased the O2-·production rate, and H2O2and MDA levels in both BJ and WY-2. ROS accumulation and MDA content of BJ were lower than those in WY-2. SOD, APX and GR activity was depressed by freezing stress in BJ, while CAT activity initially increased and then decreased. Only APX in BJ showed higher activity than that in WY-2. At the same time, the expression levels ofCu/ZnSOD,CAT,APXandGRrelated genes were increased in the two varieties. The relative expression of the enzyme related genes in BJ was higher than WY-2. The cold induced gene DREB2 was down-regulated in BJ, while theERF,DREB1,CSP, andHSPgenes were up-regulated. Among these genes,ERF,CSPandHSPshowed higher expression levels in BJ than in WY-2. In conclusion, the accumulation of ROS in BJ was lower than that in WY-2 under cold and freezing stress. Meanwhile antioxidant enzyme related genes and cold related transcription factors showed higher relative expression levels in BJ than in WY-2 under cold and freezing stress. Those differences may contribute to the higher cold tolerance of BJ.
Poapratensisvar.ancepscv. Qinghai; kentucky bluegrass; ROS; antioxidant enzyme; gene expression
史毅, 牛奎举, 余倩倩, 刘文辉, 马晖玲. 低温对青海扁茎早熟禾活性氧代谢的影响和相关基因表达分析. 草业学报, 2017, 26(12): 98-107.
SHI Yi, NIU Kui-Ju, YU Qian-Qian, LIU Wen-Hui, MA Hui-Ling. Effect of freezing stress on ROS metabolism and cold-induced genes inPoapratensisvar.ancepscv. Qinghai. Acta Prataculturae Sinica, 2017, 26(12): 98-107.
2017-02-17;改回日期:2017-05-04
国家自然科学基金(31160482)资助。
史毅(1987-),女,甘肃兰州人,在读博士。E-mail:shiyi214@126.com*通信作者Corresponding author. E-mail:mahl@gsau.edu.cn

