不同藜麦品种对盐胁迫的生理响应及耐盐性评价
杨发荣,刘文瑜,黄杰,魏玉明,金茜
(甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070)
不同藜麦品种对盐胁迫的生理响应及耐盐性评价
杨发荣,刘文瑜*,黄杰,魏玉明,金茜
(甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070)
为研究不同藜麦品种对盐胁迫的生理响应及耐盐性,本试验以3个藜麦品种——陇藜1号、陇藜3号及陇藜4号为材料,在水培和盆栽条件下,分别用100、200、300、400、500 mmol/L NaCl浓度模拟盐胁迫处理3个藜麦品种的种子和幼苗,通过测定种子发芽指标,幼苗生物量及生理生化特性,分析藜麦耐盐机制,对不同藜麦品种耐盐性进行综合评价。结果表明,随着NaCl浓度的升高,不同藜麦种子发芽率先升高后减低,种子发芽势和发芽指数均显著降低;幼苗地上部分生长和生物量积累受到抑制,而地下部分生长及生物量积累先增加后下降;幼苗叶片叶绿素、可溶性蛋白含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和过氧化物抗坏血酸酶(APX)活性先升高后降低,均在300 mmol/L NaCl浓度下达到最大值;幼苗叶片可溶性糖、脯氨酸、丙二醛(MDA)含量显著升高。说明不同藜麦品种幼苗在盐胁迫初期可通过采取提高体内可溶性糖和脯氨酸含量,增强SOD、POD、CAT和APX活性,降低MDA含量等自我保护机制以适应盐胁迫,从而促进适宜盐浓度下幼苗生长。隶属度综合评价结果表明,不同藜麦品种的耐盐阈值为300 mmol/L;陇藜1号耐盐性最强,陇藜3号次之,陇藜4号最弱。
藜麦;幼苗;盐胁迫;生理机制;隶属函数
随着人类耕作活动的增加,土壤盐渍化问题日益加重。据报道,世界范围内,近8×108hm2土地正在面临盐渍化威胁[1],我国有2.001×107hm2盐荒地和6.67×106hm2盐渍化耕地,土壤盐害已成为制约农业发展的主要环境因子,严重影响作物产量和品质。土壤中的致害盐类以中性盐为主,盐分中的Na+和Cl-极易造成特殊离子效应的单盐毒害,同时对其他离子的吸收产生拮抗作用,使植物发生营养亏缺,并破坏渗透调节[2]。盐胁迫主要对植株的光合系统和抗氧化酶系统造成损伤,由于盐胁迫造成植物体内活性氧大量积累,导致植株细胞膜蛋白受损,膜脂过氧化作用增强,光合作用减弱,植株生长受到抑制[3]。因此,在研究植物耐盐机制的基础上,选育并种植耐盐植物,开发盐荒地资源,是遏制土壤退化、改善生态环境、促进盐土农业发展的最佳途径。
藜麦(Chenopodiumquinoa)是苋科藜亚科藜属一年生双子叶草本植物[4]。藜麦种植起源于南美洲安第斯山脉,主产于秘鲁、玻利维亚和厄瓜多尔,距今已有7000多年历史,是古代印第安人的传统食物,被印加民族称为“粮食之母”[5]。藜麦籽粒营养丰富,富含蛋白质、氨基酸、维生素、矿物质,且低热量、低升糖、低脂、零胆固醇、不含麸质,被现代营养学家称为“丢失在远古的营养黄金”[6]。藜麦具有耐寒、耐旱、耐盐碱、耐瘠薄等生物学特性[7]。目前,国内外关于藜麦耐盐机制研究甚少,在耐盐品种选育方面尚处于空白,且选育耐盐性品种,是改良土壤盐渍化的主要手段。为此,本研究用不同盐浓度处理3个藜麦品种,通过测定种子发芽率,幼苗根长、株高、生物量、叶绿素、可溶性糖、可溶性蛋白、脯氨酸、MDA含量及抗氧化酶活性等生理生化指标,运用隶属函数法分析不同品种耐盐性强弱,明确藜麦耐盐阈值,探究藜麦耐盐生理机制,以期为以后藜麦耐盐品种选育及西北地区盐渍土改良提供理论依据和生产指导。
1 材料与方法
1.1 供试材料
本试验供试材料为甘肃省农业科学院自育藜麦品种,分别为陇藜1号(L-1)、陇藜3号(L-3)和陇藜4号(L-4),千粒重分别为3.49,2.72和2.97 g。
1.2 试验设计
1.2.1藜麦种子萌发实验设计 本试验于2016年4-6月在甘肃省农业科学院畜草与绿色农业研究所实验室进行。挑选饱满、大小一致且无病虫害的L-1、L-3及L-4号藜麦种子,用0.2% HgCl2浸泡3~5 min,用蒸馏水冲洗5~6次后,用0、100、200、300、400、500 mmol/L NaCl溶液处理,将处理后的种子置于垫有双层滤纸的培养皿(φ=9 cm)中,每皿50粒种子,每个盐浓度重复3次。以蒸馏水为对照(CK),每皿中分别加入8 mL上述各溶液后,将所有培养皿放置于(25±1) ℃,12 h光照/12 h黑暗,湿度80%的恒温光照培养箱中进行培养,共培养7 d,每天统计种子发芽数。
1.2.2藜麦幼苗生长实验设计 用蒸馏水浸泡种子30 min后播种于装有2 kg沙壤土的花盆(口径26 cm,底部直径12 cm,高8 cm)中,每盆播种30粒,播种后覆蛭石,放置于温室中,室温20~25 ℃,前后通风,自然光照,正常浇水。待幼苗长至6~8叶期时进行定苗,每盆留苗10株,并进行盐胁迫处理,试验共设5个盐浓度梯度处理,分别为100、200、300、400及500 mmol/L NaCl,以蒸馏水为对照(CK),每个处理重复5次。每个花盆中浇入以上各浓度盐溶液3 L,于处理后的第15 天分别取全株及叶片进行形态指标及生理生化指标测定。
1.3 测定指标与方法
1.3.1萌发指标 萌发处理后种子出现胚轴作为萌发标准[8]。处理后每24 h统计发芽种子数,直至发芽试验结束,计算种子发芽率(germination percentage,G)、发芽势(germination energy,GE)和发芽指数(germination index,GI)。计算公式如下:
发芽率=(发芽种子数/供试种子数)×100%[2]发芽势=(3 d发芽种子数/供试种子数)×100%[2]发芽指数=∑(Gt/Dt)[9]
式中:Gt为时间t天的发芽种子数;Dt为相应天数。
1.3.2生长指标 盐胁迫处理15 d后,将植株连根取出,洗净根部泥土,后用滤纸吸干根部及叶面水分,将其分成地上和地下两部分,分别测定其株高、根长、地上部分及地下部分鲜重。然后将植株鲜样放入105 ℃烘箱中杀青15 min后,在70 ℃下烘至恒重,取出分别测定其地上部分和地下部分干重。每个指标重复测定5次。
1.3.3生理生化指标 叶绿素含量的测定采用乙醇丙酮法[10];可溶性糖含量测定采用蒽酮乙酸乙酯法[10];可溶性蛋白含量测定采用考马斯亮蓝比色法[11];脯氨酸含量测定采用酸性茚三酮法[11];丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法[11];超氧化物歧化酶(SOD)活性测定参照Huang等[12]的方法并稍作改动;过氧化物酶(POD)活性测定参照Shi等[13]方法;过氧化氢酶(CAT)活性测定参照Abei[14]的方法;抗坏血酸过氧化物酶(APX)活性测定参照Nakano等[15]的方法。每个指标重复测定3次。
1.4 数据处理
采用Microsoft Excel 2010和SPSS 17.0 进行数据整理和分析,结果以“平均值±标准误”表示,用Sigma Plot 12.5 作图。
2 结果与分析
2.1 NaCl胁迫对3种藜麦种子萌发的影响
不同NaCl浓度对不同品种藜麦种子萌发影响不同(表1)。随着NaCl浓度的升高,3种藜麦种子的发芽率呈先升高后降低,发芽势和发芽指数呈逐渐降低的变化趋势,各品种不同浓度处理下差异显著(P<0.05)。与CK相比,当NaCl浓度为100 mmol/L时,各藜麦品种种子发芽率均达到最大值,分别升高了1.89%、10.80%和4.00%,当NaCl浓度达到400 mmol/L时,各品种种子发芽率显著降低,当NaCl浓度继续升高到500 mmol/L时,各藜麦品种种子各项发芽指标最低。说明低盐浓度促进藜麦种子萌发,高盐浓度则起到抑制作用。

表1 不同浓度NaCl对藜麦种子萌发的影响Table 1 Effects of different concentrations of NaCl on seed germination of C. quinoa
注:同列不同小写字母表示差异显著水平达5%,下同。
Note:Different lowercase letters in the same column indicate significant differences at 5% level, the same below.
2.2 NaCl胁迫对3种藜麦幼苗生长的影响
由表2可知,随着盐浓度的升高,不同品种藜麦幼苗根长呈先增大后减小的变化趋势。当NaCl浓度为200 mmol/L时,不同品种藜麦的根长均达到最大值,分别比对照CK增加59.6%、10.4%和17.6%,但品种间幼苗根长变化差异不显著(P>0.05),而后随着NaCl浓度的升高逐渐下降。当NaCl浓度为500 mmol/L时,3种藜麦的根长分别比CK降低了1.9%、38.8%和51.5%。另外,由表2可知,随着NaCl浓度的升高,不同品种藜麦株高呈逐渐降低的趋势,当NaCl浓度最大时,3种藜麦株高分别比CK降低了48.8%、43.7%和62.6%。
由表3可知,随着盐浓度的升高,不同品种藜麦幼苗地上部分鲜重和干重均呈逐渐下降的变化趋势,且各处理间变化差异显著(P<0.05)。当NaCl浓度为500 mmol/L时,3种藜麦地上部分鲜重和干重比CK分别降低了62.2%、87.7%、70.4%和42.7%、84.4%、71.1%。而幼苗地下部分鲜重和干重均随着盐浓度的上升呈先升高后降低的变化趋势,不同品种不同处理间差异显著(P<0.05)。当NaCl浓度为200 mmol/L时,3个品种藜麦幼苗地下部分鲜重和干重分别比CK增加了41.1%、67.7%、88.1%和41.5%、125.7%、197.5%。
综上所述,盐浓度的升高抑制了不同品种藜麦幼苗地上部分生长及生物量的累积,但促进了不同品种藜麦幼苗地下部分生长及生物量的积累。各盐浓度处理下,不同藜麦品种间根长、株高、地上部分和地下部分生物量变化差异显著(P<0.05)。各品种对盐浓度反应的敏感性由强到弱依次为L-4>L-3>L-1。说明L-1耐盐性强于其他两个品种。

表2 NaCl浓度对3种藜麦幼苗株高和根长的影响Table 2 Effects of different concentrations of NaCl on plant height and root length of C. quinoa seedlings cm
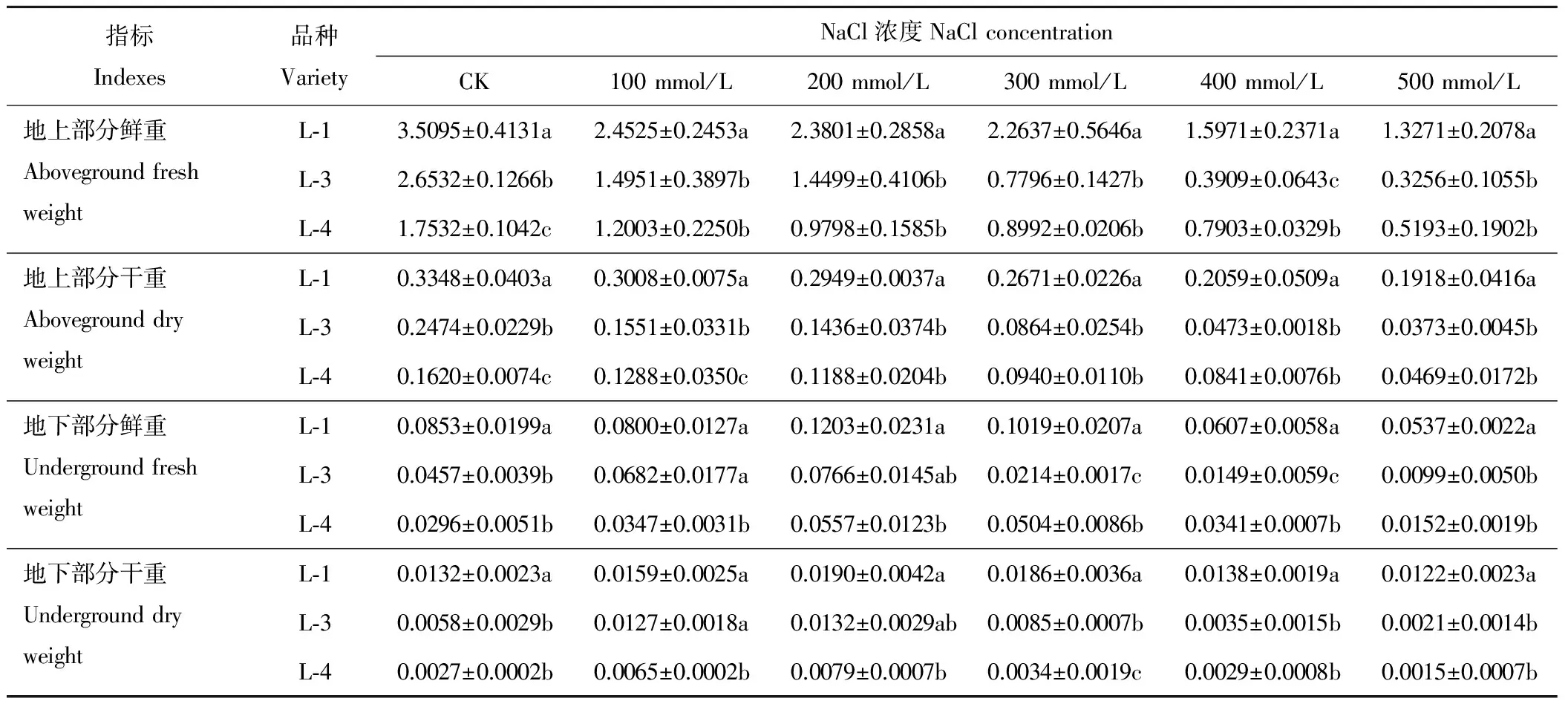
表3 NaCl浓度对3种藜麦幼苗生物量的影响Table 3 Effects of different concentrations of NaCl on biomasses of C. quinoa seedlings g/株Plant
2.3 NaCl胁迫对3种藜麦幼苗叶片叶绿素的影响
由图1可知,随着NaCl浓度的升高,不同品种藜麦幼苗叶片叶绿素含量呈先上升后下降的趋势,其中, CK、100、200和500 mmol/L处理下各品种间叶绿素含量变化差异显著(P<0.05)。当NaCl浓度为200 mmol/L时,各品种叶片叶绿素含量达到最大值,分别比CK处理下增加了66.8%、136.0%和116.7%。其后随着NaCl浓度的升高, 幼苗叶片叶绿素含量逐渐下降, 当NaCl浓度为500 mmol/L时,3个品种幼苗叶片叶绿素含量最低,其中藜麦品种L-1和L-4叶片叶绿素含量分别比CK处理降低了8.8%和5.6%。说明低盐浓度促进叶片叶绿素的积累,高盐浓度则起到抑制作用。

图1 NaCl胁迫对3种藜麦幼苗叶绿素含量的影响Fig.1 Effects of NaCl stress on chlorophyll contents of C. quinoa seedlings 不同小写字母表示差异显著水平达5%,下同。Different lowercase letters indicate significant differences at 5% level, the same below.

图2 不同浓度NaCl处理对3种藜麦幼苗渗透调节物质含量的影响Fig.2 Effects of different concentrations of NaCl on soluble sugar, soluble protein and proline contents of C. quinoa seedlings
2.4 NaCl胁迫对3种藜麦幼苗渗透调节物质含量的影响
如图2所示,随着NaCl浓度的升高,不同藜麦品种幼苗叶片可溶性糖和脯氨酸含量逐渐升高,可溶性蛋白含量先升高后下降,不同处理下各品种间上述各指标含量变化差异显著(P<0.05)。当NaCl浓度达到500 mmol/L时,3个藜麦品种幼苗叶片可溶性糖含量分别比CK处理升高了127.1%、119.6%和160.5%,不同盐浓度处理下,藜麦品种L-1幼苗叶片可溶性糖含量显著高于L-3和L-4(P<0.05),L-3幼苗叶片可溶性糖含量虽高于L-4,但差异不显著(图2A)。
不同NaCl浓度处理下,不同藜麦品种幼苗叶片可溶性蛋白含量呈先升高后降低的变化趋势。当NaCl浓度为300 mmol/L时,3个藜麦品种幼苗叶片可溶性蛋白含量分别比CK处理升高了292.9%、292.2%和48.1%,当NaCl浓度为500 mmol/L时,不同品种幼苗叶片可溶性蛋白含量虽有下降,但仍高于CK处理,且各品种间幼苗叶片可溶性蛋白含量差异显著(P<0.05),其中,藜麦品种L-1幼苗叶片含量显著高于L-3和L-4(图2B)。
不同盐浓度处理下,3个藜麦品种幼苗叶片脯氨酸含量均随着盐浓度的升高呈逐渐升高的变化趋势。当NaCl浓度为500 mmol/L时,藜麦品种L-1、L-3和L-4幼苗叶片脯氨酸含量比CK处理下升高了2.9、2.0和1.3倍。各品种间幼苗叶片脯氨酸含量变化差异显著(P<0.05),其中, L-1幼苗叶片脯氨酸含量显著高于L-3和L-4(图2C)。
2.5 NaCl胁迫对3种藜麦幼苗MDA含量的影响
如图3所示,随着NaCl浓度的升高,不同品种藜麦幼苗叶片中MDA含量呈逐渐升高的趋势。当NaCl浓度为500 mmol/L时,3个藜麦品种幼苗叶片MDA含量比CK处理下增加了55.3%、26.3%和21.9%。L-1幼苗叶片MDA含量显著低于其他两个品种(P<0.05),L-3幼苗叶片MDA含量虽低于L-4,但品种间差异不显著。
2.6 NaCl胁迫对3种藜麦幼苗抗氧化酶活性的影响

图3 不同浓度NaCl处理对3种藜麦幼苗MDA含量的影响Fig.3 Effects of different concentrations of NaCl on MDA contents of C. quinoa seedlings
如图4所示,与CK处理相比,随着NaCl浓度的升高,3种藜麦幼苗叶片中SOD、POD、CAT和APX活性呈先升高后降低的趋势。
NaCl浓度为200 mmol/L时,3个藜麦品种幼苗叶片SOD活性显著升高,并达到峰值,分别比CK升高了71.8%、45.5%和201.9%。不同盐浓度处理下各藜麦品种幼苗叶片SOD活性变化差异显著(P<0.05)。不同处理下各品种幼苗叶片SOD活性由强到弱依次为L-1、L-3和L-4。
当盐浓度为300 mmol/L时, L-1、L-3和L-4幼苗叶片中POD活性达到最大值,分别是CK处理的4.7、4.4和3.3倍。不同NaCl浓度处理下,藜麦品种L-1幼苗叶片POD活性显著高于品种L-3和L-4(P<0.05)。
当NaCl浓度达到200 mmol/L时,3种藜麦幼苗叶片中CAT活性达到最大值,分别比CK升高了98.8%、180.8%和184.3%。不同藜麦品种经不同NaCl浓度处理后,其幼苗叶片中CAT活性变化差异显著,其中藜麦品种L-1显著高于其他品种(P<0.05)。
当盐浓度从0升高到200 mmol/L时,各藜麦品种幼苗叶片中APX活性显著升高,分别是CK处理的2.0、2.5和2.0倍。不同品种的藜麦经不同盐浓度处理后,其幼苗叶片中APX活性变化差异显著(P<0.05),其中藜麦品种L-1中APX活性最高,L-3次之,L-4最低。
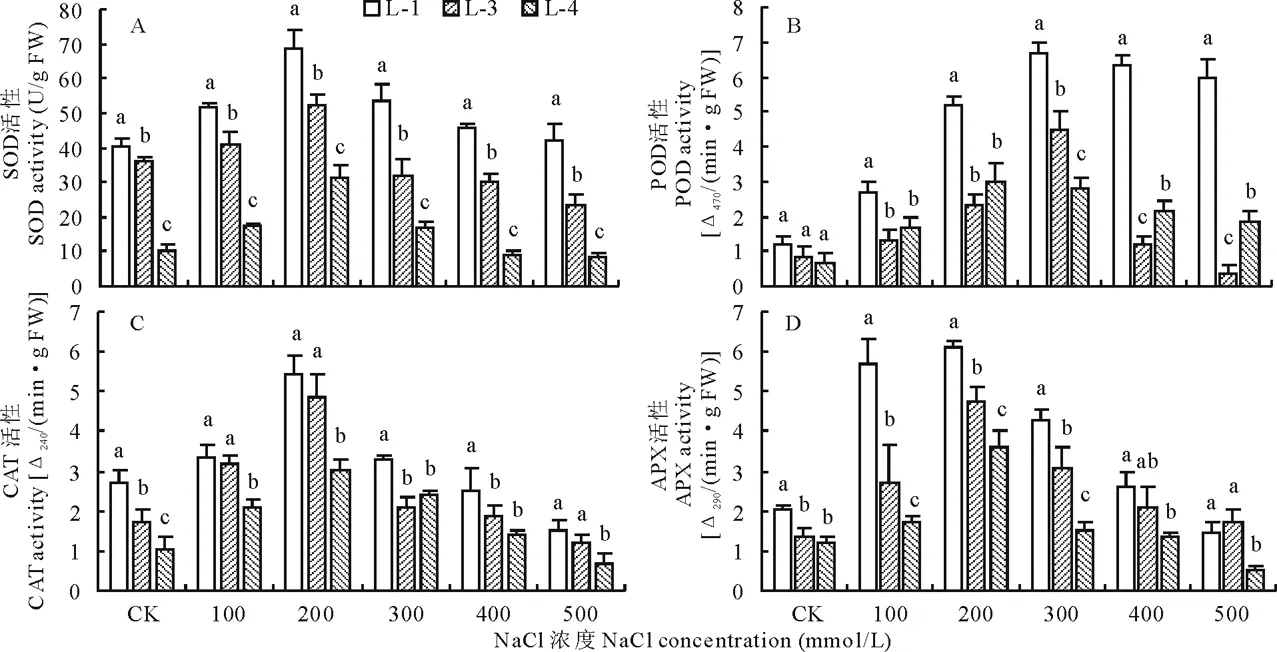
图4 不同浓度NaCl处理对3种藜麦幼苗抗氧化酶活性的影响Fig.4 Effects of different concentrations of NaCl on the activities of SOD, POD, CAT and APX of C. quinoa seedlings
2.7 耐盐性综合评价
2.7.1耐盐性指标间的相关性分析 由表4相关系数矩阵可知,各品种不同盐浓度处理下,幼苗生长指标(根长、株高、地上部分鲜重、地下部分鲜重、地上部分干重、地下部分干重)与生理生化指标(可溶性糖、脯氨酸、可溶性蛋白、叶绿素、抗氧化酶活性)间存在显著(P<0.05)或极显著(P<0.01)相关(表4)。说明这些指标可用于评判藜麦耐盐性。

2.7.2隶属函数分析及综合评价 采用模糊综合评判法[16]计算各藜麦品种的隶属函数值X(u)=(X-Xmin)/(Xmax-Xmin)。式中:X为各藜麦某一指标的测定值;Xmin为该指标测定值的最小值;Xmax为该指标测定值的最大值。将各藜麦品种每个指标的隶属函数值相加后求平均值,即为隶属度,其大小可表明各藜麦品种耐盐性。隶属度越大,受害越轻,耐盐性越强。
由表5可知,各藜麦品种隶属平均值依次为0.504,0.500和0.496,说明整体水平下藜麦品种L-1受害最轻,耐盐性最强,而L-4受害最重,耐盐性最差。
3 讨论
3.1 盐胁迫与藜麦种子萌发和幼苗生长
种子萌发与早期幼苗生长阶段是植物种群能否在盐渍环境下建植成功的关键时期[17-19]。其中种子萌发时期是最敏感的时期,决定着作物的生长及产量[20]。不同盐胁迫浓度下,作物种子发芽率、发芽势、发芽指数和活力指数均可以作为判断作物耐盐性的指标[21]。张国伟等[22]研究表明当NaCl浓度大于150 mmol/L时,棉花种子萌发受到抑制。本试验结果发现,与CK相比,当盐处理的浓度为100 mmol/L时,不同品种藜麦种子发芽率缓慢增加,但当盐浓度大于100 mmol/L时,不同品种藜麦种子萌发受到抑制,种子发芽率、发芽势、发芽指数均呈逐渐下降的趋势。
生长抑制是植物在盐渍逆境下的综合表现,一方面,植物通过减缓生长、改变形态特征、重新构建生物量分配格局来维持其在逆境下的存活;另一方面,植物应对盐渍逆境(如排Na+、合成渗透调节物质等)消耗更多的能量,使其用于生长的能量相应减少[23-26]。周琦等[27]研究发现,盐胁迫下鹅耳枥(Carpinusturzaninowii)苗高和地径的生长量明显受到抑制。郑世英等[28]研究表明,盐胁迫下小麦(Triticumaestivum)幼苗根系鲜重和干重均增高。本研究中,盐胁迫抑制了不同品种藜麦幼苗株高的生长及其生物量的积累;对根系生长的影响表现为盐浓度低于200 mmol/L时促进根系生长及其生物量的积累,当盐浓度超过200 mmol/L时,不同品种藜麦幼苗根系生长量及其生物量均降低。
3.2 盐胁迫与藜麦幼苗叶片光合作用
光合作用为植物的生长发育提供所需的物质和能量,是植物生长发育及产量形成的基础[29]。盐胁迫导致植物的光合机构受到伤害,光合电子传递受阻,光合碳同化效率降低,进而严重影响植物的生长发育[30-32]。鲁少尉等[33]研究发现 NaCl胁迫降低了番茄叶片叶绿素含量。本研究结果表明,不同品种藜麦幼苗叶片叶绿素含量随着盐浓度的升高呈先增加后降低的趋势。可能是由于较低浓度的NaCl处理刺激了幼苗叶片气孔开度增加,CO2固定能力增强,叶绿素含量升高,植株对盐胁迫的适应能力增强;后期高盐浓度造成叶片失水,叶绿素酶活性增强,从而导致叶绿素降解加快,植株生长受到抑制。
3.3 盐胁迫与藜麦幼苗叶片物质代谢
植物通过积累渗透调节物质以抵抗盐胁迫的伤害[34]。可溶性糖是一种重要的渗透调节剂,在逆境胁迫条件下,它对细胞膜和原生质体有一定保护作用,还可在细胞内无机离子浓度高时起保护酶类的作用[35]。有研究发现,NaCl胁迫显著提高了植株叶片中可溶性糖含量[36-37]。本试验中不同品种藜麦幼苗叶片中可溶性糖含量随着处理盐浓度的升高而升高。
可溶性蛋白也是一种重要的渗透调节物质。植物体内可溶性蛋白大多数是参与各种代谢的酶类,其含量是了解植物总代谢水平的一个重要指标,植物体可以通过增加其含量,提高渗透调节能力,从而增强对盐胁迫的适应能力[2]。有研究表明高盐胁迫使植株体内可溶性蛋白含量增加,使细胞渗透势降低,从而减缓了植物细胞的失水趋势[38],但也有研究发现一些作物幼苗可溶性蛋白含量随盐胁迫浓度增加而降低[39]。本试验中随着盐浓度的增加,不同品种藜麦幼苗叶片中可溶性蛋白含量呈先增加后降低的趋势,说明低浓度NaCl处理促进藜麦幼苗叶片内可溶性蛋白的积累以适应初期盐胁迫对植株幼苗的伤害,后期高浓度NaCl处理抑制了蛋白质合成,植株细胞受损。
脯氨酸是植物体内有效的渗透调节剂。它是天然氨基酸中溶解度最高的氨基酸,是细胞质中重要的渗压剂和防脱水剂,能降低细胞的渗透势,提高植物组织的持水力[40]。李源等[41]研究表明不同紫花苜蓿(Medicagosativa)材料幼苗叶片脯氨酸含量随着盐浓度的增加而积累。Kumar等[42]研究证明不同小麦品种幼苗叶片脯氨酸含量随NaCl处理浓度的增加而升高。本试验结果表明,随着处理盐浓度的升高,不同藜麦品种幼苗叶片脯氨酸含量显著高于CK。说明藜麦幼苗可通过脯氨酸的积累来适应盐胁迫对其造成的伤害。
3.4 盐胁迫与藜麦幼苗叶片抗氧化酶活性变化
植物正常生长条件下,其体内自由基的产生和清除处于动态平衡,当植物遭受逆境胁迫时,这种平衡被打破,首先受到影响的是生物膜[43],往往发生膜脂过氧化作用,积累大量的过氧化产物。MDA是主要的膜脂过氧化产物,其含量的积累会对生物膜造成伤害,可反映生物膜受损伤的程度,是常用的膜脂过氧化指标[44]。朱红霞等[45]研究发现随着盐浓度的升高和处理时间的延长,龟背竹(Monsteradeliciosa)叶片中MDA含量增高。本试验中随着NaCl浓度的升高,MDA大量积累。
抗氧化酶系统是植物在逆境胁迫下防御自由基氧化损伤最重要的酶促系统[46]。SOD、POD、CAT、APX等是植物内源活性氧清除剂,SOD是植物体内消除O2·-的关键酶[47],POD可清除线粒体或胞浆中产生的H2O2,CAT主要分布在过氧化物酶体中,胁迫条件下可将高浓度的H2O2清除。周丽等[48]研究表明,银柴胡(Stellariadichotoma)叶片SOD、POD、CAT活性均随着NaCl胁迫程度增加呈先升高后下降的趋势。本试验结果发现,随着NaCl胁迫浓度的增加,不同品种藜麦幼苗叶片SOD、POD、CAT和APX活性均呈先升高后降低的变化趋势。说明胁迫初期,抗氧化酶活性增强用以清除植株体内产生的自由基,当盐浓度继续升高,体内自由基大量积累,蛋白质合成受阻,酶活性降低。
References:
[1] Wu X X, He J, Chen J L,etal. Alleviation of exogenous 6-benzyladenine on two genotypes of eggplant (SolanummelongenaMill.) growth under salt stress. Protoplasma, 2014, 251: 169-176.
[2] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189.
刘凤岐, 刘杰淋, 朱瑞芬, 等. 4种燕麦对NaCl胁迫的生理响应及耐盐性评价. 草业学报, 2015, 24(1): 183-189.
[3] Sheokand S, Kumari A, Sawheny V. Effect of nitric oxide and putrescine on antioxidative responses under NaCl stress in chickpea plants. Physiology and Molecular Biology of Plants, 2008, 14(4): 355-362.
[4] Wang C J, Zhao X W, Lu G Q,etal. A review of characteristics and utilization ofChenopodiumquinoa. Journal of Zhejiang Agricultural and Forest University, 2014, 31(2): 296-301.
王晨静, 赵习武, 陆国权, 等. 藜麦特性及开发利用研究进展. 浙江农林大学学报, 2014, 31(2): 296-301.
[5] Yang F R. Breeding and application prospects of new varietyChenopodiumquinoacv. Longli 1. Gansu Agricultural Science and Technology, 2015, 12: 1-5.
杨发荣. 藜麦新品种陇藜1号的选育及应用前景. 甘肃农业科技, 2015, 12: 1-5.
[6] White P, Alvistur E, Diaz C,etal. Nutrient content and protein quality of quinoa and cafiihua, edible seed products of the Andes Mountais. Agricultural and Food Chemistry, 1955, 3(6): 351-355.
[7] Xiao Z C, Zhang G L. Development and utilization ofChenopodiumquinoaWilld. Chinese Wild Plant Resources, 2014, 33(2): 62-66.
肖正春, 张广伦. 藜麦及其资源开发利用. 中国野生植物资源, 2014, 33(2): 62-66.
[8] Maria A, Felipe A, Juan A. Germination and ROS detoxification in bell pepper (CapsicumannuumL.) under NaCl stress and treatment with microalgae extracts. Protoplasma, 2013, 250: 33-42.
[9] Liu W Y, Yang H W, Wei X H,etal. Effects of exogenous nitric oxide on seed germination, physiological characteristics and active oxygen metabolism ofMedicagotruncatulaunder NaCl stress. Acta Prataculturae Sinica, 2015, 24(2): 85-95.
刘文瑜, 杨宏伟, 魏小红, 等. 外源NO调控盐胁迫下蒺藜苜蓿种子萌发生理特性及抗氧化酶的研究. 草业学报, 2015, 24(2): 85-95.
[10] Zou Q. Plant Physiology Experimental Guide[M]. Beijing: China Agriculture Press, 2000: 62-174.
邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000: 62-174.
[11] Li H S. Plant Physiological and Biochemical Principle and Technology[M]. Beijing: Higher Education Press, 2000: 169-184.
李合生. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2000: 169-184.
[12] Huang X S, Liu J H, Chen X J. Overexpression ofPtrABFgene, a bZIP transcription factor isolated fromPoncirustrifoliata, enhances dehydration and drought tolerance in tobacco via scavenging ROS and modulating expression of stress-responsive genes. BMC Plant Biology, 2010, 10: 230.
[13] Shi S, Fu X Z, Peng T,etal. Spermine pretreatment confers dehydration tolerance of citrusinvitroplants via modulation of antioxidative capacity and stomatal response. Tree Physiology, 2010, 30: 914-922.
[14] Aebi H. Catalaseinvitro. Methods Enzymology, 1984, 105: 121-126.
[15] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascor bate-specific peroxidase in spinach chloroplasts. Plant Cell Physiology, 1981, 22(5): 867-880.
[16] Liu H H, Yu Y, Ding G D,etal. Evaluation on salt-tolerance of four coastal tree species. Journal of Northeast Forestry University, 2011, 39(7): 8-11, 34.
刘昊华, 虞毅, 丁国栋, 等. 4种滨海造林树种耐盐性评价. 东北林业大学学报, 2011, 39(7): 8-11, 34.
[17] Ma H Y, Liang Z W, Kong X J,etal. Effects of salinity, temperature and their interaction on the germination percentage and seedling growth ofLeymuschinensis(Trin.) Tzvel. (Poaceae). Acta Ecologica Sinica, 2008, 28(10): 4710-4717.
马红媛, 梁正伟, 孔祥军, 等. 盐分、温度及其互作对羊草种子发芽率和幼苗生长的影响. 生态学报, 2008, 28(10): 4710-4717.
[18] Qu X X, Huang Z Y. The adaptive strategies of halophyte seed germination. Acta Ecologica Sinica, 2005, 25(9): 2389-2398.
渠晓霞, 黄振英. 盐生植物种子萌发对环境的适应对策. 生态学报, 2005, 25(9): 2389-2398.
[19] Han R Y, Chen Y Y, Zhou Z H,etal. Effects of NaCl stress on seed germinations and seedling growth of sweet clover. Agricultural Research in the Arid Areas, 2014, 32(5): 78-83.
韩润燕, 陈彦云, 周志红, 等. NaCl 胁迫对草木樨种子萌发及幼苗生长的影响. 干旱地区农业研究, 2014, 32(5): 78-83.
[20] Lu Y M, Su C Q, Li H F. Effects of different salt stress on seed germination and seedling growth ofTrifoliumrepens. Acta Prataculturae Sinica, 2013, 22(4): 123-129.
卢艳敏, 苏长青, 李会芬. 不同盐胁迫对白三叶种子萌发及幼苗生长的影响. 草业学报, 2013, 22(4): 123-129.
[21] Peng Y L, Li W L, Wang Z K,etal. Effects of salt stress on seed germination and seedling growth of salt-tolerant line and salt-sensitive line of maize. Acta Prataculturae Sinica, 2012, 21(4): 62-71.
彭云玲, 李伟丽, 王泽坤, 等. NaCl胁迫对玉米耐盐系与盐敏感系萌发和幼苗生长的影响. 草业学报, 2012, 21(4): 62-71.
[22] Zhang G W, Lu H L, Zhang L,etal. Salt tolerance evaluation of cotton (Gossypiumhirsutum) at its germinating and seedling stages and selection of related indices. Chinese Journal of Applied Ecology, 2011, 22(8): 2045-2053.
张国伟, 路海玲, 张雷, 等. 棉花萌发期和苗期耐盐性评价及耐盐指标筛选. 应用生态学报, 2011, 22(8): 2045-2053.
[23] Alaoui-Sosse B, Sehmer L, Barnola P,etal. Effect of NaCl salinity on growth and mineral partitioning inQuercusroburL., arhythmically growing species. Trees, 1988, 12(7): 424-430.
[24] Grotkopp E, Rejmanek M, Rost T L. Toward a causal explanation of plant invasiveness: seedling growth and life-history strategies of 29 pine (Pinus) species. American Naturalist, 2002, 159(4): 396-419.
[25] Grundmann O, Nakajima J, Seo S,etal. Anti-anxiety effects ofApocynumvenntumL. in the elevated plus maze test. Journal of Ethnopharmacology, 2007, 110(3): 406-411.
[26] Liu Z X, Zhang H X, Yang S,etal. Effects of NaCl stress on growth and photosynthetic characteristics ofElaeagnusangustifoliaseedlings. Scientia Silvae Sinicae, 2014, 50(1): 32-40.
刘正祥, 张华新, 杨升, 等. NaCl胁迫对沙枣幼苗生长和光合特性的影响. 林业科学, 2014, 50(1): 32-40.
[27] Zhou Q, Zhu Z L, Shi M. Effects of salt stress on growth, physiological and biochemical characteristics ofCarpinusturcazninowiiseedlings. Journal of Nanjing Forestry University: Natural Sciences Edition, 2015, 39(6): 56-60.
周琦, 祝遵凌, 施曼. 盐胁迫对鹅耳枥生长及生理生化特性的影响. 南京林业大学学报: 自然科学版, 2015, 39(6): 56-60.
[28] Zheng S Y, Zheng F, Xu J,etal. Effects of silicon on the biomass and photosynthetic characteristics of wheat seedlings under NaCl stress. Journal of Triticeae Crops, 2015, 35(1): 111-115.
郑世英, 郑芳, 徐建, 等. 外源硅对NaCl胁迫下小麦幼苗生长及光合特性的影响. 麦类作物学报, 2015, 35(1): 111-115.
[29] Liu Z P, Xu S J, Zhang F Y,etal. Effect of NaCl stress on seedling biomass and photosynthetic characteristics of barley. Barley and Cereal Sciences, 2014, 4: 1-7.
刘志萍, 徐寿军, 张凤英, 等. NaCl胁迫对大麦幼苗生长及光合特性的影响. 大麦与谷类科学, 2014, 4: 1-7.
[30] Zhu X G, Zhang Q D. Advances in the research on the effects of NaCl on photosynthesis. Chinese Bulletin of Botany, 1999, 16(4): 332-338.
朱新广, 张其德. NaCl 对光合作用影响的研究进展. 植物学通报, 1999, 16(4): 332-338.
[31] Liu Y L, Wang L J, Yu S W,etal. Plant Physiology and Molecular Biology[M]. Beijing: Science Press, 1998.
刘友良, 汪良驹, 余叔文, 等. 植物生理与分子生物学[M]. 北京: 科学出版社, 1998.
[32] Zhao Y Y, Yan F, Hu L P,etal. Effect of 5-aminolevulinic acid on photosynthetic characteristics of tomato seedlings under NaCl stress. Chinese Journal of Applied Ecology, 2014, 25(10): 2919-2926.
赵艳艳, 燕飞, 胡立盼, 等. 5-氨基乙酰丙酸对NaCl胁迫下番茄幼苗光合特性的影响. 应用生态学报, 2014, 25(10): 2919-2926.
[33] Lu S W, Qi F, Li T L. Effect of NaCl and PEG iso-osmotic stresses on photosynthetic characteristics and sucrose metabolizing in tomato leaf. Acta Agriculturae Boreal-Sinica, 2012, 27(3): 136-141.
鲁少尉, 齐飞, 李天来. NaCl及等渗PEG对番茄叶片光合特性及蔗糖代谢的影响. 华北农学报, 2012, 27(3): 136-141.
[34] Xu C, Ling F L, Xu K Z,etal. Effect of salt stress on photosynthetic characteristics and biochemical traits of different rice varieties. Chinese Journal of Rice Science, 2013, 27(3): 280-286.
徐晨, 凌风楼, 徐克章, 等. 盐胁迫对不同水稻品种光合特性和生理生化特性的影响. 中国水稻科学, 2013, 27(3): 280-286.
[35] Gao Q, Li Y, Su S P,etal. Effects of salt stress on physiological characteristics ofReaumuriasoongoricaseeds during imbibition. Jounal of Desert Research, 2014, 34(1): 83-87.
高茜, 李毅, 苏世平, 等. 盐胁迫对红砂(Reaumuriasoongorica) 种子吸胀过程中生理特性的影响. 中国沙漠, 2014, 34(1): 83-87.
[36] Yan B, Sun J, Shu S,etal. Effects of exogenous calcium on photosynthetic characteristics and carbohydrate metabolism in leaves of cucumber (CucumissativusL.) seedlings under NaCl stress. Journal of Nanjing Agricultural University, 2014, 37(1): 31-36.
严蓓, 孙锦, 束胜, 等. 外源钙对NaCl胁迫下黄瓜幼苗叶片光合特性及碳水化合物代谢的影响. 南京农业大学学报, 2014, 37(1): 31-36.
[37] Xue Y, Wang Y C, Wang T Z. Physiological and biochemical mechanisms of an endemic halophyteReaumuriatrigynaMaxim. under salt stress. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(1): 136-142.
薛炎, 王迎春, 王同智. 濒危植物长叶红砂适应盐胁迫的生理生化机制研究. 西北植物学报, 2012, 32(1): 136-142.
[38] Yang Y L, Zhang J, Yang F,etal. Effects of salt stress on osmolyte and proline metabolism in two wheat seedlings. Journal of Northwest Normal University: Natural Science, 2013, 49(1): 72-77, 91.
杨颖丽, 张菁, 杨帆, 等. 盐胁迫对两种小麦渗透性调节物质及脯氨酸代谢的影响. 西北师范大学学报: 自然科学版, 2013, 49(1): 72-77, 91.
[39] Yang Y Y, Wang Q X. Effects of salt stress on osmotic adjustment substances in the seedling of different maize hybrids. Crops, 2012, 146(1): 106-109.
杨艳艳, 王庆祥. 盐胁迫对不同玉米品种幼苗渗透调节物质的影响. 作物杂志, 2012, 146(1): 106-109.
[40] Ma L. Study on Effects and Assessments of NaCl Stress on Seed Germination and Physiological and Biochemical of Seedling of Herbages[D]. Jinan: Shandong Agricultural University, 2010.
马琳. NaCl胁迫对牧草种子萌发与幼苗生理生化的影响及耐盐性评价[D]. 济南: 山东农业大学, 2010.
[41] Li Y, Liu G B, Gao H W,etal. A comprehensive evaluation of salt-tolerance and the physiological response ofMedicagosativaat the seedling stage. Acta Prataculturae Sinica, 2010, 19(4): 79-86.
李源, 刘贵波, 高洪文, 等. 紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应. 草业学报, 2010, 19(4): 79-86.
[42] Kumar V, Khare T. Differential growth and yield responses of salt-tolerant and susceptible rice cultivars to individual (Na+and Cl-) and additive stress effects of NaCl. Acta Physiologiae Plantarum, 2016, 38: 170-178.
[43] Zhang H S, Zhao G Q, Li M F,etal. Physiological responses ofPennisetumlongissimumvar.intermediumseedlings to PEG, low temperature and salt stress treatments. Acta Prataculturae Sinica, 2014, 23(2): 180-188.
张怀山, 赵桂琴, 栗孟飞, 等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答. 草业学报, 2014, 23(2): 180-188.
[44] Zhang X X, Mu D Y, Li H L,etal. Effects of NaCl stress on physiological characteristics ofUlmuspumilaL. clones. Journal of Arid Land Resources and Environment, 2016, 30(8): 188-192.
张晓晓, 慕德宇, 李红丽, 等. NaCl胁迫对不同无性系白榆生理生化特性的影响. 干旱区资源与环境, 2016, 30(8): 188-192.
[45] Zhu H X, Guo H, Zhang J Y. Effect of NaCl stress on physiological and biochemical characteristics ofM.deliciosaLiebm. Journal of Henan Agricultural Sciences, 2016, 45(9): 98-101, 106.
朱红霞, 郭晖, 张家洋. NaCl胁迫对龟背竹生理生化特性的影响. 河南农业科学, 2016, 45(9): 98-101, 106.
[46] Liu H B, Wei Y Q, Zhou W S,etal. Effect of NaCl stress on physiological and biochemical characteristics between sweet sorghum and spring wheat. Jiangsu Agricultural Sciences, 2016, 44(8): 106-111.
刘海波, 魏玉清, 周维松, 等. NaCl胁迫对萌发期甜高粱和春小麦生理生化特性的影响. 江苏农业科学, 2016, 44(8): 106-111.
[47] Chen B Y, Cao L, Wang Y F,etal. Effects of NaCl stress on growth, physiological and biochemical characteristics and quality of celery. Acta Agriculturae Boreal-Sinica, 2014, 29: 218-222.
陈宝悦, 曹玲, 王艳芳, 等. NaCl胁迫对芹菜生长、生理生化特性及品质的影响. 华北农学报, 2014, 29: 218-222.
[48] Zhou L, Lang D Y, Zhang W J,etal. Effect of NaCl stress on growth and physiological-biochemical characteristics ofStellariadichotoma. Chinese Traditional and Herbal Drugs, 2014, 45(19): 2829-2833.
周丽, 郎多勇, 张文晋, 等. NaCl 胁迫对银柴胡生长及生理生化特性的影响. 中草药, 2014, 45(19): 2829-2833.
Physiologicalresponsesofdifferentquinoavarietiestosaltstressandevaluationofsalttolerance
YANG Fa-Rong, LIU Wen-Yu*, HUANG Jie, WEI Yu-Ming, JIN Qian
InstituteofPastureandGreenAgriculture,GansuAcademyofAgriculturalSciences,Lanzhou730070,China
The aims of this study were to evaluate the physiological responses of quinoa plants to salt stress and to compare salt tolerance among different quinoa varieties. Seeds and seedlings of different quinoa varieties were pretreated with 100, 200, 300, 400, and 500 mmol/L NaCl solutions. The seed germination index, seedling biomass, and other physiological and biochemical characteristics were determined to analyze the mechanisms of salt tolerance in quinoa. The salt tolerance of the different quinoa varieties was evaluated by a membership function method. As the NaCl concentration increased, the seed germination percentage increased and then decreased, the germination potential and germination index decreased significantly, and the contents of chlorophyll and soluble proteins and activities of antioxidant enzymes (superoxide dismutase, peroxidase, catalase, and ascorbate peroxidase) increased and then decreased. The peak in the activities of the antioxidant enzymes was at 300 mmol/L NaCl. The contents of soluble sugars, proline, and malondialdehyde increased significantly as the NaCl concentration increased. These results suggested that increased contents of soluble sugars and proline, increased activities of antioxidant enzymes, and decreased malondialdehyde contents in seedlings may contribute to adaptation to salt stress and promote seedling growth in the presence of NaCl. In conclusion, the threshold of salt tolerance in quinoa seedlings was 300 mmol/L NaCl. Longli No.1 was the most salt-tolerant quinoa variety, and Longli No.4 was the least salt-tolerant variety.
Chenopodiumquinoa; seedling; salt stress; physiology mechanisms; membership function
10.11686/cyxb2016412http//cyxb.lzu.edu.cn
杨发荣, 刘文瑜, 黄杰, 魏玉明, 金茜. 不同藜麦品种对盐胁迫的生理响应及耐盐性评价. 草业学报, 2017, 26(12): 77-88.
YANG Fa-Rong, LIU Wen-Yu, HUANG Jie, WEI Yu-Ming, JIN Qian. Physiological responses of different quinoa varieties to salt stress and evaluation of salt tolerance. Acta Prataculturae Sinica, 2017, 26(12): 77-88.
2016-11-02;改回日期:2016-12-29
国家自然基金(31660357),甘肃省科技支撑计划项目(1504NKCA078-1)和嘉峪关市科技项目(14-26)资助。
杨发荣(1964-),男,甘肃宁县人,研究员,学士。E-mail:lzyfr08@163.com*通信作者Corresponding author. E-mail:yu850721.lemon@163.com

