藏药渣驯正丁醇部位对对乙酰氨基酚诱导的小鼠急性肝损伤的保护作用△
叶翠萍 王文倩 曹 赟 赵明明 曾 勇 古 锐
(成都中医药大学,四川 成都 611137)
实验研究
△江西民族传统药现代科技与产业发展协同创新中心开放基金项目(JXXT201402008-1);
△国家自然科学基金面上项目:基于分子古生物学的藏药渣驯形成机制研究(83571699)。
藏药渣驯正丁醇部位对对乙酰氨基酚诱导的小鼠急性肝损伤的保护作用△
叶翠萍 王文倩 曹 赟 赵明明 曾 勇 古 锐*
(成都中医药大学,四川 成都 611137)
目的:研究渣驯正丁醇部位对对乙酰氨基酚(APAP)诱导的小鼠急性肝损伤的保护作用。方法小鼠腹腔注射250mg·kg-1APAP制备急性肝损伤模型,检测小鼠血清中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)的活性;测定肝组织中超氧化物歧化酶(SOD)和丙二醛(MDA)含量;并做肝脏组织病理学检查。结果与正常对照组比较,模型组小鼠ALT、AST、MDA含量明显升高,SOD活性降低(P<0.01),肝细胞出现明显的变性坏死;与模型组比较,渣驯正丁醇部位中、高剂量组能够降低急性肝损伤小鼠ALT、AST和MDA的含量,提高SOD的活性(P<0.05)。结论渣驯正丁醇部位中、高剂量组对APAP诱导的小鼠急性肝损伤具有明显的保护作用。
渣驯;对乙酰氨基酚;急性肝损伤;保护作用
传统藏药渣驯,藏语发音为 Brag-zhun,藏译音“渣”是高山及岩石的名称, “驯” 为岩石中流出的岩汁或溶液,意译即“岩石的精华”,简称“岩精”。公元8世纪的《月王药诊》中记载,“岩精能干枯脓血,主治肝病,清诸热,诱发寒症”[1]。《论说续》中亦记载“渣驯能治疗一切热证,特别是清肝热等”[2]。素有“肝保”和“肝胆清”美称[3]的藏药渣驯,是藏医临床治疗热性疾病的常用药物[4],具有1300多年的应用历史。在藏医临床实践中,用于肝热病治疗的“九味牛黄丸、五味渣驯丸(藏药名:渣驯阿巴日布)”等藏成方制剂中均含有渣驯,渣驯在藏药处方中的出现频率位列第6[5]。另现代医学研究表明渣驯具有抗氧化、清除自由基、抗炎、刺激机体再生等作用,对热灼伤和四氯化碳处理的肝组织损伤再生有很好的治疗效果[4,6]。渣驯具有明确的保肝作用,但发挥该作用的药效物质基础尚不明确。因此,课题组前期进行了渣驯及其提取物保肝作用的筛选研究,结果表明渣驯正丁醇部位对刀豆蛋白A(Con A)所致肝损伤保护作用较优,可能是渣驯治疗肝损伤的有效物质基础。鉴于渣驯临床应用的广泛性,本研究将探讨渣驯正丁醇部位对APAP诱导的药物性肝损伤的保护作用,以期为渣驯单方制剂的开发及临床应用提供药理学依据。
1 材料
1.1 药物与试剂:渣驯药材购自四川省阿坝州马尔康县,经成都中医药大学降拥四郎主任藏医师鉴定为正品;对乙酰氨基酚(sigma国内分装,用生理盐水配制,可适当加热助溶);丙氨酸氨基转移酶(ALT/GPT,批号:20160425)、天冬氨酸氨基转移酶(AST/GOT,批号:20160422)、超氧化物歧化酶(SOD,批号:20160502)和丙二醛(MDA,批号:20160502))试剂盒均购自于南京建成生物工程研究所;冰醋酸、无水乙醇均购自于成都科龙化工试剂厂。
1.2 实验动物:SPF级健康昆明种小鼠,雄性,体重18~22g,由成都达硕实验动物中心提供,实验动物许可证号:SCXK(川)2013-17。适应性喂养3d,自由摄食饮水。
1.3 主要仪器:WH-3型微型旋涡混合仪(上海沪西分析仪器厂有限公司);VARIOSKAN FLASH 2.4.3型全波长多功能读数仪(美国Thermo公司);CX41型正置显微镜(OLYMPUS公司);TKD-TSB型组织脱水机(中国湖北康强医疗器械有限公司);TB-718D型石蜡包埋机(中国湖北泰维科技实业有限公司);RM2235型石蜡切片机(中国上海徕卡显微系统有限公司);DFC295-IMS型图像分析系统(中国武汉华联科生物技术有限公司)。
2 方法
2.1 渣驯正丁醇部位的制备:按照《藏药炮制规范2008年版》制备渣驯膏[7],取适量正品渣驯样品用100℃开水浸泡并过滤3次,收集滤液后用16层纱布滤过。将得到的滤液浓缩至浓稠状态,后将浓稠液在水浴锅中挥至流膏状为渣驯膏。取适量渣驯膏水溶解液用正丁醇在5000mL分液漏斗中进行萃取分离。多次萃取直到萃取层呈无色状,得渣驯正丁醇部位。
2.2 实验动物分组、造模及给药:取健康昆明种雄性小鼠48只,按体重分层,随机分为6组,每组8只:正常对照组,模型组,阳性对照组(联苯双酯150mg·kg-1),渣驯正丁醇部位低、中、高剂量组(按渣驯生药量计,分别为167mg·kg-1、333mg·kg-1、666mg·kg-1)。各组于每日上午9点开始灌胃给药,正常对照组和模型组给予等体积的0.5%CMC-Na,其余各给药组按剂量表给药(见表1),给药体积均为0.02mL/g,连续给药7d,1次/d。末次给药1h后,除正常对照组腹腔注射生理盐水外,其余各组按0.01mL/g腹腔给予250mg·kg-1APAP[8,9]制备小鼠急性肝损伤模型。
2.3 检测指标:造模24h后,所有动物称量体重后均摘眼球取血,制备血清用于ALT、AST的检测。颈椎脱臼处死小鼠,摘取肝脏,冰生理盐水漂洗,滤纸吸干后称重,用于计算小鼠肝脏指数,同时肉眼观察肝脏外观变化;取部分肝左叶制备肝组织匀浆,用WST-1法测定肝中超氧化物歧化酶(SOD)含量;用TBA法测定肝中丙二醛(MDA)含量;另取肝大叶固定于10%的中性甲醛溶液中用于苏木精-伊红染色(HE染色),光镜下观察肝脏组织病理变化。
3 结果
3.1 渣驯正丁醇部位对小鼠肝脏指数的影响:与正常对照组比较,模型组小鼠肝脏眼观可见明显的坏死,肿大,肝脏指数明显增加(P<0.05);与模型组比较,渣驯正丁醇部位各给药组肝脏指数有下降趋势,但无统计学差异。结果见表1。
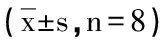
表1 渣驯正丁醇部位对小鼠肝脏指数的影响
注:与正常对照组比较,#P<0.05。
3.2 渣驯正丁醇部位对小鼠血清中ALT、AST的影响:与正常对照组比较,模型组小鼠血清ALT、AST活性显著升高(P<0.01),表明小鼠急性肝损伤模型复制成功。给予不同剂量的渣驯正丁醇部位,ALT和AST水平较模型组均有不同程度的降低,且随着剂量的增加,下降趋势更为明显。其中渣驯正丁醇部位中、高剂量组ALT、AST活性下降明显(P<0.05)。结果见表2。
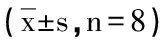
表2 渣驯正丁醇部位对小鼠血清中ALT、AST的影响
注:与正常对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.3 渣驯正丁醇部位对小鼠肝组织中SOD、MDA含量的影响:与正常对照组比较,模型组SOD活性下降,MDA含量增加,差异具有显著统计学意义(P<0.01);与模型组比较,渣驯正丁醇部位中、高剂量组SOD活性增加,MDA含量下降明显(P<0.05);低剂量组SOD、MDA含量有下降趋势,但不具有统计学差异。结果见表3。

表3 渣驯正丁醇部位对小鼠肝组织中SOD、MDA的影响
注:与正常对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
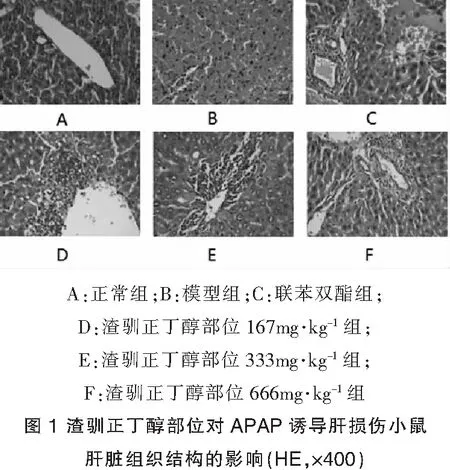
3.4 小鼠肝组织病理变化:由图1可知,正常对照组,肝组织结构清晰,未见明显异常。模型组可见肝脏广泛坏死伴淤血,肝脏结构不清,细胞核固缩、凋亡,汇管区见少量炎细胞浸润;联苯双酯组,局部汇管区水肿伴有少量炎细胞浸润,余未见明显异常;渣驯正丁醇部位各剂量组,随着剂量的增加,肝细胞坏死、变性和炎症细胞浸润的程度相应减轻。
4 讨论
药物性肝损伤(drug induced liver injury,DILI)是指在应用药物过程中由药物或其代谢产物引起的肝脏疾病[10]。近年来,随着医学的发展,各种新型药物不断上市,临床用药种类逐渐增多,以及人们保健意识的不断增强,DILI的发生率逐年上升并成为引发肝病的重要原因之一,并成为一个严重的公共卫生问题。据世界卫生组织统计,全球死亡原因的第五位已被DILI所占据。目前已有1100多种药物可引起DILI[11]。根据Hy′s法则[12],死亡风险至少为10%,Ou等[13]的研究中可达12.69%。因此,研发有效的保肝药物依然是当今药物研究的热点和难题。
对乙酰氨基酚(acetaminophen,APAP)是一种常见的解热镇痛药,临床应用实践表明,大剂量或者长期服用,常可导致肝损伤等严重的不良反应。因此,APAP成为建立药物性肝损伤模型的常用药物,其血清学指标ALT、AST是反应肝实质损害常见的主要指标。本实验研究中,模型组小鼠血清中ALT、AST含量均显著增高(P<0.01),表明模型建立成功。而各给药组在给予不同剂量的渣驯正丁醇部位后,ALT、AST、MDA含量降低,SOD活性增加,且呈现剂量依赖关系,以渣驯正丁醇部位中、高剂量组效果尤为显著(P<0.05)。此外,小鼠肝脏组织病理学检查结果表明,渣驯正丁醇部位3个剂量组随着给药剂量的增加,肝细胞坏死、变性及细胞浸润程度相应的降低,表明渣驯正丁醇部位对APAP所致的肝损伤有一定的保护作用,但其具体作用机制有待进一步研究。
[1]多吉杰傅, 和尚马哈亚娜,比如扎那,译.月王药诊[M].北京:民族出版社.1985: 138.
[2]宇妥·元丹贡布. 四部医典(藏文版)[M].拉萨:西藏人民出版社,1982, 2: 66-75.
[3]索南邓登,童丽,袁冬平,等. 传统藏药渣驯的文献研究[J]. 中国民族民间医药, 2012, 21(4):8-9.
[4]木拉提·克扎衣别克. 塔斯马依的研究进展[J]. 中国中药杂志,2013, 38(3):443-447.
[5]曹赟,古锐,马逾英,等. 藏药“渣驯”物质组成研究[J]. 中药材,2015, 38(2):279-283.
[6]Vaishwanar I,Kowale C N,Jiddewar G G. Effect of two Ayurvedic drugs shilajeet & eclinol on changes in liver & serum lipids produced by carbon tetrachloride[J]. Indian J Exp Biol, 1976, 14(1):57.
[7]洛桑多吉. 藏药炮制规范(2008年版)[M].拉萨:西藏人民出版社, 2008:114~115.
[8]陈欢,马磊,黄茹,等. 原花青素在对乙酰氨基酚诱导的急性肝损伤中的保护作用及机制[J]. 重庆医科大学学报,2015, 40(3):358-361.
[9]尹学哲,金延华,王玉娇,等. 草苁蓉不同溶剂萃取物对对乙酰氨基酚诱导的小鼠急性肝损伤的保护作用[J]. 中国药学杂志,2014, 49(6):469-472.
[10]任美欣,孟庆华. 药物性肝损伤[J]. 临床荟萃,2016, 31(7):713-716.
[11]Reuben A,Koch DG,Lee WM. Drug induced acute liver failure:results of a U.S. Multicenterprospective study[J]. Heapatology,2010, 52(6): 2065-2076.
[12]中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 中华肝脏病杂志,2015, 23(11): 810-820.
[13]Ou P,Chen Y,Li B,et al. Causes,clinical features and outcomes of drug induced liver injury in hospitalized patients in a Chinese teriary care hospital[J]. Springerplus, 2015, 4: 802.
叶翠萍,女,在读研究生,从事中药的药效与毒理研究;E-mail: 460323715@qq.com。
*通讯作者:古锐,男,副研究员,从事民族药可持续开发与利用研究;E-mail: 664893924@qq.com,Tel: 15108237310。
R291.4
A
1006-6810(2017)05-0060-03
2017年1月17日收稿

