Stanford B型主动脉夹层原发破口位置对腹腔主要分支血流灌注的影响
韩晓峰,郭 曦,刘光锐,李铁铮,黄连军(首都医科大学附属北京安贞医院介入诊疗科 北京市心肺血管疾病研究所 北京市大血管病诊疗中心,北京 100029)
·临床研究·
StanfordB型主动脉夹层原发破口位置对腹腔主要分支血流灌注的影响
韩晓峰,郭 曦,刘光锐,李铁铮,黄连军*
(首都医科大学附属北京安贞医院介入诊疗科 北京市心肺血管疾病研究所 北京市大血管病诊疗中心,北京 100029)
目的探讨Stanford B型主动脉夹层原发破口位置对腹腔主要分支动脉血流灌注的影响。方法回顾性分析130例Stanford B型主动脉夹层患者术前主动脉CTA资料,对受累的腹腔主要分支血管(腹腔干、肠系膜上动脉、双侧肾动脉)缺血类型和灌注损伤程度进行分型,并分析二者与不同夹层原发破口位置的关系。结果130例患者共计542支分支动脉中,465支(465/542,85.79%)存在缺血,包括337支(337/542,62.18%)动力型缺血及128支(128/542,23.62%)静力型缺血,其中灌注受损69支(69/542,12.73%)、灌注未受损396支(396/542,73.06%);77支(77/542,14.21%)血管无缺血。灌注受损的分支血管中,动力型缺血37支(37/69,53.62%),静力型缺血32支(32/69,46.38%),差异无统计学意义(χ2=3.077,P=0.215)。夹层原发破口位置对腹腔主要分支动脉缺血类型(动力型、静力型)及灌注改变情况(受损、未受损)无明显影响(χ2=1.352、0.776,P=0.509、0.678)。结论B型主动脉夹层原发破口的位置对腹腔主要分支动脉缺血类型及灌注损伤程度无明显影响,评估腹腔主要分支血管缺血及灌注改变情况对指导手术方案制定有重要临床意义。
体层摄影术,X线计算机;血管造影术;主动脉夹层;灌注成像
主动脉内脏分支血管灌注不良是Stanford B型主动脉夹层的严重并发症,可导致脏器缺血等严重后果[1]。Williams等[2]将夹层内膜撕裂造成的分支血管缺血分为动力型和静力型。腔内修复术治疗主动脉夹层时,因隔绝了原发破口,使真腔管径增大,对动力型缺血的分支血管血流灌注恢复较好,可有效改善分支血管血流灌注[3]。而静力型分支血管缺血则比较复杂,腔内修复术对其血流灌注的改善情况存在差异。因此,术前有效评估主动脉夹层对腹腔主要分支血管灌注情况的影响有重要临床意义。本研究回顾性分析130例Stanford B型主动脉夹层患者的资料,探讨原发破口位置对腹腔主要分支动脉灌注情况的影响,旨在为临床制定手术方案提供新思路。
1 资料与方法
1.1 一般资料 回顾性分析2015年9月—2017年3月术前经主动脉CTA证实为Stanford B型主动脉夹层的130例患者资料,男101例,女29例,年龄32~77岁,平均(53.7±10.5)岁。其中急性期(发病<15天)75例、亚急性期(发病15天~3个月)36例、慢性期(发病>3个月)19例;主要临床表现:胸背部疼痛123例,腹部不适14例,下肢麻木不适11例,无明显症状(体检偶然发现)6例;既往合并高血压112例,冠心病17例,糖尿病11例,脑梗死9例。68例患者具有10年以上吸烟史。
1.2 仪器与方法 采用Toshiba Aquilion ONE 320层螺旋CT、Toshiba Aquilion 64排螺旋CT及Siemens Somatom Definition 双源CT机,扫描范围自胸廓入口至股动脉分叉处。管电压100~120 kV,管电流350~420 mAs,管球旋转时间400~500 ms。采用双管高压注射器经肘静脉注射非离子型对比剂(优维显,370 mgI/ml),流速4.0~5.5 ml/s,同速率追加生理盐水30 ml[4-5],采用回顾性心电门控、手动触发模式。
1.3 图像分析 主动脉CTA图像分析由2名影像医师独立完成,意见不统一时,经上级医师核实后最终判定。
根据主动脉CTA表现确定原发破口位置,并结合传统分支血管缺血分型(动力型和静力型)[2]和Nagamine分支血管灌注不良细化分型(Ⅰ~Ⅲ型)[6],将主动脉夹层受累分支血管灌注不良分为动力型(Ⅰ型)和静力型(Ⅱ型和Ⅲ型)两类。动力型(Ⅰ型)分支血管完全起自真腔,又分3个亚型:Ⅰ-a型,真腔未受假腔压迫,分支血管血供良好;Ⅰ-b型,真腔受压塌陷导致分支血管血供受损;Ⅰ-c型,分支血管开口处因内膜片影响导致血供受损。静力型分支血管有撕裂内膜片(Ⅱ型)或分支血管起自假腔(Ⅲ型);其中Ⅱ型又分为Ⅱ-a型(分支血管内存在较大的再破口,分支血管血流灌注大部分来自假腔,但血流灌注良好)和Ⅱ-b型(分支血管内无再破口或再破口较小,分支血管供血大部分来自真腔),且Ⅱ-b型又分为Ⅱ-b-1型(分支血管内真腔不受假腔压迫,分支血管血供好)和Ⅱ-b-2型(分支血管内真腔受压,分支血管血供受损);Ⅲ型分支血管自开口处撕裂,又分为Ⅲ-a型(分支血管血供大部分来自假腔,分支血管血供良好)、Ⅲ-b型(分支血管内真腔受压,分支血管血供受损)和Ⅲ-c型(夹层假腔部分血栓化,分支血管血供受损)。
评估血流灌注改变时,将动力型缺血的Ⅰ-b、Ⅰ-c型及静力型缺血的Ⅱ-b-2、Ⅲ-b、Ⅲ-c型定义为血流灌注受损(图1),反之认为灌注未受损。
1.4 统计学分析 采用SPSS 22统计分析软件,计量资料以±s表示,计数资料以频数或百分率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
130例患者中夹层原发破口位于大弯侧90例(90/130,69.23%)、小弯侧31例(31/130,23.85%)、弓降部以远9例(9/130,6.92%)。共计542支腹腔分支血管(包含22支副肾动脉)中,465支(465/542,85.79%)存在缺血,337支(337/542,62.18%)为动力型缺血,128支(128/542,23.62%)为静力型缺血,其中灌注受损69支(69/542,12.73%),灌注未受损396支(396/542,73.06%);77支(77/542,14.21%)血管无缺血。69支灌注受损的分支血管中,动力型缺血37支(37/69,53.62%),静力型缺血32支(32/69,46.38%),差异无统计学意义(χ2=3.077,P=0.215)。不同夹层原发破口位置患者间缺血类型及血流灌注改变差异均无统计学意义(P均>0.05,表1),腹腔各主要分支血管灌注情况差异均无统计学意义(P均>0.05)。见表2、图2。
灌注受损的静力型缺血中,Ⅱ-b-2亚型共14支(14/32,43.75%),包括破口位于大弯侧的腹腔干1支、肠系膜上动脉6支、左肾动脉1支,破口位于小弯侧的肠系膜上动脉1支、左肾动脉1支、右肾动脉3支,破口位于弓降部以远的腹腔干1支;Ⅲ-c亚型共18支(18/32,56.25%),包括破口位于大弯侧的腹腔干4支、左肾动脉1支、右肾动脉8支及副肾动脉1支,破口位于小弯侧的右肾动脉2支,破口位于弓降部以远的左、右肾动脉各1支。
3 讨论
合并内脏缺血的主动脉夹层患者临床多表现为胸背痛伴腹部不适,本组130例患者中123例以胸背痛为主要症状就诊,仅少部分合并腹痛、腹胀、腹泻等腹部不适症状。Midulla等[7]回顾性分析728例主动脉夹层,发现19.9%患者合并灌注受损症状,并建议对于这类患者首选腔内治疗并行分支血管腔内重建。Di Eusanio等[8]分析1 809例主动脉夹层病例,发现仅3.8%的患者合并腹腔主要分支动脉血流灌注不良。本组病例中,夹层累及腹腔主要分支血管灌注受损所占的比例较低(69/542,12.73%),且其中动力型与静力型缺血比例差异无统计学意义(χ2=3.077,P=0.215)。
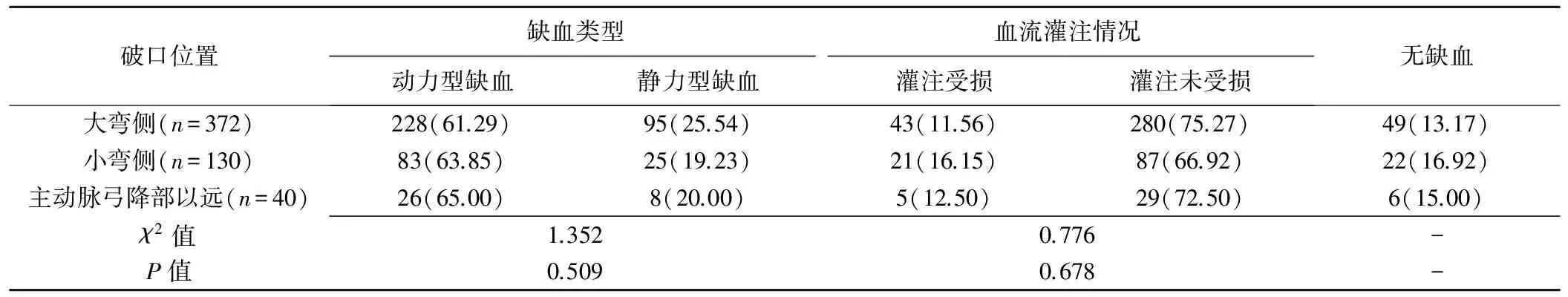
表1 不同夹层原发破口位置患者间缺血类型及血流灌注改变情况[支(%)]
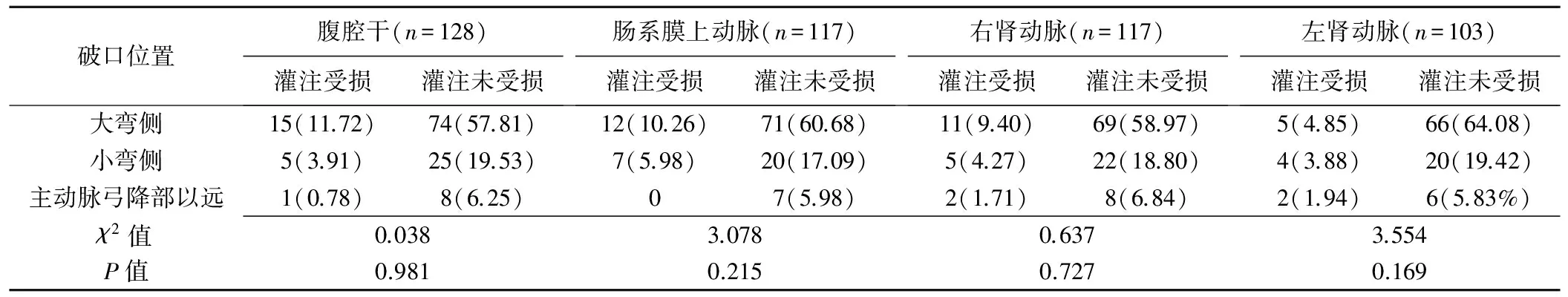
表2 不同夹层原发破口位置患者腹腔各主要分支血管灌注情况[支(%)]
注:左副肾动脉合并入左肾动脉,右侧副肾动脉合并入右肾动脉
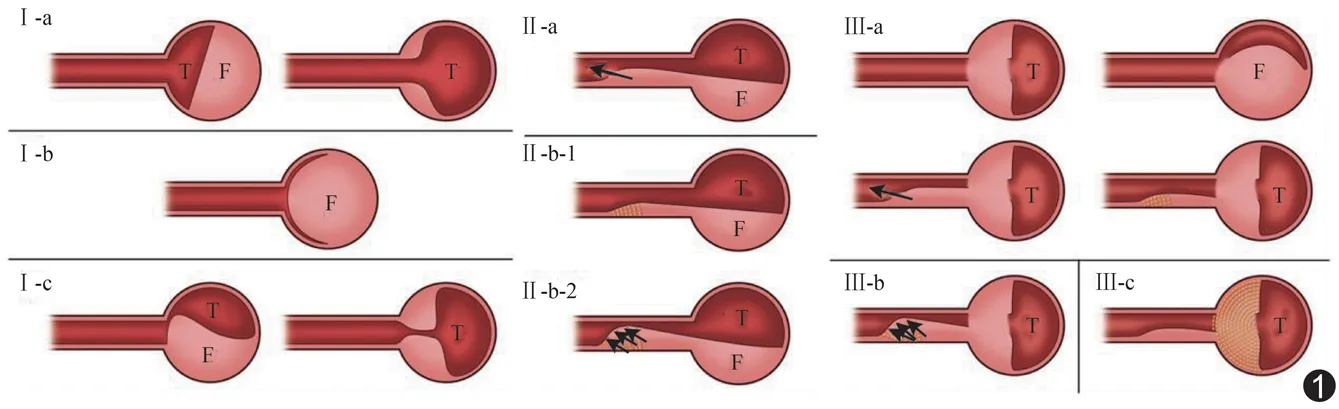
图1 主动脉夹层累及内脏分支血管血流灌注细化分型示意图 (长箭示分支血管内真假腔存在再破口;短箭示分支血管真假腔间无再破口,假腔压迫真腔;T:真腔;F:假腔)
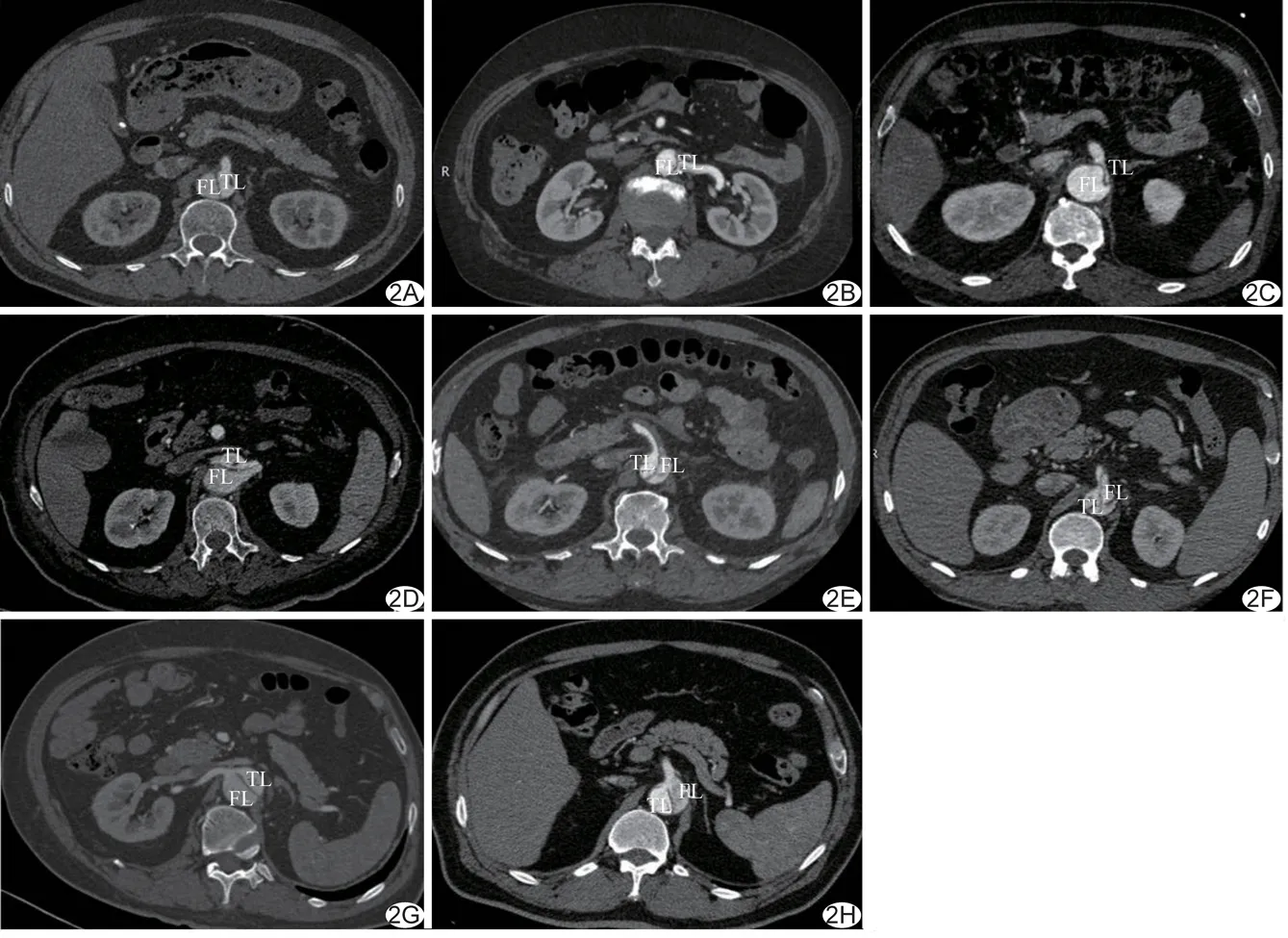
图2腹腔主要分支动脉各亚型CT表现 A.Ⅰ-a型,肠系膜上动脉; B.Ⅰ-b型,左肾动脉; C.Ⅰ-c型,腹腔干; D.Ⅱ-a型,左肾动脉; E.Ⅱ-b-1型,肠系膜上动脉; F.Ⅱ-b-2型,肠系膜上动脉; G.Ⅲ-a型,右肾动脉; H.Ⅲ-c型,腹腔干 (FL:假腔;TL真腔)
本研究结果显示,夹层导致缺血的腹腔分支血管中12.73%(69/542)血流灌注受损,73.06%(473/542,87.27%)血流灌注未受损,但夹层原发破口位置不同对分支血管灌注改变情况(受损、未受损)无明显影响(χ2=0.776,P=0.678)。本研究分析各分支血管灌注改变情况,发现不同原发破口位置对腹腔4个主要分支血管(腹腔干、肠系膜上动脉、左肾动脉和右肾动脉)的灌注改变均无明显影响(P均>0.05),提示夹层原发破口位置并不是影响腹腔主要分支动脉灌注的改变的主要因素。有研究[9]报道,腹腔动脉灌注改变还与夹层原发破口的面积、再破口的数量、主动脉弓走行及主动脉管壁本身的病理改变情况等相关。
腔内治疗术对动力型缺血分支的血管重塑效果较好[3,10-11],而对静力型缺血的效果仍待考证。本组Ⅱ-b-2亚型血管共14支。Nagamine等[6]认为,对于分支血管因夹层内膜撕裂而形成的Ⅱ-b-2型缺血,为确保良好的分支血流灌注,无论患者有无明显内脏缺血症状均应及早行分支血管重建。但Shiiya等[12-13]认为对于Ⅱ-b-2型缺血并不能一概而论,如分支血管夹层假腔内不伴有血栓时,分支缺血仍属动力型,无需植入支架重建血流;但假腔内存在血栓时,建议腔内治疗的同时行腔内分支血管重建。笔者认为腔内修复术封闭近端破口使主动脉及分支血管真腔内血流灌注增加,可部分恢复远端脏器灌注,改善内脏缺血症状。主动脉夹层腔内修复术后应即刻行DSA评估受累分支血管灌注改善状况,必要时超选该分支血管造影评估血流灌注情况,如明确分支血管灌注仍未改善,可进一步植入支架以恢复血流灌注。本组Ⅲ-c亚型血管共18支,未见Ⅲ-b型。Nagamine等[6]认为Ⅲ-c亚型一经发现,需即刻行腔内分支血管重建或外科搭桥重建恢复脏器供血。对于Ⅲ-c亚型灌注不良的治疗策略,笔者认为需术前和术中同时评估缺血脏器的功能,以决定是否有必要术中放置支架开通闭塞动脉或行外科动脉搭桥术,以恢复缺血分支动脉灌注。本组4支Ⅲ-c型缺血分支患者主动脉夹层破口位于大弯侧的腹腔干,但患者无明显临床症状,可能与病程较长、侧支循环形成较好有关。腹腔干解剖位置高,夹层内膜片向远段撕裂时其首先受累[12],而腹腔干的保护作用使肠系膜上动脉不易受累,可能是本组未发现肠系膜上动脉Ⅲ-c型缺血的原因。
总之,B型主动脉夹层累及腹腔分支动脉灌注受损的比例较低,夹层原发破口位置对腹腔主要分支动脉缺血类型及血流灌注情况无明显影响。腔内治疗术前详细评估分支血管灌注改变,对手术方案的制定及提高远期生存率均具有重要意义。
[1] Lombardi JV, Cambria RP, Nienaber CA, et al. Prospective multicenter clinical trial (STABLE) on the endovascular treatment of complicated type B aortic dissection using a composite device design. J Vasc Surg, 2012,55(3):629-640.
[2] Williams DM, Lee DY, Hamilton BH, et al. The dissected aorta: Percutaneous treatment of ischemic complications—principles and results. J Vasc Interve Radiol, 1997,8(4):605-625.
[3] 黄连军,杨剑,俞飞成,等.腔内覆膜支架治疗B型主动脉夹层对腹部分支血管供血的影响.中华放射学杂志,2005,39(6):657-660.
[4] 戴沁怡,张兆琪,吕飙,等.多层螺旋CT血管成像诊断冠状动脉瘘.中国医学影像技术,2011,27(3):537-540.
[5] 耿冀,俞婧,范占明,等.双源CT血管造影综合评估Stanford A型主动脉夹层.中国医学影像技术,2011,27(10):2053-2057.
[6] Nagamine H, Ueno Y, Ueda H, et al. A new classification system for branch artery perfusion patterns in acute aortic dissection for examining the effects of central aortic repair. Eur J Cardiothoracic Surg, 2012,44(1):146-153.
[7] Midulla M, Renaud A, Martinelli T, et al. Endovascular fenestration in aortic dissection with acute malperfusion syndrome: Immediate and late follow-up. J Thorac Cardiovasc Surg, 2011,142(1):66-72.
[8] Di Eusanio M, Trimarchi S, Patel HJ, et al. Clinical presentation, management, and short-term outcome of patients with type A acute dissection complicated by mesenteric malperfusion: Observations from the international registry of acute aortic dissection. J Thorac Cardiovasc Surg, 2013,145(2):385-390.
[9] Khoynezhad A, Walot I, Kruse MJ, et al. Distribution of intimomedial tears in patients with type B aortic dissection. J Vasc Surg, 2010,52(3):562-568.
[10] White RA, Miller DC, Criado FJ, et al. Report on the results of thoracic endovascular aortic repair for acute, complicated, type B aortic dissection at 30 days and 1 year from a multidisciplinary subcommittee of the Society for Vascular Surgery Outcomes Committee. J Vasc Surg, 2011,53(4):1082-1090.
[11] Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J, 2014,35(41):2873-2926.
[12] Shiiya N, Matsuzaki K, Kunihara T, et al. Management of vital organ malperfusion in acute aortic dissection: Proposal of a mechanism-specific approach. Gen Thorac Cardiovasc Surg, 2007,55(3):85-90.
[13] 原小军,郝粉娥,赵磊,等.主动脉夹层撕裂内膜走行规律的MSCTA研究.中国医学影像技术,2017,33(1):35-39.
ImpactofinitialintimaltearpositiononperfusionofabdominalbranchesinStanfordBaorticdissection
HANXiaofeng,GUOXi,LIUGuangrui,LITiezheng,HUANGLianjun*
(DepartmentofDiagnosticandInterventionalRadiology,BeijingAnzhenHospital,CapitalMedicalUniversity,BeijingInstituteofHeart,LungandBloodVascularDiseases,BeijingAorticDiseaseCenterinDiagnosisandTreatment,Beijing100029,China)
ObjectiveTo explore the influence of different initial intimal tear positions on abdominal branch perfusion in Stanford B aortic dissection.MethodsCTA data of 130 patients with Stanford B aortic dissection were reviewed retrospectively. The involved aortic branches (celiac trunk, superior mesenteric artery, bilateral renal artery) were classified into different types according to the degree of ischemia and perfusion damage, and their relationship with different initial intimal tear positions were also analyzed.ResultsThere were 542 branches in 130 patients, in which 465 branches (465/542, 85.79%) were ischemic, including 337 branches (337/542, 62.18%) of dynamic ischemia and 128 branches (128/542, 23.62%) of static ischemia, 77 branches (77/542, 14.21%) without ischemia. In ischemic branches, the perfusion in 69 (69/542,12.73%) of them were impaired and those of the other 396 branches (396/542, 73.06%) were unimpaired. In all of the 69 branches of impaired perfusion, 37 branches (37/69, 53.62%) were dynamic ischemia and 32 branches (32/69, 46.38%) were static ischemia, and the difference was no statistically significant (χ2=3.077,P=0.215). Furthermore, no significant impact was found in initial intimal tear positions on ischemic patterns (dynamic and static) or perfusion patterns (unimpaired and impaired;χ2=1.352, 0.776,P=0.509, 0.678).ConclusionInitial intimal tear positions has no significant impact on ischemia pattern or perfusion pattern of abdominal aortic branches. The evaluation of abdominal aortic branches is helpful for guiding surgery.
Tomography, X-ray computed; Angiography; Aortic dissection; Perfusion imaging
国家重点研发计划(2017YFC1308005)。
韩晓峰(1984—),男,河南漯河人,硕士,主治医师。研究方向:大血管与外周血管疾病诊断与治疗。E-mail: hanxiaofengaz@126.com
黄连军,首都医科大学附属北京安贞医院介入诊疗科 北京市心肺血管疾病研究所 北京市大血管病诊疗中心,100029。
E-mail: huanglianjun2008@163.com
2017-09-25
2017-10-31
10.13929/j.1672-8475.201709033
R543.1; R814.42
A
1672-8475(2017)12-0715-05

