2015年杭州地区新生儿肠道病毒脑炎病原分型及临床特征
张琼 刘玉洁 李伟 尚世强
2015年杭州地区新生儿肠道病毒脑炎病原分型及临床特征
张琼 刘玉洁 李伟 尚世强
目的分析2015年夏季杭州地区新生儿肠道病毒脑炎病原分型及临床特征。方法选择浙江大学医学院附属儿童医院2015年5-9月收治的45例有颅内感染的新生儿为研究对象,采用RT-PCR法检测脑脊液中的肠道病毒,根据结果分为病例组(阳性)与对照组(阴性),比较与分析新生儿肠道病毒脑炎病原分型及临床特征。结果45例患儿脑脊液中检出肠道病毒阳性17例(37.8%)。病例组脑脊液中糖含量高于对照组(P<0.05),蛋白含量少于对照组(P<0.05);两组患者发热、黄疸、呕吐、抽搐等临床症状比较,差异均无统计学意义(均P>0.05)。将17例脑脊液肠道病毒阳性标本进行基因分析,得到埃可病毒(ECHO)30(13例)、ECHO 16(2例)和柯萨奇病毒(CV)B2(2例);对上述临床株进行进化树分析,发现与参考株的同源性达89.6%~98.3%。结论2015年夏季杭州地区新生儿肠道病毒脑炎局部暴发流行,脑脊液生化指标的变化符合病毒性脑炎的特点,但临床表现无明显特异性;ECHO 30是主要病原体,进化树分析显示本次暴发流行可能是浙江省ECHO 30分离株的又一暴发流行。
肠道病毒脑炎新生儿病原分型临床特征
肠道病毒是单链RNA病毒,在世界范围内广泛传播。目前已知有100多个血清型,包括柯萨奇病毒(CV)A及B型、埃可病毒(ECHO)、脊髓灰质炎病毒(PV)和其他肠道病毒[1]。肠道病毒感染可以导致多种疾病,如手足口病、疱疹性咽峡炎、肠道病毒脑炎等。婴幼儿,尤其新生儿是肠道病毒的主要易感人群[2]。有文献报道肠道病毒是引起中枢神经系统感染的重要病原体,在全世界范围内不同肠道病毒血清型均可引起肠道病毒脑炎,如CV A9及B1~B5型,ECHO 4、6、9、11、19、25及30型,肠道病毒71、75、76型[3-5]。由于肠道病毒血清型很多,且各有不同的临床表现;因此,系统地监测与分析肠道病毒感染是很有必要的。本文就2015年夏季杭州地区新生儿肠道病毒脑炎病原分型及临床特征作一分析,现将结果报道如下。
1 对象和方法
1.1 对象选择浙江大学医学院附属儿童医院2015年5-9月收治的45例有颅内感染的新生儿为研究对象,收集患儿发病时间、临床表现、脑脊液检查结果等临床资料。纳入标准:(1)入院时年龄<28d;(2)符合颅内感染的诊断(依据人民卫生出版社的《实用新生儿学》第4版,即脑脊液病原学检测阳性或脑脊液常规及生化检测明显异常)。
1.2 主要仪器及设备肠道病毒通用型核酸测定试剂盒、EX2400核酸自动提取仪均购自上海之江生物科技股份有限公司;逆转录试剂盒购自上海Invitrogen公司;Taq DSC DNA聚合酶购自Enzymatics公司;ABI-PCR仪购自美国ABI公司。
1.3 方法
1.3.1 病毒总RNA提取及反转录使用肠道病毒核酸测定试剂盒、核酸自动提取仪,从新生儿脑脊液标本中提取肠道病毒RNA。
1.3.2 肠道病毒核酸的鉴定使用肠道病毒通用型核酸测定试剂盒检测脑脊液RNA样本,反应条件:50°C 15min,95°C 5min,94°C 15s,55°C 45s;循环40次。
1.3.3 VP1基因的扩增和测序对肠道病毒通用型阳性RNA样本进行VP1区的扩增和测序,VP1基因逆转录和扩增的引物依据参考文献[6]设计。逆转录反应:每份RT-PCR样本的总量为10μl,包括2μl buffer(5×)、0.4μl dNTP(10mM)、1μl DTT、0.2μl上游引物和下游引物、0.5μl SuperscriptⅢ、5μl肠道病毒RNA模板、0.4μl RNasin。反应条件:22℃10min,45℃45min,95℃5min。巢式PCR反应包括2轮:第一轮VP1基因的PCR产物总量为50μl,包括10μl RT-PCR的产物、0.5μl Taq DSC和2.5μl外引物,基因扩增的反应条件:95℃5min,(95℃30s,42℃30s,60℃45s)×40个循环,72℃10min。第二轮PCR产物总量为50μl,包括1μl第一轮PCR产品、0.5μl Taq DSC和2.5μl外引物,反应条件:95℃6min,(95℃30s,60℃20s,72℃25s)×40个循环,72℃10min。结束以上操作后,送上海美吉生物医药科技有限公司进行测序。
1.3.4 基因型分析使用Mega 5.10软件,将临床得到的VP1基因DNA序列与国家生物技术信息中心(NCBI)数据库的DNA序列进行比较与系统分析。
1.4 统计学处理应用SPSS 20.0统计软件。计量资料符合正态分布,用示,组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 新生儿肠道病毒脑炎的临床特征45例颅内感染的新生儿脑脊液标本中,检测出肠道病毒RNA阳性17例(肠道病毒脑炎),阳性率为37.8%。其中男9例,占52.9%;女8例,占47.1%。临床表现:黄疸16例,占94.1%;发热14例,占82.4%;少吃少动9例,占52.9%;皮肤花斑7例,占41.2%;腹泻3例,占17.6%;腹胀2例,占11.8%;抽搐2例,占11.8%;呼吸暂停2例,占11.8%;所有患者无呕吐症状。实验室检查:心肌酶谱增高13例,占74.5%;血WBC正常14例,占82.4%。同时行脑脊液常规检查17例,WBC增多9例,占52.9%。同时行脑脊液生化检查16例,糖含量降低6例,占37.5%;蛋白含量增高16例,占100.0%(其中蛋白含量>800mg/L 9例,占56.3%)。5-9月分别检出0、8、9、0和0例,具有明显的季节性,见图1。
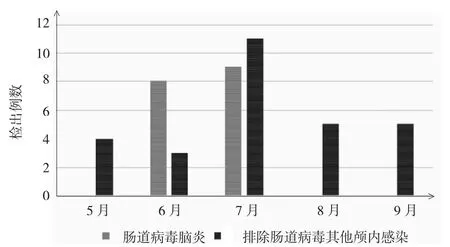
图1 45例颅内感染的新生儿肠道病毒脑炎发病的季节分布
2.2 肠道病毒脑炎患者与对照组脑脊液生化指标及临床症状比较将17例肠道病毒脑炎患者设为病例组,余下28例颅脑感染患者设为对照组。病例组脑脊液中糖含量高于对照组,蛋白含量低于对照组,差异均有统计学意义(均P<0.05);两组患者脑脊液中乳酸脱氢酶含量比较,差异无统计学意义(P>0.05),见表1。两组患者发热、黄疸、抽搐、呕吐、腹泻、少吃少动、皮肤花斑等临床表现比较,差异均无统计学意义(均P>0.05),见表2。
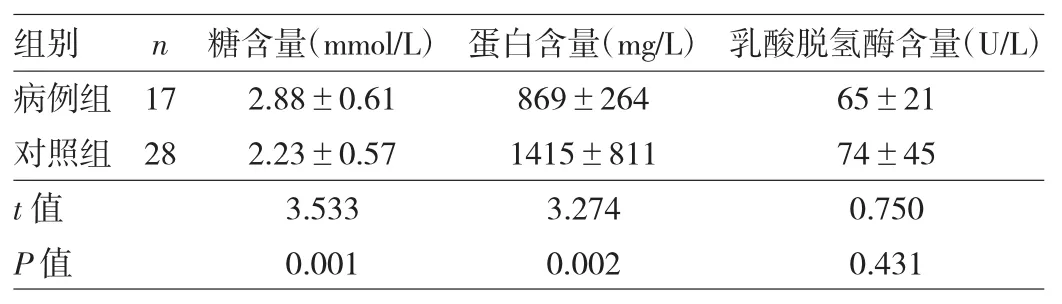
表1 病例组与对照组脑脊液生化指标比较
2.3 RT-PCR病毒测定结果及基因分型17例肠道病毒包括ECHO 30、ECHO 16和CV B2,分别有13例(76.5%)、2例(11.8%)和2例(11.8%)。比较测序所得的不同肠道病毒临床株的VP1序列,发现临床株与标准株的同源性为89.6%~98.3%。再将测序所得的VP1序列,与NCBI网站用BLAST程序在GenBank上的VP1序列进行比对,同时进行同源性分析,并绘制遗传进化树;找到与此次暴发的ECHO 30临床株同源性最近的是浙江省ECHO 30分离株,与此次暴发的ECHO 16临床株同源性最近的是云南省ECHO 16分离株,与此次流行的CV B2临床株同源性最近的是上海市CV B2分离株;肠道病毒遗传进化树见图2。
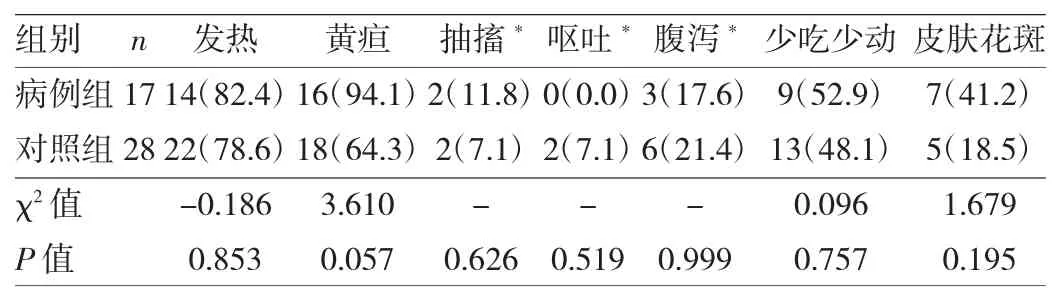
表2 病例组与对照组临床表现比较[例(%)]
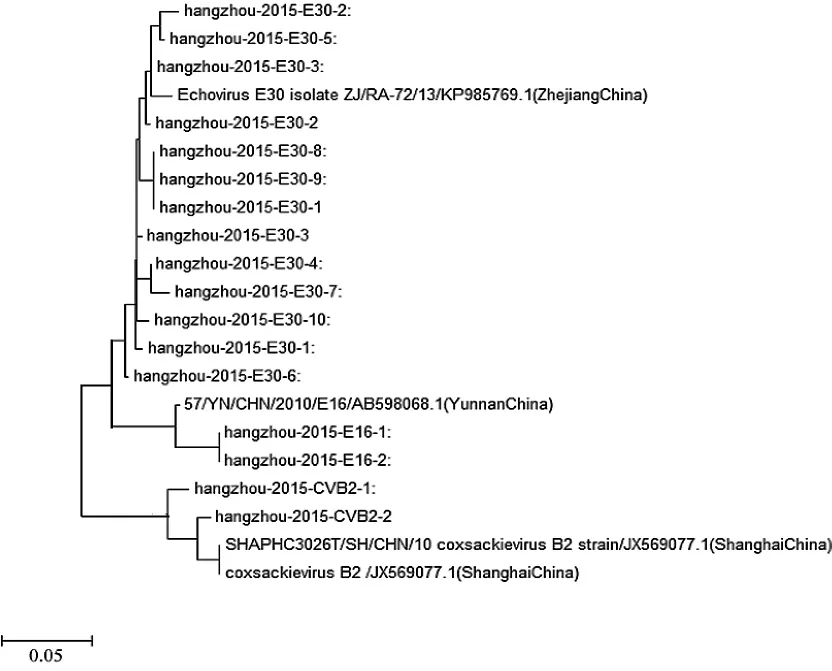
图2 肠道病毒遗传进化树
3 讨论
病毒性脑炎是由多种病毒感染引起的中枢神经系统疾病。轻者能自行缓解,重者会引起后遗症或死亡,而肠道病毒是其最主要的病原体之一[7]。新生儿一旦感染肠道病毒,最常见的并发症是无菌性脑炎[2]。既往研究均有关于儿童肠道病毒脑炎暴发流行的报道,如2004年浙江临海地区暴发了ECHO 30所致的病毒性脑炎[8];2005年山东省兖州市暴发无菌性脑膜炎,分离得到的病毒株主要为Cox B5[9];2006年希腊暴发ECHO 6所致的病毒性脑炎[10];2008年西班牙暴发ECHO 4所致的病毒性脑炎[11];2008年山东省郯城县肠道病毒脑炎暴发,病原体主要为CV B3。但是,关于新生儿肠道病毒脑炎暴发的报道不多,特别是不同肠道病毒血清型所致新生儿肠道病毒脑炎的报道更是少见。因此,笔者就2015年杭州地区新生儿肠道病毒脑炎病原分型及临床特征作一分析。
本研究对45例颅内感染的新生儿脑脊液进行肠道病毒检测及分型,检出肠道病毒17例,阳性率为37.8%;6-7月是新生儿肠道病毒脑炎的暴发季节。17例新生儿肠道病毒脑炎发病时间基本符合既往流行病学报道及研究[12-13]。进一步分析17例患儿的临床特征,并与对照组进行比较,发现两组患者发热、黄疸、少吃少动、呕吐、抽搐等临床症状方面比较差异无统计学意义,且颅内高压症状不典型;考虑与新生儿颅骨发育特点有关,即新生儿囟门及颅缝未闭合,对颅内高压有缓冲作用,且新生儿神经系统及其他脏器发育不完善,往往临床表现无明显特异性。这与近年来关于新生儿颅内感染的临床研究结果一致[14-15]。由此可见,新生儿不同病原体引起的颅内感染,其临床症状不是主要鉴别方式,检测脑脊液中病原体才是明确诊断与指导用药的金标准[16]。比较两组患儿脑脊液生化指标,发现病例组脑脊液中糖含量高于对照组,而蛋白含量少于对照组;以上脑脊液生化指标的改变符合病毒性脑炎的特点[16]。建议在肠道病毒流行的季节,应高度警惕病毒性脑炎患儿是否由肠道病毒感染引起,有检测条件的医院要对有发热、黄疸、少吃少动的新生儿尽早行脑脊液病原学检查,以明确诊断并给予及时治疗。
既往研究表明浙江省从2002年开始陆续有关于ECHO 30暴发流行的报道[8,17-18]。本研究结果发现ECHO 30仍是2015年夏季杭州地区新生儿肠道病毒脑炎的主要病原体。通过测序比较不同肠道病毒临床株的VP1基因序列,发现脑脊液ECHO 30分离株无论是核苷酸水平还是氨基酸水平,同源性都相当高,它们属于人感染肠病毒,且同位于进化树同一分支上;故本次脑炎暴发可能由来源相同的ECHO 30引起的。此外,发现与引起此次暴发的ECHO 30临床株同源性最近的是浙江省ECHO 30分离株,同源性达95.5%~98.3%;提示本次新生儿病毒性脑炎的集中发病可能是浙江省ECHO 30分离株的又一暴发流行Lukashew等[19]、Domingo等[20]研究表明RNA类病毒具有高度的遗传多样性,这类病毒在传播过程中通过改变自身的结构完整性及酶的功能,可以较快地适应新环境;因此,同一来源肠道病毒可反复引起暴发流行。
综上所述,2015年夏季杭州地区新生儿肠道病毒脑炎局部暴发流行,脑脊液生化指标的变化符合病毒性脑炎的特点,但临床表现无明显特异性;ECHO 30是主要病原体,进化树分析显示本次暴发流行可能是浙江省ECHO 30分离株的又一暴发流行。
[1] Li W,Zhang X,Chen X,et al.Epidemiology of childhood enterovirus infections in Hangzhou,China[J].VirolJ,2015,14(12):58.
[2] 韩彤妍,朴梅花,童笑梅,等.新生儿肠道病毒医院感染28例分析[J].中华医院感染学杂志,2008,18(2):212-214.
[3] Zhang L,Yan J,Ojcius DM,et al.Noveland predominant pathogen responsible for the enterovirus-associated encephalitis in eastern China[J].PLoS One,2013,8(12):e85023.
[4] KumarA,Shukla D,KumarR,etal.Molecularepidemiologicalstudy of enteroviruses associated with encephalitis in children from India[J].J Clin Microbiol,2012,50(11):3509-3512.
[5] Lewthwaite P,Perera D,OoiM H,et al.Enterovirus 75 encephalitis in children,southern India[J].Emerq Infect Dis,2010,16(11):1780-1782.
[6] Nix W A,Oberste M S,Pallansch M A.Sensitive,seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimens[J].J Clin Microbiol,2006,44(8):2698-2704.
[7] 王海岩,徐爱强,朱贞,等.无菌性脑膜炎暴发中ECHO30病毒的基因特征及分子进化分析[J].中华流行病学杂志,2006,27(9):793-797.
[8] 朱坚胜,徐建人,阮仙利,等.一起病毒性脑炎疫情爆发的流行病学调查[J].中华流行病学杂志,2005,26(6):447-447.
[9] 王海岩,李岩,徐爱强,等.柯萨奇B5病毒引起山东省一起无菌性脑膜炎暴发的鉴定及其亲缘进化分析[J].中华流行病学杂志,2010,31(1):64-68.
[10] Kyriakopoulou Z,Pliaka V,Tsakogiannis D,et al.Genome analysis of two type 6 echovirus(E6)strains recovered from sewage specimens in Greece in 2006[J].Virus Genes,2012,44(2):207-216.
[11] Cabrerizo M,Trallero G,Echevarría J E,et al.Molecular characterization of enteroviruses associated with neurological infections in Spain,2008[J].J Med Virol,2013,85(11):1975-1977.
[12] 吴瑞萍,胡亚美,江载芳,等.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2002:756.
[13] 刘春艳,申昆玲,梁国栋.2002-2005年北京儿童医院住院患儿病毒性脑炎流行病学分析[J].中国实用儿科杂志,2007,22(7):498-501.
[14] 张红爱,张惠芳,于淑群.新生儿化脓性脑膜炎的临床特点与早期诊断[J].实用儿科临床杂志,2012,27(14):1091-1092.
[15] LerardiA,LugliL,RassiC,et al.Neonatalbacterialmeningitis[J].Minerva Pediatr,2010,62(suppl1):51-54.
[16] 专家座谈会.小儿病毒性脑炎的诊断与治疗[J].中国实用儿科杂志,2004,19(7):385-402.
[17] 龚黎明,严菊英,葛琼,等.浙江省局部地区2002-2003年流行的无菌性脑膜脑炎的病原学检测与分析[J].中国计划免疫,2004,10(6):336-339.
[18] 严菊英,缪梓萍,吕华坤,等.浙江省2008-2012年肠道病毒相关病毒性脑炎病原谱及分子流行病学特征分析[J].中华流行病学杂志,2013,34(12):1189-1193.
[19] Lukashew AN.Role of recombination in evolution ofenteroviruses[J].Rev Med Virol,2005,15(3):157-167.
[20] Domingo E,Martin V,Perales C,et al.Coxsackieviruses and quasispecies theory:evolution of enteroviruses[J].Curr Top MicrobiolImmunol,2008,323:3-32.
Pathogenic genotypes and clinical features of neonatal enterovirus-associated encephalitis in Hangzhou 2015
ZHANG Qiong,LIU Yujie,LI Wei,et al.
Department of Pediatrics,Tongde Hospital of Zhejiang Province,Hangzhou 310012,China
Objective To analyze the pathogenic genotypes and clinical features of neonatal enterovirus-associated encephalitis in Hangzhou 2015.Methods Forty five newborns with intracranial infection admitted in Children's Hospital,Zhejiang University School of Medicine from May to September 2015 were enrolled in this study.The cerebrospinal fluid(CSF)samples from these newborns were collected and tested by RT-PCR.The pathogenic genotypes and clinical features of patients were analyzed.Results The enterovirus was positive in 17 CSF specimens(case group)with a positive rate of 37.8%.The glucose concentration in CSF of the case group was significantly higher(P<0.05),however,the protein content in CSF of case group was significantly lower than those of control group(P<0.05).There were no significant in clinical symptoms,including fever,jaundice,vomiting and cramps between case and control groups(P>0.05).Among 17 cases with positive intestinal virus in CSF,the Echo 30 virus was detected in 13 cases(76.5%),Echo 16 virus in 2 cases(11.8%)and CVB 2 virus in 2 cases(11.8%).Phylogenetic tree analysis showed that the homology between clinical isolates and reference strains was 89.6%-98.3%.Conclusion Echo 30 is the main pathogen of the outbreak of viral encephalitis among newborns in the summer of 2015 in Hangzhou.
Enterovirus encephalitis Newborns Pathogen parting Clinical features
10.12056/j.issn.1006-2785.2017.39.23.2016-1690
浙江省医药卫生一般计划项目(2015KYA119)
310012杭州,浙江省立同德医院儿科(张琼);浙江大学医学院附属儿童医院实验检验中心(刘玉洁、李伟、尚世强)
尚世强,E-mail:shangshiqiang33@163.com
2016-10-21)
(本文编辑:陈丹)

