亚低温上调Sirt1减少氧糖剥夺后原代神经元细胞凋亡
尹美娴,胡春林,魏红艳,廖晓星,李恒杰,杨焰,李慧,荆小莉,李浩明
(1. 广东药科大学生命科学与生物制药学院,广东 广州 510006;2. 中山大学附属第一医院急诊科,广东 广州 510080;3. 卫生部辅助循环重点实验室,广东 广州 510080)
亚低温上调Sirt1减少氧糖剥夺后原代神经元细胞凋亡
尹美娴1,2,3,胡春林2,魏红艳2,廖晓星2,李恒杰2,杨焰2,李慧2,荆小莉2,李浩明1
(1. 广东药科大学生命科学与生物制药学院,广东 广州 510006;2. 中山大学附属第一医院急诊科,广东 广州 510080;3. 卫生部辅助循环重点实验室,广东 广州 510080)
为探讨亚低温对氧糖剥夺/复氧后原代神经元细胞自噬和凋亡的影响,运用原代神经元培养及OGD/R模型构建,CCK8测定细胞活力,TUNEL检测细胞凋亡, Western-blot检测Sirt1、Foxo1、Rab7、Beclin1、LC3及p53等蛋白的表达,以及转染mRFP-GFP-LC3自噬双标腺病毒检测神经元自噬流等方法,成功培养原代神经元及构建OGD/R模型。结果发现OGD/R后Sirt1、P-Foxo1、Rab7、Beclin1、LC3b/LC3a表达随着时间延长逐渐减少,12 h更明显,与R6 h组相比,P<0.05,而 p53增加,P<0.05;OGD3 h/R12 h,亚低温组Sirt1、P-Foxo1、Rab7、Beclin1 及 LC3b/LC3a表达均明显高于常温组,P<0.05,而 p53明显低于常温组,P<0.05。R6 h亚低温组,神经元凋亡率为20%±6.7%,低于常温组的56.8%±7.6%,P<0.05。mRFP-GFP-LC3 自噬双标观察法显示亚低温组自噬溶酶体明显增多,P<0.05。实验显示原代神经元OGD/R后亚低温干预可以上调Sirt1的活性,增加Foxo1、Rab7 和自噬相关蛋白Beclin1、LC3b/LC3a的表达,同时抑制p53,促进神经元自噬,减少凋亡。
亚低温;Sirt1;神经元细胞
亚低温(mild hypothermia, MH),目前通用的概念是指32~35 ℃,是近年来脑损伤领域的研究热点。亚低温可以降低颅内压、减轻脑水肿、改善神经功能、降低致残率及增加存活率[1]。但是近些年,临床上亚低温治疗也受到一定的争议,究其原因,是亚低温的治疗机制仍然不明确。目前认为缺血/再灌注损伤(ischemia reperfusion injury, I/R)与氧化应激、细胞内钙超载、线粒体功能紊乱、细胞炎症、自噬、凋亡等诸多细胞与分子生物学机制有关,自噬在缺血/再灌注中的作用越来越受到关注,越来越多的证据表明,自噬参与了脑缺血缺氧的过程(包括全脑缺血和局部缺血)[2-3]。既然,亚低温治疗脑损伤有效,自噬又参与了缺血再灌注损伤的病理生理过程,那究竟亚低温是如何调控自噬发挥脑保护作用的呢?目前未见报道。本文将通过体外实验来探讨氧糖剥夺/复氧(oxygen-glucose deprivation/ reoxygenation, OGD/R)后原代神经元自噬和凋亡的情况以及亚低温对自噬和凋亡的影响,为亚低温干预发挥神经元保护在临床上的应用提供更可靠的理论依据。
1 材料和方法
1.1 实验动物
SPF级SD大鼠新生鼠(1 d 内),由中山大学实验动物中心提供,动物许可证号:粵20150029,合格号No. 44008500011874。
1.2 实验分组
① 正常对照组(C); ② OGD 3 h组(OGD);③ OGD 3 h /R 6 h 常温组(R6 h);④ OGD 3 h /R 12 h 常温组(R 12 h);⑤ OGD 3 h /R 6 h 亚低温组(R 6 h+MH); ⑥ OGD 3 h /R 12 h亚低温组(R 12 h+MH)。
1.3 主要实验方法
1.3.1 原代神经元细胞的培养与鉴定[4]
1)原代神经元细胞的培养用适量多聚赖氨酸包被培养板;φ=75%乙醇浸泡消毒新生鼠,断头取脑;清除脑膜、脑干和脑微血管膜,剪成0.5~1 mm3的小块;加适量w=0.125%胰蛋白酶,37 ℃消化10~15 min;吹打10次,取上清,重复操作2次,;200目滤网过滤上清,滤液800 r/min离心3 min;弃上清,用种植液(含φ=10%胎牛血清和w=0.1%双抗的DMEM培养液)重悬,将细胞密度调整为5×105个/mL后种板,培养4~8 h后,若细胞贴壁良好,可换饲养液(含w=1% GlutaMAX、w=2% B27和w=0.1%双抗的Neurobasal A),细胞培养至第5天可以进行后续各种试验。
2) 原代神经元免疫荧光鉴定培养至第5天的细胞,弃上清,PBS洗2次;w=4%的多聚甲醛固定20 min,PBS洗3次;w=0.3% Triton-X 100通透20 min,PBS洗3次;w=5% BSA封闭1 h;每张玻片滴加 β-tubulin(英国 Abcam 公司)一抗(1∶200)100 μL, 4 ℃摇床孵育过夜,PBS洗3次;加荧光二抗,湿盒中37 ℃孵育1 h,PBS洗3次;加入DAPI染核3 min,PBS洗3次;荧光显微镜拍照。
1.3.2 氧糖剥夺/复糖复氧(OGD/R)模型的构建及亚低温模型构建 据实验设计随机分组;细胞弃上清,加适量PBS,培养板置于带通气管的密封细胞培养盒,持续通入体积比为95∶5的N2、CO2(流速约0.2 L/min),通气15 min 后闭合通气管,确保盒内完全被混合气体填充,移入37 ℃培养箱诱导缺氧开始;OGD[5]后从细胞培养盒中取出培养板,分别置于37、34 ℃恒温培养箱中复氧6、12 h,构建 OGD/R模型及亚低温模型。
1.3.3 CCK8检测细胞活力 细胞以1×104个/mL接种于96孔板中,培养至第5天,取出96孔板,进行OGD造模;每孔加入80 μLw=10% CCK-8溶液后继续培养4 h;用酶联免疫检测仪在450 nm波长进行检测,测定每孔吸光值(A);据每孔吸光值计算细胞存活率,计算公式为:存活率/%=(A实验组/A对照组)× 100%。
1.3.4 Western-blot检测蛋白的表达 提取细胞总蛋白,据蛋白分子量的大小选择合适的分离胶,SDS-PAGE电泳,80 V电压电泳,待样品进入分离胶后调为120 V;转膜时电流为300 mA,据目的蛋白大小调整转膜时间;PVDF膜置w=5% BSA封闭液室温封闭1 h,再分别孵一抗和二抗;ECL发光液 A∶B = 1∶1混匀,滴加显色液,用化学发光仪进行曝光显影。Sirt1、P-Foxo1、p53一抗(英国Abcam公司),Beclin1、LC3、β-actin一抗及兔抗大鼠二抗(美国 Cell Signaling Technology 公司)。
1.3.5 TUNEL检测神经元细胞凋亡 弃培养基,PBS洗3次;w=4%多聚甲醛固定20 min,PBS洗3次;加w=0.3% Triton-X 100透膜20 min,PBS洗3次;加50 μL TUNEL 反应混合液,暗湿盒中37 ℃反应1 h;PBS洗3次;DAPI染核,倒置荧光显微镜检测神经元凋亡。
1.3.6 Ad-mRFP-GFP-LC3检测自噬流 GFP在酸性环境中降解,红绿荧光重叠后出现的黄色斑点即指示自噬体,红色的斑点指示自噬溶酶体。如吞噬体和溶酶体能正常融合,那么红色荧光多于黄色荧光,如自噬下游阻滞,吞噬体和溶酶体不能正常融合,则主要为黄色荧光。通过不同颜色斑点的计数可以清晰的看出自噬流的强弱。
1) 腺病毒转染方法及转染率检测加阴性对照腺病毒(MOI值0,50,100,200,400)或携带mRFP-GFP-LC3双标腺病毒加入培养液中,培养8 h后半量换液;每天观察细胞状态;转染24、48、72 h后,分别在荧光显微镜下观察GFP荧光,随机选择10个视野,分别计数细胞总数及绿色荧光的细胞,估算转染率。
2) 共聚焦显微镜下检测自噬流根据转染率,将MOI值为100的阴性对照腺病毒及mRFP-GFP-LC3双标腺病毒加入培养液中,培养8 h后半量换液;第3天,根据实验分组进行 OGD/R 12 h造模,分常温组及亚低温组;造模后,将培养皿置于激光共聚焦显微镜下进行拍照。
1.3.7 统计学分析 应用 SPSS19.0分析软件进行数据统计分析,分析所得到的数据都用均数±标准差(x±s)表示,采用单因素方差分析(one way ANOVA)进行组间比较,P<0.05表示差异具有统计学意义。
2 实验结果
2.1 原代神经元的培养与鉴定
经β-tubulin免疫荧光鉴定,原代神经元细胞纯度在90%以上,见图1。
2.2 探讨 OGD 不同时间后神经元的活性情况
原代神经元培养5 d后,造模 OGD 0 h(Control),OGD 1 h,OGD 2 h,OGD 3 h,OGD 4 h,分别采用CCK8测定神经元细胞的活性,结果显示,OGD 1、2、3、4 h神经元存活率分别为71.6%±2.6%、59.9%±7.1%、53.9%±3.9%、45.0%±2.2%,随着缺氧时间延长,神经元细胞存活率逐渐下降,P值均<0.05。可见,OGD 3 h神经元存活率最接近50%,因此我们选用OGD 3 h作为后续实验,见图2。

图1 原代神经元的鉴定Fig.1 The identification of original generation neurons
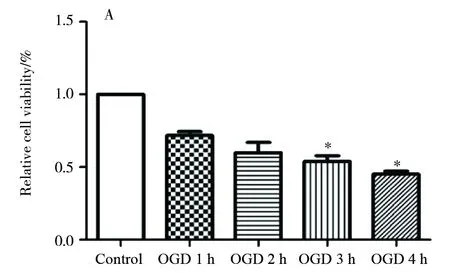
图2 OGD 不同时间后神经元的活性情况(n=3)Fig.2 The relative cell viability of neurons after OGD Mean±SD, n=3. *P<0.05 vs Control
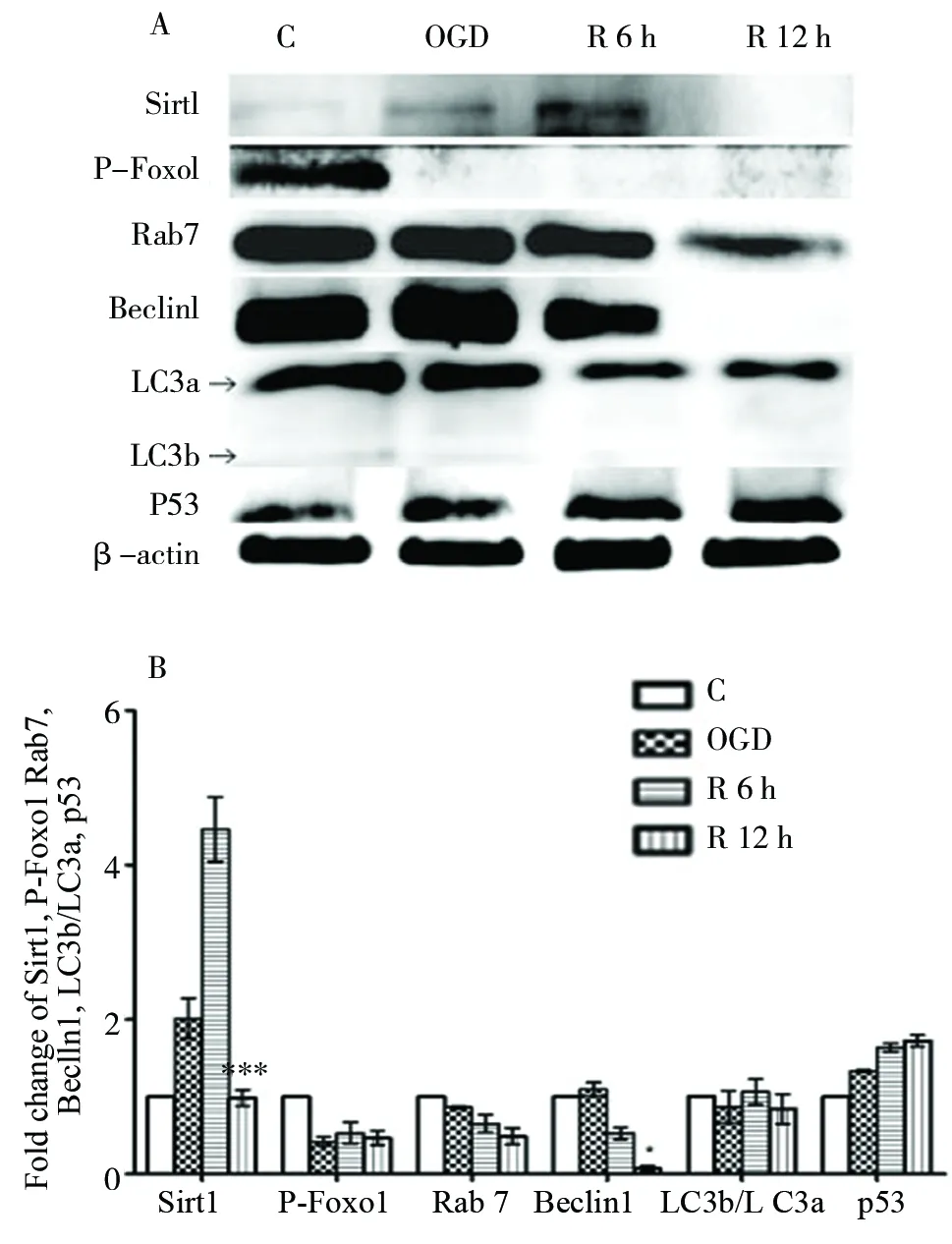
图3 OGD/R后神经元自噬相关蛋白的表达(n=3)Fig.3 The expression of Sirt1, P-Foxo1, Rab7, Beclin1, LC3 and p53 after OGD/R, n=3* P <0.05 vs R 6 h, *** P <0.001 vs R 6 h;C=control;OGD=OGD 3 h;R 6 h=OGD 3 h/R 6 h;R 12 h=OGD 3 h/R 12 h
2.3 OGD/R后神经元自噬相关蛋白的变化
常温组,原代神经元OGD 3 h/R 6 h、12 h后,western-blot检测相关蛋白表达,结果显示:Sirt1、P-Foxo1、Rab7、Beclin1 和 LC3b/LC3a蛋白表达随着时间延长逐渐减少,12 h更明显,与6 h相比,P<0.05;而p53蛋白表达明显增加,P<0.05,见图3。相对于常温组,OGD 3 h/R 12 h,亚低温组Sirt1,P-Foxo1,Rab7,Beclin1蛋白表达及LC3b/LC3a比值均高于常温组,P<0.05;而p53蛋白表达低于常温组,P<0.05,见图4。
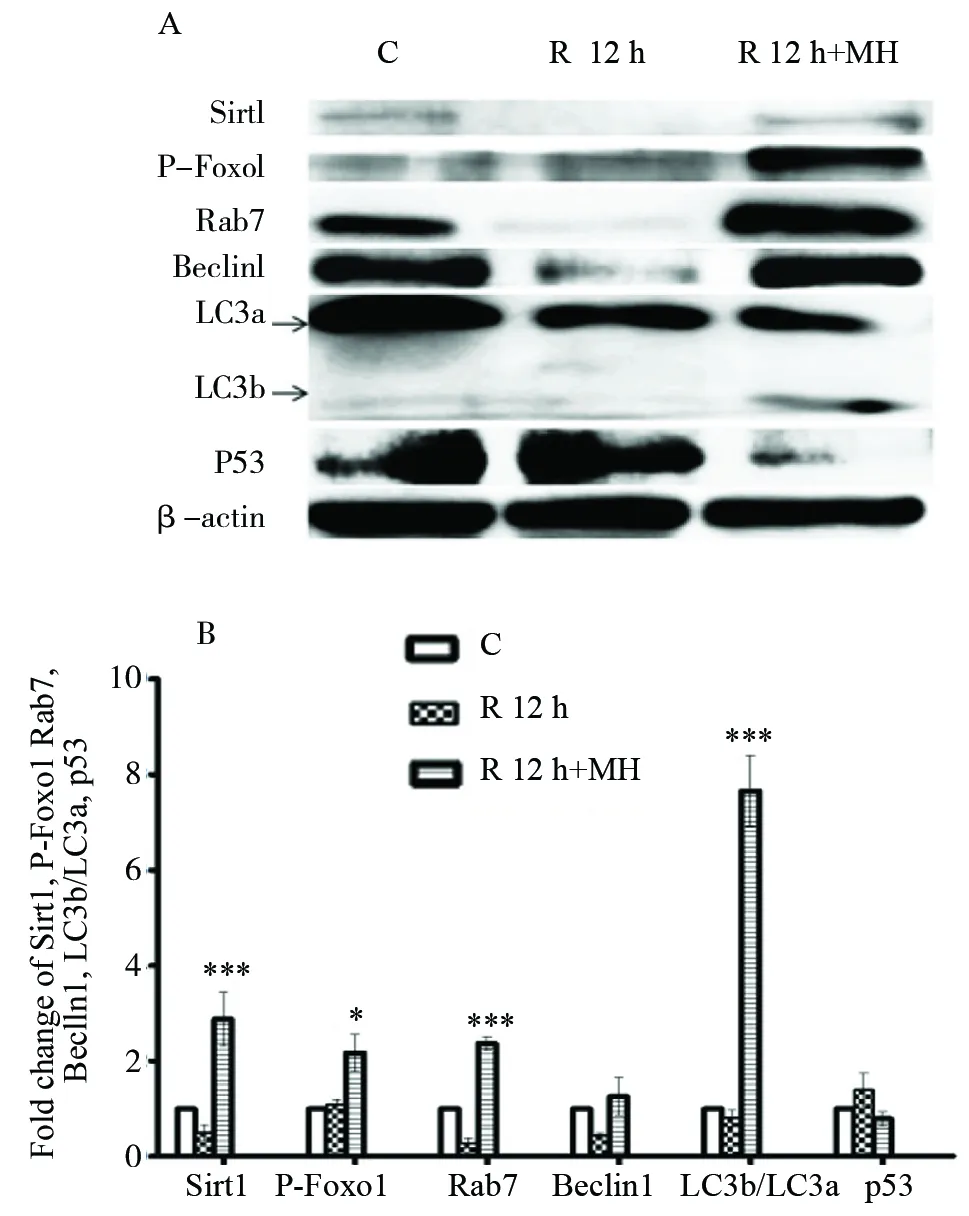
图4 亚低温对神经元自噬相关蛋白表达的影响(n=3)Fig.4 The effect of mild hypothermia on expression of autophagy related proteinn=3, * P<0.05 vs R 12 h, *** P<0.001 vs R 12 h.C=control;R 12 h=OGD 3 h/R 12 h;R 12 h+MH=OGD 3 h/(R 12 h+MH intervention)
2.4 TUNEL 检测 OGD/R 后神经元凋亡的影响
Control组、OGD 3 h常温组、R 6 h常温组、R 6 h亚低温组,神经元凋亡率分别10.2%±3.6%、56.8%±7.6%、20%±6.7%,可见,OGD/R后神经元凋亡明显增加,亚低温干预组神经元凋亡减少,P<0.05,见图5。
2.5 共聚焦显微镜观察神经元细胞自噬流的变化
mRFP-GFP-LC3双标腺病毒转染神经元细胞24、 48、72 h后,分别在荧光显微镜下观察GFP荧光。转染24 h后,在MOI值为0的空白对照组无绿色荧光,在MOI值为50、100、200、400时,可见绿色荧光,随着MOI值增加,绿色荧光强度增大。
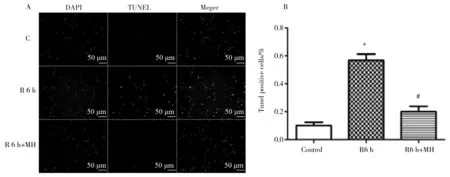
图5 OGD/R 后神经元凋亡的情况(n=6)Fig.5 The neurons apoptosis after OGD/Rn=6,* P<0.05 vs Control, #P<0.05 vs R 6 h. Note:C=control;R 6 h=OGD 3 h/R 6 h;R 6 h+MH=OGD 3 h/(R 6 h+MH intervention)
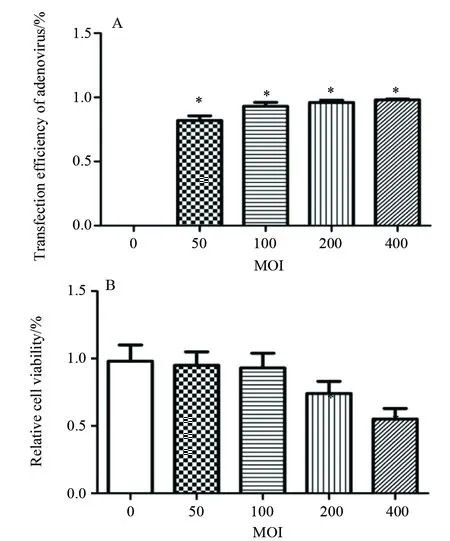
图6 腺病毒转染率及对神经元存活率的影响(n=6)Fig.6 A The transfecton efficiency of adenovirus.B The neurons viability exposed to different MOI of adenovirus by CCK8 assay Mean±SD, n=6. * P<0.05 vs Control (MOI=0)
转染72 h后,转染率分别为0、82%±6.2%、93%±5.4%、96%±3.2%、98%±1.2%,随着MOI值的增加,转染率逐渐升高,与对照组相比,差异均有统计学意义,P<0.05,见图6A。CCK8检测转染腺病毒后对原代神经元细胞存活率的影响,结果显示 MOI 值为0、50、100、200、400时,细胞存活率分别为98%±1.2%、95%±3.5%、94%±5.4%、78%±6.4%、74%±5.6%,MOI 为200和400时,细胞存活率明显下降,与对照组相比,差异有统计学意义,P<0.05,见图6 B;结合不同MOI值腺病毒转染率及对神经元细胞存活率的影响,我们选用MOI 值为100进行RFP -GFP-LC3自噬双标腺病毒转染原代神经元,观察自噬流变化。
mRFP-GFP-LC3 自噬双标腺病毒转染原代神经元细胞,与Control组相比,OGD/R后自噬溶酶体减少,而自噬小体增加,P<0.05,说明OGD/R后自噬下游受阻,自噬不足;而与OGD常温组相比,OGD后亚低温组自噬小体减少,自噬溶酶体增加,P<0.05,说明亚低温组自噬增多,见图7。
3 讨 论
自噬(autophagy)是由Ashford和 Porter 在1962年发现的细胞内 “自己吃自己(self eating)”的现象。自噬是细胞对营养底物缺乏时的一种适应性反应,在缺血/再灌注等各种因素刺激下,细胞提高自噬水平来提高对缺血缺氧的耐受性,对细胞起到一定的保护作用[6]。能量缺乏时调控自噬的主要信号通路有:①腺苷酸活化蛋白激酶(AMP- activated protein kinase,AMPK)- unc-51 like kinase (ULK1)- mTOR通路[7];②沉默信息转录调节因子1 (silent information regulator of transcription 1,Sirt1) -叉头转录因子(forkhead transcription factor,Foxox)通路[8],两条通路之间存在着交叉网络联系[9]。SIRTs 是一组组蛋白去乙酰化酶,是哺乳动物酵母 Sir2 (silent information regulator) 的同源类似物,共有7个成员,Sirt1-7。Sirt1是其中的重要一员,是细胞内重要的能量感受器,Sirt1 大量存在于神经系统,具有重要的神经保护作用,其保护机制的研究集中于Sirt1 脱乙酰化p53抑制神经元的凋亡,或者脱乙酰化叉头转录因子(forkhead transcription factor 1,Foxo1),从而保护神经元[10]。Rab7有囊泡特异性定位的功能。Beclin1能诱导自噬相关蛋白在自噬体膜上定位。LC3是自噬标记蛋白,LC3b/LC3a比值越高,意味着自噬水平越高。可见,自噬和凋亡之间以及其调控的信号通路之间存在交叉网络联系[11]。
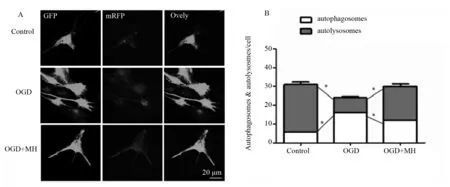
图7 mRFP -GFP-LC3 双标腺病毒转染观察神经元自噬情况(n=6)Fig.7 The autophagy after transfecton of mRFP -GFP-LC3 adenovirusn=6; * P<0.05 vs indicated group; Yellow dots represent autophagosomes; red dots represent autolysosomes;OGD=OGD 3 h/R 12 h;OGD+MH = OGD 3 h/(R 12 h+MH intervention)
我们的实验结果显示神经元OGD 3 h,复氧6 h和12 h后,Sirt1、P-Foxo1、Rab7、Beclin1、LC3b/LC3a蛋白表达随着时间延长逐渐减少,12 h更明显,而p53蛋白表达明显增加,P<0.05;TUNEL 结果显示,OGD后神经元凋亡明显增加,可见,氧糖剥夺模型诱导神经元自噬不足,凋亡增加,与我们既往的体内结果一致[12],在成年雄性 Wistar大鼠室颤(ventricular fibrillation,VF)诱发的全脑缺血缺氧模型中,自主循环恢复(return of spontaneous circulation,ROSC)后2~4 h大脑Beclin-1、LC3b/LC3a表达下降。文献报道,自噬可能是脑缺血预处理发挥保护作用的机制之一。在成年大鼠短暂性大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)前进行高压氧预处理[13]以及在永久性MCAO前进行短暂性缺血预处理[14],可使缺血后LC3水平升高和自噬体数量增加,或使缺血缺氧后自噬持续时间延长,起到脑保护作用;给予自噬抑制剂3-MA可抑制缺血预处理诱导的自噬及保护作用,而给予自噬诱导剂雷帕霉素可以增加预处理的保护作用。同样,体外实验也证明,预先短暂的非致死性氧-葡萄糖剥夺(OGD)可通过诱导自噬以减轻之后致死性OGD导致的神经元细胞损伤[15]。
我们的实验发现亚低温干预可以增加Sirt1、P-Foxo1、Rab7、Beclin1、LC3b/LC3a表达,减少p53表达。应用mRFP-GFP-LC3自噬双标腺病毒转染原代神经元细胞,发现 OGD/R 后自噬溶酶体减少,自噬小体增加,说明OGD/R后自噬下游受阻,自噬不足;而亚低温组自噬小体减少,自噬溶酶体增加,可见亚低温可以促进自噬,同时结果显示亚低温可以减少神经元凋亡,因此我们推测,亚低温干预可能通过促进神经元自噬而减少凋亡。这也许是亚低温保护神经元的作用机制之一。亚低温到底是如何调控自噬的呢?机体处于亚低温时,可以降低糖、脂肪的代谢速率,使细胞内ATP水平适度降低,进而激活AMPK,启动级联反应,激活Sirt1,进而促进自噬,清除受损细胞器,为其他细胞提供能量;同时AMPK激活可以促进葡萄糖生成,减少糖原合成,促进葡萄糖转运,增加脂肪酸氧化产生能量[16-17]。
综上所述,原代神经元细胞氧糖剥夺/复氧后,神经元自噬明显减少,凋亡增加;亚低温干预可以上调Sirt1的活性,增加Foxo1、Rab7和自噬相关蛋白 Atg6(beclin1)、Atg8(LC3b/LC3a)的表达,另一方面可能去乙酰化p53,即抑制p53,促进神经元自噬,减少凋亡,共同保护神经元,为缺氧后神经元损伤提供新的治疗靶点及开拓新的方向,为亚低温发挥脑保护作用提供有力的理论依据。
[1] ARRICH J, HOLZER M, HAVEL C, et al. Hypothermia for neuroprotection in adults after cardiopulmonary resuscitation[J]. Cochrane Database of Systematic Reviews, 2016, 2:1-52.
[2] CARLONI S, GIRELLI S, SCOPA C, et al.Activation of autophagy and Akt/CREB signaling play an equivalent role in the neuroprotective effect of rapamycin in neonatal hypoxia-ischemia[J].Autophagy, 2010, 6(3): 366 -377.
[3] 曾小云,熊海霞,李欣,等. 激活自噬减轻心肺复苏后Wistar大鼠脑损伤[J].中华急诊医学杂志, 2012, 12(22): 1327-1332.
ZENG Xiaoyun, XIONG Haixia, LI Xin, et al. Activation of autophagy improves neuron injury after the restoration of spontaneous circulation from ventricular fibrill[J]. Chinese Journal of Emergency Medicine, 2012, 12(22): 1327-1332.
[4] 王西富,魏红艳,尹美娴,等. 亚低温对氧糖剥夺神经元细胞自噬的影响 [J]. 岭南急诊医学杂志, 2016, 21(4): 352-353.
WANG Xifu, WEI Hongyan, YIN Meixian, et al. The impact of therapeutic hypothermia on neurons autophagy after oxygen and glucose deprivation injury[J].Lingnan Journal of Emergency Medicine, 2016, 21(4): 352-353.
[5] 张祥云. 亚低温通过Nrf2/Keap1/ARE通路减轻海马神经元细胞损伤的研究[D].广州:广东药科大学,2015.
ZHANG Xiangyun. The research of mild hypothermia reduce hippocampus neurons injury by Nrf2 / Keap1 / ARE pathways[D].Guangzhou:Guangdong Pharmaceutical University, 2015.
[6] ZHANG Wenliang, ZHANG Mingming, LIU Bin, et al. Optimal timing of autophagy occurrence induced by earle’s balanced salts solution in DLD-1, HCT-116, A2780, CHO, Hep G2 and SMMC7721 cancer cell lines[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016, 55(4):108-117.
[7] SALMINEN A, KAARNIRANTA K. AMP-activated protein kinase (AMPK) controls the aging process via an integrated signaling network[J]. Ageing Research Reviews, 2012, 11(2): 230-241.
[8] SALMINEN A, KAARNIRANTA K. SIRT1: regulation of longevity via autophagy[J]. Cellular Signalling, 2009, 21(9): 1356-1360.
[9] KIM J, KUNDU M, VIOLLET B, et al. AMPK and m TOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nature Cell Biology, 2011, 13(2): 132-141.
[10] ZHANG Feng, WANG Suping, GAN Li, et al. Protective effects and mechanisms of Sirtuins in the nervous system[J]. Progress Neurobiology, 2011, 95(3): 373-395.
[11] RUBINSTEIN A D, KIMCHI A. Life in the balance-a mechanistic view of the crosstalk between autophagy and apoptosis[J]. Journal of Cell Science, 2012, 125 (22):5259-5268.
[12] 魏红艳,李恒杰,李芳,等. 硫化氢通过抑制自噬减轻心脏停搏后脑损伤[J]. 中国病理生理杂志, 2016, 32(2):284-289.
WEI Hongyan, LI Hengjie, LI Fang, et al. Neuroprotective effect of H2S by inhibiting autophagy after restoration of spontaneous circulation in rats with cardiac arrest[J]. Chinese Journal of Pathophysiology, 2016, 32(2):284-289.
[13] YAN Wenjun, ZHANG Haopeng, BAI Xiaoguang, et al. Autophagy activation is involved in neuroprotection induced by hyperbaric oxygen preconditioning against focal cerebral ischemia in rats[J]. Brain Research, 2011, 1402: 109-121.
[14] SHENG Rui, ZHANG Lisha, HAN Rong, et al. Autophagy activation is associated with neuroprotection in a rat model of focal cerebral ischemic preconditioning[J].Autophagy, 2010, 6(4): 482-494.
[15] PARK H K, CHU K, JUNG K H, et al.Autophagy is involved in the ischemic preconditioning[J]. Neuroscience Letters, 2009, 45l(1):16-19.
[16] NOLAN J P, SOAR J, WENZEL V, et al. Cardiopulmonary resuscitation and management of cardiac arrest[J]. Nature Reviews Cardiology, 2012, 9(9): 499-511.
[17] PADRISSA-ALTÉS S, ZAOUALM A, ROSELLÖ-CATAFAU J. AMP-activated protein kinase as a target for preconditioning in transplantation medicine[J].Transplantation, 2010, 90(11): 1241-1242.
MildhypothermiareducesneuronsapoptosisafterOGDbyup-regulatingSirt1
YINMeixian1,2,3,HUChunlin2,WEIHongyan2,LIAOXiaoxing2,LIHengjie2,YANGYan2,LIHui2,JINGXiaoli2,LIHaoming1
(1. School of Life Science and Biopharmacology, Guangdong Parmaceutical University, Guangzhou 510006, China;2. Department of Emergency Medicine, the First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China;3. Key Laboratory of Assisted Circulation, Ministry of Health, Guangzhou 510080, China)
To investigate the primary neurons autophagy and apoptosis after Oxygen Glucose Deprivation/Re-oxygenation (OGD/R), and to explore the effect of mild hypothermia on autophagy and apoptosis, following methods were used: Primary neurons culture and OGD/R model was established; the neurons were divided into the normal temperature group (37 ℃) and the mild hypothermia group (MH, 34 ℃); The cells viability were measured by CCK8; cell apoptosis were measured by TUNEL; The protein expressions of Sirt1, Foxo1, p53, Rab7 and autophagy related genes such as Beclin1, LC3 were detected by western blot at each time point; The neurons autophagy flows were detected through transfection of adenovirus mRFP-GFP-LC3. The primary neuron cultures were successfully developed, and the OGD/R models were established; Western-blot showed that the expressions of Sirt1, P-Foxo1, Rab7, Beclin1 and LC3b/LC3a were gradually reduced, especially at 12 h after OGD/R,P<0.05; However, the expression of p53 was increased,P<0.05; In MH group, the expressions of Sirt1, P-Foxo1, Rab7, Beclin1, LC3b/LC3a were obviously higher than those in NT group,P<0.05; And the expression of p53 was obviously lower than that in NT group,P<0.05; in R6 h+MH group, the rate of neuron cells apoptosis were 20%±6.7%, lower than 56.8%±7.6% in R6 h+NT group,P<0.05; mRFP-GFP-LC3 adenovirus was transfected into primary neurons, the autophagy flow was detected by fluorescence microscopy. Compared with control group, the autolysosomes were reduced, but autophagosomes were increased after OGD/R,P<0.05; however, compared with NT group, the autophagosomes were reduced and the autolysosomes were increased in MH group,P<0.05. In conclusion, mild hypothermia therapy could increase the expression of Sirt1, Foxo1, beclin1 and LC3b/LC3a, but decrease the expression of p53, so as to promote autophagy and reduce apoptosis.
mild hypothermia; Sirt1; neurons
10.13471/j.cnki.acta.snus.2017.06.021
2017-01-05
国家自然科学基金(81372021,81571867);第四批中山一院青年人才项目(Y50152)
尹美娴(1993年生),女;研究方向微生物药学和基础医学;E-mail:1574195935@qq.com
李浩明(1962年生),男;研究方向微生物药学;E-mail:lihaoming@aliyun.com
R329.21
A
0529-6579(2017)06-0134-07

