适用免疫组化的突触素与嗜铬素A单克隆抗体的制备与临床初步评价①
闫 敏 宋军营 曾华辉 袁 永 张钟允 翟晋豫 张振强 刘文弟
(河南中医药大学中医药免疫学实验室,郑州 450046)
·免疫学技术与方法·
适用免疫组化的突触素与嗜铬素A单克隆抗体的制备与临床初步评价①
闫 敏 宋军营 曾华辉 袁 永 张钟允 翟晋豫②张振强 刘文弟
(河南中医药大学中医药免疫学实验室,郑州 450046)
目的制备突触素与嗜铬素A免疫组化单克隆抗体,期望可初步应用于临床。方法设计Syn与CgA融合基因,并构建至表达载体上表达获得融合蛋白。经过抗原免疫、细胞融合后筛选获得目标抗体。通过临床样本对比验证,研究Syn和CgA两者的特异性,评价相关系数。结果通过筛选,共获得2株分别针对Syn与CgA的抗体3D9和4A12。通过对比抗体试剂共同验证19种蜡块组织,统计结果分析,结果符合性较好,相关系数分别达到r=0.989 2与r=0.993 9。结论该方法成功制备获得了可初步适用于免疫组化的突触素与嗜铬素A抗体,该方法可为免疫学抗体研究提供一定的借鉴意义。
突触素;嗜铬素A;单克隆抗体;免疫组化
突触素(Synaptophysin,Syn)是由突触囊泡膜上分泌的一类膜蛋白。可承担神经递质传递功能,在神经元间信息传递过程当中起着重要作用[1]。突触素由307个氨基酸组成,分子量38 kD,存在有四个跨膜区。目前突触素免疫组化检测经常在神经内分泌肿瘤的诊断过程中应用较多。实际临床诊断过程中,神经元特异性烯醇化酶(Neuronspecific enolase,NSE)与嗜铬素A(Chromogranin A,CgA)常常一起作为联合分析指标,指导分析神经内分泌肿瘤的发生发展时期,并做出合理的判断与指导[2,3]。嗜铬素A是一种酸性蛋白,主要储存在肾上腺髓质和多种神经内分泌细胞的致密核心颗粒中。CgA与Syn是应用在神经内分泌标记物中使用频率最高的标记物[4]。这些单克隆抗体在实际的应用过程中有着重要的临床意义。本实验以开发具有临床检测意义的CgA与Syn单克隆抗体为目的,同时进行初步临床评价这些抗体效果,探索该方法的应用价值。
1 材料与方法
1.1材料 嗜铬细胞瘤、神经母细胞瘤等组织蜡块取自郑州大学附属河南省肿瘤医院病理科;6~8周龄BALB/c小鼠购自河南省动物实验中心;DH5α菌、BL-21菌为本实验室保存;SP2/0细胞株为本实验室保存;基因合成服务选择南京金斯瑞生物;NdeⅠ、XhoⅠ内切酶购自TaKaRa;无缝克隆试剂盒购自Novoprotein公司;弗氏完全佐剂与不完全佐剂购自Sigma公司;细胞融合用血清(FBS)、RPMI1640购自Gibco公司;免疫组化DAB套装试剂盒购自福建迈新生物;对照CgA、Syn抗体试剂工作液选择Leica试剂,由河南省肿瘤医院病理科惠赠;其他化学试剂为分析纯。
1.2方法
1.2.1抗原设计与制备 查阅Uniprot数据信息,选择Syn蛋白的胞内保守区,氨基酸序列:aa 224~300,CgA蛋白选择中段氨基酸序列,氨基酸序列:aa 200~338。将二者基因进行融合构建,经过基因直接合成,同时设计整段基因序列的上下游引物。上游引物:GTGCCGCGCGGCAGCCATATGGGGGACAGTGAGGGC;下游引物:GTGGTGGTGGTGGTGCTCGAGGTAGCCTTGCTGCCCATAGTCG。
1.2.2基因构建与蛋白表达 目的条带经过PCR扩增后切胶回收,同时pET-28a载体经过NdeⅠ和XhoⅠ双酶切,核酸电泳后切胶回收,将二者按照无缝克隆试剂盒说明书要求比例进行混合后无缝克隆,涂板,第二日挑单克隆测序并转入表达宿主菌BL-21。测序正确后经过IPTG诱导,蛋白纯化仪纯化,咪唑洗脱目的蛋白后超滤浓缩并除去咪唑,利用BCA法测定蛋白浓度。
1.2.3融合蛋白免疫与效价检测 将融合蛋白按照100 μg/只小鼠的剂量进行免疫,首次免疫将其与弗氏完全佐剂冰上乳化,第二次、第三次免疫同样按照100 μg/只剂量进行乳化后免疫。三次免疫之间时间间隔为2周,免疫方式均为腹腔内注射免疫。第三次免疫后2周进行小鼠尾血效价检测,采集尾血离心取上清后按照1∶1 000开始等体积梯度进行稀释,融合蛋白包被浓度为100 ng/孔。ELISA间接法检测,以阴性血清为对照,统计结果分析免疫效果。
1.2.4细胞融合与抗体筛选 融合前3 d,小鼠尾静脉冲击抗原50 μg,同时复苏SP2/0细胞株,调整细胞生长状态,待融合前达到1×107~2×107细胞量。融合时,收集脾脏进行研磨,将脾脏细胞进行过滤并计数、与SP2/0细胞株按照1∶(5~10)的比例混合,离心后PEG作用1 min,1640培养液终止,再利用含HAT的20%FBS、80%RPMI1640培养液进行铺96孔板,每孔250 μl培养液,铺板密度为1×105个/孔。培养第11天全换液,第12天进行ELISA检测,待上清培养一定时间后,将阳性细胞上清经过免疫组化评价,筛选初步适用于免疫组化的分泌抗体细胞株。
1.2.5临床初步评价抗体 利用从医院获得的19个不同蜡块或切片(神经母细胞瘤、神经节细胞瘤、结肠腺癌肿瘤细胞、肝脏、胰十二指肠等),与对照试剂相比,评价通过腹水制备纯化获得的自制CgA与Syn单克隆抗体特异性、两者交叉性及与对照试剂的符合系数,结果使用组织学评分法(Histological score,H-score)进行评分统计,强度表达按阳性细胞着色强度由弱至强分别记分,细胞膜无黄色颗粒样沉淀为0分、淡黄色为1分、棕黄色为2分、深棕黄色为3分;显微镜下统计完整细胞总数及阳性细胞数。具体公式:H-score=强度×阳性细胞/视野网格下细胞总数×100%。
1.3统计学方法 对照组与自产抗体组针对相同样本的IHC结果利用t检验进行分析,结果通过H-score进行评分统计,统计后利用SPSS分析软件分析评估,进而评估该方法在临床诊断抗体制备过程中的价值。
2 结果
2.1融合基因PCR结果与克隆后PCR鉴定 合成获得的融合基因,经过PCR扩增后,得到的目的条带如图1A所示,再经过无缝克隆重组连接后,经PCR鉴定结果如图1B所示。结果显示目的基因与pET-28a质粒载体重组成功。
2.2蛋白纯化结果与小鼠免疫效价分析 蛋白诱导表达后进行镍柱纯化,纯化结果如图2所示。
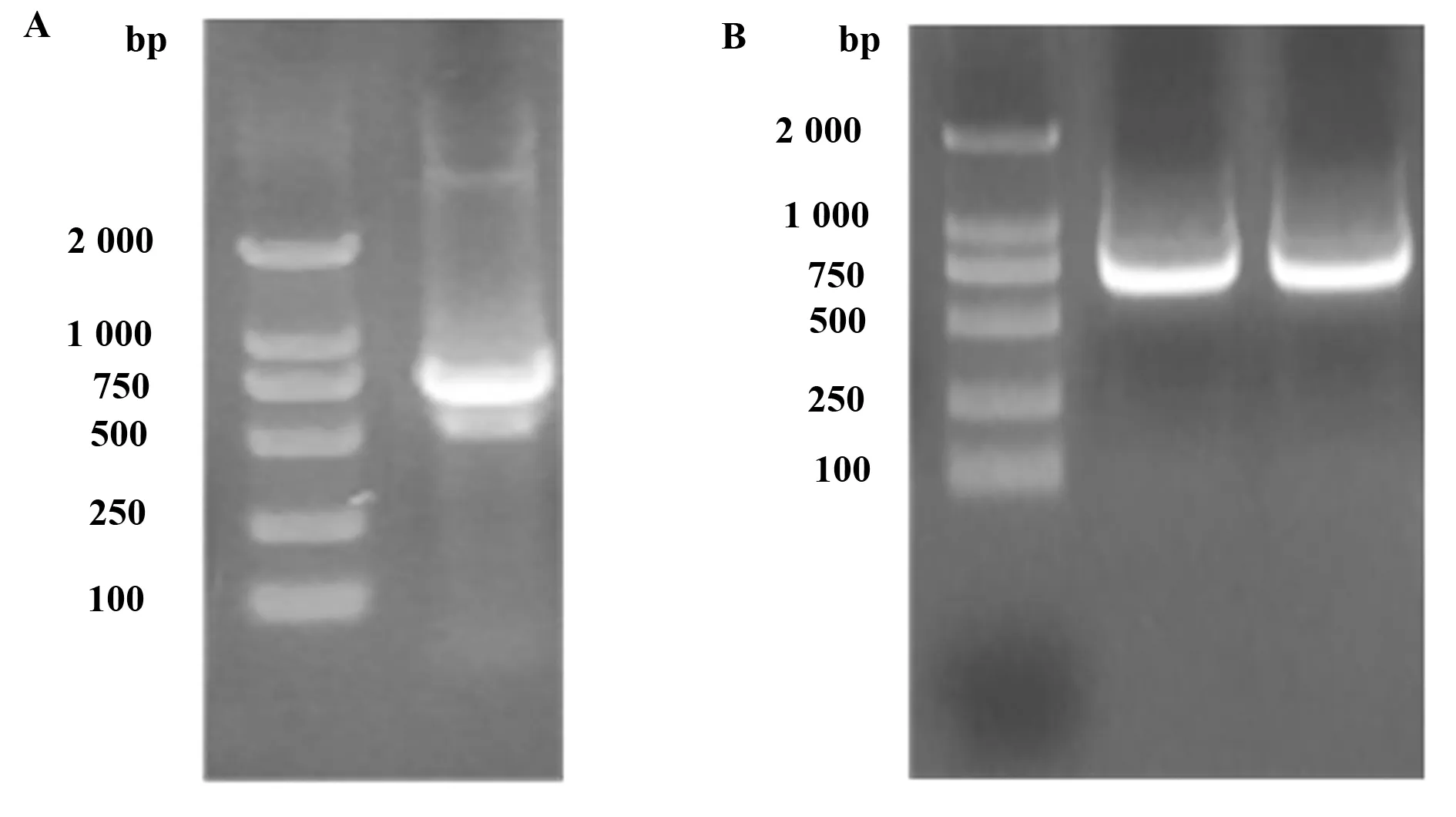
图1 融合基因PCR检测与克隆鉴定结果Fig.1 Electrophoresis of PCR product geneNote: A.The PCR amplification results of fusion gene;B.The PCR identification results of fusion gene construction.
表1小鼠尾血效价检测结果
Tab.1Resultsofimmunizingpotency
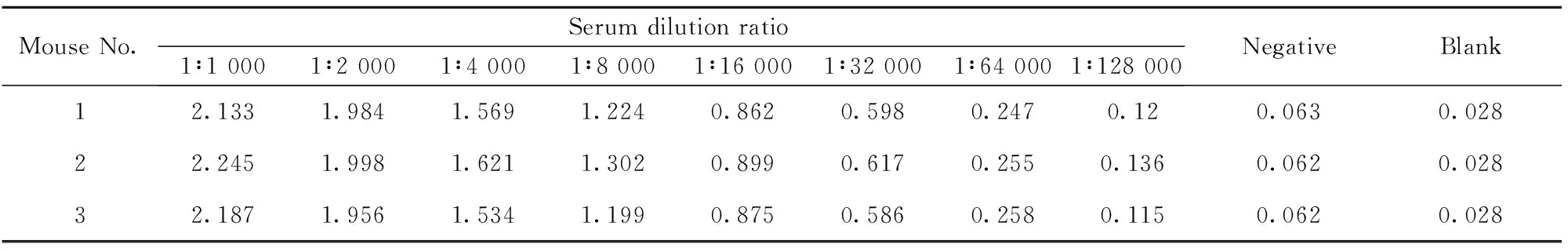
MouseNo.Serumdilutionratio1∶10001∶20001∶40001∶80001∶160001∶320001∶640001∶128000NegativeBlank12.1331.9841.5691.2240.8620.5980.2470.120.0630.02822.2451.9981.6211.3020.8990.6170.2550.1360.0620.02832.1871.9561.5341.1990.8750.5860.2580.1150.0620.028

图2 蛋白纯化结果Fig.2 Purification results of recombinant proteinNote: 1.Supernatant of lysate;2.Precipitation of lysate;3.Flow through;4.Elution by 50 mmol/L imidazole;5.Elution by 200 mmol/L imidazole.
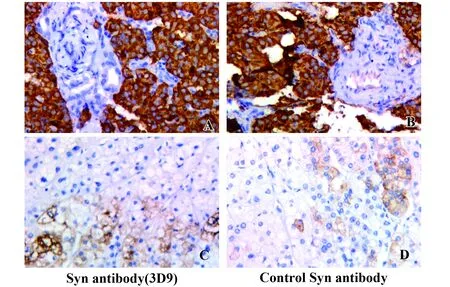
图3 突触素自制抗体与对照试剂IHC初步对比验证结果(×400)Fig.3 Comparison between 3D9(Syn)mAb and Leica mAb in IHC detection(×400)Note: A,B.Neuroendocrine carcinoma;C,D.Liver.
通过将该抗原进行免疫,免疫结果显示,蛋白条带大小符合预期,免疫效果达到可融合要求(见表1)。
2.3初步经ELISA方法与免疫组化筛选获得细胞株 经过融合后ELISA筛选与免疫组化实验验证,获得较好的细胞株为3D9(Syn)与4A12(CgA),免疫组化验证选择Leica对照试剂。部分图片如图3(Syn)、图4(CgA)所示,结果与对照试剂基本符合。

图4 CgA自制抗体与对照试剂IHC初步对比验证结果(×400)Fig.4 Comparison between 4A12(CgA)mAb and Leica mAb in IHC detection(×400)Note: A,B.Bowel adenocarcinoma tumor;C,D.Pancreatic duodenum.
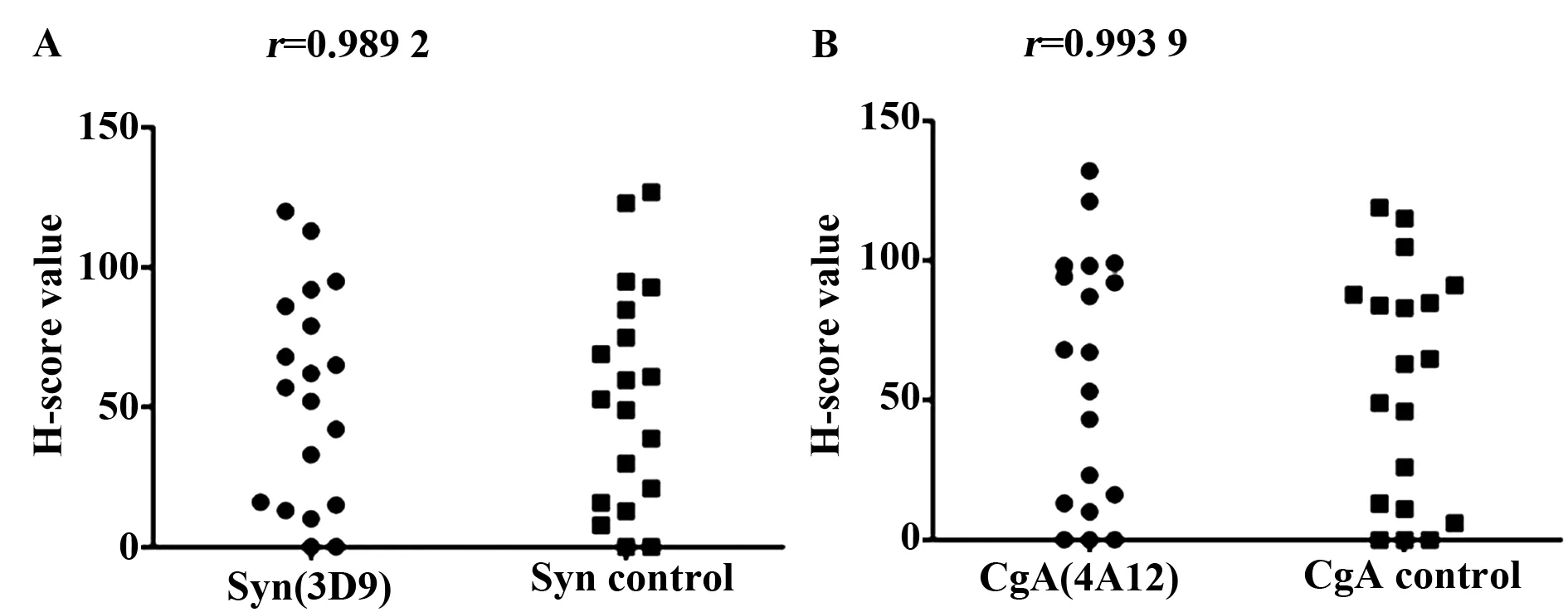
图5 两种抗体临床评价对比结果Fig.5 Contrast results of clinical evaluationNote: A.The Score statistics of Syn antibody (3D9) and control reagent;B.The Score statistics of CgA antibody (4A12) and control reagent.
2.4临床评价结果 通过医院获取的19种不同样本,经过免疫组化对照试验,结果通过H-score进行评分统计自制抗体与对照抗体之间相关系数r,结果显示Syn与对比试剂相关系数r=0.989 2,CgA与对比试剂相关系数r=0.993 9(见图5),该制备抗体临床评价结果达到了较好的效果。
3 讨论
Syn与CgA是临床评价肿瘤的两类重要指标,在对胃肠胰腺神经内分泌肿瘤[5]、小细胞肺癌[6]、髓质病变[7]、原发食管小细胞癌[8]等的诊断及预后均具有重要的指导作用。WHO国际肿瘤组织学中明确指出:CgA阳性表达、Syn阳性表达、电镜直接观察到有神经内分泌颗粒,这三类只要有一项满足,即可认定肿瘤细胞存在神经内分泌分化。Syn与CgA作为神经内分泌肿瘤标记物,在实际的临床诊断过程当中,往往是被作为神经内分泌肿瘤分析的必选方案[9]。Nordi在对Syn的质评方面更是开展了6次评比验证(http://www.nordiqc.org/),足以见到其的重要性。因此Syn与CgA的免疫组化抗体制备具有重要的意义。
本实验抗原设计过程中,通过分析Syn与CgA的保守区序列,为了提高免疫组化抗体制备的成功率,将两者组成融合蛋白后,解决了单独Syn与CgA蛋白分子量较小,免疫原性弱可能带给免疫效果的不良影响,而且一次融合可以制备出两种抗体,具有较高的实用价值。经免疫、效价评定、细胞融合后进行筛选并制备纯化得到该抗体。后期从医院选择的19种肿瘤组织,对比Leica抗体,在评价的过程当中,两者识别位点专一,特异性较强,两者之间不存在特异性交叉现象,19种肿瘤组织分别与对照免疫组化统计相关系数r=0.989 2(Syn)和r=0.993 9(CgA)。
抗原免疫是决定整个抗体制备的关键,抗原的选择与制备方法非常重要。本研究利用复合抗原验证并成功制备出两株分别针对Syn和CgA的抗体,并初步评价可初步应用于免疫组化。3个氨基酸区段及以上复合构建的抗原能否应用,值得尝试。同时,Syn与CgA在目前国内市场中,包括迈新与中杉等大型免疫组化抗体供应商,皆无该自制抗体,目前市场应用主要还是依赖进口分装,因此,本篇文章获得两种免疫组化细胞株不仅有方法学的意义,同时也有着较高的市场价值。
[1] Gordon SL,Harper CB,Smillie KJ,etal.A fine balance of synaptophysin levels underlies efficient retrieval of synaptobrevin II to synaptic vesicles[J].PLoS One,2016,11(2):e0149457.
[2] Annaratone L,Medico E,Rangel N,etal.Search for neuro-endocrine markers (chromogranin A,synaptophysin and VGF) in breast cancers.an integrated approach using immunohistochemistry and gene expression profiling[J].Endocr Pathol,2014,25(3):219-228.
[3] 马志红,沈琦斌,费淑祎,等.CEA、CA125、CYFRA21-1、NSE联合检测肺癌的临床价值[J].中国免疫学杂志,2013,29(11):1174-1176.
[4] Wachter DL,Hartmann A,Beckmann MW,etal.Expression of neuroendocrine markers in different molecular subtypes of breast carcinoma[J].Bio Med Res Int,2014,2014:408459.
[5] 叶必星,林 琳.嗜铬素A和突触素对胃肠胰腺神经内分泌肿瘤诊断及预后的临床价值[J].中华消化杂志,2012,32(1):29-32.
[6] Kayser G,Csanadi A,Otto C,etal.Simultaneous multi-antibody staining in non-small cell lung cancer strengthens diagnostic accuracy especially in small tissue samples[J].PLoS One,2013,8(2):e56333.
[7] Mula-Abed W-AS,Ahmed R,Ramadhan FA,etal.A rare case of adrenal pheochromocytoma with unusual clinical and biochemical presentation:a case report and literature review[J].Oman Med J,2015,30(5):382-390.
[8] Funahashi H,Miyai H,Wakasugi T,etal.Successful combination chemotherapy with irinotecan hydrochloride and cisplatin for primary gastric small cell carcinoma:report of a case[J].World J Surg Oncol,2013,11:263.
[9] 宋佳乐,李丕鹏.胸腺神经内分泌功能与衰老[J].中国免疫学杂志,2011,27(3):274-276.
PreparationandclinicalevaluationofsynaptophysinandchromograninAmonoclonalantibodiesagainstimmunohistochemistry
YANMin,SONGJun-Ying,ZENGHua-Hui,YUANYong,ZHANGZhong-Yun,ZHAIJin-Yu,ZHANGZhen-Qiang,LIUWen-Di.
ChineseMedicineImmunologyLaboratory,HenanUniversityofChineseMedicine,Zhengzhou450046,China
Objective:To prepare the synaptophysin and chromogranin A monoclonal antibodies with clinical evalua-tion.MethodsThe fuse gene (Syn and CgA) was designed and it was constructed on the expression vector pET-28a.Then ,the fusion protein was purified.After protein immunization,cell fusion and screening,the target antibodies were selected.Specificity study and correlation coefficient of Syn and CgA was evaluated by clinical sample comparison validation.ResultsBy screening,two antibodies 3D9 and 4A12,respectively,for Syn and CgA,were obtained.19 kinds of wax block organization were detected by 3D9,4A12 and control antibody(Leica).The statistical results were analyzed,the results were in good agreement,and the correlation coefficients werer=0.9892 andr=0.993 9,respectively.ConclusionThis method is prepared to obtain the synaptophysin and chromogranin A antibodies successfully and both can be used for immunohistochemistry.This method can also provide some reference for the study of antibody.
Synaptophysin ;Chromogranin A;Monoclonal antibody ;Immunohistochemistry
10.3969/j.issn.1000-484X.2017.12.015
R392.3
A
1000-484X(2017)12-1828-04
①本文为2015年度河南省科技创新人才计划(154100510019)、河南省基本科研业务费(2014KYYWF-ZZCX3-06,2014KYYWF-ZZCX3-04)、2014年度河南中医学院创新团队(2014XCXTD01)和河南省高校科技创新人才支持计划(13HASTIT027)。
②河南省肿瘤病理诊断试剂工程技术研究中心,郑州 450001。
闫 敏(1985年-),女,硕士,助理实验师,主要从事免疫学研究,E-mail:yanmin85@126.com。
及指导教师:张振强(1971年-),男,博士,教授,主要从事中医药与免疫性疾病研究,E-mail:zhang_zhenqiang@126.com。
[收稿2017-07-04 修回2017-07-17]
(编辑 倪 鹏)