Lactobacillus casei Zhang 对扑热息痛诱导的小鼠急性肝损伤的保护作用①
张晓慧 颜 妍 赵世敏 王昕旭 刘春妍 谢基明 王玉珍 武春燕
(内蒙古农业大学生命科学学院,呼和浩特 010018)
·基础免疫学·
LactobacilluscaseiZhang对扑热息痛诱导的小鼠急性肝损伤的保护作用①
张晓慧 颜 妍 赵世敏 王昕旭 刘春妍 谢基明②王玉珍 武春燕
(内蒙古农业大学生命科学学院,呼和浩特 010018)
目的研究益生菌Lactobacillus casei Zhang(Lcz)对扑热息痛(APAP)所致小鼠急性肝损伤的保护作用及其机制。方法C57BL/6小鼠被随机分为空白组(Ctrl)、APAP诱导急性肝损伤模型组(Acetaminophen ,APAP)、阳性药物组(N-Acetylcysteine,NAC)、Lcz预防组(Lcz/APAP)和Lcz对照组(Lcz)。Lcz(1×109CFU/ml)连续灌胃30 d后,NAC组在APAP处理前1 h腹腔注射NAC(150 mg/kg)。APAP、NAC以及Lcz/APAP组均腹腔注射APAP(300 mg/kg)。APAP作用18 h后,采集血液和收集肝脏组织,检测血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)的水平。通过Western blot检测肝脏组织中血红素氧化酶(HO-1)、超氧化物歧化酶2(SOD2)、Bcl-2以及TLR4的表达水平。结果Lcz能抑制APAP诱导的急性肝损伤血清中ALT和AST水平。Lcz提高了HO-1、SOD2和Bcl-2的蛋白表达水平,而降低了APAP诱导的TLR4的表达。结论益生菌Lcz对APAP诱导的小鼠急性肝损伤有保护作用,其保肝作用机制可能与其抗氧化和抗炎活性有关。
Lactobacillus casei Zhang;扑热息痛;超氧化物歧化酶2;血红素氧化酶;Bcl-2
肝损伤的发病机制复杂,有很多因素如氧化应激、细胞因子、病毒感染、酒精、药物、代谢性疾病等都可以导致肝损伤[1]。药物性肝损伤是由于长期或高剂量服用某种药物后因药物本身或其代谢产物直接或间接的毒副作用引起。人体对药物或其代谢产物产生的过敏反应也会诱导肝损伤[2,3]。
扑热息痛(Acetaminophen,APAP)诱导的肝损伤是药物性肝损伤中最常见的。APAP是一类解热镇痛药。长期或过量服用APAP会导致体内生成的毒性代谢产物不能及时排出而诱导急性肝损伤[4]。N-乙酰半胱氨酸(N-Acetylcysteine,NAC)是治疗APAP性肝损伤的标准疗法。其作用机制主要是通过提高细胞内的GSH的存储量来降低NAPQI引起的毒性[5]。在动物实验研究中,NAC经常作为阳性药物使用。但是NAC发挥作用的窗口期很短。益生菌是一类对宿主有益的活性微生物,不仅对肠道微生态环境有显著的调节作用,而且对肠道外疾病以及肝脏疾病的预防和治疗具有重要意义[6]。益生菌Lactobacillus casei Zhang(Lcz) 是内蒙古农业大学具有自主知识产权的益生菌,张和平课题组的研究表明,Lcz除了可以调节肠道菌群外还具有一定的抗氧化和抗炎作用[7,8]。
抗炎和抗氧化作用中首先研究的是TLR4、HO-1、SOD2等蛋白的表达水平。TLR4是天然免疫应答中与炎症反应相关的模式识别分子,它的激活能够使促炎性因子活化并诱导细胞因子的表达[9]。HO-1是一种应激反应蛋白,通过抗凋亡、抗氧化、抗炎性作用来调节细胞损伤,有研究表明HO-1在急性肝损伤中扮演着重要的角色[10]。SOD2是体内活性氧清除系统中重要的酶,在机体抗氧化途径中发挥作用。Bcl-2在细胞发生凋亡时能够调节线粒体膜的通透性,是保护细胞的抗凋亡基因[11]。
本实验通过检测TLR4、HO-1、SOD2、Bcl-2的蛋白表达水平来研究益生菌Lcz对扑热息痛诱导的小鼠急性肝损伤的保护作用,并为开发益生菌的临床应用奠定了基础。
1 材料与方法
1.1材料
1.1.1材料与试剂 益生菌Lactobacillus casei Zhang(Lcz)来自内蒙古农业大学“乳品生物技术与工程”教育部重点实验室。APAP和NAC均为Sigma公司的产品。
1.1.2实验动物 C57BL/6系雄性小鼠购于北京维通利华实验动物有限公司。5~8周龄,体重约为(20±2)g,共50只,分笼饲养。饲养条件:动物房保持通风、干燥、室温22~25℃,湿度(50±5)%,12 h/12 h白昼交替,自由饮水,标准饲养饲料。
1.2方法
1.2.1APAP 诱导小鼠肝损伤模型的建立 小鼠适应喂养1周后,随机分为5组:空白组(Ctrl)、APAP诱导的肝损伤模型组(Acetaminophen,APAP)、阳性药物组(N-Acetylcysteine,NAC)、Lcz治疗组(Lcz/APAP)和Lcz对照组, 每组10只。益生菌样品用生理盐水配制,连续灌胃给药30 d,空白组和模型组均给予相同体积的生理盐水。灌胃结束后,小鼠禁食不禁水24 h,阳性药物组在APAP处理前腹腔注射NAC(150 mg/kg),1 h后除空白组和Lcz对照组外,其他组均腹腔注射APAP(300 mg/kg)构建急性肝损伤模型。摘取眼球取血,收集血液,分离血清备用,并收集肝脏冻存。
1.2.2血清生化指标的检测 小鼠血清ALT和AST活性采用速率法以及全自动生化分析仪测定,在内蒙古自治区人民医院检验科完成。
1.2.3肝脏组织切片的制作 HE染色观察肝脏组织形态学变化:处死小鼠后,取出肝脏组织,置于10%的甲醛溶液中固定,在内蒙古农业大学兽医学院完成组织切片的制作。
1.2.4Western blot分析肝脏组织中HO-1、SOD2、Bcl-2以及TLR4的表达水平 SDS-PAGE电泳分离所提取的肝脏组织蛋白,经湿法转膜到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭2 h后孵育一抗过夜,TBST洗涤PVDF膜5次后加二抗,室温孵育90 min,再次洗膜5次,用Odyssye 红外激光扫描成像系统检测蛋白表达含量后进行分析。

2 结果
2.1Lcz对肝损伤小鼠血清中ALT和AST水平的影响 从图1中可以看出,与Ctrl组相比较,APAP组血清中ALT、AST水平显著升高(P<0.01)。表明APAP作用后对小鼠肝细胞造成了严重的损伤,动物模型建立成功。其余各组与模型组相比,ALT和 AST水平显著降低(P<0.01)。Lcz对APAP诱导的急性肝损伤具有一定的保护作用。

图1 Lcz对APAP诱导肝损伤血清中ALT和AST的影响Fig.1 Effects of Lcz on serum ALT and AST levels in APAP-induced liver injuryNote: Compared with APAP group,**.P<0.01.

图2 Lcz作用后对APAP诱导的肝损伤组织学的改善Fig.2 Histological mitigation effect of Lcz on APAP-induced liver injuryNote: A.Ctrl;B.APAP;C.NAC group;D.Lcz/APAP group;E.Lcz group.

图3 Lcz对肝脏中SOD2和HO-1表达的影响Fig.3 Effects of Lcz on hepatic expression of SOD2 and HO-1Note: Compared with APAP group,*P<0.05;**.P<0.01.
2.2Lcz作用后对肝脏组织学变化的改善 从HE染色图来看,正常组肝小叶轮廓清晰,肝细胞胞质丰富,核大而圆,核仁清晰(如图2A)。APAP作用后可见肝小叶中央明显的颗粒变性和坏死,并出现大量的坏死灶,局部可见肝细胞大面积溶解(如图2B);NAC以及Lcz/APAP组可观察到肝细胞病变症状有所减轻(如图2C、D)。Lcz组肝组织形态与正常组类似(如图2E)。
2.3Western blot分析Lcz对肝脏组织中SOD2、HO-1表达的影响 如图3所示,与空白组相比,模型组中SOD-2的表达降低,而NAC以及益生菌Lcz处理后其表达量增高。空白组与Lcz对照组的HO-1几乎没有表达,模型组表达量升高,NAC及Lcz治疗组均高于模型组,灰度扫描分析显示,Lcz作用后显著提高了SOD2(P<0.05)以及HO-1的表达(P<0.01)。
2.4Western blot 分析Lcz对肝脏组织中TLR4表达的影响 从图4中可以看出,与空白组相比,模型组中TLR4的表达量显著升高,而NAC以及Lcz治疗组的TLR4的表达均显著降低(P<0.01)。
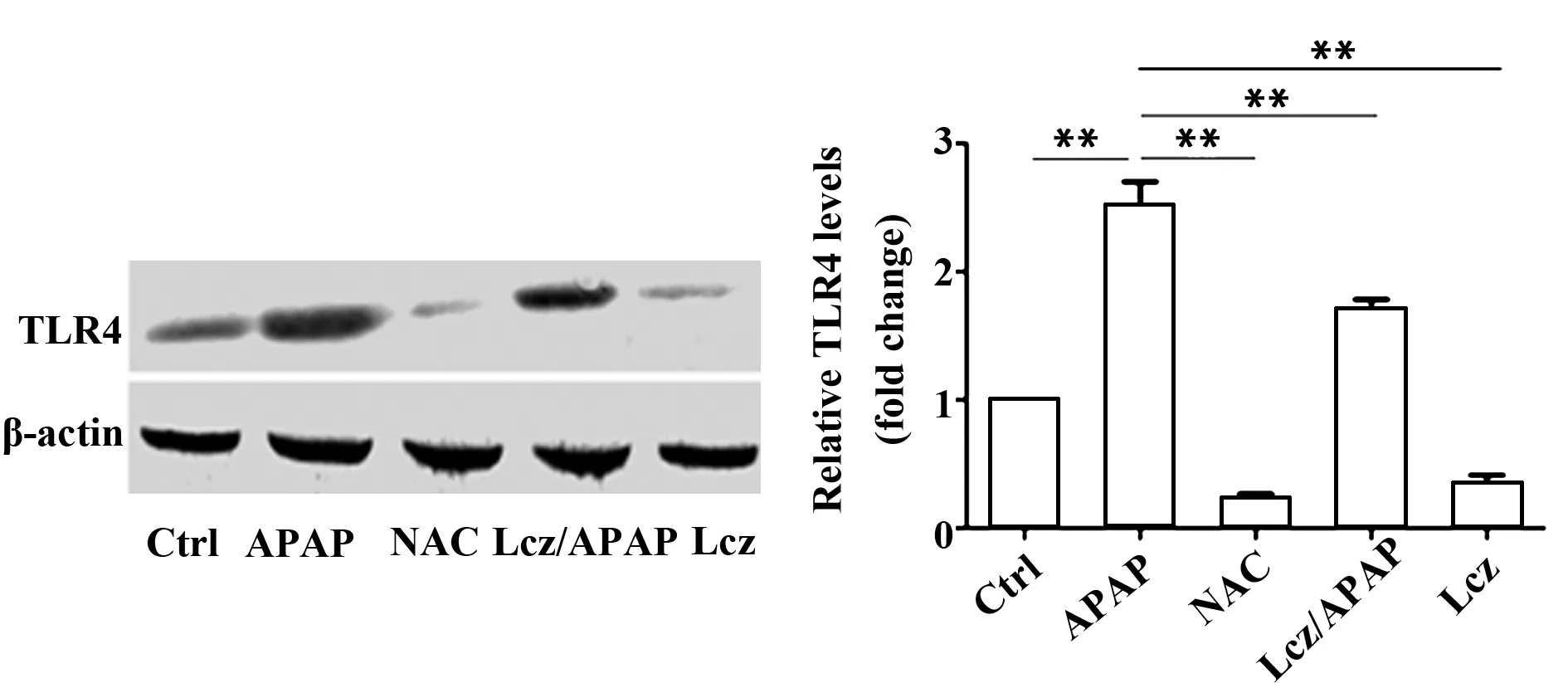
图4 Western blot检测Lcz对肝脏中TLR4的影响Fig.4 Effects of Lcz on TLR4 in liver by Western blotNote: Compared with APAP group,**.P<0.01.
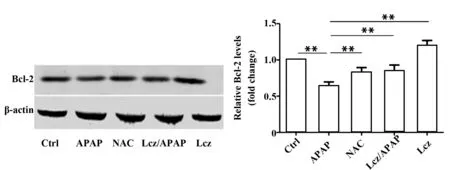
图5 Lcz对肝脏中Bcl-2表达的影响Fig.5 Effects of Lcz on hepatic expression of Bcl-2Note: Compared with APAP group,**.P<0.01.
2.5Western blot分析Lcz对肝脏组织中Bcl-2表达的影响 从图5中可以看出,模型组Bcl-2的显著表达量低于空白组(P<0.01)。而NAC和Lcz处理都显著提高了Bcl-2的表达水平(P<0.01)。
3 讨论
益生菌对肠道菌群作用的研究越来越广泛。已有研究表明,益生菌可以直接改善肠道功能[12],维持肠道微生物的平衡,保护肠道的屏障功能,调节肠道中天然免疫和适应性免疫应答[13]。由于肝肠轴的存在,益生菌可以通过调节肠道菌群,改善由饮酒、病毒性感染以及代谢紊乱引起的慢性肝病[14]。我们之前的研究表明,益生菌Lcz对大鼠内毒性肝损伤具有良好的保护作用[15],该研究再次证实Lcz对APAP诱导的急性肝损伤也有保护作用。
ALT和AST是检测肝细胞是否坏死的重要指标。我们的研究显示预先给予Lcz降低了APAP诱导的ALT和AST水平,说明Lcz作用后部分恢复了肝脏功能。从HE染色的结果中也可以看出,Lcz作用后肝细胞形态明显改善,炎性浸润程度较模型组低。而且Lcz能够有效降低APAP诱导的小鼠急性肝损伤组织中TLR4的表达水平,结合HE染色的结果来看,Lcz确实能够通过抗炎作用保护肝细胞的损伤。除此之外,益生菌Lcz还调节了Nrf2下游靶基因HO-1、SOD2的蛋白表达水平。单独饲喂益生菌Lcz并没有激活HO-1的表达。APAP刺激后,HO-1被激活,而益生菌Lcz作用后进一步提高HO-1的表达。我们推断Lcz作用通过调控HO-1的表达来发挥抗氧化功能。Bcl-2是细胞内抗凋亡蛋白,能阻止细胞色素C从线粒体释放到细胞质,从而抑制细胞凋亡[16]。益生菌Lcz治疗组与模型组相比较,Bcl-2的表达量也是有所升高。说明Lcz也可能通过提高肝脏的抗凋亡功能来发挥保护作用。更多的保护机制还需要进一步研究。
综上所述,益生菌Lcz可能通过抗炎和抗氧化途径对APAP诱导的小鼠急性肝损伤具有很好的保护作用,本实验的研究对今后益生菌的临床应用奠定基础。
[1] 梁 惠,吕 锐,傅 泳.益生菌对大鼠酒精性肝损伤的保护作用及机制研究[J].中国药理学通报,2016,32(7):991-997.
[2] Kleiner DE.Drug-induced liver injury:The hepatic pathologist′s approach[J].Gastroenterol Clin North Am,2017,46(2):273-296.
[3] 贺蕾艳,郭瑶雪,李 春,等.药物性肝损伤生物标志物研究进展[J].2015,50(8):959-965.
[4] Uchida NS,Silva-Filho SE,Aguiar RP,etal.Protective effect of cymbopogon citratus essential oil in experimental model of acetaminophen-induced liver injury[J].Am J Chin Med,2017,45(3):515-532.
[5] Yin H,Cheng L,Holt M,etal.Lactoferrin protects against acetaminophen-induced liver injury in mice[J].Hepatology,2010,51(3):1007-1016.
[6] Wang ZJ,Chen XF,Zhang ZX,etal.Effects of anti-helicobacter pylori concomitant therapy and probiotic supplementation on the throat and gut microbiota in humans[J].Microb Pathog,2017,37(6):342-248.
[7] Wang Y,Xie J,Li Y,etal.Probiotic lactobacillus casei zhang reduces pro-inflammatory cytokine production and hepatic inflammation in a rat model of acute liver failure[J].Eur J Nutr,2016,55(2):821-831.
[8] Zhang Y,Ma C,Zhao J,etal.Lactobacillus casei zhang and vitamin k2 prevent intestinal tumorigenesis in mice via adiponectin-elevated different signaling pathways[J].Oncotarget,2017,8(15):24719-24727.
[9] Yu Q,Nie SP,Wang JQ,etal.Toll-like receptor 4 mediates the antitumor host response induced by ganoderma atrum polysaccharide[J].J Agric Food Chem,2015,63(2):517-525.
[10] Yin Y,Liu Q,Wang B,etal.Expression and function of heme oxygenase-1 in human gastric cancer[J].Exp Biol Med (Maywood),2012,237(4):362-371.
[11] Wu Y,Tang L.Bcl-2 family proteins regulate apoptosis and epithelial to mesenchymal transition by calcium signals[J].Curr Pharm Des,2016,22(30):4700-4704.
[12] Wasilewska E,Zlotkowska D,Pijagin ME.The role of intestinal microflora and probiotic bacteria in prophylactic and development of colorectal cancer[J].Postepy Hig Med Dosw (Online),2013,67:837-847.
[13] Beilharz JE,Kaakoush NO,Maniam J,etal.Cafeteria diet and probiotic therapy:Cross talk among memory,neuroplasticity,serotonin receptors and gut microbiota in the rat[J].Mol Psychiatry,2017,52(3):254-263.
[14] Kwak DS,Jun DW,Seo JG,etal.Short-term probiotic therapy alleviates small intestinal bacterial overgrowth,but does not improve intestinal permeability in chronic liver disease[J].Eur J Gastroenterol Hepatol,2014,26(12):1353-1359.
[15] Wang Y,Li Y,Xie J,etal.Protective effects of probiotic lactobacillus casei zhang against endotoxin-and d-galactosamine-induced liver injury in rats via anti-oxidative and anti-inflammatory capacities[J].Int Immunopharmacol,2013,15(1):30-37.
[16] Khera A,Vanderlelie JJ,Holland O,etal.Overexpression of endogenous anti-oxidants with selenium supplementation protects trophoblast cells from reactive oxygen species-induced apoptosis in a bcl-2-dependent manner[J].Biol Trace Elem Res,2017,177(2):394-403.
ProtectiveeffectofLactobacilluscaseiZhangagainstAcetaminophen-inducedacuteliverinjuryinmice
ZHANGXiao-Hui,YANYan,ZHAOShi-Min,WANGXin-Xu,LIUChun-Yan,XIEJi-Ming,WANGYu-Zhen,WUChun-Yan.
CollegeofLifeScience,InnerMongoliaAgriculturalUniversity,Hohhot010018,China
Objective:To investigate the protective effects of Lactobacillus casei Zhang (Lcz) on mice with Acetaminophen (APAP)-induced acute liver injury.MethodsMice were randomly divided into five groups:Control group (ctrl),APAP-induced liver injury group (APAP),N-Acetylcysteine positive control group (NAC),Lcz preventive group (Lcz/APAP) and Lcz control group (Lcz).Mice were orally administrated with Lcz (1×109CFU/ml) for 30 continuous days prior to APAP exposure.Positive control group were intraperitoneally injected with 150 mg/kg NAC 1 h before APAP challenge.Mice in the APAP,NAC and Lcz/APAP group were intraperitoneally injected with 300 mg/kg APAP.Blood and liver samples were collected 18 h post APAP challenge.The expression of HO-1,SOD2,Bcl-2 and TLR4 were detected by Western blot.ResultsLcz could significantly inhibit APAP-induced increase in ALT and AST levels.Furthermore,pretreatment with Lcz increased the hepatic expression of HO-1,SOD2 and Bcl-2,while suppressing the expression of Toll-like receptor 4 (TLR4).ConclusionLcz can protect against APAP-induced acute liver injury in mice.The hepatoprotective effects of Lcz are associated with its anti-oxidative and anti-inflammatory capacity.
Lactobacillus casei Zhang;Acetaminophen;SOD2;HO-1;Bcl-2
10.3969/j.issn.1000-484X.2017.12.001
R392
A
1000-484X(2017)12-1761-04
①本文为国家自然科学基金(81260662,81560677)、内蒙古杰出青年培育基金(2016JQ08)和内蒙古自然科学基金(2016MS0836,2015MS0884)。
②内蒙古自治区人民医院检验科,呼和浩特 010020。
张晓慧(1992年-),女,硕士,主要从事益生菌与免疫应答方面的研究,E-mail:1041896658@qq.com。
及指导教师:武春燕(1983年-),女,硕士,实验师,主要从事微生物方面的研究。
[收稿2017-06-09 修回2017-08-09]
(编辑 张晓舟)