脑缺血中一氧化氮前体/供体的作用研究
周佩洋,任自敬,孙成林,刘广志,姚 旋,曹治华,王 璞,高 平
(湖北医药学院附属襄阳市第一人民医院神经内科,湖北 襄阳 441000)
脑缺血中一氧化氮前体/供体的作用研究
周佩洋,任自敬,孙成林,刘广志,姚 旋,曹治华,王 璞,高 平
(湖北医药学院附属襄阳市第一人民医院神经内科,湖北 襄阳 441000)
目的观察一氧化氮(nitric oxide,NO)前体/供体对大鼠脑损伤的保护作用,并检测大脑中动脉栓塞对大鼠脑组织微管相关蛋白2(MAP-2)表达的影响。方法将66只SD大鼠随机分为假手术组(sham组,n=12)、大脑中动脉栓塞模型(MCAO)组(n=18)、硝酸甘油(nitroglycerin,NG)治疗组(n =18)、精氨酸(arginine,ARG)治疗组(n = 18)。sham 组仅进行手术,不造成缺血事实;其余组采用 Zea-Longa改良法线栓法制作成MCAO模型,缺血2 h后再灌注即刻介入给药。各组大鼠术后立即肌肉注射注射用青霉素钠6万U以预防感染。各组于再灌注后3 h及24 h分批处死。根据处死时间各组再分为2个亚组,进行行为学评分、脑梗死体积测定,脑切片行MAP2免疫荧光染色检测。结果66只大鼠术后全部存活。再灌注3 h时间点,ARG组和NG组大鼠Longa评分与MCAO模型组相比,差异均有显著性(P<0.05);再灌注24 h时间点,TTC染色显示,2个介入给药组与 MCAO模型组相比,差异均有显著性(P<0.05);再灌注3 h和24 h两个时间点,NG组、ARG组分别与MCAO模型组相比,MAP-2阳性细胞平均光密度均明显降低(P<0.05)。结论脑缺血早期给予NO前体/供体,可能通过抑制MAP-2降解、修复大量细胞骨架结构,起到脑保护作用。
一氧化氮前体/供体;介入;大脑中动脉栓塞模型;微管相关蛋白2;大鼠;作用机制
急性大血管闭塞是缺血性脑梗死中最危及生命和致残的一种类型,常规治疗多选择组织型纤溶酶原激活剂(rt-PA)或行血管内血栓切除术治疗,后者是目前治疗颅内大血管急性闭塞(ELVO)的新举措、新标准,能确保血管再通和缺血区再灌注[1-3],但仍需其他药物在血管再通后行辅助治疗。如能对缺血靶点进行直接给药,避免全身性副反应将是理想选择[4]。一氧化氮(NO)除有抗血管痉挛、抗血小板聚集、抗炎性细胞黏附等作用外,还有明确的抗兴奋毒性脑损害作用。本研究中通过介入方式对大脑中动脉栓塞(MCAO)模型动物梗死靶点直接给药,然后根据行为学评分、脑组织中微管相关蛋白2(MAP-2)表达变化的检测结果,判断NO前体/供体(硝酸甘油/精氨酸)对脑损伤的保护作用。现报道如下。
1 材料和方法
1.1 动物、试药与仪器
动物:健康雄性SD大鼠(动物合格证号为42000900000481)66 只,体质量 250~300 g,湖北医药学院动物实验中心提供,饲养条件为,温度20~25℃,相对湿度40% ~60%,饲料由该动物实验中心提供,大鼠自由饮水,自由活动。本研究实验方案经过实验动物伦理委员会审核。
试药:小鼠抗微管相关蛋白-2单克隆抗体(monoclonal Anti-MAP2,Millipore Chemicon 公司);山羊抗小鼠IgG多克隆抗体,封闭血清(武汉博士德生物公司)。
仪器:Champion Image HPIAS-1000型图像分析系统。
1.2 建模及分组方法
按随机化原则将大鼠分为假手术(sham)组(n=12)、标准大鼠大脑中动脉栓塞模型(MCAO)组(n=18)、硝酸甘油(NG)组(n=18)和精氨酸(ARG)组(n=18)。sham组仅进行手术,不造成缺血事实。其余组采用Zea-Longa改良法线栓法制作成MCAO模型,缺血2 h后再灌注即刻介入给药,其中MCAO组给予生理盐水(0.5m L /kg),NG 组给予硝酸甘油注射液(广州白云山明兴制药有限公司,国药准字H44020569,规格为每支1 m L ∶5 mg)0.06 mL /kg+ 生 理盐水(0.44 mL /kg),ARG组给予盐酸精氨酸注射液(天津金耀氨基酸有限公司,国药准字 H12020999,规格为每支 20 mL∶5 g)0.12 m L /kg + 生理盐水(0.38 m L /kg)。各组大鼠术后立即肌肉注射注射用青霉素钠(华北制药股份有限公司,规格为每支100万U)6万U,以预防感染。各组于再灌注后3 h及24 h分批处死,再分为2个亚组:前者均为6只(用于行为学评分,组织切片免疫荧光MAP-2标记染色),后者除sham组为6只外其余组均为12只(用于行为学评分,组织切片免疫荧光MAP2标记染色及TTC染色)。
1.3 观察指标
神经行为学评分:大鼠完全清醒后,由两名研究者对大鼠进行神经行为学观察,并按Longa 5分制评分标准[5]对各组动物在造模后缺血再灌注3 h及24 h后进行运动行为评分。评分标准:无神经损伤记0分;左前肢伸展障碍记1分;向左打圈记2分;行走时向左侧倾倒记3分;意识昏迷记4分;死亡记5分。
脑梗死体积及MAP-2阳性细胞平均光学密度:大鼠迅速断头取脑、制作切片,对脑切片进行TTC染色,测出各区脑梗死面积,根据公式梗死体积=[左侧半球体积-(右侧半球体积-苍白区体积)]/全脑体积,算出梗死体积百分比。
MAP-2阳性细胞平均光学密度:采用Champion Image HPIAS-1000型图像分析系统测定。
1.4 统计学处理
采用 SPSS 22.0统计学软件分析。TTC染色和MAP-2染色数据以均数±标准差(±s)表示,行t检验,各组评分用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 行为学评估
结果见表1。
2.2 梗死体积
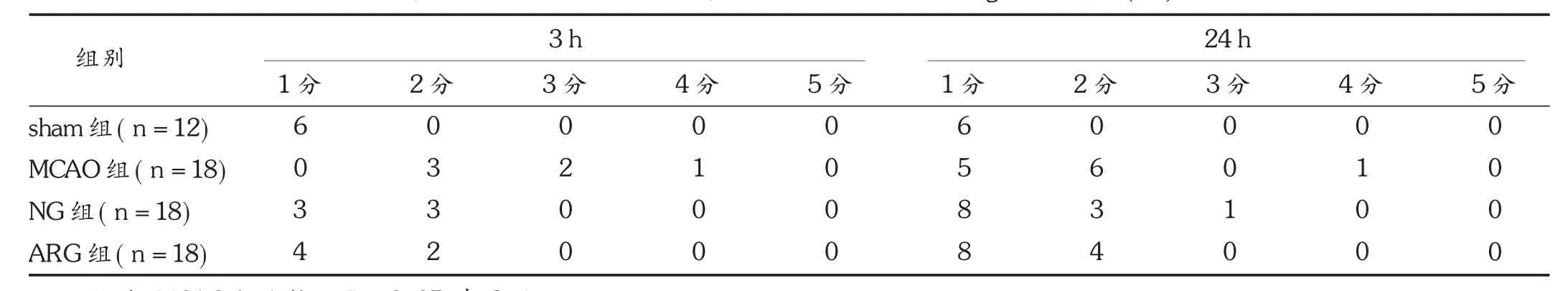
表1 各组动物缺血-再灌注3 h及24 h后的Longa评分情况(只)
结果见图1和表2。在缺血-再灌注24 h时间点,TTC染色显示,2个介入给药组苍白区(缺血区)明显减小;定量检测显示,2个介入给药组梗死体积较MCAO组显著减少(P<0.05)。
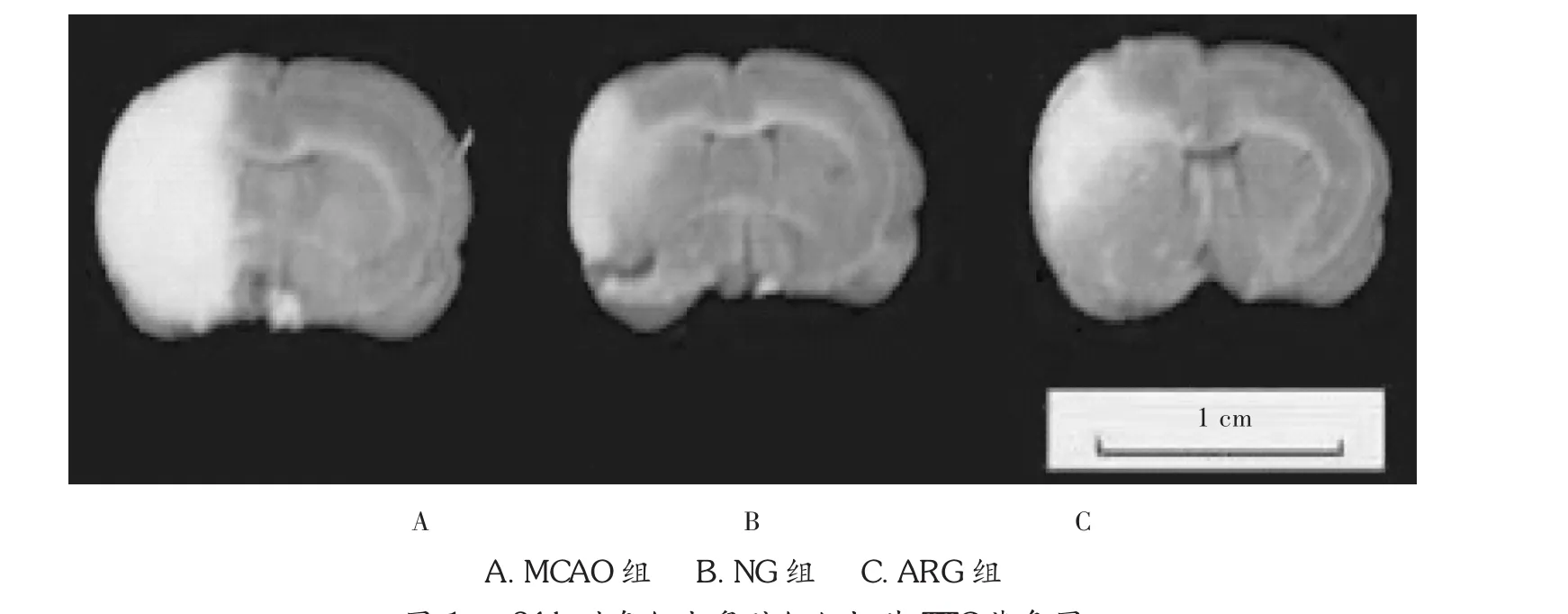
图1 24 h时各组大鼠脑组织切片TTC染色图
表2 TTC染色各组大鼠大脑梗死体积(±s,%,n=18)

表2 TTC染色各组大鼠大脑梗死体积(±s,%,n=18)
组别MCAO组NG组ARG组梗死体积23.01 ± 4.078.00 ± 0.9810.49 ± 1.16
2.3 M AP2 光密度
结果见表3。缺血-再灌注3 h后,MAP2呈细长条索状骨架结构,且 MCAO组、NG组及 ARG组大鼠MAP2免疫染色强度与sham组相比明显减弱。NG组、ARG组与MCAO模型组比,染色强度显著增强(P<0.05),提示大脑中动脉闭塞后,细胞骨架结构会坍塌、坏死,而NG/ARG抑制MAP2的降解,维持神经元结构的完整性。缺血-再灌注24 h后,sham组大鼠脑组织皮层和海马CA1,CA3区可见大量细长条索状骨架结构,排列规则;与sham组相比,MCAO组大鼠脑组织皮层和海马CA1,CA3区几乎无阳性显色,提示细胞骨架结构坍塌坏死程度进一步加深,差异显著(P<0.05);和MCAO组相比,NG组、ARG组阳性细胞数量增加,免疫染色强度增强(P<0.05)。NG组、ARG组大鼠脑组织皮层和海马CA1,CA3区均可见绿色细长条索状结构,排列规则,提示大量细胞骨架结构修复。
表3 各组大鼠MAP2在大脑皮层、海马CA1区、CA3区阳性细胞的光学密度(±s)

表3 各组大鼠MAP2在大脑皮层、海马CA1区、CA3区阳性细胞的光学密度(±s)
注:与 sham 组相比,#P<0.05;与 MCAO 组相比, P<0.05。
组别 大脑皮层 大脑海马CA1区 大脑海马CA3区sham 组(n=12)MCAO 组(n=18)NG 组(n=18)ARG组(n=18)缺血-再灌注3 h 0.46 ± 0.031.10 ± 0.03#0.60 ± 0.04#0.62 ± 0.07#缺血-再灌注24 h 0.46 ± 0.031.02 ± 0.04#0.70 ± 0.03#0.74 ± 0.06#缺血-再灌注3 h 0.49 ± 0.071.08 ± 0.08#0.63 ± 0.04#0.69 ± 0.07#缺血-再灌注24 h 0.48 ± 0.041.12 ± 0.06#0.73 ± 0.05#0.75 ± 0.05#缺血-再灌注3 h 0.51 ± 0.061.10 ± 0.11#0.62 ± 0.05#0.66 ± 0.09#缺血-再灌注24 h 0.47 ± 0.051.11 ± 0.07#0.71 ± 0.04#0.76 ± 0.06#
3 讨论
脑血管病具有高发病率、高死亡率、高致残率和高复发率4大特点,其中80%为缺血性卒中,且大部分患者遗留有不同程度的神经功能障碍,给社会和家庭带来非常沉重的负担。有研究者提出,通过动脉介入(intraarterial,IA)方式直接向再通大脑血管递送神经保护类化合物是临床治疗急性缺血性卒中的下一个合乎逻辑的步骤。该研究者还对比了大脑中动脉直接给药与常规给药方式在MCAO模型动物中的疗效及安全性,发现动脉内直接给药耐受性良好,靶向性强,梗死体积减少显著,神经元存活和功能改善增加显著,无死亡及系统性不良反应等优点[4-5]。NO前体/供体相关的临床药物较多,其中NG/ARG是最为人所知用于治疗缺血性心脏病的血管扩张剂,目前已开始研究其在缺血性卒中中的潜在治疗益处,包括降低血压、促进再灌注及神经保护作用[6-9]。鉴于高浓度的NO可能对脑组织产生毒性,临床难以直接评估NG/ARG在急性缺血性卒中患者中的安全性和有效性,研究更多地局限于动物水平[10-14]。如Maniskas等[11]检测到,中脑动脉闭塞后施用硝酸甘油GTN 1 d后,组织学检测到的梗死体积显著降低,神经元特异性核蛋白NeuN含量显著升高。Awooda等[12]也发现,通过腹膜内注射 L-精氨酸甲酯(L-NAME)处理能显着改善大鼠脑缺血-再灌注导致的神经功能缺损及总抗氧化能力。但目前尚未发现介入给予NO前体/供体处理对急性缺血性卒中的作用研究。
本研究中构建了MCAO大鼠模型,通过IA给药方式检测NO前体/供体(NG/ARG)对卒中的脑保护效应及在缺血性卒中模型中作为辅助治疗的潜力。行为学结果显示,ARG组、NG组缺血-再灌注3 h后Longa评分与MCAO组相比均存在显著性差异(P<0.05),提示从行为学上可观察到脑保护作用;TTC染色结果显示,与MCAO模型组相比,ARG组和NG组缺血再灌注24 h后,苍白区明显减小,系统定量检测各组动物脑梗死体积,结果ARG组、NG组与MCAO组相比,差异均有显著性(P<0.05),提示 ARG和NG可减少脑缺血体积,增强脑保护作用。
MAP-2属于结构性微管相关蛋白家族,是脑组织中较丰富的蛋白质,主要分布于神经元胞体、树突及树突棘,可同微管蛋白形成微管,联同其他结构元件如微丝、肌动蛋白等作用构成细胞骨架,也可与突触后膜受体及信号蛋白相连,是多种神经信号传导通路的底物。神经元中MAP-2的丢失或含量降低,常涉及神经元结构破坏及功能发挥障碍,MAP-2与神经元结构的完整性、形态和功能的正常发挥密切相关。Härtig[15]发现,无论是大鼠卒中模型、小鼠卒中模型还是卒中患者自体样本,均能发现缺血发生后缺血区域微管相关蛋白tau与MAP-2的免疫反应性降低。本研究中免疫组化结果显示,MAP-2在 sham组大鼠脑组织皮层和海马 CA1、CA3区均呈阳性表达,可见细长条索状骨架结构;而MCAO组动物的MAP-2免疫染色强度与sham组相比明显减弱,且随时间延长,减弱趋势更明显;NG组和ARG组免疫染色强度较MCAO组显著增强,说明经IA介入给予NG和ARG治疗可抑制MAP-2降解,具有明显的减少神经元脱失,修复细胞骨架结构,减轻病理损害,挽救神经细胞死亡的脑保护作用。
急性缺血性卒中的治疗旨在避免死亡并尽量减少功能障碍。虽然本研究中未见动物死亡,初步显示了IA给药方式及NG和ARG的安全性,但研究中也发现一些意外事件,如NG急性IA介入给药会引起部分MCAO模型大鼠严重的行为学毒性反应,给药后动物经常出现短暂抽搐、四肢持续性抖动,个别动物出现昏迷、醒后精神状态差的现象。推测可能与NG代谢迅速、起效快、扩血管作用强烈相关,继而增高模型鼠颅内压,而其他器官血流灌注减少,出现全身血压下降等不良反应。因此,有关NG/ARG在缺血性卒中神经药理学中的功效及机制仍需要进一步研究。
[1]Campbell BCV,Mitchell PJ,Kleinig TJ,et al.Endovascular thera-py for ischemic stroke with perfusion-imaging selection[J].New England Journal of Medicine,2015,372(11):1009-1018.
[2]Parsons MW,Albers GW.Mr Rescue:is the glass half-full or half-empty[J].Stroke,2013,44(7):2055-2057.
[3]Grunwald IQ,Wakhloo AK,Walter S,et al.Endovascular stroke treatment today[J].American Journal of Neuroradiology,2011,32(2):238-243.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5]Maniskas ME,Roberts JM,Aron I,etal.Stroke neuroprotection revisited:Intra-arterial verapamil is profoundly neuroprotective in experimental acute ischemic stroke[J].Journal of Cerebral Blood Flow & Metabolism,2016,36(4):721-730.
[6]Watanabe A,Sasaki T,Yukami T,et al.Serine racemase inhibition induces nitric oxide-mediated neurovascular protection during cerebral ischemia[J].Neuroscience,2016,339:139-149.
[7]Zhang D,Wang H,Liu H,etal.nNOSTranslocates into the Nucleus and Interacts with Sox2 to Protect Neurons Against Early Excitotoxicity via Promotion of Shh Transcription[J].Mol Neurobiol,2016,53(9):6444-6458.
[8]Zheng L,Ding J,Wang J,etal.Effects and Mechanism of Action of Inducible Nitric Oxide Synthase on Apoptosis in a Rat Model of Cerebral Ischemia-Reperfusion Injury[J].Anat Rec (Hoboken),2016,299(2):246-255.
[9]Yaidikar L,Byna B,Thakur SR.et al.Neuroprotective effect of punicalagin against cerebral ischemia reperfusion-induced oxidative brain injury in rats[J].J Stroke Cerebrovasc Dis,2014,23(10):2869-2878.
[10] Bath PM, Krishnan K, Appleton JP.Nitric oxide donors(nitrates),L-arginine,ornitric oxide synthase inhibitors foracute stroke[J].Cochrane Database Syst Rev,2017,4:CD000398.
[11]Maniskas ME,Roberts JM,Trueman R,et al.Intra-arterial nitroglycerin as directed acute treatment in experimental ischemic stroke[J].Journal of NeuroInterventional Surgery,2016:neurintsurg-2016-012793.
[12]Awooda HA,Lutfi MF,Sharara GM,et al.Role of N-Nitro-L-Arginine-Methylester as anti-oxidant in transient cerebral ischemia and reperfusion in rats[J].Experimental& translational strokemedicine,2013,5(1):1.
[13]何学令,尹海林.脑缺血动物模型的研究进展[J].中国比较医学杂志,2004,14(4):248-252.
[14]张建新,张会欣,李兰芳,等.L-精氨酸对大鼠局灶性脑缺血损伤的影响[J].中华麻醉学杂志 2002,22(3):161-164.
[15]HärtigW,Krueger M,Hofmann S,etal.Up-regulation of neuro-filament light chains is associated with diminished immunoreac-tivities for MAP2 and tau after ischemic stroke in rodents and in a human case[J].Journal of Chemical Neuroanatomy,2016,78:140-148.
Effect of NO Precursor/Donor on Cerebral Ischemia
Zhou Peiyang,Ren Zijing,Sun Chenglin,Liu Guangzhi,Yao Xuan,Cao Zhihua,Wang Pu,Gao Ping
( Department of Neurology, Xiangyang First People′s Hospital Affiliated to Hubei Medical College, Xiangyang, Hubei, China 441000)
Objective T observe the protective effect of NO precursor /donor on stroke-induced brain injury in rats,and detect the effect of middle cerebral artery occlusion(MCAO) on the expression of MAP-2 in the brain tissue of rats.Methods Totally 66 SD rats were randomly divided into four groups:sham operation group(sham group, n = 12);MCAO model group(MCAO group, n = 18),nitroglycerin treatment group(NG group, n = 18),arginine treatment group(ARG group, n = 18).Sham group was only underwent surgery without causing ischemia.In the other groups,the MCAO models were made by Zea-Longa modified normal embolus.After 2 h of is-chemia,reperfusion was immediately taken into the administration.Rats in each group were immediately intramuscular injected with Benzylpenicillin Sodium for Injection 60000 U to prevent infection.After 3,24 h of reperfusion,rats in each group were killed in batches,each group was divided into two subgroups according to the different sacrificed time point.Longa score was recorded at different time points.Infarct volume was assessed by TTC.The expression of MAP-2 in each group rats brain tissue slices was detected by im-munofluorescence staining.Results All of the 66 rats survived.At 3 h after reperfusion,the Longa scores in ARG group and NG group were significantly different from those in MCAO group(P<0.05).At 24 h after reperfusion,the results of TTC staining in the ARG group and NG group had significant difference from those in MCAO group(P<0.05).At 3,24 h after reperfusion,the mean optical density of MAP-2 positive cells in NG group and ARG group were significantly lower than those in MCAO group(P<0.05).Conclusion NO precursor/donor in the early stage of cerebral ischemia may play a role in brain protection by inhibiting the degradation of MAP-2 and repairing a large number of cytoskeleton structures.
NO precursor/donor;intervention;MCAO model;MAP-2;rat;mechanism
湖北省科学技术研究计划指导性项目[B2015483];湖北省襄阳市科技计划研究与开发项目[襄科计〔2014〕11号]。
周佩洋,博士研究生,副主任医师,主要从事脑血管病临床研究,(电子信箱)13597491119@126.com。
高平,博士研究生,副主任医师,主要从事神经系统影像与临床研究,(电子信箱)43825009@qq.com。
R965.2
A
1006-4931(2017)24-0004-04
10.3969 /j.issn.1006-4931.2017.24.002
2017-08-16;
2017-09-26)

