一株耐锌菌株的分离鉴定及其生长特性研究
曹 礼, 李晓慧, 张芹辉, 贾东波, 孙晓杰, 徐丽梅, 雷玉明
(河西学院 农业与生物技术学院 甘肃省河西走廊特色资源利用重点实验室, 张掖 734000)
一株耐锌菌株的分离鉴定及其生长特性研究
曹 礼, 李晓慧, 张芹辉, 贾东波, 孙晓杰, 徐丽梅, 雷玉明
(河西学院 农业与生物技术学院 甘肃省河西走廊特色资源利用重点实验室, 张掖 734000)
从造纸厂排污口的土壤中分离对锌具有较强耐受性的菌株HXZ-1。菌株HXZ-1能够在含锌离子浓度为50 mg/L的液体培养基中生长良好,能耐受锌离子的最高浓度为1000 mg/L。结合其生理生化特征和16S rRNA基因系统发育分析,将该菌株鉴定为原小单孢菌属(Promicromonosporasp. HXZ-1)。菌株HXZ-1最适培养条件为:锌离子浓度为50 mg/L、葡萄糖为碳源、蛋白胨为氮源。当锌离子浓度为50 mg/L时,菌株HXZ-1对锌吸附率最大,为29.1%;当锌离子浓度为500 mg/L时,培养时间为10 h时,菌株HXZ-1吸附率最大,为18.8%。菌株HXZ-1是一株对锌有较强抗性和吸附性的细菌,为重金属污染的微生物修复提供参考。
耐锌;16S rRNA;原小单孢菌属;生长特性
随着现代工业的发展,资源开发与利用为国家的建设和发展做出了巨大贡献的同时,也造成了生态环境的破坏甚至生态失衡,比如采矿、冶金、炼油等重工业产生的污染物。越来越多的重金属离子通过各种途径进入土壤和水体环境中,从而对生态环境和人体健康造成了重大影响[1]。
锌是维持机体正常生长发育、新陈代谢的重要物质,曾被誉为“生命之花”[2]。锌离子进入环境后,它具有高毒性、难转化、难迁移和生物富集等特性。其一旦进入环境后不能被生物转化,将参与食物链的循环,最终在人体内富集,破坏人体内正常的生理代谢,危害人体健康[3]。实验和流行病学调查证实,人体尿样中含锌量为1000 μg/L以上时,人体处于锌中毒状态[4]。
微生物修复技术因其具有处理费用低,对环境影响小、效率高等优点, 在治理重金属污染方面具有广泛的应用前景。近年来,利用环境中的微生物来修复重金属离子对生态环境的污染问题逐渐引起人们的重视。如廖佳等从铅锌矿区分离筛选出耐锌菌株AspergillusoryzaeHA,研究了不同试验条件对菌株生长的影响以及菌株对锌离子的吸附[5];樊霆等从某锌尾砂坝土壤中筛选分离得到一株对锌具有较强抗性的菌株AspergillusflavusCTB430-1,锌对该菌株的最低抑菌浓度为800 mg/L[6];王慧萍等从江西德兴铜矿重金属污染土壤中筛选得到一株菌株Sphingomonassp. DX-T3-03,可以抗 25 mmol/L的锌[7];李慧芬等从铅锌尾矿区与污水灌溉区土壤中筛选到一株抗锌的菌株StreptomycesciscaucasicusCCNWHX 72-14,对锌的抗性达到845 mg/L[8];李进等从湖南资兴铅锌矿区的尾砂矿矿渣中筛选到菌株VerticilliuminsectorumJ3,在最佳条件下对锌的去除率为 87.7%[9]。因此,从重金属污染区土壤中分离耐性菌株用于治理重金属污染,已成为生物修复生态环境的有效途径[10-12]。
本研究从甘肃省某造纸厂排污口污水处,长期受重金属污染的土壤中筛选出一株具有抗锌能力的菌株,通过其生理生化特征和16S rRNA基因系统发育分析鉴定该菌株,通过不同碳源、氮源和金属离子对其菌株HXZ-1生长影响的研究,探讨该菌株的生长特性,为该菌在重金属污染的微生物修复技术中提供理论依据。
1 材料和方法
1.1 材料
1.1.1 样品采集
菌株由本实验室分离纯化所得,样品采自甘肃省某造纸厂排污口土壤的不同位置,装塑料袋密封保存,备用。
1.1.2 试剂和培养基
分子操作中所用的酶、抗生素均购自大连宝生物工程有限公司,DNA凝胶回收试剂盒购自Axygen公司,PCR引物由上海生工生物工程有限公司合成,其余试剂为分析纯。
LB培养基(g/L):酵母粉5.0,蛋白胨10.0,NaCl 8.0,pH 7.0,固体培养基在上述培养基的基础上加入15 g/L的琼脂。
1.1.3 仪器与设备
分析天平(FA2104N)、恒温振荡培养箱(HZQ-X400)、分光光度计(722 s)购于上海精密科学仪器有限公司;高压式蒸汽灭菌锅(YXQ-LS-50SII)购于上海博讯实业有限公司医疗设备厂;超净工作台(SWCJ-1)购于苏州净化设备;离心机(IS-R)购于上海安亭科学仪器厂; Alpha凝胶成像系统(JS-780)购于上海思伯明仪器有限公司。
1.2 方法
1.2.1 耐锌菌株的驯化与分离
耐锌菌株的分离采用梯度压力驯化法[7]。称取10 g待测污水样品,加入100 mL无菌水中,30℃、150 r/min振荡培养24 h,使细菌充分悬浮。移取1 mL培养液至另一盛有新鲜的5% LB培养基(含100 mg/L的ZnCl2)的三角瓶中于30℃、150 r/min振荡培养5 d;移取l mL培养液至另一盛有新鲜的5% LB培养基(含200 mg/L的ZnCl2)的三角瓶中于30℃、150 r/min振荡培养5 d;培养后依次移入含300、400、500、600、700、800、900和1000 mg/L ZnCl2的5% LB液体培养基中于30℃、150 r/min振荡培养5 d。吸取适量菌液稀释涂布于含有500 mg/L ZnCl2的固体LB培养基上,于30℃下培养48 h,挑取长势良好的单菌落,经连续分离纯化后,得到具有锌抗性的菌株,编号为HXZ-1,将纯化的菌培养后于冰箱中保存备用。
1.2.2 生理生化特征鉴定
菌株形态观察、生理生化试验等参照《常见细菌系统鉴定手册》[13]《Bergey′s Manual of Determinative Bacteriology》[14]等进行。
1.2.3 16S rRNA基因PCR扩增及其测序
采用高盐法提取菌体的染色体总DNA[15]。以菌株的总DNA为模板,使用通用引物来扩增菌株的16S rRNA基因。5′端引物为5′-AGAGTTTGATCCTGGCTCAG-3′(Escherichiacolibases 8~27),3′端引物为5′-TACCTTGTTACGACTT-3′(E.colibases 1507~1492)。50 μL的反应体系:10×Buffer 5.0 μL,MgCl2(25 mmol/L)4.0 μL,dNTP(2.5 mmol/L)4.0 μL,引物(1 mmol/L)各1.0 μL,DNA模板(50.0 ng/μL)1.0 μL,Taq酶(5.0 U/μL)0.5 μL,超纯水33.5 μL。PCR反应条件:94℃预变性2 min;94℃变性30 s,52℃退火30 s,72℃延伸1.5 min,共30个循环;最后,72℃再延伸10 min。取PCR产物于0.75%的琼脂糖凝胶上电泳。PCR产物由上海生工生物工程有限公司完成测序。
1.2.4 菌株HXZ-1对不同碳源利用试验
试验测定的碳源分别为:葡萄糖、乳糖、蔗糖、淀粉、甘露醇、木糖、麦芽糖、阿拉伯糖。在无碳源培养基中分别加入不同碳源使其终浓度为0.5%。将菌株HXZ-1按3% (V/V) 的接种量接种到装有20 mL 不同碳源培养基的三角瓶中,于30℃、150 r/min培养12 h,在600 nm下测吸光值,每个试验设计3个平行,取平均值。
1.2.5 菌株HXZ-1对不同氮源利用试验
试验测定的氮源分别为:酵母粉、蛋白胨、硝酸钠、硝酸铵、尿素、亚硝酸钠、草酸铵。在无氮源培养分别加不同氮源使其终浓度为0.5%,将菌株HXZ-1按3%(V/V)的接种量接种到装有20 mL 不同氮源培养基的三角瓶中,于30℃、150 r/min培养12 h,在600 nm下测吸光值,每个试验设计3个平行,取平均值。
1.2.6 不同锌离子浓度对菌株HXZ-1生长的影响
在50 mL三角瓶中分别装入20 mL LB培养基,于120℃灭菌30 min。在培养基中加入ZnCl2母液,使其终浓度分别为0、50、100、200、300、400、500、600、700、800、900、1000和1200 mg/L,以1%的接种量分别接入处于对数生长的种子液,设置空白对照(不添加任何金属离子),于30℃,150 r/min培养11 h取样,在600 nm下测吸光值,所有实验设3个平行,各样品均设不接菌的空白对照。
1.2.7 菌株HXZ-1在不同锌离子浓度下的吸附试验[16]

1.2.8 菌株HXZ-1在不同培养时间对锌离子的吸附试验[17]

2 结果与分析
2.1 耐锌菌株HXZ-1的筛选
样品经过多次驯化培养后,吸取适量菌液稀释涂布于含有800 mg/L ZnCl2的固体LB培养基上,于30℃下培养48 h,得到一株长势良好的菌株,编号为HXZ-1,在LB固体平板上生长24 d后形成乳黄色、不透明、边缘整齐、表面隆起、湿润光滑、易挑起的圆形菌落(如图1-A和1-B),革兰氏染色为阳性(如图1-C),无鞭毛,不运动,不产芽孢。
2.2 不同锌离子浓度对菌株HXZ-1生长的影响
通过菌株HXZ-1在不同浓度的锌离子液体培养基中的生长状况,了解菌株对不同锌离子浓度的耐受性情况。如图2所示,当锌离子浓度为1200 mg/L时,OD600为0,菌体生长被完全抑制;当锌离子浓度为50 mg/L时,OD600最大,为0.895。从总体趋势来看,随着锌离子浓度的逐渐增大,OD600的值先升高后降低。这说明,低浓度的锌离子(50 mg/L)对菌株HXZ-1生长均有刺激作用,而锌离子浓度高于50 mg/L时会对菌株HXZ-1生长有抑制作用,抑制作用随浓度增加而增大。这可能是由于高浓度的锌离子对菌株有一定的毒性,导致新陈代谢活性和生长量降低[6]。据报道,菌株耐锌浓度为1~10 mmol/L时为中度耐锌细菌,而耐锌浓度超过10 mmol/L为抗锌细菌[18],菌株HXZ-1能耐受锌离子的最高浓度为1000 mg/L,因此可以判断出菌株HXZ-1为抗锌细菌。
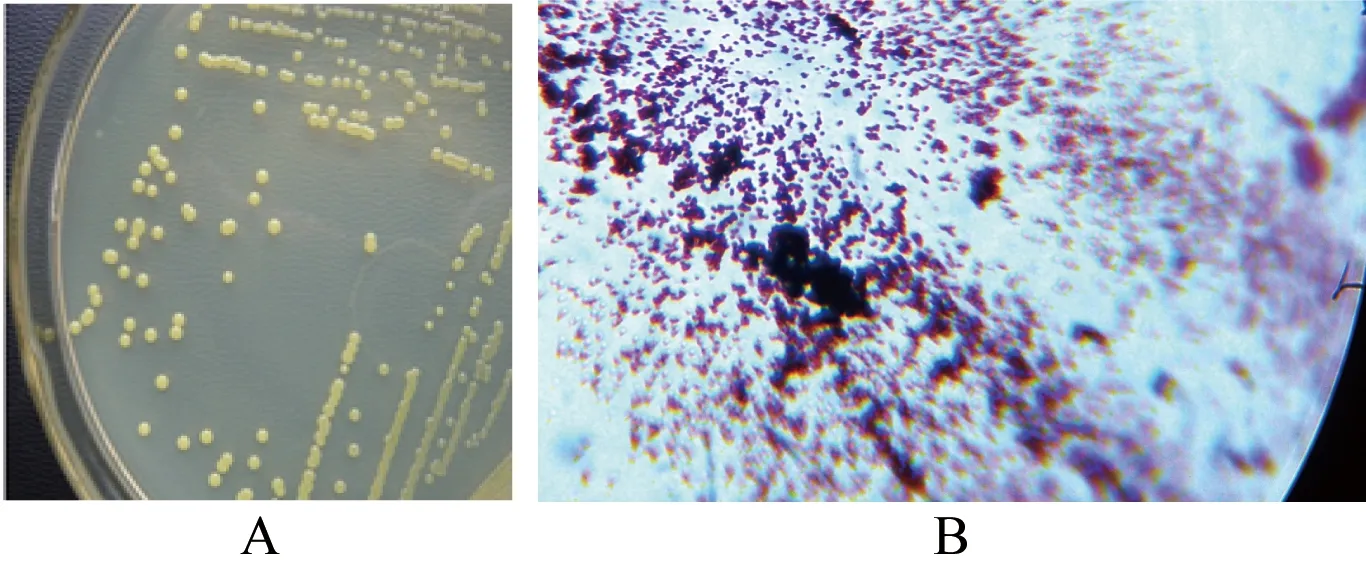
图1 菌株HXZ-1在LB固体培养基上的菌落形态(A)及其革兰氏染色(B)的结果
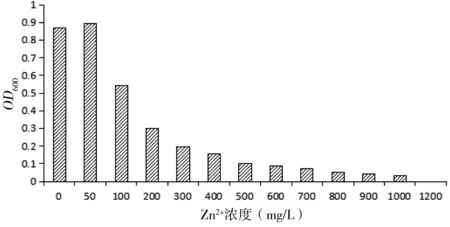
图2 不同锌离子浓度对菌种HXZ-1生长的影响
2.3 16S rRNA基因扩增
菌株HXZ-1的基因组DNA提取结果见图3,基因组DNA在电泳图上的23 130 bp附近一条明显的条带,可以用于PCR扩增,16S rRNA 序列扩增长度为1500 bp左右。
2.4 16S rRNA基因序列的测定及系统发育分析
根据16S rRNA基因的测序结果,将其序列与EzTaxon-e server(http://eztaxon-e.ezbiocloud.net/)数据库中16S rRNA基因序列进行同源性比较,选择其中的12株菌的16S rRNA基因序列用于系统发育学分析,采用CLUSTAL_X将菌株XHZ-1的16S rRNA基因序列与其同源关系相近的序列比对分析后[19],把两头的序列剪切整齐,用MEGA version 5.0 软件包中的Kimura-Parameter Distance 模型计算进化距离,用Neighbor-Joining 构建系统进化树[20],1000次随机抽样,计算自引导值(Bootstrap)以评估系统进化树的置信度。结果如图4,菌株HXZ-1所得16S rRNA基因序列与其序列相近的菌株都在Promicromonospora属,与模式菌株PromicromonosporaflavaCC 0387T具有最高的相似性为98.46%,结合前述的菌株形态特征,可以鉴定该菌株HXZ-1为原小单孢菌属(Promicromonosporasp. HXZ-1)。
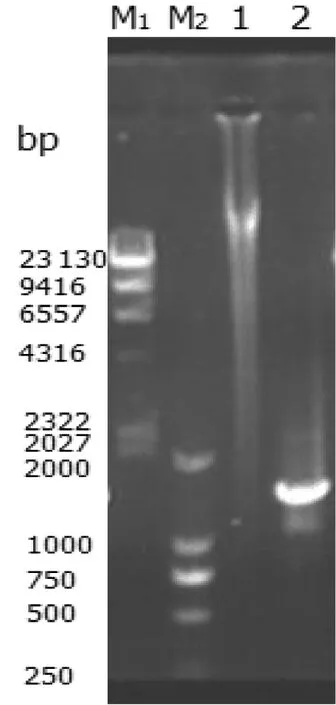
图3 菌株HXZ-1的基因组DNA、16S rRNA基因的PCR扩增
M1: λDNA /HindIII Marker; M2: DL 2000 Marker; 1: total DNA of strain HXZ-1; 2: 16S rRNA gene

图4 菌株 HXZ-1的系统发育分析
The scale bar represents an evolutionary distance of 0.01, the accession numbers are in parentheses
2.5 菌株HXZ-1对不同碳源利用试验
不同碳源对菌株HXZ-1生长影响的结果如图5所示。不同的微生物利用糖、醇、有机酸、脂肪酸等的能力有很大的差异,这是菌株鉴定中的一项重要指标。在以NH4NO3作氮源的情况下,供试的8种碳源中:菌株HXZ-1对葡萄糖、甘露醇和蔗糖的利用较好,其中对葡萄糖利用最好,OD600值最大,为0.771;对淀粉、阿拉伯糖和麦芽糖利用较差,说明菌株HXZ-1的最适碳源为葡萄糖。
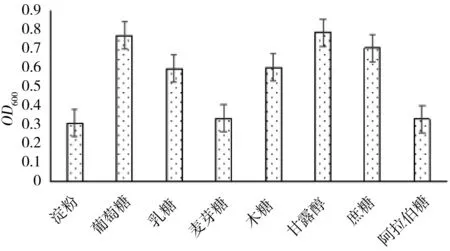
图5 不同碳源对菌株HXZ-1生长的影响
2.6 菌株HXZ-1对不同氮源利用试验
不同氮源对菌株HXZ-1生长影响的结果如图6所示。不同的微生物利用氮源的能力有很大的差异,也是菌株鉴定中的一项重要指标。在以葡萄糖作碳源的情况下,供试的7种氮源中:菌株HXZ-1对2种有机氮源蛋白胨、酵母粉利用较好,而对硝酸钠和亚硝酸钠的利用较差,当蛋白胨作为氮源时,OD600值最大,为0.728;说明菌株HXZ-1的最适氮源为蛋白胨。
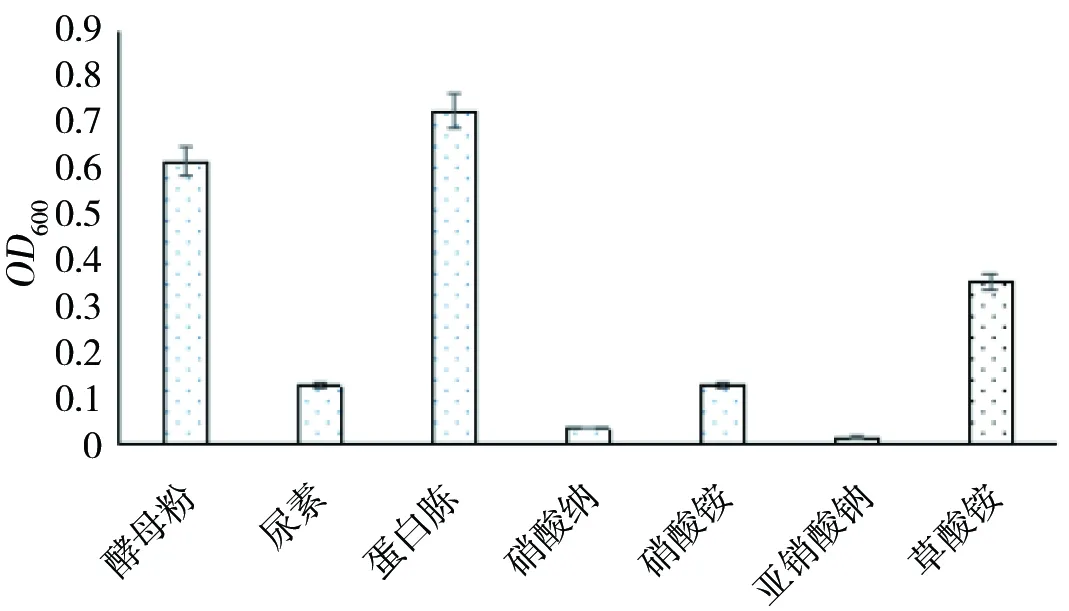
图6 不同氮源对菌株HXZ-1生长的影响
2.7 菌株HXZ-1对不同浓度锌离子的吸附试验
菌株HXZ-1对不同浓度锌离子的吸附率如图7所示。微生物对不同浓度的金属离子的吸附能力有很大的差异。从总体趋势来看,随着锌离子浓度的增大,菌株HXZ-1对锌离子的吸附率先升高后降低。在0~50 mg/L,随着锌离子浓度的增加,菌株HXZ-1对锌离子的吸附率呈上升趋势;当锌离子浓度大于50 mg/L时,吸附率逐渐减小,当大于200~1000 mg/L之间,吸附率较低。当锌离子浓度为50 mg/L时,菌株HXZ-1对锌离子的吸附率最大,为29.1%,这可能与菌株HXZ-1在含有50 mg/L的LB培养基中生长良好有关。
2.8 菌株HXZ-1在不同时间内对锌离子的吸附试验
微生物在不同生长时间内对金属离子的吸附能力有很大的差异,在培养体系中锌离子浓度为500 mg/L时仍能生长的细菌,被认为是耐锌性较强的微生物[18]。当锌离子浓度为500 mg/L时,菌株HXZ-1在不同培养时间对锌吸附率的结果如图9所示。总的来看,随着培养时间的延长,菌株HXZ-1对锌离子的吸附率先升高后降低。该菌株HXZ-1在0~4 h内,吸附率上升趋势较慢;在4~10 h内,吸附率上升趋势较快;当培养时间大于10 h时,菌株HXZ-1对锌离子的吸附率开始下降。试验表明,当菌株HXZ-1的培养时间为10 h时,菌株HXZ-1对锌离子的吸附率最大,为18.8%。
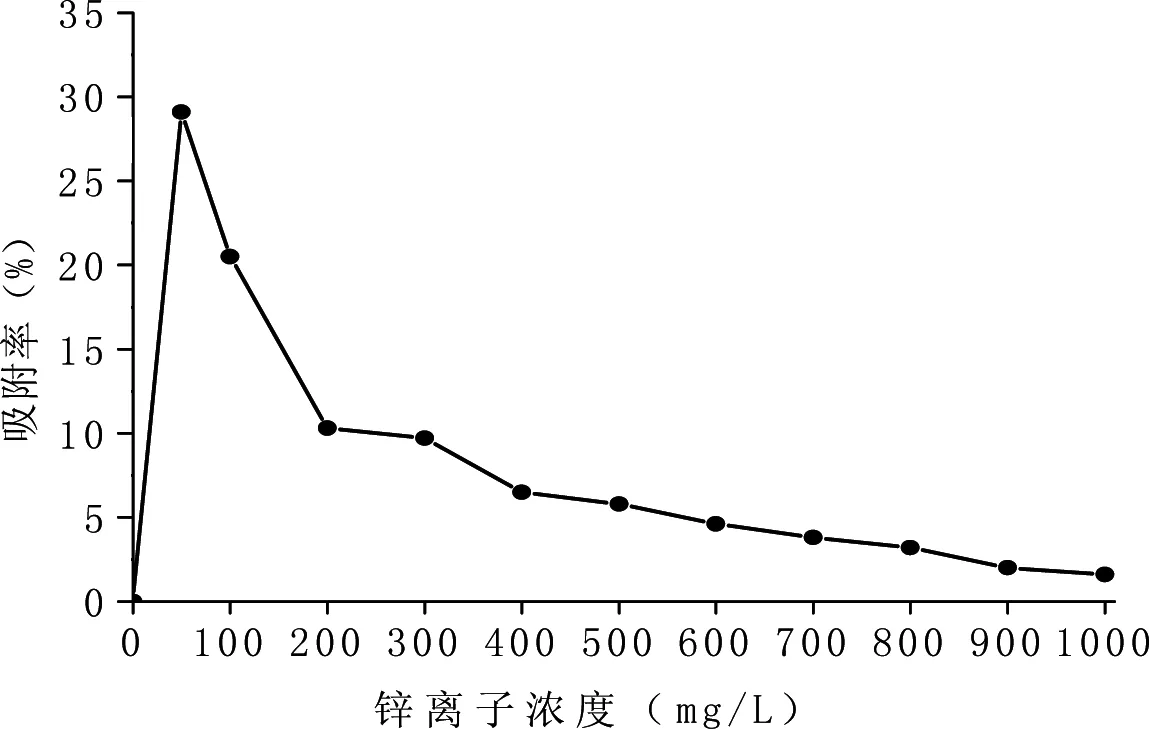
图7 培养基中不同锌浓度时菌体HXZ-1对锌吸附率的影响

图8菌株HXZ-1在不同培养时间对Zn2+吸附率的影响
3 结论
本研究从某造纸厂的污水中筛选到一株对锌具有抗性的菌株HXZ-1,对其进行生理生化研究和系统发育分析,将其鉴定为原小单孢菌属(Promicromonosporasp. HXZ-1)。当前,抗锌菌株报道较多,主要在Aspergillus,Penicillium,Sphingomonas,Streptomyces和Verticillium等属[5-9, 21],尚未在Promicromonospora属有抗锌菌株的报道。因此,Promicromonospora属抗锌菌株的分离,为锌污染区域的微生物修复提供了新的菌种资源。
菌株HXZ-1在锌离子浓度为50 mg/L的LB培养基中生长良好,能耐受锌离子的最高浓度为1000 mg/L。菌株HXZ-1在葡萄糖为碳源、蛋白胨为氮源生长最好。当菌株HXZ-1在此最优培养条件下生长,锌离子浓度为50 mg/L时,菌株HXZ-1对锌离子的吸附率最大,为29.1%;当锌离子浓度为500 mg/L时,培养时间为10 h时,菌株HXZ-1对锌离子的吸附率最大,为18.8%。因此,菌株HXZ-1是一株对锌有较强抗性和吸附性的细菌,在重金属锌污染区域的微生物修复中有着良好的应用潜力。
[1]林凡华, 陈海博, 白 军. 土壤环境中重金属污染危害的研究[J]. 环境科学与管理, 2007, 32(7): 74-76.
[2]郑超一, 胡妙申. 在儿童生长发育中铅的危害与锌的作用[J]. 广东微量元素科学, 2001, 8(10): 10-13.
[3]隆美容, 谢小林, 冯广达, 等. 铅锌尾矿中耐重金属镉的丝状真菌的分离鉴定[J]. 微生物学通报, 2013, 40(12): 2203-2216.
[4]向中兰. 补锌过量对人体的危害[J]. 现代医药卫生, 2001, 17(9): 727.
[5]廖 佳, 冯冲凌, 李科林, 等. 耐性真菌HA吸附铅、锌的影响因素及吸附机理研究[J]. 微生物学通报, 2015, 42(2): 254-263.
[6]樊 霆, 张颖慧, 李定心, 等. 一株耐锌真菌CTB430-1 分离鉴定及其富集特性[J]. 激光生物学报, 2013, 22(5): 453-458.
[7]王慧萍, 谢学辉, 柳建设. 抗锌细菌Sphingomonassp. DX-T3-03 分离、鉴定及性质[J]. 微生物学通报, 2010, 37(10): 1495-1500.
[8]李慧芬, 林雁冰, 王娜娜, 等. 一株Zn抗性菌株的筛选鉴定及吸附条件优化[J]. 环境科学学报, 2010, 30(11): 2189-2196.
[9]李 进, 冯冲凌, 李科林, 等. 抗铅锌功能菌生长菌株和干菌体吸附 Pb2+, Zn2+性能优化及机理分析[J]. 微生物学通报, 2015, 42(7): 1224-1233.
[10]金 羽, 曲娟娟, 李 影, 等. 一株耐铅细菌的分离鉴定及其吸附特性研究[J]. 环境科学学报, 2013, 33(8): 2248-2255.
[11]薛高尚, 胡丽娟, 田 云, 等. 微生物修复技术在重金属污染治理中的研究进展[J]. 中国农学通报, 2012, 28(11): 266-271.
[12]张颖慧, 樊 霆, 李定心, 等. 霉菌吸附重金属在污水处理中的研究进展[J]. 中国农学通报, 2014, 30(11): 196-199.
[13]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-398.
[14]KERSTERS K, VANCANNEYT M. Bergey’s manual of systematic bacteriology[M]. Chicago: Springer Verlag, 2005: 244-254.
[15]MILLER S A, DYKES D D, POLESKY H F, et al. A simple salting out procedure for extracting DNA from human nucleated cells[J]. Nucleic Acids Research, 1988, 16(3): 1215.
[16]FENG J, YANG Z, ZENG G, et al. The adsorption behavior and mechanism investigation of Pb (II) removal by flocculation using microbial flocculant GA1[J]. Bioresource Technology, 2013, 148: 414-421.
[17]KLIMEK B. Effect of long-term zinc pollution on soil microbial community resistance to repeated contamination[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 88(4): 617-622.
[18]MERGEAY M, NIES D, SCHLEGEL H G, et al.AlcaligeneseutrophusCH34 is a facultative chemolithotroph with plasmid-bound resistance to heavy metals[J]. Journal of Bacteriology, 1985, 162(1): 328-334.
[19] KIM O S, CHO Y J, LEE K, et al. Introducing EzTaxon-e: a prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(Pt 3): 716-721.
[20]THOMPSON J D, GIBSON T J, PLEWNIAK F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25(24): 4876-4882.
[21] FAN T, LIU Y, FENG B, et al. Biosorption of cadmium(II), zinc(II) and lead(II) byPenicilliumsimplicissimum: isotherms, kinetics and thermodynamics[J]. Journal of Hazardous Materials, 2008, 160(2-3): 655-661.
Isolationandidentificationofazinc-resistancestrainandresearchonitsgrowthcharacteristics
CAO Li, LI Xiao-hui, ZHANG Qin-hui, JIA Dong-bo, SUN Xiao-jie, XU Li-mei, LEI Yu-ming
(College of Agriculture and Biotechnology; Key Laboratory of Hexi Corridor Resourses Utilization of Gansu, Hexi University, Zhangye 734000, China)
A bacterium with strong tolerance to zinc, strain HXZ-1, was isolated from sewage of a paper mill. It could tolerate 1000 mg/L of zinc ion. Based on the phylogenetic analysis of the 16S rRNA gene and the physiologic & biochemical characteristics, it was identified asPromicromonosporasp. HXZ-1. The culture conditions of strain HXZ-1 were zinc ion concentration of 50 mg/L, glucose as carbon source and peptone as the nitrogen source. When the concentration of zinc ions in cultural liquid was 50 mg/L, the zincic adsorption rate of HXZ-1 reached the maximum of 29.1%; the maximum zincic adsorption rate of strain HXZ-1 run up to 18.8% after cultured 10 h in concentration of zinc ions as 500 mg/L. Strain HXZ-1 had better adsorption effect and tolerance to zinc.
zinc-resistance; 16S rRNA;Promicromonospora; growth characteristics
2016-11-26;
2017-01-05
河西走廊特色资源利用重点实验室项目(No. XZ1401)
曹 礼,副教授,博士,研究方向为环境微生物学,E-mail:caolicl@126.com
雷玉明,教授,研究方向为应用微生物学,E-mail:zyymlei@126.com
10.3969/j.issn.2095-1736.2017.06.060
Q93-331; Q935
A
2095-1736(2017)06-0060-05

